一种基于四面体框架核酸的复合佐剂、mRNA疫苗及其制备方法和用途
一种基于四面体框架核酸的复合佐剂、mrna疫苗及其制备方法和用途
技术领域
1.本发明属于生物医药领域,具体涉及一种基于四面体框架核酸的复合佐剂、mrna疫苗及其制备方法和用途。
背景技术:
2.核酸疫苗,包括dna和rna疫苗,在多类疾病的预防和治疗中显示出巨大的前景。人工体外合成的dna或rna被运输到细胞中,通过转录和/或翻译,最终形成内源性抗原。与减毒疫苗或肽疫苗相比,核酸疫苗的关键优势在于它们优先刺激细胞免疫而不是体液免疫。这是因为内源性抗原由mhc(major histocompatibility complex)-1类分子介导抗原呈递,导致cd8阳性t细胞的活化,从而促进细胞免疫。这对于肿瘤和病毒的免疫治疗尤其重要。此外,核酸序列易于体外扩增,使得快速量产核酸疫苗的可行性较高,因此尤其适用于突发性传染疾病。
3.核酸疫苗中的mrna疫苗通常在蛋白质翻译后受到降解,具有很高的生物安全性。目前已有较多研究意识到了mrna疫苗的优点,并在初期临床阶段成功验证了mrna疫苗的功效。例如新型冠状病毒的mrna疫苗已被批准用于开发和全球应用。此外,诸多mrna疫苗正在针对多种肿瘤进行临床试验,如黑色素瘤和前列腺癌。
4.但是,mrna疫苗的广泛应用仍然面临挑战。mrna是核苷酸的长链状聚合物,带负电荷,若没有载体递送,易导致细胞通透性差。此外,单链mrna的稳定性较差,人工合成时通常需要特定核酸(例如5-甲基胞苷)的修饰以提高稳定性。然而,这一类的修饰往往降低了mrna自身的佐剂效应,从而削弱了对抗原呈递细胞的活化的刺激能力。目前,脂质体载体被广泛使用于mrna的递送。除了递送mrna外,脂质体还能够通过共同递送佐剂或者自身的化学修饰以增强免疫刺激性。美中不足的是,这类载体具有一系列潜在缺点,例如体内毒性,对抗原呈递细胞缺乏靶向性,以及难以共同递送多种佐剂。对于mrna药物而言,理想的载体及佐剂应至少满足以下特征:(1)增强mrna的递送;(2)有效激活免疫细胞,尤其是抗原呈递细胞;(3)优先诱导细胞免疫而非体液免疫;(4)非特异性免疫低;(5)不引起体内毒性;但目前兼具上述优异特性的mrna疫苗佐剂还鲜有报道。
技术实现要素:
5.本发明的目的在于提供一种基于四面体框架核酸的新型复合佐剂。
6.本发明提供了一种复合佐剂,它由连接有cpg的dna四面体cpg-tfna和mdf2β复合而成;
7.所述dna四面体由4条dna单链自组装形成,
8.所述cpg连接于4条dna单链中至少一条单链的5’端。
9.进一步地,上述cpg的序列如seq id no.1所示,和/或所述dna四面体的4条dna单链的序列分别一对一地选自seq id no.2~5的所述序列。
10.更进一步地,上述cpg连接于4条dna单链的5’端;
11.优选地,所述cpg与dna单链通过连接序列ttttt连接,所述4条dna单链连接cpg后的序列如seq id no.6~9所示。
12.更进一步地,上述cpg-tfna和mdf2β的摩尔比为1:(200~500),优选为1:300。
13.更进一步地,上述cpg-tfna由如下方法制备而成:将dna四面体的4条dna单链置于足以使其变性的温度下维持至少10min,再将温度降低到2~8℃维持至少20min;所述4条dna单链中至少一条的5’端连接有cpg。
14.本发明还提供了上述复合佐剂的制备方法,它是将cpg-tfna和mdf2β在室温下孵育至少1h。
15.本发明还提供了上述的复合佐剂在制备mrna疫苗或dna疫苗中的用途。
16.本发明还提供了一种纳米疫苗,它由上述的复合佐剂和mrna组成,优选地,所述复合佐剂中cpg-tfna与mrna的摩尔比为1:(1~5),更优选为1:1。
17.进一步地,上述mrna为编码卵清蛋白的mrna。
18.本发明还提供了上述的纳米疫苗的制备方法,它是将所述复合佐剂和mrna在室温下孵育至少1h。
19.本发明还提供了上述的纳米疫苗在免疫调节和/或肿瘤预防药物中的应用。
20.本发明的有益效果:本发明首次提供了一种基于cpg-tfna和mdf2β的复合佐剂mrna纳米疫苗。mrna在没有佐剂的情况下几乎不会进入细胞发挥功能,而使用本发明复合佐剂的mrna纳米疫苗不但生物安全性好,而且可被树突状细胞内化并促进其成熟,成熟的树突状细胞分泌细胞因子并在细胞膜上表达共刺激分子,随后迁移并与t细胞接触以进行抗原呈递;活化的抗原特异性cd8+t细胞迁移至外周,浸润早期肿瘤组织,识别和攻击肿瘤细胞,最终抑制肿瘤的发生和生长,两种佐剂复合起到了协同增效作用,比仅使用一种佐剂的mrna纳米疫苗具有更好的效果,具有很好的应用前景。
21.本发明术语“cpg”是指cpg odn,即含有胞嘧啶-磷酸-鸟嘌呤基序的寡脱氧核苷酸。“mdf2β”是指鼠β防御素2。
22.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
23.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
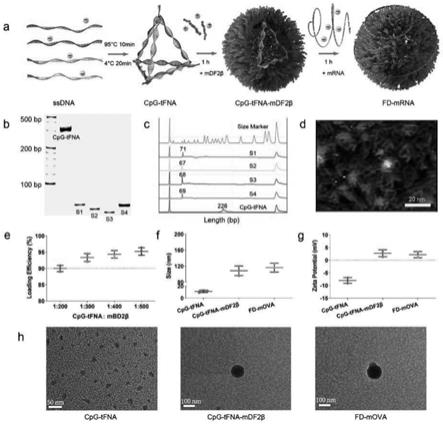
24.图1为cpg-tfna,复合佐剂,复合mrna纳米疫苗的表征结果。
25.图2为fd-megfp的透射电镜(tem)观察结果。
26.图3为d-mova的透射电镜(tem)观察结果。
27.图4为纳米疫苗对树突状细胞(dcs)的成熟及抗原呈递的影响表征结果。
28.图5为流式细胞术验证egfp在细胞内表达的结果。
29.图6为树突状细胞迁移统计结果。
30.图7为光学显微镜观察树突状细胞形态变化结果。
31.图8为纳米疫苗单次注射后的生物分布及免疫反应表征结果。
32.图9为d-cy5-megfp和fd-cy5-megfp在心、肝、肺、肾中的积聚结果。
33.图10为单次疫苗接种5天后脾淋巴细胞中ova特异性cd8+t细胞统计结果。
34.图11为单次疫苗接种7天后外周血淋巴细胞中ova特异性cd8+t细胞统计结果。
35.图12为纳米疫苗在预防接种模型中对肿瘤生长的抑制结果。
36.图13为纳米疫苗对肿瘤组织作用的h&e染色结果。
具体实施方式
37.本发明所用原料与设备均为已知产品,通过购买市售产品所得。
38.实施例1、本发明复合佐剂的制备
39.将四份等摩尔浓度的ssdna(序列见表1)溶解在含有10mm tris-hcl和50mm mgcl2·
6h2o的tm缓冲液(ph≈8.0)中。随后,将混合物在95℃加热10分钟并降温至4℃保持20分钟,以形成cpg-tfna。
40.将cpg-tfna与mdf2β在室温下孵育1h以形成复合佐剂。cpg-tfna与mdf2β的摩尔比为1:300。
41.表1
[0042][0043]
[0044]
实施例2、本发明复合佐剂纳米疫苗的制备
[0045]
将实施例1制得的复合佐剂与编码卵清蛋白(ova)的mrna(mova)在室温下共孵育1h,制得复合佐剂纳米疫苗fd-mrna。cpg-tfna、mdf2β和mrna的摩尔比为1:300:1。
[0046]
对比例1、单佐剂纳米疫苗的制备
[0047]
mdf2β与mova(摩尔比为300:1)在室温下直接孵育1h,形成单佐剂纳米疫苗d-mrna。
[0048]
以下通过实验例证明本发明复合佐剂纳米疫苗的有益效果。
[0049]
本发明复合佐剂和纳米疫苗的制备过程示意图如图1a所示。
[0050]
实验例1、cpg-tfna,复合佐剂,复合mrna纳米疫苗的表征
[0051]
1、实验方法
[0052]
为了验证cpg-tfna的成功合成,分别使用8%聚丙烯酰胺凝胶电泳(page)和高效毛细管电泳(hpce)测量了四份ssdna及合成产物cpg-tfna(1μm)的分子量及核酸序列长度。使用afm(cypher vrs,oxford instruments,united kingdom)观察cpg-tfna的纳米形态。
[0053]
为了验证复合佐剂和mrna纳米疫苗的成功合成,通过dls和els分别测量合成物的粒径和ζ电位,基于zetasizer nano zs90(malvern instruments ltd,u.k.)。使用tem(tecnai g2 f20,fei,america)观察合成物的纳米形态。
[0054]
此外,使用酶标仪(varioskan flash 3001;thermo,usa)分析mdf2β/cpg-tfna的负载效率。在220nm波长处记录mdf2β溶液(梯度浓度:5、10、15、20和25μm)的吸光度,以获得mdf2β的浓度-吸光度标准曲线。以不同摩尔比(200:1、300:1、400:1、500:1)孵育mdf2β和cpg-tfna溶液(300nm),随后在5-kd超滤管(ultra 30k,amicon)中以5000rpm的速度离心10分钟。根据标准曲线计算出超滤管中剩余的未负载的mdf2β的浓度。根据以下方程式计算mdf2β与cpg-tfna的负载效率(cl和c2分别表示mdf2β的总浓度和未负载浓度):
[0055]
loading efficiency(%)=“c1-c2”/“c1
”×
100%
[0056]
2、实验结果
[0057]
page和hpce分别验证了cpg-tfna分子量的增加和核酸序列长度的延长(图1b,1c)。在原子力显微镜(afm)图像中,可见cpg-tfna呈现出四面体框架结构(图1d),证明cpg-tfna的成功合成。
[0058]
从mdf2β与cpg-tfna的负载效率结果(图1e)来看,mdf2β的摩尔数超过cpg-tfna的300倍后,其负载效率提高不显著,负载效率趋于平稳。因此,优选cpg-tfna与mdf2β摩尔比1:300作为后续实验的主要对象。
[0059]
通过动态光散射(dls)测定,cpg-tfna的纳米粒径约为10nm,复合mdf2β及mova后逐渐增加到120nm左右(图1f)。通过电泳光散射(els)测定,cpg-tfna的ζ电位约为-10mv,复合mdf2β及mova后逐渐增加到+3mv左右(图1g)。在透射电子显微镜(tem)图像(图1h)中,cpg-tfna呈现出较为典型的三角形结构,而复合佐剂(cpg-tfna-mdf2β)和复合佐剂mova纳米疫苗(fd-mova)均呈现典型的球形结构,且直径较之cpg-tfna显著增大。类似地,发明人还使用cpg-tfna-mdf2β与编码增强型绿色荧光蛋白(egfp)的mrna(megfp)结合,由此合成的fd-megfp在tem图像(图2)中也表现为典型的球形结构,说明本发明的复合佐剂可自发形成球形结构。总之,基于静电相互作用,我们构建了复合佐剂mrna纳米疫苗,其电性为微正电,直径约为120nm。
[0060]
而mdf2β直接与mova以300:1的分子比例结合,由此产生的单佐剂纳米疫苗d-mova(对比例1)在tem图像(图3)中显示出长链状结构。相比于长链状结构,球型纳米疫苗通常在体外和体内展现出较好的生物稳定性和细胞摄取效果。
[0061]
实验例2、树突状细胞(dcs)的成熟及抗原呈递
[0062]
树突状细胞是一组不同类型的造血细胞,在先天免疫系统和后天免疫系统之间起着通道的作用。它们起源于淋巴-骨髓造血作用,来源于骨髓。它们是先天免疫细胞,因为它们可以识别病原体,但它们也可以在主要组织相容性复合体(mhc)蛋白的作用下制备和呈递抗原,以激发初始t细胞对威胁作出应答。
[0063]
1、实验方法
[0064]
mrna疫苗发挥作用的先决条件是进入细胞内表达出目标抗原。为了便于观测,使用megfp代替mova制备了基于实施例1的复合佐剂的纳米制剂(fd-megfp),将单独的megfp或fd-megfp施加于树突状细胞,并评估egfp的表达水平。使用共聚焦成像和流式细胞术进行分析。
[0065]
此外,对使用d-mova(对比例1)、fd-mova(实施例1)处理后的树突状细胞进行细胞计数实验(cck-8)和划痕实验,并用扫描电子显微镜(sem)观察树突状细胞的形态变化;酶联免疫吸附试验(elisa)、流式细胞术分析抗原提呈所需的主要生物分子的表达情况。
[0066]
2、实验结果
[0067]
使用共聚焦成像(图4a)和流式细胞术(图5)进行分析,发现d-megfp和fd-megfp处理后均可见绿色荧光,提示egfp的成功表达,而单独使用megfp则未见明显荧光,提示无佐剂情况下难以表达egfp。
[0068]
此外,细胞计数实验(cck-8)表明,与d-mova相比,fd-mova处理后树突状细胞具备更高的细胞活力(图4b)。划痕实验表明,较之d-mova,fd-mova可引起更高的细胞迁移率(图4c;统计结果见图6)。细胞形态方面,扫描电子显微镜(sem)(图4d)和光学显微镜(图7)中,d-mova和fd-mova均引起树突状细胞的形态变化,由较为圆滑平整的形态变为不规则的形态,且产生树突样特征,这表明了树突状细胞的成熟。
[0069]
上述结果说明,佐剂的使用能够促进mrna进入细胞进行表达,而本发明的复合佐剂相比于单佐剂,能够使得树突状细胞维持高活力和迁移能力,促进树突状细胞成熟,有利于抗原呈递,实现免疫调节。
[0070]
进一步探究抗原提呈所需的主要生物分子的表达情况发现,包括细胞因子的分泌和共刺激分子及抗原-mhc-1复合物在细胞膜上的表达。酶联免疫吸附试验(elisa)表明,与d-mova相比,fd-mova可诱导树突状细胞分泌更多的趋化因子配体(ccl)-18和白细胞介素(il)-12(p70),前者趋化淋巴细胞,后者诱导细胞免疫(图4e)。同时,d-mova和fd-mova几乎未引起促炎性细胞因子的分泌增加,包括肿瘤坏死因子(tnf)-α和il-1β(图4e)。此外,与d-mova相比,fd-mova诱导树突状细胞表达更多的共刺激分子cd40和cd86,以及抗原-mhc-1复合物h-2kb siinfekl(ova257-264),表达阳性率的上调情况分别为约29%至约37%、约37%至约44%、约35%至约41%(图4f为代表性的流式细胞术结果)。
[0071]
上述结果说明,本发明的复合佐剂相比于单佐剂,更有利于抗原呈递。
[0072]
综上所述,本发明本发明的cpg-tfna和mdf2β复合佐剂起到了协同增效的作用,显著促进树突状细胞的生长、迁移和成熟,刺激多类生物分子的表达,为树突状细胞-t细胞之
间的抗原呈递与相互作用奠定了基础。
[0073]
实验例3、纳米疫苗单次注射后的生物分布及免疫反应
[0074]
1、实验方法
[0075]
(1)基于上述体外结果,我们进一步评估了单次注射mrna纳米疫苗后的活体反应。mrna纳米疫苗在活体内发挥作用的首要条件是优先富集于免疫相关器官,如淋巴结和脾脏。为便于观察,我们使用荧光性cy5-megfp代替mova制备了基于实施例1的复合佐剂的纳米制剂(fd-cy5-megfp),和基于对比例1的单佐剂的纳米制剂(d-cy5-megfp),注射于c57小鼠,进行活体成像。注射12小时后,分离出小鼠的器官进行荧光分析。
[0076]
(2)评估实施例1的纳米疫苗fd-mova单次注射12小时候的小鼠体温变化;
[0077]
(3)进一步评估实施例1(fd-mova)、对比例1(d-mova)单次疫苗接种5天后,小鼠的脾细胞中ova特异性cd8+t细胞的增殖情况;以及接种7天后,小鼠的外周血细胞中ova特异性cd8+t细胞的增殖情况。
[0078]
2、实验结果
[0079]
mrna纳米疫苗在腹腔注射5分钟后逐渐从肝脏分散到全身各处(图8a)。发现d-cy5-megfp和fd-cy5-megfp在脾脏中有明显的积聚,但无佐剂的cy5-megfp在脾脏中几乎没有积聚(图8a)。此外,d-cy5-megfp和fd-cy5-megfp在其它器官(心、肝、肺、肾)中几乎无积聚(图9),这表明了其具有器官靶向性。
[0080]
评估纳米疫苗注射12小时后的小鼠体温(图8b)发现注射后所有小鼠的体温均保持在37℃左右,表明本发明纳米疫苗成分的生物安全性相对较高,产生全身性炎症的可能性较低。
[0081]
进一步评估ova特异性cd8+t细胞的增殖情况,这是细胞免疫的先驱条件。发现单次疫苗接种5天后,与d-mova相比,fd-mova在脾淋巴细胞中诱导产生了更多的ova特异性cd8+t细胞(大约由11%增加至15%;代表性流式细胞术结果见图8c;统计结果见图10)。接种7天后,对小鼠的外周血细胞进行分析,发现fd mova在外周血淋巴细胞中诱导产生了更多的ova特异性cd8+t细胞(大约由8%增加至13%;代表性流式细胞术结果见图8d;统计结果见图11)。
[0082]
上述结果说明,本发明纳米疫苗生物安全性高,具有脾脏器官的靶向性,能够在脾淋巴细胞中诱导更多ova特异性cd8+t细胞的产生,并且活化的抗原特异性cd8+t细胞可迁移至外周,提高外周血淋巴细胞中ova特异性cd8+t细胞的量。说明本发明纳米疫苗能够有效诱导特异性免疫。
[0083]
实验例4、纳米疫苗在预防接种模型中的有效性
[0084]
1、实验方法
[0085]
使用了ova阳性的t细胞淋巴瘤的预防性疫苗接种模型,来评估所研发的mrna纳米疫苗的肿瘤预防效果。按照图12a所示的时间流程,我们记录了小鼠在注射肿瘤细胞后19天内的肿瘤体积曲线。在第19天,所有小鼠均被处死,取出其肿瘤组织和器官进行组织学评估,使用苏木精-伊红(h&e)染色来评估肿瘤的凋亡和坏死程度以及纳米疫苗的全身毒性。
[0086]
2、实验结果
[0087]
从图12b、12e可以看出,d-mova和fd-mova有效控制了肿瘤体积,明显抑制了肿瘤生长,肿瘤的平均发生时间从大约8天延长到大约15天(图12c),观察结束时(第19天)的肿
瘤平均重量从大约4g减少到大约1g(统计结果见图12d;肿瘤离体照片见图12f)。
[0088]
h&e染色结果如图13所示,图13a可见对照组可见典型的病理性有丝分裂(黄色箭头所示),肿瘤坏死和凋亡程度不明显;mova组的病理学特征与对照组基本一致。不同的是,d-mova组可见更高程度的肿瘤凋亡(蓝色箭头所示),fd-mova组可见更高程度的肿瘤凋亡(蓝色箭头所示)和坏死(红色箭头所示;大约36%的肿瘤坏死面积)。这些组织学结果表明fd-mova具有良好的抗肿瘤作用。此外,肿瘤组织的cd8免疫组化分析显示,fd-mova诱导的cd8+细胞浸润面积最大(图13b;约为对照组的16倍)。同时,心、肝、脾、肺和肾的组织学切片中均未观察到明显改变,这意味着mrna纳米疫苗配方具备较好的生物安全性。
[0089]
上述结果说明,与其它制剂相比,本发明复合佐剂的纳米疫苗fd-mova生物安全性高,引起的肿瘤组织学改变最为明显,本发明的cpg-tfna和mdf2β复合佐剂起到了协同增效的作用,可显著预防肿瘤发生发展,最有利于延长荷瘤小鼠的生存期。
[0090]
综上,本发明提供了一种cpg-tfna和mdf2β的复合佐剂以及基于该复合佐剂的mrna纳米疫苗。mrna在没有佐剂的情况下几乎不会进入细胞发挥功能,而使用本发明复合佐剂的mrna纳米疫苗不但生物安全性好,而且可被树突状细胞内化并促进其成熟,成熟的树突状细胞分泌细胞因子并在细胞膜上表达共刺激分子,随后迁移并与t细胞接触以进行抗原呈递;活化的抗原特异性cd8+t细胞迁移至外周,浸润早期肿瘤组织,识别和攻击肿瘤细胞,最终抑制肿瘤的发生和生长,两种佐剂复合起到了协同增效作用,比仅使用一种佐剂的mrna纳米疫苗具有更好的效果,应用前景优异。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1