抑制MUC1表达和糖基化修饰的物质在降低抗乳腺癌药物耐药性中的应用
抑制muc1表达和糖基化修饰的物质在降低抗乳腺癌药物耐药性中的应用
技术领域
1.本发明属于生物医学领域,具体涉及抑制muc1表达和糖基化修饰的物质在降低抗乳腺癌药物耐药性中的应用。
背景技术:
2.乳腺癌是全世界女性最常被诊断的癌症。乳腺癌肿瘤具有高度异质性,多种信号通路可介导其发生进展,早期筛查是预防乳腺癌的主要手段。尽管随着科技的发展,乳腺癌的治疗方式不断增加(如手术切除、化学治疗、放射治疗、内分泌靶向治疗),但类似于三阴性乳腺癌,由于缺乏激素受体,化疗成为挽救这类癌症最为主要的方法。耐药性是乳腺癌临床治疗中最为严峻的挑战,复发后的乳腺癌对化疗的毒性敏感度急剧下降。并且,有部分乳腺癌即便不产生特定药物的抗药性,其固有特性也使得对化疗药物响应度低。因此,提高乳腺癌的化疗敏感度是急需克服的艰巨挑战。
3.芹菜素,学名为4',5,7-三羟基黄酮,难溶于水,呈黄色针状结晶,在洋甘菊、欧芹、洋葱、莓果及金桔内含量较多,广泛存在于居民膳食饮食中。芹菜素作为植物抵抗逆境产生的次级代谢物,具有极强的生理活性,在抗炎抑菌、抗氧化、稳定机体代谢、调节内分泌、预防心脑血管疾病及中枢神经保护等方面表现优良,尤其是在抑制癌细胞增殖转移方面的研究日益扩增和深入——芹菜素对正常细胞组织具有极低的毒副作用,但对癌细胞却具有较强的杀伤力。在以往的研究中,由于难溶于水的芹菜素生物利用度和吸收率有限,其体内外的使用剂量通常较高,大大限制了这一天然药物临床上的广泛应用。与芹菜素结构类似的黄酮类类药物还有白杨素、香叶木素、木犀草素、槲皮素等,均在体内外具有较强的抑癌活性,具有开发为天然抗癌药物的巨大潜力。然而,黄酮类化合物及顺铂等临床用药均属于小分子药物,其药物敏感度和耐药性一直是癌症治疗临床应用的主要障碍。
4.muc1是i型跨膜粘蛋白,具有高度糖基化的胞外结构。muc1含有可变数目的o-连接的糖基化位点,由于基因的多态性,不同人群可以携带约100-750个范围内的o-聚糖。muc1高度糖基化的胞外结构域可从细胞表面延伸至200-500 nm,在其糖链的末端区通常有大量唾液酸修饰。具体而言,muc1的n端结构域被广泛的o-糖基修饰,交织覆盖在细胞表面形成保护屏障。根据重复序列的数量和糖基化程度,o-糖基化占muc1总重量的50-90%,因此其分子量也随之变化,高分子量代表更多的糖基化修饰。典型的粘蛋白型o-糖基化是通过n-乙酰半乳糖胺(galnac)启动的,其中galnac是连接到丝氨酸或苏氨酸的第一个单糖,可以扩展到各种不同的结构。同时,muc1的糖基化修饰取决于多种糖基转移酶的组织特异性表达和共同协调,其中糖基转移酶gcnt3是修饰muc1核心区 o-糖基化的关键转移酶之一。
技术实现要素:
5.本发明的目的是提高乳腺癌细胞对抗乳腺癌药物的敏感度,从而治疗乳腺癌。
6.本发明首先保护抑制乳腺癌细胞中muc1表达的物质或抑制乳腺癌细胞中muc1糖
基化修饰的物质的应用,可为a1)-a5)中的至少一种:a1)提高乳腺癌细胞对抗乳腺癌药物的敏感度;a2)降低抗乳腺癌药物的耐药性;a3)制备用于提高乳腺癌细胞对抗乳腺癌药物的敏感度的产品;a4)制备用于降低抗乳腺癌药物的耐药性的产品;a5)制备用于辅助治疗乳腺癌的产品。
7.上述应用中,所述抗乳腺癌药物可为顺铂、5-氟尿嘧啶、伯莱霉素、芹菜素、白杨素、香叶木素、木犀草素和槲皮素中的至少一种。
8.上述应用中,所述抑制乳腺癌细胞中muc1表达的物质可为寡聚核酸1、寡聚核酸2或寡聚核酸3;寡聚核酸1由seq id no:1所示的核酸分子和seq id no:2所示的核酸分子组成;寡聚核酸2由seq id no:3所示的核酸分子和seq id no:4所示的核酸分子组成;寡聚核酸3由seq id no:5所示的核酸分子和seq id no:6所示的核酸分子组成。
9.上述应用中,所述抑制乳腺癌细胞中muc1糖基化修饰的物质可为bag、唾液酸酶或抑制乳腺癌细胞中糖基转移酶gcnt3表达的物质。
10.所述抑制乳腺癌细胞中糖基转移酶gcnt3表达的物质可为寡聚核酸a、寡聚核酸b或寡聚核酸c;寡聚核酸a由seq id no:7所示的核酸分子和seq id no:8所示的核酸分子组成;寡聚核酸b由seq id no:9所示的核酸分子和seq id no:10所示的核酸分子组成;寡聚核酸c由seq id no:11所示的核酸分子和seq id no:12所示的核酸分子组成。
11.本发明还保护一种产品,由上述任一所述抗乳腺癌药物和抑制muc1的物质组成;所述抑制muc1的物质为上述任一所述抑制乳腺癌细胞中muc1表达的物质或上述任一所述抑制乳腺癌细胞中muc1糖基化修饰的物质;所述产品的功能可为b1)-b3)中的至少一种:b1)提高乳腺癌细胞对抗乳腺癌药物的敏感度;b2)降低抗乳腺癌药物的耐药性;b3)辅助治疗乳腺癌。
12.本发明还保护一种上述任一所述抗乳腺癌药物的增敏剂,为上述任一所述抑制乳腺癌细胞中muc1表达的物质或上述任一所述抑制乳腺癌细胞中muc1糖基化修饰的物质。
13.本发明还保护一种抗乳腺癌药物的筛选方法,所述抗乳腺癌药物可以被上述任一所述抑制乳腺癌细胞中muc1表达的物质或上述任一所述抑制乳腺癌细胞中muc1糖基化修饰的物质增敏。
14.本发明还保护一种提高乳腺癌细胞对抗乳腺癌药物的敏感度的方法,可通过抑制乳腺癌细胞中muc1表达或抑制乳腺癌细胞中muc1糖基化修饰实现;所述方法用于非疾病的诊断与治疗。
15.本发明还保护一种降低乳腺癌细胞对抗乳腺癌药物的耐药性的方法,可通过抑制乳腺癌细胞中muc1表达或抑制乳腺癌细胞中muc1糖基化修饰实现;所述方法用于非疾病的诊断与治疗。
16.上述任一所述的方法中,所述抑制乳腺癌细胞中muc1表达可通过向乳腺癌细胞中导入抑制乳腺癌细胞中muc1表达的物质实现。所述抑制乳腺癌细胞中muc1表达的物质可为寡聚核酸1、寡聚核酸2或寡聚核酸3;寡聚核酸1由seq id no:1所示的核酸分子和seq id no:2所示的核酸分子组成;寡聚核酸2由seq id no:3所示的核酸分子和seq id no:4所示的核酸分子组成;寡聚核酸3由seq id no:5所示的核酸分子和seq id no:6所示的核酸分子组成。
17.上述任一所述的方法中,所述抑制乳腺癌细胞中muc1糖基化修饰可通过方式一或方式二实现;所述方式一可为用bag或唾液酸酶处理乳腺癌细胞;所述方式二可为向乳腺癌细胞中导入抑制乳腺癌细胞中muc1糖基化修饰的物质实现。所述抑制乳腺癌细胞中muc1糖基化修饰的物质可为抑制乳腺癌细胞中糖基转移酶gcnt3表达的物质;所述抑制乳腺癌细胞中糖基转移酶gcnt3表达的物质可为寡聚核酸a、寡聚核酸b或寡聚核酸c;寡聚核酸a由seq id no:7所示的核酸分子和seq id no:8所示的核酸分子组成;寡聚核酸b由seq id no:9所示的核酸分子和seq id no:10所示的核酸分子组成;寡聚核酸c由seq id no:11所示的核酸分子和seq id no:12所示的核酸分子组成。
18.所述方式一中,bag的处理浓度可为1-3mm(如1-2mm、2-3mm、1mm、2mm或3mm)。
19.所述方式一中,唾液酸酶的处理时间可为6-12h(如6-9h、9-12h、6h、9h或12h)。
20.上述任一所述的方法中,所述抗乳腺癌药物可为顺铂、5-氟尿嘧啶、伯莱霉素、芹菜素、白杨素、香叶木素、木犀草素和槲皮素中的至少一种。
21.上述任一所述乳腺癌细胞为mcf-7细胞和mda-mb-231细胞。
22.本发明的发明人通过细胞实验证明,芹菜素、白杨素、香叶木素、木犀草素和槲皮素等黄酮类化合物和临床常用小分子药物(如顺铂、5-氟尿嘧啶、伯莱霉素)的敏感度均依赖于muc1的表达或muc1的糖基化修饰,缺乏muc1时,靶向其糖基化抑制无法再协同增效药物的胞内毒性。本发明的发明人通过动物实验证明,敲除muc1能够有效提高芹菜素的药物敏感度,促进药物在体内的毒性发挥,降低肿瘤发生发展。由此可见,抑制乳腺癌细胞中muc1表达的物质或抑制乳腺癌细胞中muc1糖基化修饰的物质可与抗乳腺癌药物联合施用患者,从而达到治疗乳腺癌的目的。本发明具有重要的应用价值。
附图说明
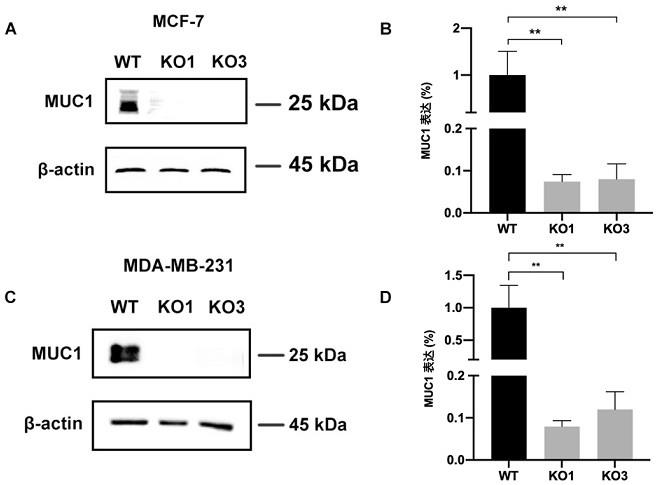
23.图1为crispr cas9介导的muc1单克隆敲除细胞系的蛋白免疫印迹和qpcr检测。其中p
ꢀꢁ
《
ꢁ
0.05被认为具有统计学的显著性:* 表示p《 0.05,**表示p《 0.01,***表示p《 0.001,****表示p《 0.0001,ns表示无显著差异。
24.图2为对乳腺癌细胞生长无额外毒性及muc1转录水平无影响的o-糖基化抑制剂(benzyl-n-acetyl-α-galactosaminide,以下均简称bag)浓度和唾液酸酶(neuraminidase,以下均简称neu)处理时间的筛选。其中p
ꢀꢁ
《
ꢁ
0.05被认为具有统计学的显著性:* 表示p《 0.05,**表示p《 0.01,***表示p《 0.001,****表示p《 0.0001,ns表示无显著差异。
25.图3为o-糖基化抑制剂bag抑制muc1糖基化的蛋白验证。
26.图4为唾液酸酶neu抑制muc1糖基化的蛋白验证。
no:2),之后退火,得到退火产物1。用bsmi(neb公司产品)酶切plenti-crispr v2 all in one载体(addgene)去除特定filter区域,通过切胶回收得到载体骨架。再将退火产物1与载体骨架通过t4连接酶(takara公司产品)进行连接,得到plenti-cripsr v2 all-in-one muc1敲除载体1,简称敲除载体1号。
39.2、按照上述方法,将human muc1 sg1-forward替换为human muc1 sg2-forward:5
′‑
caccgactgggtgcccggtgtca-3
′
(seq id no:3),human muc1 sg1-reverse替换为human muc1 sg2-reverse:5
′‑
aaactgacaccgggcacccagtc-3
′
(seq id no:4),其它步骤均不变,得到lenti-cripsr v2 all-in-one muc1敲除载体2,简称敲除载体2号。按照上述方法,将human muc1 sg1-forward替换为human muc1 sg3-forward:5
′‑
caccgcaggaagaaaggagact-3
′
(seq id no:5),human muc1 sg1-reverse替换为human muc1 sg3-reverse:5
′‑
aaacagtctcctttcttcctgc-3
′
(seq id no:6),其它步骤均不变,得到lenti-cripsr v2 all-in-one muc1敲除载体3,简称敲除载体3号。
40.3、取生长状态极佳的293t细胞,培养至80%融合度时转染敲除载体(敲除载体1号、敲除载体2号或敲除载体3号),72h后收取病毒液,用0.45μm滤膜过滤,收集滤液,即为病毒液。
41.4、取生长状态良好的乳腺癌细胞(mcf-7细胞或mda-mb-231细胞),待细胞融合度生长至40%时加入病毒液感染24h,再用0.5-1μg/ml的嘌呤霉素杀细胞1-2周,将存活的细胞进行收集并在96孔板内单克隆分选,每个存活的、生长良好的单克隆细胞即为一个muc1单克隆敲除细胞系。提取乳腺癌细胞和各个扩增后的muc1单克隆敲除细胞系的蛋白并进行免疫印迹验证,muc1兔单克隆抗体(碧云天公司产品)作为一抗(β-actin为内参蛋白),辣根过氧化物酶标记山羊抗兔igg作为二抗。
42.部分检测结果见图1中a和c(wt为乳腺癌细胞)。结果表明,muc1单克隆敲除细胞系内的muc1均被敲除,将其中3个muc1单克隆敲除细胞系命名为muc1 ko1、muc1 ko2和muc1 ko3。
43.5、使用常规trizol裂解法提取细胞(mcf-7细胞、mda-mb-231细胞、mcf-7 muc1 ko1、mcf-7 muc1 ko3、mda-mb-231 muc1 ko1或mda-mb-231 muc1 ko3)的mrna,溶解于depc水内;之后使用酶标仪对mrna进行浓度和纯度检测,确保浓度高于500ng/
µ
l且od值在1.8-2.0之间才能进行后续反转录;最后将提取得到的mrna进行反转录后,按照m5 super qpcr rt kit的说明书的步骤进行实时荧光定量pcr,用于检测细胞中muc1的mrna表达量;以乳腺癌细胞中muc1的mrna表达量作为1,计算其它细胞的mrna相对表达量(以gapdh作为内参)。
44.检测muc1的引物为:5
’‑
gttacgggttctggtcatgc-3’和5
’‑
tagtcggtgctgggatcttc-3’。检测gapdh的引物为:5
’‑
gggtcatcatctctgcacct-3
’ꢀ
和 5
’‑
ggtcataagtccctccacga-3’。
45.检测结果见图1中b和d(wt为乳腺癌细胞,b为mcf-7,d为mda-mb-231)。结果表明,与乳腺癌细胞相比,muc1单克隆敲除细胞系中muc1的mrna表达量显著降低。
46.由此可见,mcf-7 muc1 ko1、mcf-7 muc1 ko3、mda-mb-231 muc1 ko1和mda-mb-231 muc1 ko3中的muc1均已成功敲除。
47.实施例2、对乳腺癌细胞生长无额外毒性及转录水平无影响的o-糖基化抑制剂(bag)浓度和唾液酸酶(neu)处理时间的筛选
检测muc1基因的引物为5
’‑
gttacgggttctggtcatgc-3’和5
’‑
tagtcggtgctgggatcttc-3’。检测内参基因gapdh的引物为:5
’‑
gggtcatcatctctgcacct-3
’ꢀ
和 5
’‑
ggtcataagtccctccacga-3’。
48.1、提前1-2天将乳腺癌细胞(mcf-7细胞或mda-mb-231细胞)均匀铺设于无菌进口96孔板中,使得密度为3000个/孔,每孔加入100
µ
l培养基。待细胞融合度达到30-40%时,加入培养基(作为对照组)或含有bag的培养基(bag在培养基中的浓度为2mm或4mm),在37℃恒温培养箱内连续培养3天。
49.实验期间,使用cck8法每天检测体系的od
450nm
值;以时间为横坐标,od
450nm
值为纵坐标,绘制生长曲线。mcf-7细胞的检测结果见图2中a(con为对照组)。结果表明,连续处理3天后,2mm的bag对乳腺癌细胞生长无额外毒性。
50.处理24h后,提取乳腺癌细胞的mrna并进行muc1基因的qpcr检测。以对照组的乳腺癌细胞中muc1的表达量作为1.0,计算bag处理的乳腺癌细胞相对表达量(以gapdh作为内参)。
51.检测结果见图2中b(con为对照组)。结果表明,2mm的bag对muc1的转录水平无影响。
52.后续选择2mm的bag进行实验。
53.2、提前1-2天将细胞(mcf-7细胞、mda-mb-231细胞、mcf-7 muc1 ko1或mda-mb-231 muc1 ko1)均匀铺设于无菌进口96孔板中,使得密度为3000个/孔,每孔加入100
µ
l培养基。待细胞融合度达到30-40%时,加入dpbs(作为对照组)或含150 mu/ml唾液酸酶的dpbs,在37℃恒温培养箱内连续培养6h或12h。
54.采用cck8法检测细胞活力,以对照组细胞活力作为1.0,计算唾液酸酶处理的细胞相对活力。
55.部分检测结果见图2中c(con为对照组,neu-6h为唾液酸酶处理6h,neu-12h为唾液酸酶处理12h,wt mcf-7为mcf-7细胞,wt 231为mda-mb-231细胞,ko mcf-7为mcf-7 muc1 ko1,ko 231为mda-mb-231 muc1 ko1)。结果表明,不论是对于野生型细胞(mcf-7细胞或mda-mb-231细胞)还是敲除细胞(mcf-7 muc1 ko1或mda-mb-231muc1 ko1),唾液酸酶处理6h对细胞生长均无额外毒性。
56.唾液酸酶处理后,提取细胞(mcf-7细胞或mda-mb-231细胞)的mrna并进行muc1基因的qpcr检测。以对照组的细胞的表达量作为1.0,计算唾液酸酶处理的细胞的相对表达量。
57.检测结果见图2中d(con为对照组,neu-6h为唾液酸酶处理6h,neu-12h为唾液酸酶处理12h)。结果表明,唾液酸酶处理6h或12h对muc1的转录水平无影响。
58.后续选择唾液酸酶处理6h进行实验。
59.实施例3、bag抑制剂对muc1糖基化的抑制作用用培养基(作为对照组)或含有2mm bag的培养基处理mcf-7细胞24h,提取蛋白后使用免疫印迹方法检测其糖基化表达,一抗为全膜孵育muc1抗体(proteintech公司产品),histone h3(proteintech公司产品)为内参。
60.检测结果见图3(wt为对照组)。结果表明,浓度为2mm 的bag处理mcf-7细胞24h显著抑制其糖基化,具体表现为其高分子量蛋白部分的印迹明显减少,表明muc1糖基化被成
功抑制。
61.实施例4、唾液酸酶对muc1糖基化的抑制作用1、取已生长mcf-7细胞的6孔板,加入dpbs(作为对照组)或含150μu/ml唾液酸酶的dpbs,37℃培养6h(目的为去唾液酸化)。
62.2、完成步骤1后,用预冷的pbs小心清洗mcf-7细胞两次后,使用ripa裂解液冰上快速裂解蛋白后提取蛋白使用免疫印迹方法检测其糖基化表达,一抗为全膜孵育muc1兔单克隆抗体,histone h3兔单克隆抗体为内参。
63.检测结果见图4(wt为对照组)。结果表明,唾液酸酶处理mcf-7细胞6h显著抑制其糖基化,具体表现为其高分子量蛋白部分的印迹减少,表明muc1糖基化被成功抑制。
64.实施例5、使用crispr cas9基因编辑技术构建糖基转移酶gcnt3敲除细胞系1、人工设计并合成human gcnt3 sg1-forward:5
′‑
caccggaagtgtgactctgaccact-3
′
(seq id no:7)和human gcnt3 sg1-reverse:5
′‑
aaacagtggtcagagtcacacttcc-3
′
(seq id no:8),之后退火,得到退火产物1。用bsmi(neb公司产品)酶切plenti-crispr v2 all in one载体(addgene公司产品)去除特定filter区域,通过切胶回收得到载体骨架。再将退火产物1与载体骨架通过t4连接酶(takara公司产品)进行连接,得到plenti-cripsr v2 all-in-one gcnt3敲除载体ko1,简称敲除载体ko1。
65.2、按照上述方法,将human gcnt3 sg1-forward替换为human gcnt3 sg2-forward:5
′‑
caccgggctattctgaataacctgg-3
′
(seq id no:9),human gcnt3 sg1-reverse替换为human gcnt3 sg2-reverse:5
′‑
aaacccaggttattcagaatagccc-3
′
(seq id no:10),其它步骤均不变,得到lenti-cripsr v2 all-in-one gcnt3敲除载体ko2,简称敲除载体ko2。按照上述方法,将human gcnt3 sg1-forward替换为human gcnt3 sg3-forward:5
′‑
caccggcaagctgacctcaactgca-3
′
(seq id no:11),human gcnt3 sg1-reverse替换为human gcnt3 sg3-reverse:5
′‑
aaactgcagttgaggtcagcttgcc-3
′
(seq id no:12),其它步骤均不变,得到lenti-cripsr v2 all-in-one gcnt3敲除载体ko3,简称敲除载体ko3。
66.3、取生长状态极佳的293t细胞,培养至80%融合度时转染敲除载体(敲除载体ko1、敲除载体ko2或敲除载体ko3),72h后收取病毒液,用0.45μm滤膜过滤,收集滤液,即为病毒液。
67.4、取生长状态良好的mcf-7细胞,待细胞融合度生长至30-40%时加入病毒液感染24h,再用1μg/ml嘌呤霉素杀细胞1-2周,将存活下来的细胞进行96孔板单克隆分选,每个存活的、生长状态良好的单克隆细胞即为一个糖基转移酶gcnt3敲除细胞系。
68.将mcf-7细胞和各个糖基转移酶gcnt3敲除细胞系的蛋白进行免疫印迹验证,使用gcnt3兔多克隆抗体(abclonal公司产品)作为一抗,histone h3为内参蛋白,使用辣根过氧化物酶标记山羊抗兔igg作为二抗。部分检测结果见图5中a(wt为mcf-7细胞)。结果表明,部分糖基转移酶gcnt3敲除细胞系内的gcnt3均被敲除。将其中3个糖基转移酶gcnt3敲除细胞系命名为gcnt3 ko1、gcnt3 ko2和gcnt3 ko3。
69.冰上快速提取mcf-7细胞和上述3个糖基转移酶gcnt3敲除细胞系的蛋白后使用免疫印迹方法检测其糖基化表达,全膜孵育muc1单克隆抗体(proteintech公司的产品)作为一抗,histone h3为内参(proteintech公司的产品)。
70.部分检测结果见图5中b(gcnt3 ko为gcnt3 ko1)。结果表明,上述3个糖基转移酶
muc1ko1)均匀铺设于无菌进口96孔板中,使得密度为3000个/孔,每孔加入100
µ
l培养基;待细胞融合度达到30-40%时,随机分为五组进行处理:10
µ
m芹菜素处理组:先加入培养基,37℃恒温培养箱培养6h;接着换液为含10
µ
m芹菜素的培养基,37℃恒温培养箱继续培养48h;50
µ
m芹菜素处理组:先加入培养基,37℃恒温培养箱培养6h;接着换液为含50
µ
m芹菜素的培养基,37℃恒温培养箱继续培养48h;唾液酸酶预处理+10
µ
m芹菜素处理组:先加入含有150mu/ml唾液酸酶的dpbs,37℃恒温培养箱培养6h;接着换液为含10
µ
m芹菜素的培养基,37℃恒温培养箱继续培养48h;唾液酸酶预处理+50
µ
m芹菜素处理组:先加入含有150mu/ml唾液酸酶的dpbs,37℃恒温培养箱培养6h;接着换液为含50
µ
m芹菜素的培养基,37℃恒温培养箱继续培养48h;对照组:先加入培养基,37℃恒温培养箱培养6h;接着换液为新鲜培养基,37℃恒温培养箱继续培养48h;cck8检测试剂盒分别检测五组的细胞活性。
77.实验结果见图7中a(con表示为对照组,10
µ
m为10
µ
m芹菜素处理组,50
µ
m为50
µ
m芹菜素处理组,neu+10
µ
m为唾液酸酶预处理+10
µ
m芹菜素处理组,neu+50
µ
m为唾液酸酶预处理+50
µ
m芹菜素处理组,wtmcf-7为mcf-7细胞,wt231为mda-mb-231细胞,komcf-7为mcf-7muc1ko1,ko231为mda-mb-231muc1ko1)。
78.2、实验前1天在24孔板内铺细胞(mcf-7细胞或mcf-7muc1ko1),密度约为1200个/孔,加入500
µ
l培养基进行培养,37℃培养过夜;第二天生长状态佳时,随机分为四组进行处理:apionly即为芹菜素单独处理组:先加入培养基,37℃恒温培养箱培养24h;接着换液为含50
µ
m芹菜素的培养基,37℃恒温培养箱继续培养1-2周;neuonly即为neu单独处理组:先加入培养基,37℃恒温培养箱培养24h;接着加入含有150mu/ml唾液酸酶的dpbs,37℃恒温培养箱预培养6h,最后换液为新鲜培养基,37℃恒温培养箱继续培养1-2周;neu+api即为neu与芹菜素联合处理组:先加入培养基,37℃恒温培养箱培养24h;接着加入含有150mu/ml唾液酸酶的dpbs,37℃恒温培养箱预培养6h;接着换液为含50
µ
m芹菜素的培养基,37℃恒温培养箱继续培养1-2周;dmso即为溶剂对照组:先加入培养基,37℃恒温培养箱培养24h;接着换液为含1%dmso的培养基,37℃恒温培养箱继续培养1-2周;多聚甲醛固定15分钟后进行结晶紫染色,imagej软件进行计数统计,其中的combine组即为neu+api处理组。
79.观察到的克隆形成结果见图7中b。对克隆的统计结果见图7中c,其中的combine组即为bag+api处理组。
80.结果表明,mcf-7细胞内,唾液酸酶预处理显著提高了芹菜素的毒性敏感度,细胞死亡增加,克隆形成数目下降,但在mcf-7muc1ko1内该现象消失,唾液酸酶不再具有协同增效的作用,表明芹菜素毒性敏感度依赖于muc1的糖基化表达。
81.实施例8、糖基转移酶gcnt3敲除提高乳腺癌细胞对芹菜素的胞内毒性敏感度gcnt3&muc1双敲除mcf-7细胞的制备方法为:(1)取生长状态极佳的293t细胞,
培养至80%融合度时转染gcnt3敲除载体(将敲除载体ko1的嘌呤霉素(puro)抗性序列通过分子克隆技术更换为neo(遗传霉素)抗性序列获得),72h后收取病毒液,用0.45μm滤膜过滤,收集滤液,即为病毒液;(2)取生长状态良好的mcf-7 muc1 ko1细胞,待细胞融合度生长至30-40%时加入病毒液感染24h,再用500μg/ml遗传霉素杀细胞1-2周,将存活下来的细胞进行96孔板单克隆分选,每个存活的、生长状态良好的单克隆细胞即为一个糖基转移酶gcnt3和muc1双敲除细胞系。将其中一个细胞系命名为gcnt3 & muc1双敲除mcf-7细胞。
82.提前1-2天将细胞(mcf-7细胞、mcf-7 gcnt3 ko1、mcf-7 muc1 ko1或gcnt3 & muc1双敲除mcf-7细胞)均匀铺设于无菌进口96孔板中,使得密度为3000个/孔,每孔加入100
µ
l培养基;待细胞融合度达到30-40%时,加入dmso或浓度为50μm的芹菜素溶液(溶剂为dmso),37℃培养48h;cck8检测试剂盒检测细胞活性。
83.实验结果见图8(wt为mcf-7细胞,gcnt3 ko为mcf-7 gcnt3 ko1,muc1 ko为mcf-7 muc1 ko1,double ko 为gcnt3 & muc1双敲除mcf-7细胞,api为加入浓度为50μm的芹菜素溶液)。结果表明,相比于mcf-7细胞,mcf-7 gcnt3 ko1对芹菜素毒性敏感度显著上调,细胞存活率降低;在mcf-7 muc1 ko1和gcnt3 & muc1双敲除mcf-7细胞,gcnt3的进一步敲除没有增加细胞对芹菜素的毒性敏感度,进一步表明芹菜素毒性敏感度依赖于muc1的表达及其糖基化修饰,缺乏muc1时,糖基化抑制无法协同增效芹菜素的胞内毒性。
84.实施例9、muc1缺失可以显著提高多种黄酮类化合物的毒性敏感度1、选取4种与芹菜素结构类似的黄酮类化合物(分别为白杨素(chrysin)、香叶木素(diosmetin)、木犀草素(luteolin)和槲皮素(quercetin))进行实验。
85.提前1-2天将细胞(mcf-7细胞或mcf-7 muc1 ko1)均匀铺设于无菌进口96孔板中,使得密度为3000个/孔,每孔加入100
µ
l培养基。待细胞融合度达到30-40%时,加入含50
µ
m 待测药物(白杨素、香叶木素、木犀草素或槲皮素)的培养基,在37℃恒温培养箱内连续培养48h,cck8检测试剂盒检测细胞活性。
86.实验结果见图9中a(wt为mcf-7细胞,ko为mcf-7 muc1 ko1)。结果表明,相比于mcf-7细胞,mcf-7 muc1 ko1死亡率明显增多,对以上4种黄酮类化合物毒性敏感度显著增加,细胞活性降低。
87.2、提前1-2天将细胞(mcf-7细胞或mcf-7 muc1 ko1)均匀铺设于无菌进口96孔板中,使得密度为3000个/孔,每孔加入100
µ
l培养基。待细胞融合度达到30-40%时,加入含待测药物(白杨素、香叶木素、木犀草素或槲皮素)的培养基(待测药物在培养基中的浓度为0μm、2μm、4μm、8μm、16μm、32μm、64μm、128μm),在37℃恒温培养箱内连续培养48h,cck8检测试剂盒检测细胞活性。
88.实验结果见图9中b(wt为mcf-7细胞,ko为mcf-7 muc1 ko1)。结果表明,白杨素、香叶木素、木犀草素和槲皮素的ic
50
(半数致死浓度)在mcf-7 muc1 ko1内显著下调,提示药物敏感度的提高。可见白杨素、香叶木素、木犀草素和槲皮素物的毒性敏感度依赖于muc1的表达。
89.实施例10、o-糖基化抑制剂联合芹菜素类似黄酮类化合物的细胞毒性敏感度检测提前1-2天将细胞(mcf-7细胞或mcf-7 muc1 ko1)均匀铺设于无菌进口96孔板中,使得密度为3000个/孔,每孔加入100
µ
l培养基。待细胞融合度达到30-40%时,随机分为四组进行处理:
bag处理组:先加入培养基,37℃恒温培养箱培养24h;接着换液为含2mm bag的培养基,37℃恒温培养箱培养24h,接着换液为新鲜培养基;待测药物处理组:先加入培养基,37℃恒温培养箱培养24h;接着换液为含50
µ
m待测药物(chr、dio、lut或que)的培养基,37℃恒温培养箱继续培养48h;combine处理组:先加入含有2mm bag的培养基,37℃恒温培养箱预培养24h;接着分别换液为含50
µ
m chr、50
µ
m dio、50
µ
m lut和50
µ
m que的培养基,37℃恒温培养箱继续培养48h;dmso组:先加入培养基,37℃恒温培养箱培养24h;接着换液为含1% dmso的培养基,37℃恒温培养箱继续培养48h;cck8检测试剂盒检测细胞活性。
90.实验结果见图10(wt为mcf-7细胞,ko为mcf-7 muc1 ko1)。结果表明,在mcf-7细胞内,bag预处理显著增加了对白杨素、香叶木素、木犀草素和槲皮素的敏感度,细胞活性降低;但在mcf-7 muc1 ko1内,该现象消失,bag无法协同增效,表明白杨素、香叶木素、木犀草素和槲皮素的毒性敏感度依赖于muc1的糖基化修饰,缺乏muc1时,靶向其糖基化抑制无法再协同增效药物的胞内毒性。
91.实施例11、o-糖基化抑制剂联合临床常用小分子药物(如顺铂、5-氟尿嘧啶、伯莱霉素)的细胞毒性敏感度检测选取3个临床常用小分子药物(分别为顺铂(cisplatin)、5-氟尿嘧啶(5-fu)和伯莱霉素(bleomycin))进行实验。
92.提前1-2天将细胞(mcf-7细胞或mcf-7 muc1 ko1)均匀铺设于无菌进口96孔板中,使得密度为3000个/孔,每孔加入100
µ
l培养基。待细胞融合度达到30-40%时,随机分为八组进行处理:dmso组:先加入培养基,37℃恒温培养箱培养24h;接着换液为含1% dmso的培养基,37℃恒温培养箱继续培养48h;bag处理组:先加入含有2mm bag的培养基,37℃恒温培养箱预培养24h,最后换液为新鲜培养基,37℃恒温培养箱继续培养48h;cisplatin处理组:先加入培养基,37℃恒温培养箱培养24h;接着换液为含20
µ
m cisplatin的培养基,37℃恒温培养箱继续培养48h;bag+cis处理组:先加入含2mm bag的培养基,37℃恒温培养箱培养24h;接着换液为含20
µ
m cisplatin的培养基,37℃恒温培养箱继续培养48h;5-fu处理组:先加入培养基,37℃恒温培养箱培养24h;接着换液为含10
µ
m 5-fu的培养基,37℃恒温培养箱继续培养48h;bag+5-fu处理组:先加入含2mm bag的培养基,37℃恒温培养箱培养24h;接着换液为含10
µ
m 5-fu的培养基,37℃恒温培养箱继续培养48h;bleomycin处理组:先加入培养基,37℃恒温培养箱培养24h;接着换液为含20
µ
m bleomycin的培养基,37℃恒温培养箱继续培养48h;bag+bleo处理组:先加入含2mm bag的培养基,37℃恒温培养箱培养24h;接着换液为含20
µ
m bleomycin的培养基,37℃恒温培养箱继续培养48h;cck8检测试剂盒检测细胞活性。
93.实验结果见图11(wt为mcf-7细胞,ko为mcf-7 muc1 ko1)。结果表明,在mcf-7细胞内,bag预处理显著增加对顺铂、5-氟尿嘧啶和伯莱霉素的敏感度,细胞活性降低;但在mcf-7 muc1 ko1内,该现象消失,bag无法协同增效,表明小分子药物的毒性敏感度依赖于muc1的表达及其糖基化修饰,缺乏muc1时,靶向其糖基化抑制无法再协同增效药物的胞内毒性。
94.实施例12、裸鼠荷瘤实验验证spf级雌性balb/c nude裸鼠为北京charles river公司的产品,饲养于中国农业大学spf级动物饲养中心;下述spf级雌性balb/c nude裸鼠简称裸鼠。
95.1、取生长至5周龄的裸鼠,每只右腋窝皮下接种细胞(mcf-7细胞或mcf-7 muc1 ko1),细胞接种浓度均为1
×
106个/100μl(pbs:matrigel=1:1,matrigel为基质胶,购于赛默飞公司),接种量为100μl/只。
96.2、完成步骤1 1-2周后,将肿瘤移植成功的裸鼠随机分为药物处理组(n=8)和对照组(n=8),对照组给予溶剂dmso(1%)处理,药物处理组给予芹菜素处理(剂量为40 mg/kg/天),连续处理16天,给药方式均为腹腔注射。实验期间,每隔1天测量肿瘤重量、肿瘤体积和裸鼠体重。
97.实验结果见图12(wt+dmso为接种mcf-7细胞并给予dmso处理,ko+dmso为接种mcf-7 muc1 ko1并给予dmso处理,wt+api为接种mcf-7细胞并给予40 mg/kg的芹菜素处理,ko+api为接种mcf-7 muc1 ko1并给予40 mg/kg的芹菜素处理)。结果表明,对照组中,接种mcf-7 细胞和mcf-7 muc1 ko1的肿瘤体积及肿瘤重量均无显著差异;药物处理组中,接种mcf-7 muc1 ko1的肿瘤体积及肿瘤重量显著小于mcf-7 细胞;四组裸鼠的体重无显著差异,表明裸鼠均正常生长。由此可见,敲除muc1能够有效提高芹菜素的药物敏感度,促进药物在体内的毒性发挥,降低肿瘤发生发展。
98.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1