一种用于ADC的双药-接头的制备方法及其用途与流程
一种用于adc的双药-接头的制备方法及其用途
技术领域
1.本发明属于药物领域,具体涉及一种用于adc的双药-接头的制备方法及其用途。
背景技术:
2.抗体-药物偶联物(antibody-drug conjugate;adc)能够选择性的向癌细胞输送药物,并杀死癌细胞,但是对正常细胞的影响较小,开创了肿瘤治疗的新纪元。作为adc,已有多个药物获得fda批准上市,如抗体cd33连接卡奇霉素而成的mylotarg,cd30抗体连接澳瑞他汀e而成的adcetris用于霍奇金淋巴瘤和未分化大细胞淋巴瘤患者的治疗,her2抗体和喜树碱衍生物dxd连接而成的ds-8201用于her2阳性的乳腺癌患者的治疗以及靶向trop-2抗原(也称作上皮糖蛋白1,egp-1)的sacituzumabgovitecan。
3.迄今为止被fda承认的adc中含有的药物主要以dna或微管蛋白为靶标。已上市的adc分别由抗体和靶向dna或者微管蛋白的药物连接,目前没有任何将抗体和靶向dna和微管蛋白的药物同时连接的adc上市,尚不清楚将靶向dna和微管蛋白的药物同时连接到抗体上是否能通过两种不同的抗肿瘤作用机制杀伤肿瘤,是否能有效发挥作用。
4.作为抗肿瘤的小分子化合物,已知作为抑制dna拓扑异构酶i而达到抗肿瘤作用的化合物的喜树碱衍生物,如sn-38,dxd,dx-8951在体内和体外均确认了对多种癌细胞有杀伤作用,显示出强抗肿瘤效果。作为抑制微管蛋白而达到抗肿瘤作用的化合物,如eribulin,mmae,mmaf,美登素等在体内和体外均确认了对多种癌细胞有杀伤作用,显示出强抗肿瘤效果。将两种不同机制的抗肿瘤药物连接到相同的抗体上,可能会对抗肿瘤活性有协同作用,也可能会抗肿瘤活性产生拮抗作用,实际效果无法预期。
5.因此,亟需研究出一种高效、安全的多药物多靶点作用机制的adc,这对开发抗肿瘤效果和安全性优异的抗肿瘤药物具有非常重要的意义。
技术实现要素:
6.本发明的目的在于提供一种双药物链接组装单元及其对应的双药靶向接头-药物偶联物。
7.本发明提供了式iii所示的双药物链接组装单元、或其立体异构体、或其旋光异构体、或其氘代化合物:
[0008][0008][0009]
其中,t是拴系基团,它能够与靶向接头连接;所述靶向接头为能够靶向结合病变部位的物质;
[0010]
u是三叉型连接子部分,u的结构为其中,y1、y2、y3各自独立的选自conh、nhco、co、nh、coo、oco、各自独立的选自conh、nhco、co、nh、coo、oco、或无;la、lb、lc、ld、le、lf、lg、lh各自独立的选自0~8个亚甲基;a选自n、取代或未取代的以下基团:芳基、杂芳基、链烷基、稠环烷基、杂稠环基、饱和环烷基或饱和杂环烷基,所述取代基各自独立的选自卤素、氰基、羟基、c
1~6
烷基或c
1~6
烷氧基;
[0011]
m、n、p各自独立的选自0~30的整数,且n、p不同时为0;
[0012]
w1、w2、w3各自独立的选自亚甲基、各自独立的选自亚甲基、亚烯基、亚炔基、3~8元芳基、3~8元杂芳基;wa选自2~8整数;
[0013]
l1和l2为可断裂或不可断裂的链接基团;
[0014]
d1、d2分别是第一药物结构单元和第二药物结构单元,d1和d2的结构相同或不同。
[0015]
进一步地,所述t能够与靶向接头上的巯基、氨基反应连接。
[0016]
进一步地,所述的结构选自:
[0017]
[0018]
[0019][0020]
进一步地,所述双药物链接组装单元的结构如式iv所示:
[0021][0022]
其中,u的结构为其中,y1、y2、y3各自独立的选自conh、co、nh、o、conh、co、nh、o、或无;la、lb、lc、ld、le、lf、lg、lw、lv各自独立的选自0~4个亚甲基;a选自n、取代或未取代的以下基团:
芳基、杂芳基、链烷基、饱和环烷基或饱和杂环烷基,所述取代基各自独立的选自卤素、氰基、羟基、c
1~6
烷基或c
1~6
烷氧基;
[0023]
m、n、p各自独立的选自0~30的整数,且n、p不同时为0;
[0024]
w1、w2、w3各自独立的选自亚甲基、各自独立的选自亚甲基、亚烯基、亚炔基、3~8元芳基、3~8元杂芳基;wa选自2~4整数;
[0025]
x1、x2各自独立的选自其中,a、b、c、d各自独立的选自0或1,r1、r2、r3、r4各自独立的选自h、c
1~5
烷基、取代或者未取代的苄基、-l7nhconh2,l7为0~3个亚甲基;
[0026]
b1,b2,c1,c2,e1,e2各自独立的选自取代或未取代的以下基团:l8nhl3、l4ol5或无;所述取代基各自独立的选自c
1~5
烷基;其中l8、l3、l4、l5、l6各自独立的选自0~2个亚甲基;
[0027]
d1、d2各自独立的选自细胞毒性药物、治疗自身免疫疾病的药物或抗炎的药物;
[0028]
t如上所述。
[0029]
进一步地,所述双药物链接组装单元的结构如式v所示:
[0030][0031]
其中,y1、y2、y3各自独立的选自conh、co、nh、o、各自独立的选自conh、co、nh、o、或无;la、lb、lc、ld、le、lf、lg、lw、lv各自独立的选自0~4个亚甲基;a选自n、取代或未取代的苯基、取代或未取代的所述取代基各自独立的选自卤素、氰基、羟基、c
1~6
烷基或c
1~6
烷氧基;
[0032]
m、n、p各自独立的选自0~30的整数,且n、p不同时为0;
[0033]
w1、w2、w3各自独立的选自亚甲基、各自独立的选自亚甲基、wa选自2~3整数;且w2、w3中至少一个为
[0034]
x1,x2,b1,b2,c1,c2,e1,e2,d1、d2如上所述。
[0035]
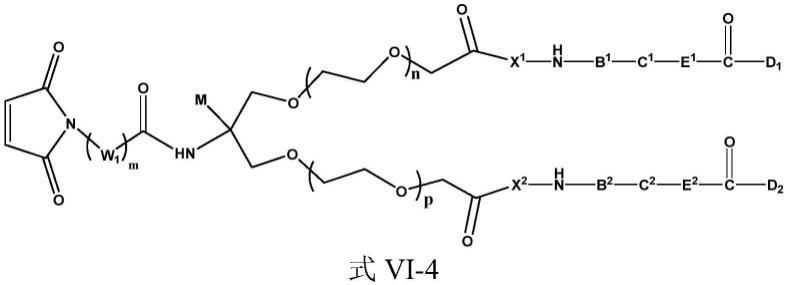
进一步地,所述双药物链接组装单元的结构如式vi-1、vi-2、vi-3或vi-4所示:
[0036]
[0037][0038]
其中,m、n、p各自独立的选自0~30的整数;
[0039]
w1、w2、w3各自独立的选自亚甲基、各自独立的选自亚甲基、wa选自2~3整数;且w2、w3中至少一个为
[0040]
m选自卤素、氰基、羟基、c
1~6
烷基或c
1~6
烷氧基;
[0041]
la、lb、lc、ld、lg各自独立的选自0~2个亚甲基;
[0042]
x1、x2、b1、b2、c1、c2、e1、e2、d1、d2如上所述。
[0043]
进一步地,所述双药物链接组装单元的结构选自以下结构之一:
[0044]
[0045]
[0046]
[0047]
[0048][0049]
其中,m选自0~8的整数;
[0050]
n、p各自独立的选自0~20的整数,且n、p不同时为0;
[0051]
w1、w2、w3各自独立的选自亚甲基、各自独立的选自亚甲基、wa选自2~3整数;且w2、w3中至少一个为
[0052]
la、lb、lc、ld、lg各自独立的选自无、亚甲基或亚乙基;
[0053]
d1、d2如上所述。
[0054]
进一步地,所述双药物链接组装单元的结构为以下结构之一:
[0055]
[0056]
[0057][0058]
其中,n、p各自独立的选自0~20的整数,且n、p不同时为0;w2、w3各自独立的选自亚
甲基、且w2、w3中至少一个为
[0059]
lb、ld各自独立的选自无或亚乙基;
[0060]
d1、d2如上所述。
[0061]
进一步地,所述d1、d2各自独立的选自以dna为靶标的药物单元或以微管蛋白为靶标的药物单元;所述以dna为靶标的药物单元优选为sn-38,dxd,dx-8951或其衍生物,和/或,所述以微管蛋白为靶标的药物单元优选为eribulin,mmae,mmaf,美登素或其衍生物。
[0062]
进一步地,所述双药物链接组装单元为以下结构之一:
[0063]
[0064]
[0065]
[0066]
[0067]
[0068]
[0069]
[0070][0071]
本发明还提供了一种双药靶向接头-药物偶联物分子、或其立体异构体、或其旋光异构体、或其氘代化合物,所述双药靶向接头-药物偶联物分子是由靶向接头和q个上述的双药物链接组装单元连接所得;所述靶向接头为能够靶向结合病变部位的物质;所述双药靶向接头-药物偶联物分子的结构如式i所示:
[0072][0073]
其中,ab为靶向接头,1≤q≤8,t、w1、w2、w3、m、n、p、u、l1、l2、d1、d2如上所述。
[0074]
进一步地,所述靶向接头为抗体、抗体片段、蛋白、多肽或核酸适配体,所述抗体优选为针对细胞表面受体和肿瘤相关抗原的抗体。
[0075]
进一步地,所述双药靶向接头-药物偶联物分子的结构选自以下结构之一:
[0076]
[0077]
[0078]
[0079]
[0080]
[0081]
[0082]
[0083][0084]
本发明还提供了一种双药靶向接头-药物偶联物、或其立体异构体、或其旋光异构体、或其氘代化合物,其特征在于:所述双药靶向接头-药物偶联物是由靶向接头和上述的双药物链接组装单元连接所得;所述靶向接头为能够靶向结合病变部位的物质,优选为抗体、抗体片段、蛋白或核酸适配体;所述抗体优选为针对细胞表面受体和肿瘤相关抗原的抗体。
[0085]
进一步地,所述双药靶向接头-药物偶联物由式xia所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为3.5
±
1.0,优选为3.5;
[0086]
或,所述双药靶向接头-药物偶联物由式xib所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为3.8
±
1.0,优选为3.8;
[0087]
或,所述双药靶向接头-药物偶联物由式xic所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为3.9
±
1.0,优选为3.9;
[0088]
或,所述双药靶向接头-药物偶联物由式xid所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.1
±
1.0,优选为4.1;
[0089]
或,所述双药靶向接头-药物偶联物由式xie所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.6
±
1.0,优选为4.6;
[0090]
或,所述双药靶向接头-药物偶联物由式xif所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为3.7
±
1.0,优选为3.7;
[0091]
或,所述双药靶向接头-药物偶联物由式xig所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.2
±
1.0,优选为4.2;
[0092]
或,所述双药靶向接头-药物偶联物由式xih所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.1
±
1.0,优选为4.1;
[0093]
或,所述双药靶向接头-药物偶联物由式xii所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.7
±
1.0,优选为4.7;
[0094]
或,所述双药靶向接头-药物偶联物由式xij所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为2.8
±
1.0,优选为2.8;
[0095]
或,所述双药靶向接头-药物偶联物由式xik所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为2.9
±
1.0,优选为2.9;
[0096]
或,所述双药靶向接头-药物偶联物由式xil所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.5
±
1.0,优选为4.5;
[0097]
或,所述双药靶向接头-药物偶联物由式xim所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.4
±
1.0,优选为4.4;
[0098]
或,所述双药靶向接头-药物偶联物由式xin所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为3.7
±
1.0,优选为3.7;
[0099]
或,所述双药靶向接头-药物偶联物由式xio所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为3.9
±
1.0,优选为3.9;
[0100]
或,所述双药靶向接头-药物偶联物由式xip所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为3.5
±
1.0,优选为3.5;
[0101]
或,所述双药靶向接头-药物偶联物由式xiq所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.8
±
1.0,优选为4.8;
[0102]
或,所述双药靶向接头-药物偶联物由式xir所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.9
±
1.0,优选为4.9;
[0103]
或,所述双药靶向接头-药物偶联物由式xis所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.2
±
1.0,优选为4.2;
[0104]
或,所述双药靶向接头-药物偶联物由式xit所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为5.3
±
1.0,优选为5.3;
[0105]
或,所述双药靶向接头-药物偶联物由式xiu所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.5
±
1.0,优选为4.5;
[0106]
或,所述双药靶向接头-药物偶联物由式xiv所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.9
±
1.0,优选为4.9;
[0107]
或,所述双药靶向接头-药物偶联物由式xiw所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为3.8
±
1.0,优选为3.8;
[0108]
或,所述双药靶向接头-药物偶联物由式xix所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.9
±
1.0,优选为4.9;
[0109]
或,所述双药靶向接头-药物偶联物由式xiy所示双药靶向接头-药物偶联物分子中的两种或两种以上组成,该双药靶向接头-药物偶联物的dar值为4.8
±
1.0,优选为4.8。
[0110]“dar值”表示双药靶向接头-药物偶联物中,一个靶向接头上偶联的双药物链接组装单元的平均个数,相当于q值的平均值。dar值可以不是整数。
[0111]
本发明还提供了上述双药靶向接头-药物偶联物分子,或上述双药靶向接头-药物偶联物的制备方法,其特征在于:所述方法包括以下步骤:将靶向接头与双药物链接组装单元偶联,即得。
[0112]
本发明还提供了一种预防和/或治疗肿瘤的药物,它是以上述的双药靶向接头-药物偶联物分子或上述双药靶向接头-药物偶联物为活性成分,加上药学上可接受的辅料制
成的制剂。
[0113]
本发明还提供了上述的双药靶向接头-药物偶联物分子或上述双药靶向接头-药物偶联物在制备预防和/或治疗肿瘤的药物中的用途。
[0114]
进一步地,所述肿瘤为her2阳性肿瘤。
[0115]
进一步地,所述肿瘤选自肺癌、尿道癌、大肠癌、前列腺腺癌、卵巢癌、胰腺癌、乳腺癌、膀胱癌、胃癌、胃肠道间质瘤、宫颈癌、食道癌、鳞状细胞癌、腹膜癌、肝癌、结肠癌、直肠癌、结直肠癌、子宫癌、唾液腺癌、肾癌、外阴癌、甲状腺癌、阴茎癌、白血病、恶性淋巴瘤、浆细胞瘤、骨髓瘤或肉瘤。
[0116]
关于本发明的使用术语的定义:除非另有说明,本文中基团或者术语提供的初始定义适用于整篇说明书的该基团或者术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
[0117]
拴系基团,是指能够与靶向接头连接的基团。
[0118]
本文“取代”是指分子中的1个、2个或多个氢原子被其它不同的原子或分子所替换,包括该分子中同位原子或异位原子上的1个、2个或多个取代。
[0119]“芳基”指具有共轭的π电子体系的全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,例如苯基和萘基。所述芳基环可以稠合于其它环状基团(包括饱和和不饱和环),但不能含有杂原子如氮,氧,或硫,同时连接母体的点必须在具有共轭的π电子体系的环上的碳原子上。芳基可以是取代的或未取代的。
[0120]“杂芳基”指包含一个到多个杂原子的杂芳族基团。这里所指的杂原子包括氧、硫和氮。例如呋喃基、噻吩基、吡啶基、吡唑基、吡咯基、n-烷基吡咯基、嘧啶基、吡嗪基、咪唑基、四唑基等。所述杂芳基环可以稠合于芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为杂芳基环。杂芳基可以是任选取代的或未取代的。
[0121]“稠环烷基”指多环的环烷基,且该多环的环烷基中有两个环共用两个相邻的碳原子。
[0122]“杂稠环基”指多环的杂环基,且该多环的杂环基中有两个环共用两个相邻的碳原子或杂原子。
[0123]
本发明中,“q”表示平均值。例如,当1≤q≤8时,表示该平均值为大于等于1且小于等于8之间的数值。
[0124]“抗体”或“抗体单元”在其所属范围内,包括抗体结合的任何部分。这一单元可以结合,反应性关联或者络合一个受体,抗原,或者靶向细胞群体具有的其他受体单元。抗体可以是任何蛋白或蛋白类分子,它可以结合,络合或者与待治疗或生物改造的细胞群体的一部分反应。
[0125]
本发明中的抗体能够专一性的与抗原结合。设计的抗原包括:肿瘤相关抗原(taa),细胞表面受体蛋白和其他细胞表面分子,细胞存活调节因子,细胞增殖调节因子,与组织生长或分化相关的分子(如已知或预知的具有功能性的),淋巴因子,细胞因子,参与细胞循环调节的因子,参与血管生成的分子,以及与血管生成相关的分子。肿瘤相关抗原可以是簇分化抗原(如cd蛋白)。本发明中所述抗体结合的抗原可以是上述分类中的一个或一个子集,其他的子集包含其他的具有特殊性质的分子/抗原。
[0126]
应用在本发明双药物链接组装单元及双药靶向接头-药物偶联物中的抗体包括,
但不局限于,针对细胞表面受体的肿瘤相关的抗原的抗体。肿瘤相关抗原包括但不局限于,以下列出的肿瘤相关抗原,包括名称和基因库登录号。抗体靶向对应肿瘤相关的抗原包括所有的氨基酸序列变种和同种,与参考文献中确认的序列具有至少70%,80%,85%,90%或95%的同源性,或者具备与引用文献中的肿瘤相关抗原序列具有完全一致的生物性质和特性。
[0127]
肿瘤相关抗原有:bmpr1b(genbank登录号:nm-001203),e16(genbank登录号:nm-003486),steap1(genbank登录号:nm-012449),0772p(genbank登录号:af361486),mpf(genbank登录号:nm-005823),napi3b(genbank登录号:nm-006424),sema 5b(genbank登录号:ab040878),pscahlg(genbank登录号:ay358628),etbr(genbank登录号:ay275463),msg783(genbank登录号:nm-017763),steap2(genbank登录号:af455138),trpm4(genbank登录号:nm-017636),cripto(genbank登录号:np-003203或nm-003212),cd21(genbank登录号:m26004),cd79b(genbank登录号:nm-000626),fcrh2(genbank登录号:nm-030764),her2(genbank登录号:m11730),nca(genbank登录号:m18728),mdp(genbank登录号:bc017023),il20rα(genbank登录号:af184971),brevican(genbank登录号:af229053),ephb2r(genbank登录号:nm-004442),geda(genbank登录号:ay260763),baff-r(genbank登录号:af1164546),cd22(genbank登录号:ak026467),cd79a(genbank登录号:np-001774.1),cxcr5(genbank登录号:np-001701.1),hla-dob(genbank登录号:np-002111.1),p2x5(genbank登录号:np-002552.2),cd72(genbank登录号:np-001773.1),ly64(genbank登录号:np-005573.1),fcrh1(genbank登录号:np-443170.1),irta2(genbank登录号:np-112571.1),tenb2(genbank登录号:af179274)。
[0128]
如本文所用,“药物”或者代号为“d”泛指任何具有期望的生物活性、并具有反应性官能团以制备本发明所述的偶联物的化合物。进一步地,药物包括一种用于癌症治疗的细胞毒性化合物,一种具有生物活性的蛋白或者多肽,包括但不限于喜树碱衍生物,如sn-38,dxd,dx-8951,作用于微管蛋白的化合物,如eribulin,mmae,mmaf,美登素等(结构如下)。
[0129][0130][0131]
按照细胞内药物释放机制,本文所述“连接子”或“抗体药物偶联物连接子”可被分为两类:不可断裂连接子和可断裂连接子。
[0132]
对于含有不可断裂连接子的双药抗体药物偶联物,其药物释放机制为:偶联物和抗原结合并被细胞内吞后,抗体在溶酶体中被酶解,释放出小分子药物,连接子和抗体氨基酸残基共同组成的活性小分子。
[0133]
可断裂连接子在目标细胞内断裂并释放出活性药物(小分子药物自身),可断裂连接子可分为两个主要的类别:化学不稳定连接子和酶不稳定连接子。
[0134]
化学不稳定连接子可以由于血浆和细胞质性质的不同而选择性的断裂,这样的性质包括ph值,谷胱甘肽浓度等。酶不稳定连接子,如肽连接子,能够更好的控制药物释放。肽连接子能够被溶酶体内蛋白酶,如组织蛋白酶或纤溶酶有效的切断。这种肽连接被认为在血浆中非常稳定,因为细胞外不合宜的ph值及血清蛋白酶抑制剂导致蛋白酶通常在细胞外不具备活性。鉴于较高的血浆稳定性和良好的细胞内断裂选择性和有效性,酶不稳定连接子被广泛用于抗体药物偶联物的可断裂连接子。
[0135]“自稳定接头”指在双药抗体药物偶联物中将抗肿瘤化合物连接于抗体的接头结构。
[0136]
本发明提供了一种双药物链接组装单元,该双药物链接组装单元能够与靶向接头链接得到对应的双药靶向接头-药物偶联物,该双药靶向接头-药物偶联物能够靶向作用于肿瘤细胞,降低对正常细胞的毒副作用,同时能够有效克服药物的耐药性,取得了协同增效的抗肿瘤效果。与已经上市的adc:ds-8201相比,本发明提供的adc对her2阳性细胞株n87和sk-br-3d抑制作用都明显提高。本发明的双药物链接组装单元和双药靶向接头-药物偶联物在制备预防和/或治疗的抗肿瘤药物中具有广阔的应用前景。
[0137]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0138]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
[0139]
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
[0140]
实施例1、本发明双药链接组装单元式xia的制备
[0141][0142]
步骤1:中间体l-3的制备
[0143][0144]
化合物l-2的制备方法参照申请号为2020107518214的中国专利申请。
[0145]
25ml反应瓶中加入化合物l-2(179mg,0.15mmol),化合物l-1(87mg,0.15mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(69mg,0.18mmol),n,n-二异丙基乙胺(29mg,0.227mmol),n,n-二甲基甲酰胺(2ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物tlc层析纯化(展开剂:二氯甲烷:甲醇=10:1),得中间体l-3,重132mg,收率52.3%。
[0146]
步骤2:中间体l-4的制备
[0147][0148]
25ml反应瓶中加入中间体l-3(30mg,0.017mmol),1,8-二偶氮杂双螺环[5.4.0]十一-7-烯(2.7mg,0.017mmol),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc监控反应完全,直接用于下一步。
[0149]
步骤3:中间体l-6的制备
[0150][0151]
25ml反应瓶中加入中间体l-4(30mg,0.02mmol),中间体l-5(26mg,0.07mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(25mg,0.07mmol),n,n-二异丙基乙胺(9.2mg,0.07mmol),n,n-二甲基甲酰胺(3ml),室温反应30分钟,tlc显示原料l-4消失,反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物tlc层析纯化(二氯甲烷:甲醇=10:1),得中间体l-6重17mg,收率47%。
[0152]
步骤4:中间体l-8的制备
[0153]
[0154]
25ml反应瓶中加入中间体l-7(60mg,0.071mmol),l-1(41mg,0.071mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(32.5mg,0.085mmol),n,n-二异丙基乙胺(13.8mg,0.101mmol),n,n-二甲基甲酰胺(1ml),室温搅拌反应0.5h,tlc监控显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物tlc层析纯化(二氯甲烷:甲醇=10:1),得中间体l-8,重58.4mg,收率60%。
[0155]
步骤5:中间体l-9的制备
[0156][0157]
10ml反应瓶中加入l-8(10mg,0.007mmol),1,8-二偶氮杂双螺环[5.4.0]十一-7-烯(2mg,0.010mmol),n,n-二甲基甲酰胺(1.5ml),室温搅拌反应10分钟,tlc显示l-8消失,反应完全,直接用于下一步。
[0158]
步骤6:化合物xia的制备
[0159][0160]
25ml反应瓶中加入中间体l-6(10mg,0.005mmol),l-9(6mg,0.005mmol),n,n-二甲基甲酰胺(1.5ml),n,n-二异丙基乙胺(1.2mg,0.007mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂
苯并三唑-1-基)六氟磷酸脲(2mg,0.006mmol),冰水浴冷却搅拌反应1小时,tlc显示l-6消失,反应完全。减压浓缩除去n,n-二甲基甲酰胺,残余物tlc薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xia,重11.7mg。收率72%。
[0161]
实施例2、本发明双药链接组装单元xib的制备
[0162][0163]
步骤1:化合物xib的制备
[0164][0165]
25ml反应瓶中,加入中间体l-6(10mg,0.005mmol),中间体l-7(5.8mg,0.005mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(2.5mg,0.006mmol),n,n-二异丙基乙胺(1.2mg,0.007mmol),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xib,重12mg,收率96%。
[0166]
实施例3、本发明双药链接组装单元式xic的制备
[0167][0168]
步骤1:化合物c-1的制备
[0169][0170]
25ml反应瓶中加入化合物l-1(100mg,0.18mmol),化合物c(200mg,0.18mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(101mg,0.27mmol),n,n-二异丙基乙胺(45mg,0.35mmol),n,n-二甲基甲酰胺(4ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物tlc层析纯化(展开剂:二氯甲烷:甲醇=10:1),得中间体c-1,重200mg,收率67%。
[0171]
步骤2:化合物c-2的制备
[0172][0173]
25ml反应瓶中加入中间体c-1(30mg,0.020mmol),1,8-二偶氮杂双螺环[5.4.0]十一-7-烯(4.5mg,0.030mg),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc监控反应完全,直接用于下一步。
[0174]
步骤3:化合物xic的制备
[0175][0176]
25ml反应瓶中,加入中间体l-6(10mg,0.006mmol),中间体c-2(8.2mg,0.006mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(3.42mg,0.009mmol),n,n-二异丙基乙胺(1.5mg,0.012mmol),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xic,重14mg,收率67%。
[0177]
实施例4、本发明双药链接组装单元式xid的制备
[0178][0179]
步骤1:化合物xid的制备
[0180][0181]
25ml反应瓶中,加入中间体l-6(10mg,0.006mmol),中间体c(5mg,0.006mmol),n,
n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(3.42mg,0.009mmol),n,n-二异丙基乙胺(1.5mg,0.012mmol),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xid,重8mg,收率50%。
[0182]
实施例5、本发明双药链接组装单元式xie的制备
[0183][0184]
步骤1:化合物xie的制备
[0185][0186]
向25ml反应瓶中加入中间体l-12(15mg,0.008mmol),l-9(10mg,0.008mmol),n,n-二甲基甲酰胺(1ml),n,n-二异丙基乙胺(1.5mg,0.012mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(3.6mg,0.010mmol),室温搅拌反应20分钟,lcms监测l-12消失,反应完全。直接反相制备得到12mg黄色固体,收率52%。
[0187]
实施例6:本发明双药链接组装单元xif的制备
[0188][0189]
步骤1:中间体l-11的制备
[0190][0191]
25ml反应瓶中加入l-10(460mg,1.475mmol),3-氨基戊二酸(200mg,1.359mmol),
碳酸氢钠(148mg,1.767mmol),四氢呋喃6ml,水12ml,室温搅拌反应24小时,过滤,滤液用50ml乙酸乙酯萃取,分液,水相用盐酸调ph为2,用100ml乙酸乙酯:甲醇=40:1萃取,无水硫酸钠干燥,浓缩,得化合物l-11,重35mg,收率7%。
[0192]1h nmr(400mhz,cdcl3)δ12.01(s,1h),11.90(s,1h),8.14(s,1h),δ7.83(s,1h),7.74(s,1h),4.24(m,1h),4.00(t,j=9.1hz,2h),2.42(dd,j=12.8hz,2h),2.15(t,j=9.8hz,2h),1.63(m,2h),1.38-1.20(m,4h).
[0193]
步骤2:中间体l-12的制备
[0194][0195]
25ml反应瓶中加入l-11(16mg,0.047mmol),l-4(20mg,0.014mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(18mg,0.047mmol),n,n-二异丙基乙胺(6.1mg,0.047mmol),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩,除去溶剂,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得中间体l-12,重10mg,收率40%。
[0196]
步骤3:化合物xif的制备
[0197][0198]
25ml反应瓶中加入化合物l-12(10mg,0.007mmol),l-7(5.8mg,0.007mmol),n,n-二甲基甲酰胺(1.5ml),n,n-二异丙基乙胺(1.8mg,0.014mmol)和n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(2.5mg,0.010mmol),室温搅拌20分钟,tlc显示反应完全,减压浓缩除去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=8:1),得化合物xif,重6.8mg。
[0199]
实施例7、本发明双药链接组装单元式xig的制备
[0200][0201]
步骤1:化合物xig的制备
[0202][0203]
向25ml反应瓶中加入中间体l-12(15mg,0.008mmol),c-2(12mg,0.008mmol),n,n-二甲基甲酰胺(1ml),n,n-二异丙基乙胺(1.5mg,0.012mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(3.6mg,0.010mmol),室温搅拌反应20分钟,lcms监测l-12消失,反应完全。直接反相制备得到13mg白色固体,收率50%。
[0204]
实施例8、本发明双药链接组装单元式xih的制备
[0205][0206]
步骤1:化合物xig的制备
[0207][0208]
向25ml反应瓶中加入中间体l-12(15mg,0.008mmol),c(9mg,0.008mmol),n,n-二甲基甲酰胺(1ml),n,n-二异丙基乙胺(1.5mg,0.012mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(3.6mg,0.010mmol),室温搅拌反应20分钟,lcms监测l-12消失,反应完全。直接反相制备得到10mg白色固体,收率43%。
[0209]
实施例9、本发明双药链接组装单元式xii的制备
[0210][0211]
步骤1:化合物e-1的制备
[0212][0213]
25ml反应瓶中,加入中间体e(100mg,0.19mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(109mg,0.29mmol),n,n-二异丙基乙胺(49mg,0.38mmol),n,n-二甲基甲酰胺(4ml),室温搅拌反应5分钟,缓慢滴加中间体l-5(34mg,0.19mmol)后室温反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=6:1),得化合物e-1,重34mg,收率26%。
[0214]1h nmr(400mhz,cdcl3)δ12.74(s,1h),12.56(s,1h),10.10(s,1h),8.51(d,j=2.3hz,1h),8.42(d,j=2.3hz,1h),8.16(d,j=1.2hz,1h),δ7.83(s,1h),7.74(s,1h),3.72
(m,4h),3.50-2.50(m,30h),2.22(dd,j=12.8hz,2h).
[0215]
步骤2:化合物e-2的制备
[0216][0217]
25ml反应瓶中,加入中间体e-1(50mg,0.70mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(54mg,0.14mmol),n,n-二异丙基乙胺(18mg,0.14mmol),n,n-二甲基甲酰胺(4ml),室温搅拌反应5分钟,缓慢滴加中间体l-4(58mg,0.04mmol)的n,n-二甲基甲酰胺(1ml)溶液后室温反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=8:1),得化合物e-2,重32mg,收率38%。
[0218]
步骤3:化合物xii的制备
[0219][0220]
25ml反应瓶中,加入中间体e-2(10mg,0.005mmol),中间体l-7(3.9mg,0.005mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(2.8mg,0.007mmol),n,n-二异丙基乙胺(1.2mg,0.010mmol),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xii,重8mg,收率57%。
[0221]
实施例10、本发明双药链接组装单元式xij的制备
[0222]
[0223]
步骤1:化合物xij的制备
[0224][0225]
25ml反应瓶中,加入中间体e-2(10mg,0.005mmol),中间体c(5.3mg,0.005mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(2.8mg,0.007mmol),n,n-二异丙基乙胺(1.2mg,0.010mmol),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xij,重7.8mg,收率56%。
[0226]
实施例11、本发明双药链接组装单元式xik的制备
[0227][0228]
步骤1:化合物b-1的制备
[0229][0230]
25ml反应瓶中加入化合物l-7(100mg,0.12mmol),化合物m(143mg,0.12mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(68mg,0.18mmol),n,n-二异丙基乙胺(30mg,0.24mmol),n,n-二甲基甲酰胺(4ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物tlc层析纯化(展开剂:二氯甲烷:甲醇=10:1),得中间体c-1,重80mg,收率34%。
[0231]
步骤2:化合物b-2的制备
[0232][0233]
25ml反应瓶中加入中间体b-2(80mg,0.04mmol),1,8-二偶氮杂双螺环[5.4.0]十一-7-烯(9.1mg,0.06mg),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc监控反应完全,直接用于下一步。
[0234]
步骤3:化合物xik的制备
[0235][0236]
25ml反应瓶中,加入中间体e-2(10mg,0.005mmol),中间体b-2(10mg,0.005mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(2.8mg,0.007mmol),n,n-二异丙基乙胺(1.2mg,0.010mmol),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xik,重13mg,收率65%。
[0237]
实施例12、本发明双药链接组装单元式xil的制备
[0238][0239]
步骤1:化合物c-3的制备
[0240][0241]
25ml反应瓶中,加入中间体e-1(50mg,0.70mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(54mg,0.14mmol),n,n-二异丙基乙胺(18mg,0.14mmol),n,n-二甲基甲酰胺(4ml),室温搅拌反应5分钟,缓慢滴加中间体c-2(58mg,0.04mmol)的n,n-二甲基甲酰胺(1ml)溶液后室温反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=8:1),得化合物c-3,重33mg,收率38%。
[0242]
步骤2:化合物xil的制备
[0243][0244]
25ml反应瓶中,加入中间体c-3(10mg,0.005mmol),中间体l-7(3.9mg,0.005mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(2.8mg,0.007mmol),n,n-二异丙基乙胺(1.2mg,0.010mmol),n,n-二甲基甲酰胺(1ml),室温搅拌反应30分钟,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xil,重7.3mg,收率55%。
[0245]
实施例13、本发明双药链接组装单元式xim的制备
[0246]
[0247]
步骤1:化合物xim的制备
[0248][0249]
25ml反应瓶中加入中间体l-4(15mg,0.010mmol),中间体l-5(1mg,0.005mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(3.8mg,0.010mmol),n,n-二异丙基乙胺(2.0mg,0.015mmol),n,n-二甲基甲酰胺(3ml),室温反应30分钟,tlc显示原料l-4消失,反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物tlc层析纯化(二氯甲烷:甲醇=10:1),得产物xim重5mg,收率31%。
[0250]
实施例14、本发明双药链接组装单元式xin的制备
[0251][0252]
步骤1:化合物xin的制备
[0253][0254]
向25ml反应瓶中加入中间体l-11(2mg,0.004mmol),l-4(12mg,0.008mmol),n,n-二甲基甲酰胺(1ml),n,n-二异丙基乙胺(1.5mg,0.012mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮
杂苯并三唑-1-基)六氟磷酸脲(3.6mg,0.010mmol),室温搅拌反应20分钟,lcms监测l-12消失,反应完全。直接反相制备得到8mg白色固体,收率61%。
[0255]
实施例15、本发明双药链接组装单元式xio的制备
[0256][0257]
步骤1:化合物xio的制备
[0258][0259]
向25ml反应瓶中加入中间体l-11(2mg,0.004mmol),l-9(9.5mg,0.008mmol),n,n-二甲基甲酰胺(1ml),n,n-二异丙基乙胺(1.5mg,0.012mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(3.6mg,0.010mmol),室温搅拌反应20分钟,lcms监测l-12消失,反应完全。直接反相制备得到6mg黄色固体,收率56%。
[0260]
实施例16、本发明双药链接组装单元式xip的制备
(7-氮杂苯并三唑-1-基)六氟磷酸脲(85mg,0.225mmol),n,n-二异丙基乙胺(30mg,0.300mmol),n,n-二甲基甲酰胺(2ml)的反应瓶中,室温搅拌反应30分钟,lcms监测原料反应完全,加入水(5ml),并用乙酸乙酯(15ml
×
3)萃取,无水硫酸钠干燥,过滤,旋干,加入少量甲醇,反相制备得到50mg油状液体,收率63%。
[0271]1h nmr(400mhz,cdcl3)δ7.86(s,1h),7.81(s,1h),4.09(m,2h),3.70-3.50(m,12h),2.42(m,4h),2.11-1.62(m,8h),1.37(s,18h).
[0272]
步骤4:中间体d-4的制备
[0273][0274]
向10ml反应瓶中加入d-3(50mg,0.095mmol),加入三氟乙酸(1ml),二氯甲烷(1ml),室温搅拌反应4h,lcms监测原料反应完全,旋掉二氯甲烷,加入少量甲醇,反相制备得到30mg油状液体,收率77%。
[0275]1h nmr(400mhz,cdcl3)12.09(s,1h),11.91(s,1h),δ7.86(s,1h),7.81(s,1h),4.12(m,2h),3.65-3.47(m,12h),2.45(m,4h),2.08-1.67(m,8h).
[0276]
步骤5:中间体d-5的制备
[0277][0278]
向25ml反应瓶中加入中间体d-4(30mg,0.072mmol),l-2(27mg,0.024mmol),n,n-二甲基甲酰胺(3ml),n,n-二异丙基乙胺(9mg,0.072mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(27mg,0.072mmol),室温搅拌反应20分钟,tlc显示l-2消失,反应完全。减压浓缩除去n,n-二甲基甲酰胺,残余物加入少量甲醇,反相制备得到23mg白色固体,收率64%。
[0279]
步骤6:化合物xip的制备
[0280][0281]
向25ml反应瓶中加入中间体d-5(23mg,0.015mmol),d-2(17mg,0.015mmol),n,n-二甲基甲酰胺(2ml),n,n-二异丙基乙胺(3mg,0.022mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(8mg,0.022mmol),室温搅拌反应20分钟,tlc显示d-5消失,反应完全。直接反相制备得到15mg白色固体,收率38%。
[0282]
实施例17、中间体ggfge的制备
[0283][0284]
步骤1:化合物d2的制备
[0285][0286]
500ml反应瓶中,加入中间体d1(20g,56.49mmol),乙腈(200ml),完全澄清后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(11g,56.49mmol),n-羟基丁二酰亚胺(7g,56.49mmol),室温搅拌反应12h,tlc显示反应完全,过滤,固体干燥,得化合物d2,重22g,收率90%。
[0287]
步骤2:化合物d3的制备
[0288][0289]
500ml反应瓶中,加入中间体l-苯丙氨酸(8g,48.48mmol),碳酸氢钠(8g,96.96mmol),水(200ml),完全澄清后将化合物d2(22g,48.48mmol)溶于乙二醇二甲醚(50ml)中,缓慢加入到上述反应液中。室温搅拌反应12h,tlc显示反应完全,减压浓缩除去乙二醇二甲醚,残余物滴入0.5m盐酸水溶液(500ml)中,析出大量固体,过滤,固体干燥,得化合物d3,重15g,收率62%。
[0290]1h nmr(400mhz,cdcl3)12.51(s,1h),9.04(s,1h),8.31(s,1h),7.95(s,1h),7.90(d,j=8.0hz,2h),7.56(d,j=7.8hz,2h),7.38-7.28(m,4h),7.19-7.14(m,5h),4.85(t,j=8.2hz,1h),4.71(d,j=8.2hz,2h),4.39(t,j=8.4hz,1h),4.10-3.83(m,4h),3.12(d,j=9.6hz,1h),2.85(d,j=9.6hz,1h).
[0291]
步骤3:化合物d4的制备
[0292][0293]
500ml反应瓶中,加入中间体d3(15g,29.9mmol),乙腈(200ml),加入1-(3-二甲氨
基丙基)-3-乙基碳二亚胺盐酸盐(6g,29.9mmol),n-羟基丁二酰亚胺(4g,29.9mmol),室温搅拌反应12h,tlc显示反应完全,过滤,固体干燥,得化合物d4,重13g,收率72%。
[0294]
步骤4:化合物d5的制备
[0295][0296]
500ml反应瓶中,加入中间体甘氨酸(3g,40.0mmol),碳酸氢钠(7g,80.0mmol),水(150ml),完全澄清后将化合物d4(13g,40.0mmol)溶于乙二醇二甲醚(40ml)中,缓慢加入到上述反应液中。室温搅拌反应12h,tlc显示反应完全,减压浓缩除去溶剂,残余物滴入0.5m盐酸水溶液(300ml)中,析出大量固体,过滤,固体干燥,得化合物d5,重15g,收率71%。
[0297]1h nmr(400mhz,cdcl3)13.01(s,1h),9.01(s,1h),8.27(s,1h),7.98(s,1h),7.89(d,j=8.0hz,2h),7.54(d,j=7.8hz,2h),7.34-7.23(m,4h),7.19-7.14(m,5h),4.75(t,j=8.2hz,1h),4.61(d,j=8.2hz,2h),4.30(t,j=8.4hz,1h),4.04-3.83(m,6h),3.10(d,j=9.6hz,1h),2.75(d,j=9.6hz,1h).
[0298]
步骤5:化合物d6的制备
[0299][0300]
25ml反应瓶中,加入中间体d5(200mg,0.36mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(163mg,0.43mmol),n,n-二异丙基乙胺(66.9mg,0.54mmol),n,n-二甲基甲酰胺(5ml),室温搅拌反应5min后加入艾日布林(263.1mg,0.36mmol),tlc显示反应完全,减压浓缩除去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物d6,重300mg,收率50%。
[0301]
步骤6:化合物ggfge的制备
[0302][0303]
25ml反应瓶中,加入中间体d6(20mg,0.016mmol),1,8-二偶氮杂双螺环[5.4.0]十一-7-烯(5mg,0.032mmol),n,n-二甲基甲酰胺(3ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物ggfge,重10mg,收率62%。
[0304]
实施例18、本发明双药链接组装单元式xiq的制备
[0305][0306]
步骤1:化合物m-1的制备
[0307][0308]
25ml反应瓶中依次加入化合物m(1.00g,4.9mmol),溶剂n,n-二甲基甲酰胺(15ml),待反应液澄清后,依次加入碳酸钾(2.43g,17.6mmol),碘化钾(1.63g,9.8mmol),2-氯乙氧基-2-乙氧基二乙醇(1.63g,9.8mmol),110℃搅拌反应12h,tlc显示反应完全,过滤后减压浓缩除去多余的n,n-二甲基甲酰胺,残余物hplc纯化,得中间体m-1,重1.5g,收率83%。
[0309]1h nmr(400mhz,cdcl3)δ7.32-7.29(m,5h),4.51(s,2h),4.43(s,1h),3.72
–
3.69(m,4h),3.55
–
3.50(m,8h),2.65
–
2.50(m,6h),1.59
–
1.34(m,8h).
[0310]
步骤2:化合物m-2的制备
[0311][0312]
25ml反应瓶中加入中间体m-1(1.50g,3.95mmol),四丁基溴化铵(2.10g,1.58mmol),二氯甲烷(10ml),0℃搅拌反应30min后,将氢氧化钠(1.26g,31.60mmol)溶于水
(1.2ml)中,澄清后缓慢滴加到上述反应液中,0℃下继续反应10min后撤离冰浴,室温下反应3h。lc-ms监控反应完全。用ph=3的稀盐酸将反应液调至弱酸性,萃取二氯甲烷(10ml*3),合并有机相用饱和食盐水洗涤后,有机相用无水硫酸钠干燥、过滤后减压蒸馏除去多余的二氯甲烷得到目标产物1.7g,收率75%,直接用于下一步。
[0313]
步骤3:化合物m-3的制备
[0314][0315]
25ml反应瓶中,依次加入中间体m-2(1g,1.57mmol),甲醇(10ml),催化量的钯碳,氢气保护,室温搅拌反应2h,lc-ms显示反应完全,过滤除去钯碳,后减压浓缩多余溶剂,残余物物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物m-3,重900mg,收率75%。
[0316]1h nmr(400mhz,cdcl3)δ3.72
–
3.69(m,4h),3.55
–
3.50(m,12h),2.65
–
2.42(m,10h),1.59
–
1.34(m,8h),1.49(s,18h).
[0317]
步骤4:化合物m-4的制备
[0318][0319]
25ml反应瓶中,依次加入中间体m-3(900mg,1.57mmol),thf(10ml),水(2.5ml),待反应液澄清后依次加入碳酸氢钠(210mg,2.50mmol),9-芴甲基-n-琥珀酰亚胺基碳酸酯(530mg,1.57mmol)。室温搅拌反应2h,lc-ms显示反应完全,后减压浓缩多余溶剂,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物m-4,重1g,收率74%。
[0320]1h nmr(400mhz,cdcl3)δ7.90(d,j=8.9hz,2h),7.55(d,j=9.2hz,2h),7.38-7.28(m,4h),4.70(d,j=11.2hz,2h),4.46(t,j=11.2hz,1h),3.71
–
3.67(m,4h),3.53
–
3.48(m,12h),2.55
–
2.41(m,10h),1.51
–
1.24(m,8h),1.41(s,18h).
[0321]
步骤5:化合物m-5的制备
[0322][0323]
25ml反应瓶中,依次加入中间体m-4(1g,1.54mmol),二氯甲烷(5ml),三氟乙酸(5ml),室温搅拌反应2h,lc-ms显示反应完全,减压浓缩出去多余溶剂,残余物物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物m-5,重600mg,收率75%。
[0324]
步骤6:化合物m-6的制备
[0325][0326]
25ml反应瓶中,加入中间体ggfge(50mg,0.05mmol),中间体m-5(50mg,0.10mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(38mg,0.10mmol),n,n-二异丙基乙胺(12.9mg,0.10mmol),n,n-二甲基甲酰胺(4ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物m-6,重50mg,收率33%。
[0327]
步骤7:化合物m-7的制备
[0328][0329]
25ml反应瓶中,加入中间体m-6(30mg,0.02mmol),中间体l-7(16mg,0.02mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(7.6mg,0.02mmol),n,n-二异丙基乙胺(2.58mg,0.02mmol),n,n-二甲基甲酰胺(3ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物m-7,重20mg,收率44%。
[0330]
步骤8:化合物m-8的制备
[0331][0332]
25ml反应瓶中,加入中间体m-7(20mg,0.008mmol),1,8-二偶氮杂双螺环[5.4.0]十一-7-烯(2.45mg,0.016mmol),n,n-二甲基甲酰胺(3ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物m-8,重15mg,收率75%。
[0333]
步骤9:化合物xiq的制备
[0334][0335]
25ml反应瓶中,加入中间体m-8(10mg,0.004mmol),中间体mal-5peg-acid(1.60mg,0.004mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(1.52mg,0.004mmol),n,n-二异丙基乙胺(0.52mg,0.004mmol),n,n-二甲基甲酰胺(3ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xiq,重7mg,收率44%。
[0336]
实施例19、本发明双药链接组装单元式xir的制备
[0337][0338]
步骤1:化合物xir的制备
[0339][0340]
25ml反应瓶中,加入中间体m-8(10mg,0.004mmol),中间体mal-8peg-acid(1.70mg,0.004mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(1.52mg,0.004mmol),n,n-二异丙基乙胺(0.52mg,0.004mmol),n,n-二甲基甲酰胺(3ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩除去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xir,重6.5mg,收率45%。
[0341]
实施例20、本发明双药链接组装单元式xis的制备
[0342][0343]
步骤1:化合物m-9的制备
[0344][0345]
25ml反应瓶中,加入中间体ggfge(50mg,0.05mmol),中间体m-5(13mg,0.03mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(38mg,0.10mmol),n,n-二异丙基乙胺(13mg,0.10mmol),n,n-二甲基甲酰胺(4ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩出去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物m-9,重40mg,收率81%。
[0346]
步骤2:化合物m-10的制备
[0347][0348]
25ml反应瓶中,加入中间体m-9(20mg,0.007mmol),1,8-二偶氮杂双螺环[5.4.0]十一-7-烯(2.35mg,0.014mmol),n,n-二甲基甲酰胺(3ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩除去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物m-10,重15mg,收率83%。
[0349]
步骤3:化合物xis的制备
[0350][0351]
25ml反应瓶中,加入中间体m-10(10mg,0.004mmol),中间体mal-8peg-acid(2mg,0.004mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(2mg,0.004mmol),n,n-二异丙基乙胺(1mg,0.004mmol),n,n-二甲基甲酰胺(3ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩除去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xis,重6.5mg,收率45%。
[0352]
实施例21、本发明双药链接组装单元式xit的制备
[0353][0354]
步骤1:化合物xit的制备
[0355][0356]
25ml反应瓶中,加入中间体m-8(10mg,0.004mmol),中间体mal-2peg-acid(1.34mg,0.004mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(1.52mg,0.004mmol),n,n-二异丙基乙胺(0.52mg,0.004mmol),n,n-二甲基甲酰胺(3ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩除去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xit,重5.9mg,收率53%。
[0357]
实施例22、本发明双药链接组装单元式xiu的制备
[0358][0359]
步骤1:化合物xiu的制备
[0360][0361]
25ml反应瓶中,加入中间体m-8(10mg,0.004mmol),中间体l-2(1.34mg,0.004mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(1.52mg,0.004mmol),n,n-二异丙基乙胺(0.52mg,0.004mmol),n,n-二甲基甲酰胺(3ml),室温搅拌反应30min,tlc显示反应完全,减压浓缩除去n,n-二甲基甲酰胺,残余物薄层层析纯化(二氯甲烷:甲醇=10:1),得化合物xiu,重5.6mg,收率52%。
[0362]
实施例23、本发明双药链接组装单元式xiv的制备
[0363][0364]
步骤1:中间体n-1的制备
[0365][0366]
向25ml反应瓶中加入中间体n-0(2.0g,5.63mmol)n,n-二甲基甲酰胺(10ml),在氮气保护条件下,于冰水浴中冷却15分钟,分批加入钠氢(0.4g,8.44mmol),搅拌5分钟后,再加入溴乙酸叔丁酯(1.6g,8.44mmol),缓慢升至室温,搅拌反应1小时,tlc显示n-0消失,反应完全。加入水(15ml),并用乙酸乙酯(30ml*3)萃取,无水硫酸钠干燥,过滤,旋干,加入少量甲醇,反相制备得到1.7g油状液体,收率50%。
[0367]1h nmr(400mhz,cdcl3)δ7.55-7.33(m,10h),5.34(s,2h),5.02(s,2h),4.33(s,2h),4.28(t,j=11.2hz,1h),3.71
–
3.46(m,3h),2.40
–
2.25(m,2h),1.42(s,9h).
[0368]
步骤2:中间体n-2的制备
[0369][0370]
向25ml反应瓶中加入n-1(1.7g,3.62mmol),钯碳(0.2g,10%),甲醇(20ml),于氢气氛围下,室温搅拌反应2小时,lcms监测n-1消失,反应完全,过滤,旋干,得到800mg粗品,直接进行下一步。
[0371]
步骤3:中间体n-3的制备
[0372][0373]
向25ml反应瓶中加入l-2(413mg,1.96mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(744mg,1.96mmol),diea(315mg,2.45mmol),n,n-二甲基甲酰胺(5ml)的反应瓶中,室温搅拌反应10min,再滴加n-2(400mg,1.63mmol),继续搅拌30分钟,lcms监测原料反应完全,加入水(15ml),并用乙酸乙酯(30ml*3)萃取,无水硫酸钠干燥,过滤,旋干,加入少量甲醇,反相制备得到500mg白色固体,收率70%。
[0374]1h nmr(400mhz,cdcl3)δ12.22(s,1h),7.90(s,1h),7.85(s,1h),4.33(m,3h),4.02(t,j=11.2hz,2h),3.71
–
3.46(m,3h),2.46(m,1h),2.21(m,1h),2.02(t,j=9.8hz,2h),1.61
–
1.24(m,6h),1.40(s,9h).
[0375]
步骤4:中间体n-4的制备
[0376][0377]
向10ml反应瓶中加入n-3(500mg,1.14mmol),加入三氟乙酸(5ml),二氯甲烷(5ml),室温搅拌反应4h,lcms监测原料反应完全,减压旋蒸除去多余溶剂,加入少量甲醇,反相制备得到300mg油状液体,收率78%。1h nmr(400mhz,cdcl3)δ12.80(s,1h),12.25(s,1h),7.89(s,1h),7.80(s,1h),4.31(m,3h),4.00(t,j=11.2hz,2h),3.77
–
3.46(m,3h),2.45(m,1h),2.20(m,1h),2.05(t,j=9.8hz,2h),1.63(m,2h),1.53(m,2h),1.32(m,2h).
[0378]
步骤5:中间体n-5的制备
[0379][0380]
向25ml反应瓶中加入中间体n-4(40mg,0.105mmol),n,n-二甲基甲酰胺(3ml),n,n-二异丙基乙胺(13mg,0.105mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(40mg,0.105mmol),室温搅拌反应10min,再滴加ggfge(27mg,0.026mmol溶于1ml n,n-二甲基甲酰胺),继续搅拌反应30min,lcms监测ggfge消失,反应完全。直接反相制备得到20mg白色固体,收率54%。
[0381]
步骤6:化合物xiv的制备
[0382][0383]
向25ml反应瓶中加入中间体n-5(20mg,0.014mmol),b(12mg,0.014mmol),n,n-二甲基甲酰胺(2ml),n,n-二异丙基乙胺(3mg,0.021mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(6mg,0.017mmol),室温搅拌反应20min,lcms监测n-5消失,反应完全。直接反相制备得到15mg黄色固体,收率48%。
[0384]
实施例24、本发明双药链接组装单元式xiw的制备
[0385][0386]
步骤1:化合物n-7的制备
[0387][0388]
向25ml反应瓶中加入中间体n-6(1.0g,3.25mmol),n-6-0(0.6g,3.89mmol),碳酸氢钠(1.1g,13.00mmol),乙二醇二甲醚(15ml),水(15ml),室温搅拌反应20小时,lcms监测大部分是目标化合物分子量。浓缩一半溶剂后,直接反相制备得到110mg无色液体,收率10%。
[0389]1h nmr(400mhz,cdcl3)δ12.66(s,1h),12.01(s,1h),7.90(s,1h),7.76(s,1h),4.55(t,j=9.8hz,1h),4.05(t,j=11.2hz,2h),2.33(t,j=9.2hz,2h),2.05(m,4h),1.65(m,2h),1.32
–
1.28(m,4h).
[0390]
步骤2:化合物n-8的制备
[0391][0392]
向25ml反应瓶中加入中间体n-7(26mg,0.076mmol),n,n-二甲基甲酰胺(2ml),n,
n-二异丙基乙胺(10mg,0.076mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(29mg,0.076mmol),室温搅拌反应10min,再滴加ggfge(20mg,0.019mmol溶于1ml n,n-二甲基甲酰胺),继续搅拌反应30min,lcms监测ggfge消失,反应完全。直接反相制备得到18mg白色固体,收率69%。
[0393]
步骤3:化合物xiw的制备
[0394][0395]
向25ml反应瓶中加入中间体n-8(18mg,0.013mmol),b-1(6mg,0.013mmol),n,n-二甲基甲酰胺(2ml),n,n-二异丙基乙胺(3mg,0.020mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(6mg,0.015mmol),室温搅拌反应20min,lcms监测n-8消失,反应完全。直接反相制备得到14mg黄色固体,收率60%。
[0396]
实施例25、本发明双药链接组装单元式xix的制备
[0397][0398]
步骤1:化合物n-10的制备
[0399][0400]
向25ml反应瓶中加入中间体n-10(200mg,0.37mmol),钯碳(20mg,10%),甲醇(5ml),于氢气氛围下,室温搅拌反应2小时,lcms监测n-10消失,反应完全。直接过滤,浓缩,得到粗品150mg油状液体,收率90%。
[0401]
步骤2:化合物n-11的制备
[0402][0403]
向25ml反应瓶中加入中间体n-10(150mg,0.33mmol),sm-1(79mg,0.33mmol),n,n-二甲基甲酰胺(5ml),n,n-二异丙基乙胺(65mg,0.50mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(152mg,0.40mmol),室温搅拌反应10min,lcms监测大部分为目标化合物分子量,反应完全。直接反相制备得到110mg油状液体,收率49%。
[0404]1h nmr(400mhz,cdcl3)δ7.76(s,1h),7.55(s,1h),3.73
–
3.67(m,8h),3.52
–
3.48(m,8h),3.37(m,4h),3.40(d,j=8.2hz,2h),2.42
–
2.38(m,5h),2.06(m,1h),1.73-1.70(m,4h),1.42(s,18h),1.38(m,4h).
[0405]
步骤3:化合物n-12的制备
[0406][0407]
向10ml反应瓶中加入n-11(110mg,0.16mmol),加入三氟乙酸(3ml),二氯甲烷(3ml),室温搅拌反应4h,lcms监测原料反应完全,减压旋蒸除去多余的溶剂,加入少量甲醇,反相制备得到60mg油状液体,收率67%。1h nmr(400mhz,cdcl3)δ12.10(s,1h),11.93(s,1h),7.86(s,1h),7.65(s,1h),3.61
–
3.52(m,16h),3.40
–
3.37(m,6h),2.40
–
2.38(m,5h),2.03(m,1h),1.72-1.70(m,4h),1.36(m,4h).
[0408]
步骤4:化合物xix的制备
[0409][0410]
向25ml反应瓶中加入中间体n-12(5mg,0.008mmol),b(15mg,0.018mmol),n,n-二甲基甲酰胺(2ml),n,n-二异丙基乙胺(3mg,0.024mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(7mg,0.018mmol),室温搅拌反应20min,lcms监测n-12消失,反应完全。直接反相制备得到10mg黄色固体,收率55%。
[0411]
实施例26、本发明双药链接组装单元式xiy的制备
[0412][0413]
步骤1:化合物n-13的制备
[0414][0415]
向25ml反应瓶中加入中间体l-2(97mg,0.46mmol),sm-1(200mg,0.46mmol),n,n-二甲基甲酰胺(5ml),n,n-二异丙基乙胺(89mg,0.68mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(209mg,0.55mmol),室温搅拌反应20min,lcms监测l-2消失,反应完全。直接反相制备得到200mg白色固体,收率69%。
[0416]1h nmr(400mhz,cdcl3)δ7.86(s,1h),7.75(s,1h),7.65-7.56(m,4h),7.51-7.45(m,4h),4.00(t,j=11.2hz,2h),3.42
–
3.40(m,4h),3.32
–
3.28(m,8h),2.45(s,3h),2.41(s,3h),2.27(t,j=9.8hz,2h),1.63-1.53(m,4h),1.32(m,2h).
[0417]
步骤2:化合物n-14的制备
[0418][0419]
向25ml反应瓶中加入中间体n-13(200mg,0.32mmol),苯酚(149mg,1.59mmol),33%hbr/醋酸(5ml),室温搅拌反应20h,lcms监测n-13消失,反应完全。将反应液直接滴加入甲基叔丁基醚(30ml),析出固体,过滤,得到140mg褐色固体,收率92%。
[0420]
步骤3:化合物n-15的制备
[0421][0422]
向25ml反应瓶中加入中间体n-14(140mg,0.29mmol),溴乙酸叔丁酯(130mg,0.67mmol),碳酸钾(160mg,1.16mmol),n,n-二甲基甲酰胺(5ml),室温搅拌反应20h,lcms监测n-14消失,反应完全。将反应液过滤,浓缩,反相制备得到120mg油状液体,收率75%。
[0423]1h nmr(400mhz,cdcl3)δ7.84(s,1h),7.73(s,1h),4.05(t,j=10.2hz,2h),3.32
–
3.30(m,8h),2.62(m,4h),2.46(m,4h),2.29(t,j=10.1hz,2h),1.64-1.52(m,4h),1.42(s,18h),1.31(m,2h).
[0424]
步骤4:化合物n-16的制备
[0425][0426]
向10ml反应瓶中加入n-15(120mg,0.22mmol),加入三氟乙酸(3ml),二氯甲烷(3ml),室温搅拌反应4h,lcms监测原料反应完全,减压旋蒸除去多余溶剂,加入少量甲醇,反相制备得到60mg油状液体,收率63%。
[0427]
步骤5:化合物xiy的制备
[0428][0429]
向25ml反应瓶中加入中间体n-16(4mg,0.008mmol),b(15mg,0.018mmol),n,n-二甲基甲酰胺(2ml),n,n-二异丙基乙胺(3mg,0.024mmol),n,n,n
′
,n
′‑
四甲基-o-(7-氮杂苯并三唑-1-基)六氟磷酸脲(7mg,0.018mmol),室温搅拌反应20min,lcms监测n-16消失,反应完全。直接反相制备得到10mg黄色固体,收率58%。
[0430]
实施例27、抗体
‑‑
药物偶联物(adc)的制备
[0431]
1.制备
[0432]
步骤(1)抗体的还原:将抗体介质替换为ph7.2 pbs/edta,制备成4mg/ml的抗体浓度。将本溶液(0.5ml)放入到1.5ml聚丙烯制试管中,向该溶液中添加tceppbs溶液(8ul:相对于一分子抗体为3当量),于25℃条件下孵育1小时,由此,将抗体内铰链部的二硫键部分还原。
[0433]
步骤(2)抗体与药物接头的偶联:在25℃条件下,向上述溶液中添加dmso(43ul)和含有实施例1~26所得双药链接组装单元的dmso溶液(6.7ul:相对于一分子抗体为5当量),使用试管混匀器混匀,在室温下搅拌120分钟,将药物接头与抗体连接。接下来,添加100mm nac水溶液(2ul:相对于一分子抗体为18.4当量),进而在室温下搅拌20分钟,终止药物接头的反应,分别得到各adc:xia~xiy。
[0434]
2.表征
[0435]
利用排阻色谱法检测adc的聚集度,利用lcms检测adc的dar值,利用hic方法检测adc中裸抗的含量。
[0436]
表1.抗体
‑‑
药物偶联物xia~xiy的表征结果
[0437][0438][0439]
以下通过试验例证明本发明的有益效果。
[0440]
试验例1:细胞活性测试
[0441]
1.实验方法
[0442]
实验细胞:n87细胞,sk-br-3细胞,mda-mb-468细胞。
[0443]
实验步骤:收集对数生长期细胞,使用细胞计数仪进行计数,用完全培养基重新悬浮细胞,计算细胞浓度至合适浓度并按照100μl/孔将细胞悬液接种于96孔板中,放置于37℃,100%相对湿度,5%co2培养箱中孵育24小时。加药前用培养基将待测adc稀释至所设置
的相应作用浓度,按照并以25μl/孔加入96孔板中。细胞置于37℃,100%相对湿度,5%co2培养箱中孵育144h。加入10μl/孔cck-8置于37℃培养箱中孵育2-4h。轻轻震荡后在spectramax i3x reader上测定450nm波长处的吸光度,以650nm处吸光度作为参比(即450nm吸光度-650nm吸光度),计算抑制率,进一步计算ic
50
值。
[0444]
以已经上市已知adc:ds-8201作为阳性对照。
[0445]
2.实验结果
[0446]
表2.细胞毒性测试结果
[0447][0448][0449]
实验结果表明,本发明adc对her2阳性细胞株n87和sk-br-3都具有很好的抑制活性,对her2阴性细胞株mda-mb-468没有抑制活性,说明本发明adc具有很好的抗肿瘤效果及抗原特异性。
[0450]
此外,与已经上市的adc:ds-8201相比,本发明提供的adc对her2阳性细胞株n87和sk-br-3d抑制作用也都明显提高。
[0451]
综上,本发明提供了一种双药物链接组装单元,该双药物链接组装单元能够与靶向接头链接得到对应的双药靶向接头-药物偶联物,该双药靶向接头-药物偶联物能够靶向作用于肿瘤细胞,降低对正常细胞的毒副作用,同时能够有效克服药物的耐药性,取得了协同增效的抗肿瘤效果。与已经上市的adc:ds-8201相比,本发明提供的adc对her2阳性细胞
株n87和sk-br-3d抑制作用都明显提高。本发明的双药物链接组装单元和双药靶向接头-药物偶联物在制备预防和/或治疗的抗肿瘤药物中具有广阔的应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1