基因miR-199a-3p和miR-199a-5p在抗非小细胞肺癌药物中的应用
基因mir-199a-3p和mir-199a-5p在抗非小细胞肺癌药物中的应用
技术领域
1.本发明涉及一种非小细胞肺癌中mirna基因的应用,具体而言,涉及mir-199a-3p和mir-199a-5p在抗非小细胞肺癌药物制备中的应用。
背景技术:
2.微小rna(microrna,mirna)是一类单链非编码rna分子,约18~24个核苷酸(nucleotide,nt),能在肿瘤以及许多重大疾病中参与调控。mirna与靶基因mrna的非编码序列(3
′‑
utr或5
′‑
utr)存在着一对多的关系,与其靶基因序列的互补性高低,能抑制蛋白质翻译,或是引发mrna降解,从而负调控靶基因的表达。
3.肺癌在所有的癌症中是最常见、最致命的癌症之一,其死亡率和发病率在男性和女性中均位居前列。肺癌分为两类,分别是约占到15%的小细胞肺癌(small cell lung cancer,sclc)和约占到85%的非小细胞肺癌(non-small cell lung cancer,nsclc),具有高复发率和高转移率的特征,其5年存活率仅为15%,主要原因是缺乏有效的针对肺癌的早期诊断和治疗手段。
4.就目前的医疗进展而言,对nsclc的治疗手段主要包括外科手术切除、放疗、化疗、免疫治疗及靶向治疗。外科治疗是肺癌最主要及首选的治疗方法,可是这一疗法仅适合于中早期的治疗;放疗和化疗治疗方法有过多副作用,可能导致身体脱发、恶心呕吐、疲乏等,还可能会损伤机体正常细胞,如血细胞、淋巴细胞和神经细胞等;近年来分子靶向药兴起,靶向治疗主要针对肺癌特异性突变的基因或肿瘤微环境,能阻断肺癌的进展及转移,并且不会损伤正常组织,如今已研制出多种临床药物,如抑制表皮生长因子受体(epithelial growth factor receptor,egfr)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,alk)和ros 1(reactive oxygen species 1)等;另外,值得关注的是近两年发展快速的肿瘤免疫疗法和基因编辑技术在肿瘤治疗上的应用,通过激发机体的自身免疫来对抗癌细胞,比如利用pd-l1抗体的药物现已用于nsclc的临床治疗,为肺癌的治疗开启了全新的思路。所以,发掘更多肺癌的关键分子标记物尤为重要,寻找可能的治疗靶点是治疗肺癌的一大关键。
5.mirna通过调控靶基因mrna的翻译,在肺癌发生、发展及转移发挥着重要作用。研究表明,很多mirna在不同肿瘤中异常表达,在肿瘤的发病机制中扮演着重要的角色,一些mirna甚至有望成为肿瘤药物治疗的基因靶点。mirna可能成为肺癌早期诊断和癌症进程相关的新的标志物,有助于疾病的准确诊断及个性化治疗。这一切设想的实现建立在对mirna及其靶基因功能研究工作的基础上。
技术实现要素:
6.为了解决现有技术问题,本发明的目的在于克服已有技术存在的不足,提供一种基因mir-199a-3p和mir-199a-5p在药物制备中的应用,mir-199a-3p和mir-199a-5p参与调
控与肿瘤相关基因的表达,并且这两个mirna在基因表达上担任着重要开关的作用。本发明的目的在于探究mir-199a-3p和mir-199a-5p在非小细胞肺癌中的应用。本发明通过mir-199a-3p/5p共同靶向rheb抑制mtor信号通路,进而抑制nsclc的调控过程。用于验证pre-mir-199a/rheb/mtor轴在非小细胞肺癌中的抑癌作用,为mir-199a-3p/5p成为nsclc早期诊断标志物或治疗靶点提供更可靠的参考依据。
7.为达到上述目的,本发明采用如下技术方案:
8.本发明mirna基因mir-199a-3p和mir-199a-5p在nsclc病人组织及细胞系中呈低表达。
9.本发明实施在于提供mirna基因
10.mir-199a-3p:5
′‑
acaguagucugcacauugguua-3
′
11.mir-199a-5p:5
′‑
cccaguguucagacuaccuguuc-3
′
12.一种利用mirna基因mir-199a-3p和mir-199a-5p在抗非小细胞肺癌药物中的应用,利用两种基因调控非小细胞肺癌癌细胞中细胞增殖、迁移及凋亡过程;其中,mir-199a-3p基因序列为:acaguagucugcacauugguua;mir-199a-5p基因序列为:cccaguguucagacuaccuguuc。本发明基因mir-199a-3p/5p在非小细胞肺癌中抑制细胞增殖、迁移及促进凋亡能发生作用。
13.一种利用mirna基因mir-199a-3p和mir-199a-5p的共同靶基因rheb,制备参与调控mtor信号通路的药物的应用。两种基因mir-199a-3p和mir-199a-5p共同靶向抑制rheb的表达,参与调控mtor信号通路。
14.一种在mirna基因mir-199a-3p和mir-199a-5p中下调共同靶基因rheb后,调控非小细胞肺癌细胞功能的药物制备中应用。
15.一种利用mirna基因mir-199a-3p和mir-199a-5p抑制非小细胞肺癌瘤体生长及转移瘤生长的药物制备过程中的应用。本发明通过小鼠皮下瘤模型、转移瘤模型和pdx模型实施,提供两种基因mir-199a-3p和mir-199a-5p抑制小鼠nsclc瘤体生长及转移瘤生长。
16.一种利用mirna基因mir-199a-3p和mir-199a-5p在非小细胞肺癌中egfr-t790m引起吉非替尼药物敏感性的药物制备过程中的应用。优选本发明两种基因mir-199a-3p和mir-199a-5p基因增强nsclc中egfr-t790m引起吉非替尼药物敏感性。
17.本发明的实施步骤如下所述:
18.第一步:利用qrt-pcr技术检测临床肺癌患者组织样本和与癌旁组织样本中mir-199a-3p和mir-199a-5p的表达水平;同时,又在6种nsclc细胞系中检测了mir-199a-3p和mir-199a-5p的表达情况,并从中选择两种mir-199a-3p和mir-199a-5p表达下调较明显的非小细胞肺癌系,后续验证实验在这两种细胞系中检测。另外,通过oncomir数据库分析mir-199a-3p和mir-199a-5p的表达情况对肺癌病人的总生存率的影响,以及通过funrich 3.1软件对mir-199a-3p/5p进行go(gene ontology)功能分析。
19.其中对组织样本通过trizol法抽提总rna,步骤如下:
20.(1)将1ml含trizol-细胞的匀浆中加入200μl氯仿,trizol:氯仿的体积比为5:1。颠倒6~8次,剧烈震荡10s,室温静置3min,4℃,12,000g,离心15min。
21.(2)离心期间,准备新的1.5ml rnase-free ep管,加入等体积异丙醇,离心完后分三层,上层水相的体积,一般是1ml trizol/200μl氯仿/600μl异丙醇。
22.(3)离心好之后,从离心机平缓取出离心管,小心地吸取上层水相至(2)步骤的rnase-free ep管中,颠倒混匀6~9次,剧烈振荡4s,室温静置10min。
23.(4)在4℃下,12,000g离心20min,弃去上清。
24.(5)加入500μl质量百分比为75%的rnase-free乙醇,颠倒混匀10次,4℃,12,000g离心5min弃去上清。
25.(6)重复步骤(5)一次。
26.(7)打开盖子倒置于吸水纸上,室温干燥10min;可短离,彻底吸掉上清,缩短干燥的时间。
27.(8)提前打开金属浴加热至65℃;加入20~50μl rnase-free ddh2o充分溶解rna,rna浓度及纯度用nanodrop 2000分光光度计机器检测,rna溶液如果暂时不用需保存在-80℃防止降解。
28.通过takara公司的primescript
tm
rt master mix试剂盒对mrna进行逆转录过程,从而构建后续实验所需的mrna cdna文库。
29.另外,利用transgen公司的mirna firststrand cdna synthesis supermix kit试剂盒对mirna进行逆转录过程,从而构建后续实验所需的mirna cdna文库。
30.a:mrna定量的模板cdna
31.①
在200μl ep管中配反应混合体系,体系如下表所示:
32.mrna cdna混合体系组分及用量
[0033][0034]
*10μl反应体系最大使用500ng total rna。
[0035]
②
混合均匀后,放置于bio-rad pcr仪上进行逆转录。
[0036]
反应条件:37℃15min85℃5s4℃forever
[0037]
③
产物加90μl ddh2o稀释10倍,用于后续实验或放置-20℃中保存。
[0038]
b:关于mirna定量的模板cdna
[0039]
在200μlep管中配制反应混合液,体系如下表所示:
[0040]
mirna cdna混合体系组分及用量
[0041][0042]
*10μl反应体系中total rna不超过2.5μg,本课题使用1μg。
[0043]
②
混合均匀后,放置于bio-rad pcr仪上进行逆转录。
[0044]
反应条件:37℃60min85℃5min4℃forever
[0045]
③
产物加90μl ddh2o稀释10倍,置于-20℃保存,备用。
[0046]
第二步:验证mir-199a-3p/5p在非小细胞肺癌中抑制细胞增殖、迁移及促进凋亡的应用。
[0047]
通过lipo2000转染试剂向a549及h1299细胞中转染mir-199a-3p mimic和mir-199a-5p mimic以及其阴性对照nc,并通过qrt-pcr方法检验使a549及h1299两种细胞系中mir-199a-3p和mir-199a-5p的表达量升高。接着,用的同样的量向a549和h1299细胞转染mir-199a-3p和mir-199a-5pmimic,采用cck-8法、克隆形成实验检测细胞增殖的情况,采用transwell法检测mir-199a-3p和mir-199a-5p对细胞迁移的影响,采用annexinv-fitc/pi染色并用流式细胞仪分析处理细胞凋亡的影响。
[0048]
非小细胞肺癌细胞被培养在含有10wt.%胎牛血清的1640/dmem培养基中。co2培养箱中含有体积百分比为5%的co2并且湿润,温度为37℃。为了降低细胞密度、试剂用量及转染等因素造成的孔间差异,保证实验的可靠性和重复性,本实验中每个转染样品设置了3个复孔。接种细胞时,每孔接种的细胞数量尽量保持一致,并且细胞在各孔的表面平均分布。
[0049]
其中转染步骤:
[0050]
①
转染非小细胞肺癌细胞的前一天,接种适当数量的细胞至培养板中,每孔加入不含抗生素的培养基,使转染时的细胞密度能够达到50%。
[0051]
②
准备mimic-lipo2000混合液:a.稀释mirna mimic:用50μl不含血清培养基opti-mem稀释mirna mimics,使加入细胞中的终浓度为50nmol/l,轻轻混匀,室温孵育5min;b.稀释lipo2000:用50μl不含血清的opti-mem稀释1μl lipo2000,轻轻混匀并室温孵育5min;c.将a与b轻轻混匀,室温孵育20min。注意:稀释好的lipo2000长时间放置可能导致转染试剂活性的降低,应尽量在25min之内与稀释好的mimics混合。在混合试剂时,不能剧烈吹打或震荡,手指轻弹管壁即可,过度用力可能会破坏脂质体的结构和mirna-mimics-lipo2000混合物的形成;
[0052]
③
将mirna-mimics-lipo2000混合液加入含有细胞及培养液的培养孔中,轻轻混匀;
[0053]
④
将培养板置于37℃的co2培养箱中48h。培养6h后,将孔里含有mimics-lipo2000混合液的培养基移去,更换新鲜培养基。
[0054]
cck-8法:
[0055]
(1)首先按常规方法把细胞消化下来,置1.5ml无菌ep管中,850rpm,离心5min,吸出并舍弃上清。把细胞重悬,细胞计数,在透明的96孔板中每孔接种2
×
103个细胞,每组设置3~4个重复孔。
[0056]
(2)实验组分别设置24h、48h、72h三个时间点,空白对照组加入等量培养基。
[0057]
(3)每隔24h进行检测,每孔加6μl cck-8溶液及94μl无血清细胞培养基(cck-8试剂盒说明书),放置培养箱中孵育2h30min。
[0058]
(4)用酶标仪检测在450nm波长下的od(optical density)值。
[0059]
克隆形成:
[0060]
(1)预处理细胞:首先按常规方法把细胞消化下来,将细胞悬液转移到1.5ml ep管
中,900rpm、离心5min,吸出并舍弃上清。用完全培养基把细胞重悬,在3cm细胞培养皿中每孔接种500个转染后的细胞。之后置于培养箱(体积百分比为5%的co2、37℃)中培养10~12天,培养期间保持细胞培养皿静置。
[0061]
(2)10~12天后,观察细胞生长状况,细胞长到合适程度便可处理。(4)吸出培养皿中的培养基,pbs清洗2次。
[0062]
(3)固定细胞:在3cm细胞培养皿中加入250μl无水甲醇溶液,固定15min。
[0063]
(4)吸出无水甲醇,在细胞中加入200μl草酸铵结晶紫溶液,室温静置放置15min。
[0064]
(5)吸出结晶紫溶液,蒸馏水冲洗培养皿,可将培养皿倒置在吸水纸上至水分吸干。
[0065]
(6)对细胞计数,并做统计分析。
[0066]
transwell法检测细胞迁移:本实验中用8.0μm孔径的transwell小室(corning),检测mirna/shrna对细胞迁移能力的影响。
[0067]
(1)准备24孔带transwell小室的细胞板,在每孔的下层加入带血清或趋化因子的培养基,在上层小室内接种已转染好的细胞,每孔细胞铺8,000个细胞,轻柔的把培养板放置培养箱。
[0068]
(2)24h后,用已消毒的镊子取出transwell小室,pbs清洗2次。
[0069]
(3)质量百分比为4%的多聚甲醛固定细胞30min。
[0070]
(4)用diffquick(dade diagnostika gmbh,munich,germany)试剂染色细胞15min,pbs清洗3次。
[0071]
(5)bz-8000显微镜(keyence,osaka,japan)在320倍的放大倍数下,选取10~15个显微镜区域观察迁移细胞的数量,并拍照。
[0072]
(6)计算并统计细胞迁移能力:
[0073][0074]
细胞凋亡检测:
[0075]
(1)收集培养基置于新的标记好的试管,使用胰酶消化并收集6孔板或12孔板中的细胞置于同样的试管中。
[0076]
(2)1,000rpm转速,离心5min,弃上清。
[0077]
(3)加入提前预冷的pbs 1ml洗2遍,1,000rpm,离心5min。
[0078]
(4)加入250μl 1
×
binding buffer(用pbs稀释),悬浮细胞。
[0079]
(5)加入2.5μl annexin v-fitc和2.5μlpi,轻柔混匀,室温,避光孵育15min;
[0080]
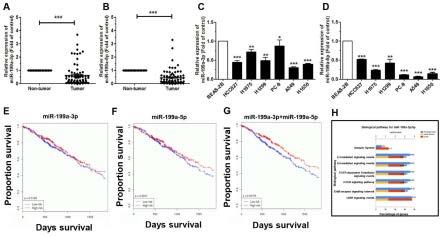
(6)尼龙网膜(孔径:50μm)过滤样品中的细胞,防止细胞团阻塞机器管道。
[0081]
(7)流式细胞仪检测,统计分析细胞凋亡率。
[0082]
第三步:筛选mir-199a-3p和mir-199a-5p共同靶基因,并验证两者的靶向关系。
[0083]
通过四个在线预测软件targetscan,miranda,pita和mirwalk的预测和汇总,筛选出rheb为mir-199a-3p和mir-199a-5p共同靶基因。通过qrt-pcr检测rheb在常见肺癌癌细胞系及临床组织样本中的表达情况,并预测rheb与mir-199a-3p或mir-199a-5p的相关性。在数据库上进一步验证rheb在组织样本的表达情况。随后,将rheb3'-utr中含有与mir-199a-3p和mir-199a-5p结合位点的片段克隆到pgl3-mireport荧光素酶报告载体上。将
mir-199a-3p或mir-199a-5p与重组质粒共转入hek-293t细胞,48h后检测荧光强度,以确定mir-199a-3p和mir-199a-5p与rheb的靶向关系。其中,在ncbi数据库查找到rheb基因的mrna序列,进而查找到该mrna的3
′‑
utr序列。设计引物,进行pcr,将该位点包含在内。
[0084]
rheb-3
′‑
utr引物为forward:5
′‑
gctctagaggggaaagtacaaatacc-3
′
,
[0085]
reverse:5
′‑
cggaattcataatctgaagggaggg-3
′
。
[0086]
同时,还设计了rheb与mir-199a-3p/5p结合位点处的突变位点,设计引物,mir-199a-3p-rheb-3
′‑
utr的突变引物为forward:
[0087]
tgttactcaagtattaactaggcttcagtata,
[0088]
reverse:ttttactacgtataacaatgagttcataattg,
[0089]
mir-199a-5p-rheb-3
′‑
utr的突变引物为forward:
[0090]
ctgctgcaaagcctgaggtctcagcgaat,
[0091]
reverse:gcttcttcaggtagaatatattcgctgagacctcag。
[0092]
接着,通过qrt-pcr和western blot方法检测了mir-199a-3p和mir-199a-5p表达水平对于rheb的mrna水平和蛋白水平的影响。提取rna,然后用takara公司的primescript rt master mix perfect real time试剂盒进行反转录,再进行qrt-pcr检测。用来检测的仪器为bio-rad公司的iq5系统,试剂为takara公司的sybr green mix。这种试剂里面含有taq dna聚合酶,dntp mix,sybr green dye。18s用来作为内参基因。本实验所用到的引物为:rheb引物forward:5
′‑
ctatctttcctcagacatactcca-3
′
,
[0093]
reverse:5
′‑
caccatatccaacaatttgccatg-3
′
;
[0094]
18s引物forward:5
′‑
ctcgcttcggcagcaca-3
′
,
[0095]
reverse:5
′‑
gcctcactaaaccatccaa-3
′
。
[0096]
另外,已知rheb是mtor信号通路的激活因子,则进一步验证mir-199a参与调控了mtor信号通路。
[0097]
第四步:验证靶基因rheb相关细胞功能的应用。
[0098]
通过rna干扰技术人为的敲低rheb表达水平,利用invitrogen block-it
tm rnai designer在线网站设计2组特异性shrna序列,其中shrheb-1引物
[0099]
forward:
[0100]5′‑
ccgggttggttgggaataagaaagactcgagtctttcttattcccaaccaactttttg-3
′
,
[0101]
reverse:
[0102]5′‑
aattcaaaaagttggttgggaataagaaagactcgagtctttcttattcccaaccaac-3
′
;
[0103]
shrheb-2引物forward:
[0104]5′‑
ccgggcaagtcttcatgctcggtgactcgagtcaccgagcatgaagacttgctttttg-3
′
,
[0105]
reverse:5
′‑
aattcaaaaagcaagtcttcatgctcggtgactcgagtcaccgagcatgaagacttgc-3
′
;并将其克隆到plko.1-puro载体上。随后,通过慢病毒包装系统构建了rheb敲低稳转细胞株及对照组细胞株,并用qrt-pcr和western blot的方法检测rheb的mrna及提取的蛋白水平变化情况,检测rheb敲低程度。随后,通过cck-8法、克隆形成及流式细胞仪检测敲低rheb后对于nsclc的细胞增殖及凋亡的影响。
[0106]
第五步:通过构建小鼠皮下瘤模型、转移瘤模型和pdx模型实施,检验mir-199a-3p和mir-199a-5p对小鼠瘤体生长的影响。
[0107]
裸鼠成瘤(皮下瘤和转移瘤模型)实验,具体操作步骤如下:
[0108]
(1)采用慢病毒感染方法构建a549稳定高表达mir-199a(mir-199a-3p和mir-199a-5p)的细胞株;
[0109]
(2)扩大培养能稳定高表达mir-199a(mir-199a-3p和mir-199a-5p)的a549细胞株;
[0110]
(3)培养细胞至一定数量之后,常规消化、收集细胞,按照每只小鼠5
×
106cells/100μl(皮下瘤)和2.5
×
106cells/200μl(转移瘤)的规格来计数细胞;
[0111]
(4)稳转株细胞通过皮下注射每只100μl,构建皮下瘤模型;
[0112]
(5)稳转株细胞通过尾静脉注射每只200μl,构建转移瘤模型;
[0113]
(6)每隔一周时间定时测量并记录瘤体生长情况(用游标卡尺);
[0114]
(7)一般6~8周后,小鼠瘤体生长至合适的体积,体积一般不超过1,500mm3,严格按照动物伦理规定合理方式处死小鼠;
[0115]
(8)取出皮下瘤,称量并拍照;
[0116]
(9)取出转移瘤(整个肺部),称量并拍照;
[0117]
(10)瘤体一部分置于质量百分比为4%的多聚甲醛中室温过夜,然后可转移到4℃长期保存,用于免疫组化检测;一部分放入细胞冻存管,置于液氮中,随后转移到-80℃保存,用于检测基因的rna和蛋白。
[0118]
pdx模型具体实施步骤如下:
[0119]
从上海胸科医院获得新鲜肿瘤组织。已获得患者知情同意,并获得上海市胸科医院伦理委员会许可。新鲜肿瘤组织放置在冰浴的无菌rpmi 1640中,将组织剪成约2
×2×
2mm3大小的碎片,并用rpmi培养基洗涤三次。裸鼠用异氟烷麻醉,背腹部皮肤用75%酒精消毒,于一侧前腋下附近用无菌手术剪剪出2mm皮肤破口,再以18号穿刺针头进入破口并于皮下钝性分离直至形成10mm长皮下窦道,将切好的肿瘤组织碎片用3mm内径定制的穿刺针推入窦道,最后于皮肤破1:2滴加双抗(100x青霉素/链霉素)。用游标卡尺测量皮下瘤体体积,公式为:肿瘤体积=(长
×
宽2)/2。当肿瘤体积大于200mm3开始传代,肿瘤组织就会传给下一代,直到第三代。我们使用第三代小鼠通过agomir-199a-3p/5p验证mir-199a对肿瘤的抑制作用。组织取出一部分用10%中性福尔马林固定,一部分快速冷冻并在-80℃保存用于组织病理学检测。
[0120]
第六步:验证mir-199a-3p和mir-199a-5p在nsclc中egfr-t790m引起吉非替尼药物敏感性的影响。
[0121]
首先确立在egfr-t790m耐药突变型pc-9gr(pc-9 gefitinib resistance)细胞中吉非替尼对mir199a-3p/5p高表达与对照组细胞的半数抑制浓度(ic
50
)。随后,在pc-9和pc-9gr中分别构建mir-199a稳定高表达的稳转细胞株。对pc-9和pc-9gr的稳转细胞株用吉非替尼给药,检测对细胞的增殖、迁移以及细胞凋亡的影响,以检测过表达mir-199a对nsclc中吉非替尼敏感性的影响。
[0122]
在本研究中,发现mir-199a-3p和mir-199a-5p在nsclc肺癌组织样本和细胞系中均呈低表达,且在病人样本的数据库中也得到验证。在nsclc细胞系中过表达mir-199a-3p和mir-199a-5p后,细胞的增殖和迁移受到显著抑制,细胞凋亡得到提高,并能增加细胞的自噬水平。通过软件预测、双荧光素酶报告基因及western blot等实验发现,mir-199a-3p
5p共同作用下对a549、h1299细胞增殖的影响;d和e为转染mir-199a-3p/5p/nc及mir-199a-3p和mir-199a-5p共同作用下对a549、h1299细胞克隆形成的影响;f和g为transwell实验检测mir-199a-3p和mir-199a-5p分别对a549和h1299细胞迁移能力的影响;h和i为mir-199a-3p/5p及两者共同作用下对a549和h1299细胞凋亡的影响。
[0133]
图3-1为mir-199a-3p/5p共同靶向抑制rheb的表达。
[0134]
其中,a为通过targetscan,pita,mirmap和miranda在线软件对mir-199a-3p、mir-199a-5p的靶基因进行预测筛选;b为对预测的mir-199a-3p、mir-199a-5p的靶基因与mtor信号通路分子进一步分析筛选出交集;c为通过qrt-pcr检测rheb在肺癌细胞系的表达水平;d为临床组织样本中rheb的表达水平;e为mir-199a-3p与rheb之间的相关性;f为mir-199a-5p与rheb之间的相关性;g临床样本组织切片,通过免疫组化检测rheb的表达水平;h为kaplan-meier plotter分析rheb对病人生存率的影响;i为通过gepia数据库分析在luad和lusc组织样本中rheb的表达水平;j为mir-199a-3p和mir-199a-5p的种子序列与rheb3'-utr结合区域模式图,定点突变位点位于结合mir-199a-3p和mir-199a-5p种子序列的rheb3'-utr区域;k共转染mir-199a-3p/5p mimic或nc与rheb3'-utr wt,通过双萤光素酶报告基因系统检测相对荧光活性;l通过qrt-pcr方法,检测提高mir-199a-3p和mir-199a-5p的表达对rheb mrna水平的影响;m和n为通过western blot,检测过表达mir-199a-3p和mir-199a-5p对提取的蛋白rheb水平的影响。
[0135]
图3-2为在nsclc中mir-199a抑制mtor信号通路。
[0136]
其中,a为encori数据库分析rheb与mtor的相关性;b为通过western blot检测mir-199a-3p/5p过表达时,a549和h1299细胞中p-mtor和mtor表达水平。
[0137]
图4为敲低rheb在nsclc中对细胞增殖和细胞凋亡的影响。
[0138]
其中a、b和c为rheb敲低后,稳转细胞株中rheb的mrna和蛋白水平变化;d为通过cck-8法检测rheb敲低对nsclc细胞增殖的影响;e为通过克隆形成检测rheb敲低对nsclc细胞增殖的影响;f为通过annexin v-fitc/pi细胞凋亡双染试剂盒检测下调rheb对a549和h1299细胞的凋亡情况。
[0139]
图5-1为构建mir-199a稳转细胞株a549(plenti-mir-199a)。
[0140]
其中a为稳转细胞株荧光效果图;b和c为mir-199a-3p和mir-199a-5p在a549细胞中上调水平。
[0141]
图5-2为mir-199a对小鼠nsclc瘤体生长及转移瘤生长的影响。
[0142]
其中a为裸鼠皮下瘤注射plenti/plenti-mir-199a a549稳转株细胞后,瘤体示意图;b为每周瘤体的体积大小;c为瘤体的重量;d为瘤体组织研磨,用qrt-pcr方法,检测mir-199a-3p和mir-199a-5p的表达情况;e为瘤体组织研磨,经qrt-pcr检测,rheb的表达情况;f和g为通过免疫组化检测小鼠瘤体组织中增殖标记物ki-67、rheb、e-cadherin和n-cadherin的蛋白表达情况(放大倍数
×
100);h为转移瘤模型,肺部转移瘤示意图;i为肺部转移灶数量;j为肺部重量;k为h&e染色,肺部切片。
[0143]
图5-3为通过pdx瘤体模型,检测mir-199a对小鼠nsclc瘤体生长的影响。
[0144]
其中a为pdx瘤体模型构建流程;b为瘤体示意图;c为在构建成功的第4代pdx裸鼠,每周测量肿瘤生长曲线,第35天开始皮下注射agomir-199a-3p/5p治疗,每3天测量一次体积;d瘤体的重量;e为通过elisa法检测il-6和tnf-α的表达情况;f为通过免疫组化检测小
鼠瘤体组织中增殖标记物ki-67、rheb、e-cadherin和n-cadherin的蛋白表达情况。
[0145]
图6为在nsclc中mir-199a对egfr-t790m引起的吉非替尼药物敏感性的影响。
[0146]
其中a为在egfr-t790m耐药突变型pc-9gr(pc-9 gefitinib resistance)细胞中检测吉非替尼对mir199a-3p/5p高表达与对照组细胞的半数抑制浓度(ic
50
);b为pc-9和pc-9gr细胞中mir199a-3p/5p表达水平;c为pc-9和pc-9gr细胞中靶基因rheb和甲基化转移酶dnmt3b表达情况;d和e为吉非替尼给药后,通过cck-8法检测mir-199a稳转细胞株pc-9和pc-9gr中对细胞增殖的影响;f和g为吉非替尼给药后,通过克隆形成检测mir-199a稳转细胞株pc-9和pc-9gr中对细胞增殖的影响;h和i为吉非替尼给药后,mir-199a稳转细胞株pc-9和pc-9gr中对细胞迁移的影响;j和k为吉非替尼给药后,检测mir-199a稳转细胞株pc-9和pc-9gr中对细胞凋亡的影响。
[0147]
图中*p<0.05,**p<0.01,***p<0.001。
具体实施方式
[0148]
下面将结合具体实例进一步阐述本发明。这些实例仅用于阐述本发明,而不用于限制本发明的范围。下列实例中未注明具体实验条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
[0149]
以下结合具体的实施例子对上述方案做进一步说明,本发明的优选实施例详述如下:
[0150]
实施例一:
[0151]
确定在nsclc病人组织及细胞系中mir-199a-3p/5p呈低表达
[0152]
本发明所用到的临床肺癌患者组织样本和与癌旁组织样本来自上海交通大学附属上海市胸科医院,对肺癌患者经外科手术切除的肿瘤组织,用到的临床样本经上海交通大学附属上海市胸科医院伦理委员会审批通过。
[0153]
我们首先在74对肺癌患者组织样本与其对应的癌旁组织用trizol法裂解组织,加入氯仿,待蛋白与核酸分层,离心之后吸取上清并加入异丙醇沉淀,再次离心后以乙醇洗涤沉淀,晾干,获得总rna。利用takara公司的反转录试剂盒构建两种组织的cdna文库,以oligo dt为引物进行反转录,通过变性反应和反转录获得后续实验的cdna。通过qrt-pcr法检测了mir-199a-3p和mir-199a-5p在74对肺癌患者组织样本中的表达水平。结果显示,mir-199a-3p和mir-199a-5p的表达水平在肺癌组织中均呈现显著低表达的趋势(参见图1a,b)。同时,又在6种nsclc细胞系(hcc827、h1975、h1299、pc-9、a549和h1650)中检测了mir-199a-3p和mir-199a-5p的表达情况。实验结果显示,与正常的肺上皮细胞beas-2b比较,mir-199a-3p和mir-199a-5p在这些nsclc细胞系中均呈明显下调趋势(参见图1c,d)。
[0154]
此外,通过oncomir数据库中的肺癌组织组织样本病例(http://www.oncomir.org/oncomir/search_mir_surv.html),分析了mir-199a-3p和mir-199a-5p的表达情况对肺癌病人的总生存率的影响。结果显示mir-199a-3p和mir-199a-5p高表达的情况下,病人的生存率上升,但是生存率影响不太明显(参见图1e,f);然而,在mir-199a-3和mir-199a-5p共同起作用下,即mir-199a-3p与mir-199a-5p同时高表达情况下,病人的生存率显著上升(参见图1g)。说明mir-199a-3p和mir-199a-5p表达水平提高,对肺癌病人有良好的预后效果。
[0155]
随后,通过funrich 3.1软件对mir-199a-3p/5p进行go(geneontology)功能分析,分析结果显示mir-199a-3p/5p可能参与到mtor信号通路调控(参见图1g)。
[0156]
以上说明mir-199a-3p/5p不管是在临床肺癌组织样本还是在细胞系水平中都特异性低表达,还参与到mtor等信号通路的调控。并且mir-199a-3p/5p的高表达有利于肺癌的总生存率,预示着mir-199a可能作为一个抑癌基因参与调控肺癌的进程。
[0157]
实施例二:
[0158]
本实施例与实施例一基本相同,特别之处在于:
[0159]
在本实施例中,mir-199a-3p/5p在nsclc中对细胞增殖、迁移和细胞凋亡的影响。
[0160]
通过lipo2000转染试剂向a549及h1299细胞中分别转染50nm mir-199a-3p mimic和mir-199a-5p mimic以及其阴性对照nc,并通过qrt-pcr方法检验在a549及h1299这两种细胞系中的表达情况。结果显示,mir-199a-3p在a549和h1299中大约分别上调了240倍和150倍,mir-199a-5p分别上调了约450倍和260倍(参见图2a)。mir-199a-3p和mir-199a-5p在a549及h1299这两种细胞系中的表达水平显著上调。
[0161]
接着,向a549和h1299细胞转染50nm mir-199a-3p和mir-199a-5p mimic,采用cck-8法并利用酶标仪(波长:450nm)测od值,连续检测24h,48h和72h细胞活性,3天的od值变化,绘制出细胞生长曲线。实验结果表明:与对照组相比,过表达mir-199a-3p和mir-199a-5p能把a549和h1299细胞增殖给抑制,72h时尤其明显;并且,mir-199a-3p和mir-199a-5p共同作用下抑制细胞增殖的效果更明显(参见图2b,c)。又通过克隆形成实验检测,把细胞铺在直径3cm的培养皿中,每皿500个细胞。实验结果显示:高表达mir-199a-3p和mir-199a-5p之后,a549和h1299的细胞克隆形成的数目明显比对照组减少,在a549细胞中,过表达mir-199a-3p、mir-199a-5p及两者共同作用下细胞克隆数目分别减少了32%、38%和56%,在h1299中分别下降了35%、40%和45%,细胞克隆数目都受到了明显的抑制(参见图2d,e)。
[0162]
随后,检验了mir-199a-3p和mir-199a-5对nsclc的迁移的影响。在a549和h1299细胞中转染mir-199a-3p mimic、mir-199a-5p mimic、mir-199a-3p+5p mimic或nc,6h后,细胞消化下来转移到带有transwell小室的12孔培养板中,每个小室铺大约8,000个细胞。24h后,对小室中的细胞样品处理,最后在倒置显微镜下随机选取至少4个清晰观察的视野,拍摄并计数处理分析。结果显示,导入mir-199a-3p、mir-199a-5p和两者共同作用后,聚碳酸酯膜下层附着的a549和h1299细胞数量较对照组明显减少,这再次验证在nsclc细胞中过表达mir-199a-3p和mir-199a-5p能抑制细胞迁移的能力(参见图2f,g)。
[0163]
前面证明mir-199a-3p和mir-199a-5p能抑制细胞增殖及细胞的迁移,接着实验验证还发现mir-199a-3p/5p对细胞凋亡也有显著的影响。转染mir-199a-3p和mir-199a-5p提高表达水平后,用annexin v-fitc/pi染色,通过流式细胞仪分析处理凋亡细胞的比例,结果显示:在a549细胞中,高表达mir-199a-3p、mir-199a-5p和两者共同作用后,凋亡率分别为14.71%、16.89%和20.45%,而对照组a549细胞的凋亡率为7.96%;同样条件下,在h1299细胞中,其凋亡率分别为13.18%、12.52%和16.49%,而对照组h1299细胞中的凋亡率则为9.7%。以上结果表明mir-199a-3p和mir-199a-5p能明显促进细胞凋亡(参见图2h,i)。
[0164]
实施例三:
[0165]
本实施例与上述实施例基本相同,特别之处在于:
[0166]
在本实施例中,mir-199a-3p/5p共同靶向抑制rheb的表达。
[0167]
通过四个在线预测软件targetscan(http://www.targetscan.org/vert_72/),miranda(http://miranda.org.uk/),pita(https://genie.weizmann.ac.il/pubs/mir07/mir07_data.html)和mirwalk(http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk2/)的预测和汇总,并结合前面的go功能分析出mir-199a-3p/5p是与mtor信号通路有关系。基于此筛选分析出mir-199a-3p和mir-199a-5p有三个共同靶基因,对这3个候选基因进行进一步分析和文献查阅,最终确定rheb为研究对象(参见图3-1a,b),已知rheb在肺癌中是一个促癌基因。通过qrt-pcr检测了rheb在6种常见肺癌癌细胞系(hcc827、h1975、h1299、pc-9、a549及h1650)中的表达情况。结果显示,与正常的肺上皮细胞beas-2b比较,rheb在nsclc细胞系中的表达水平大多数呈上调趋势,与预测相符(参见图3-1c)。同时,还检测了rheb在临床组织样本的表达情况,通过qrt-pcr方法验证发现:rheb在74对临床组织样本中高表达(图参见图3-1d)。并结合前面检测的mir-199a-3p和mir-199a-5p在临床样本组织中的表达情况,进一步spss分析发现,rheb与mir-199a-3p或mir-199a-5p都呈负相关的关系(参见图3-1e,f)。另外,我们还对病例组织的癌与癌旁进行了免疫组化,发现与癌旁相比,癌组织rheb的表达水平的确上调(参见图3g)所以我们猜测mir-199a-3p/5p通过抑制癌基因rheb从而抑制了nsclc的发生发展。
[0168]
通过kaplan-meier plotter online database(www.kmplot.com/analysis)线上数据库分析在1926例病人中,在rheb表达水平高的情况下,病人的生存率下降,rheb的表达水平与病人生存率呈负相关(参见图3-1h)。通过gepia(http://gepia.cancer-pku.cn/index.html)在线数据分析,发现在luad(lung adenocarcinoma)组织中,以347例正常组织为对照,483例癌症病人中rheb的表达水平呈高表达;同样的,在lusc(lung squamous cell carcinoma)组织中,与正常组织比较,在癌症病人组织中rheb也呈高表达趋势(参见图3-1i)。
[0169]
随后,通过基因序列比对,mir-199a-3p和mir-199a-5p的种子序列与靶基因rheb的mrna 3'-utr能够互补配对,这意味着mir-199a-3p和mir-199a-5p可能与靶基因rheb的mrna 3'-utr有结合,并抑制其表达(参见图3-1j)。为了确定rheb是否是mir-199a-3p和mir-199a-5p共同的靶基因,分别将rheb3'-utr中含有与mir-199a-3p和mir-199a-5p结合位点的片段克隆到pgl3-mireport荧光素酶报告载体上。当mir-199a-3p或mir-199a-5p与rheb 3'-utr结合之后,荧光素酶的表达会受到阻碍,该体系荧光素的分解能力也有所下降。基于此,我们根据实验组中荧光素活力值高低的变化情况,判断mir-199a-3p和mir-199a-5p能否共同直接靶向作用于rheb 3'-utr。结果显示,与对照组相比,在过表达mir-199a-3p和mir-199a-5p后,我们检测到相对荧光素活性值明显降低,萤火虫的荧光素酶活性下降(参见图3-1k)。此外,我们还对rheb 3'-utr中与mir-199a-3p或mir-199a-5p结合的位点进行了定点突变。实验结果显示,较对照组而言,实验组的相对荧光素活性值并未发生显著变化(参见图3-1k)。基于以上结果,我们确认了mir-199a-3p和mir-199a-5p与rheb确实具有直接的靶向关系。
[0170]
接着,通过qrt-pcr和western blot方法检测了mir-199a-3p和mir-199a-5p表达水平对于rheb的mrna水平和蛋白水平的影响。实验结果显示,在a549和h1299细胞中,提高
mir-199a-3p和mir-199a-5p的表达水平,rheb的mrna及蛋白水平降低(参见图3-1l,m,n)。这表明mir-199a-3p和mir-199a-5p的rna水平抑制rheb蛋白水平的表达。
[0171]
另外,已知rheb是mtor信号通路的激活因子,通过encori(http://starbase.sysu.edu.cn/index.php)数据库分析rheb与mtor也呈正相关的关系(参见图3-2a)。结合前面通过go功能分析发现mir-199a-3p/5p参与调控mtor信号通路,并且已证明了mir-199a-3p/5p与rheb确实存在靶向结合关系,为了验证mir-199a是否通过rheb调控了mtor信号通路,我们对通路mtor的活性进行了检测。在a549和h1299细胞中高表达mir-199a-3p和mir-199a-5p,发现mtor水平变化不大,而mtor磷酸化程度下降(参见图3-2b),但mir-199a-3p的作用不明显。以上说明mir-199a参与调控了mtor信号通路。
[0172]
实施例四:本实施例与上述实施例基本相同,特别之处在于:
[0173]
在本实施例中,敲低rheb抑制nsclc的细胞增殖和细胞凋亡。
[0174]
验证rheb在肺癌中的调控作用,我们利用rna干扰技术人为的敲低rheb表达水平,进而探究rheb对nsclc的细胞功能的影响。首先,我们利用invitrogen block-it
tm
rnai designer在线网站设计了2组特异性shrna序列,并将其克隆到plko.1-puro载体上。随后,通过慢病毒包装系统构建了rheb敲低稳转细胞株及对照组细胞株,并用qrt-pcr和western blot的方法检测rheb的mrna及提取的蛋白水平变化情况。实验结果显示,shrna-2在a549和h1299中的敲低效果最明显。因此,选rheb-shrna-2稳转细胞株用来进行后续的实验(参见图4a-c)。
[0175]
随后,通过cck-8法、克隆形成及流式细胞仪检测敲低rheb后对于nsclc的细胞增殖及凋亡的影响。实验结果显示,rheb敲低之后能够抑制a549和h1299的细胞增殖。克隆形成实验也证明,敲低rheb后,a549和h1299细胞的克隆数量明显的减少(参见图4d,e)。
[0176]
同时,利用之前同样的方法对细胞进行处理并检测对细胞凋亡的影响。结果表明,抑制rheb的表达后,将显著提高a549和h1299细胞凋亡率,即促进了这两株细胞的凋亡(参见图4f)。
[0177]
由此,我们可以得出,下调rheb的表达可以抑制nsclc的增殖,并促进细胞凋亡。
[0178]
实施例五:
[0179]
本实施例与上述实施例基本相同,特别之处在于:
[0180]
在本实施例中,mir-199a抑制小鼠nsclc瘤体生长及转移瘤的生长。
[0181]
通过构建小鼠皮下瘤、转移瘤和人源肿瘤异体移植瘤模型(patient-derived xenograft,pdx),在动物体内水平检验mir-199a-3p和mir-199a-5p的作用。
[0182]
首先,通过慢病毒感染的方法构建mir-199a(mir-199a-3p和mir-199a-5p)的a549稳转株细胞,使a549细胞能持续且稳定的高表达mir-199a-3p和mir-199a-5p。根据稳转株构建方法,转染空载plenti和载体pllenti-mir-199a,通过分选,选出绿色荧光阳性细胞,扩大培养,并在荧光显微镜下观察并拍摄细胞效果图,阳性效率高达99%(参见图5-1a)。通过qrt-pcr方法检测a549稳转细胞株中mir-199a-3p和mir-199a-5p的表达情况,实验组中mir-199a-3p和mir-199a-5p表达水平分别提高约10倍和45倍左右(参见图5-1b,c)。
[0183]
在裸鼠皮下注射plenti-mir-199a a549或plenti a549稳转细胞株构建皮下瘤模型,七周后,与对照组相比,过表达mir-199a(mir-199a-3p和mir-199a-5p)能显著抑制肿瘤生长(参见图5-2a),从小鼠生长统计图中可以看出,从二到三周间开始,对照组小鼠瘤体生
长速度已明显超过实验组的瘤体,待到第七周,取出瘤体并称重,实验组瘤体的大小及重量明显受到抑制(参见图5-2b,c)。经过对瘤体组织研磨,提取rna,通过qrt-pcr检测瘤体中mir-199a及靶基因rheb的表达情况,实验组中mir-199a-3p上调了8倍左右,mir-199a-5p上调了24倍左右(参见图5-2d),而瘤体中的rheb表达水平下调了约50%(参见图5-2e)。
[0184]
随后,对小鼠瘤体组织进行免疫组化实验,检测了一些关键基因。实验结果发现mir-199a高表达的瘤体中,细胞增殖的标志物ki67明显下调,靶基因rheb的表达水平降低,e-钙粘蛋白增多(e-cadherin),n-钙粘蛋白减少(n-cadherin),说明实验组细胞有着更加明显的上皮-间质转化(emt),即mir-199a(mir-199a-3p和mir-199a-5p)抑制了肿瘤细胞的转移(参见图5-2f,g)。
[0185]
同时,还通过尾静脉注射plenti-mir-199aa549或plentia549稳转细胞株构建转移瘤模型,七周后,对小鼠解剖分析发现,与对照组相比,过表达mir-199a的小鼠肺部形成的转移灶数量明显下降(参见图5-2h,i),整个肺部取出称量发现,相比于对照组,高表达mir-199a组的小鼠肺部重量减少(参见图5-2j)。通过h&e染色发现对照组小鼠的肺部细胞更加密集,而过表达mir-199a组的小鼠肺部呈网状结构更大、更稀疏,趋于正常的肺部组织结构(参见图5-2k)。
[0186]
另外,通过使用患者新鲜的肺肿瘤组织构建pdx模型(参见图5-3a),经患者知情同意,从上海胸科医院获得新鲜肿瘤组织,2小时内皮下移植至麻醉6周龄裸鼠的左侧。当肿瘤体积达到200mm3时,肿瘤组织传给下一代,直到第四代。将第四代小鼠随机分为4组,nc组、agomir-199a-3p组、agomir-199a-5p组和agomir-199a-3p+agomir-199a-5p组(每组不少于5只)。当皮下肿瘤在35天左右达到适当大小时,在形成的皮下肿瘤周围注射agomir-199a-3p/agomir-199a-5p,每3天注射一次,并测量肿瘤大小。结果显示,注射agomir-199a-3p和agomir-199a-5p组抑制肿瘤的生长率,当agomir-199a-5p和agomir-199a-3p共同作用时,这种现象更为明显(参见图5-3b-d)。此外,我们还检测了小鼠血清中炎症因子的表达。结果显示,与nc组相比,agomir-199a-5p和agomir-199a-3p+agomir-199a-5p组白细胞介素-6(il-6)表达水平显著上调。与nc组比较,agomir-199a-3p、agomir-199a-5p、agomir-199a-3p+agomir-199a-5p组ifn-α表达也上调(参见图5-3e)。这提示mir-199a-3p/5p可能参与肿瘤免疫的调控。此外,我们还通过免疫组化方法检测肿瘤组织中ki67、rheb、e-cadherin和n-cadherin的表达。结果显示,注射agomir-199a-3p和agomir-199a-5p后,肿瘤组织中ki67和rheb显著下调,并诱导e-cadherin表达,但降低n-cadherin表达(参见图5-3f)。这些结果进一步验证mir-199a-3p/5p抑制肿瘤的生长。
[0187]
实施例六:
[0188]
本实施例与上述实施例基本相同,特别之处在于:
[0189]
在本实施例中,mir-199a增强nsclc中egfr-t790m引起的吉非替尼药物的敏感性。
[0190]
在肿瘤治疗过程中,许多靶向药物或化疗药物耐药性的产生大大阻碍了肿瘤治疗的效果。根据前面的实验基础,我们接下来检测了mir199a-3p/5p对nsclc细胞吉非替尼耐药的影响。
[0191]
首先通过cck-8法,在egfr-t790m耐药突变型pc-9gr(pc-9 gefitinib resistance)细胞中检测吉非替尼对mir199a-3p/5p高表达与对照组细胞的半数抑制浓度(ic
50
)。我们设置了10个浓度梯度,结果发现,mir199a-3p和mir-199a-5p高表达组的ic
50
分
别是290.6nm和331.4nm,明显低于对照组ic
50
=1112nm,表明高表达mir-199a-3p/5p能显著提高其对吉非替尼的敏感性(参见图6a)。我们还检测到pc-9gr中mir199a-3p和mir199a-5p表达水平低于pc-9(参见图6b),并且甲基化转移酶dnmt3b呈现明显的高表达趋势,导致具有抑癌作用的mir-199a-3p/5p基因上游启动子区域的甲基化水平升高,从而有可能发生表观遗传学沉默,而其共同的靶基因rheb表达水平上调(参见图6c),则激活了下游akt/mtor信号通路。
[0192]
随后,利用稳转株构建方法,我们在pc-9和pc-9gr中分别构建了mir-199a的稳转细胞株。对pc-9和pc-9gr的稳转细胞株用吉非替尼(50nm)给药,检测对细胞的增殖、迁移以及细胞凋亡的影响。实验结果显示,当给药细胞后,与对照组相比,cck-8和克隆形成实验都表明mir-199a稳定高表达的pc-9细胞受到的抑制增殖程度比pc-9gr的更大(参见图6d-g)。细胞划痕实验表明给药后高表达mir-199a的pc-9细胞受到的抑制迁移程度比pc-9gr的更明显(参见图6h,i)。流式细胞术检测结果显示,mir-199a高表达的pc-9和pc-9gr细胞都能促进细胞凋亡,pc-9组给药后凋亡率更明显(参见图6j,k)。综合以上结果表明过表达mir-199a能增强nsclc中吉非替尼的药物敏感性。
[0193]
上述实施例非小细胞肺癌中mirna基因的应用。pre-mir-199a的两个成熟体在nsclc肺癌组织样本和细胞系中均呈低表达,且在病人样本的数据库中也得到验证。mir-199a-3p和mir-199a-5p的一种共同靶基因是rheb,上述实施例通过与靶基因mrna的3
′‑
utr互补,抑制靶基因mrna的翻译或直接降解靶基因的mrna。在非小细胞肺癌细胞系中mir-199a-3p/5p与rheb有相互作用。这种相互作用影响了细胞的增殖、迁移及凋亡等生命活动。本发明通过软件预测、双荧光素酶报告基因及western blot等技术发现,mir-199a-3p和mir-199a-5p可直接共同靶向结合rheb,调控mtor信号通路,抑制了细胞增殖、迁移和促进细胞的凋亡。下调rheb的表达后出现同样抑制nsclc的效果。接着,通过动物体内实验(皮下瘤模型、转移瘤模型、pdx模型)验证出mir-199a能够明显抑制瘤体生长、转移及其靶基因的表达,说明mir-199a在nsclc中扮演着抑癌角色。另外,在nsclc的耐药细胞株(pc-9gr)中证明mir-199a-3p和mir-199a-5p能增强nsclc中egfr-t790m引起的吉非替尼药物敏感性。上述实施例在临床上为利用mirna来诊断和治疗非小细胞肺癌,以及提供药物治疗靶点方面提供了一定的应用价值。
[0194]
上面结合附图对本发明实施例进行了说明,但本发明不限于上述实施例,还可以根据本发明的发明创造的目的做出多种变化,凡依据本发明技术方案的精神实质和原理下做的改变、修饰、替代、组合或简化,均应为等效的置换方式,只要符合本发明的发明目的,只要不背离本发明的技术原理和发明构思,都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1