仿细菌纳米药物递送系统及其制备方法和应用
1.本发明属于药物载体技术领域,涉及一种仿细菌纳米药物递送系统,具体地说是仿细菌纳米药物递送系统及其制备方法和应用。
背景技术:
2.恶性肿瘤是严重危害人类健康的难治疾病之一,除临床上常用的手术、放疗、化疗等常规治疗手段外,肿瘤免疫疗法已显示出强大潜力,其机理是利用机体的免疫系统攻击肿瘤细胞。理想的肿瘤免疫疗法应至少具有高效性和低的毒副作用等特点,即高效激活抗肿瘤免疫应答、实现对肿瘤细胞的有效杀伤,而不对机体的正常组织产生损伤,或影响极小。但目前的肿瘤免疫疗法的肿瘤靶向性较弱,一方面限制了治疗效果,另一方面也易引起副反应。
3.为解决上述问题,利用药物递送系统对肿瘤组织和特定种类免疫细胞和肿瘤细胞进行靶向递送,是提高疗效,减低毒副作用的重要途径,在此基础上,抗肿瘤药物递送系统的相关研究十分活跃,作为递送系统药物载体的成分也多种多样。
4.目前相关的药物载体研究大多集中在动物水平。单独的药物很难实现高水平的肿瘤富集,纳米载体可通过增强的渗透和滞留效应(epr效应)增加药物在肿瘤部位的富集,但提高水平和靶向能力仍较为有限。通过在纳米载体表面修饰靶向性配体等方式可在一定程度上增强纳米载体的靶向性,但进入体内后表面快速形成的蛋白冠显著削弱其靶向功能。另外,如何实现对免疫细胞和肿瘤细胞的双重靶向,增强肿瘤免疫疗法的高效性、降低毒副作用是肿瘤免疫治疗领域亟待解决的难题。
5.因此,研发一种能够在肿瘤部位高富集长滞留、靶向作用于目标免疫细胞和肿瘤细胞的药物载体,构建形成稳定的药物递送系统,将极大提高抗肿瘤药物的作用效果。
技术实现要素:
6.本发明的一个目的,是要提供一种仿细菌纳米药物递送系统,记为bnms,采用生物可降解聚合物、阳离子脂质、sirna药物和细菌外膜囊泡为原料,制得在肿瘤部位高富集长滞留、树突状细胞和肿瘤细胞双重靶向的仿细菌纳米药物递送系统;
7.本发明的另一个目的,是要提供上述仿细菌纳米药物递送系统的制备方法,以达到高效制备的目的;
8.本发明还有一个目的,是提供仿细菌纳米药物递送系统用作制备抗肿瘤药物的应用。
9.为实现上述目的,本发明所采用的技术方案如下:
10.一种仿细菌纳米药物递送系统,制成它的有效成分的原料,包括:生物可降解聚合物、阳离子脂质、sirna药物和细菌外膜囊泡。
11.作为一种限定,所述生物可降解聚合物,为peg-pla和/或peg-plga;优选为peg
5k-plga
11k
或peg
5k-pla
25k
。
12.作为本发明的另一种限定,所述sirna药物为含yth结构域的家族蛋白1sirna的药物(记为siythdf1)或含程序性死亡因子配体1sirna的药物(记为sipd-l1)。
13.作为本发明的第三种限定,所述阳离子脂质为(2,3-二油酰基-丙基)-三甲胺(记为dotap)或n,n-二羟乙基-n-甲基-n-2-(胆固醇氧羰基氨基)乙基溴化铵(记为bhem-胆固醇)。
14.本发明还提供了上述仿细菌纳米药物递送系统的一种制备方法,包括依次进行的以下步骤:
15.s1.纳米颗粒浓缩液的制备
16.向含有生物可降解聚合物和阳离子脂质的氯仿中,加入sirna药物,经第一次超声后加水,再经第二次超声,除去氯仿,经过滤、浓缩,得纳米颗粒浓缩液;
17.s2.仿细菌纳米药物递送系统的制备
18.取纳米颗粒浓缩液和细菌外膜囊泡混合,经第三次超声,得仿细菌纳米药物递送系统;
19.其中,生物可降解聚合物、阳离子脂质、氯仿、sirna药物和水的比例关系为20~30g:2~3g:0.4~0.6l:10~15μmol:4~6l。
20.作为一种限定,所述细菌外膜囊泡,是由减毒沙门氏菌培养及后续分离所得。
21.作为进一步限定,取减毒沙门氏菌经增殖培养所得的培养液离心,得上清液,上清液经浓缩,分离,洗涤,得沉淀,即为细菌外膜囊泡。
22.作为再进一步限定,所述上清液经浓缩前,还需经0.45μm滤膜过滤。
23.作为本发明的另一种限定,所述纳米颗粒浓缩液中的纳米颗粒和细菌外膜囊泡的质量比为10g:2mg。
24.本发明还提供了上述仿细菌纳米药物递送系统的一种应用,即所述仿细菌纳米药物递送系统用作抗肿瘤药物。
25.本发明的仿细菌纳米药物递送系统可增强药物在肿瘤的富集和滞留,并可实现树突状细胞和肿瘤细胞的双重靶向。
26.由于采用了上述的技术方案,本发明与现有技术相比,所取得的技术进步在于:可实现同时向树突状细胞和肿瘤细胞递送药物,进而实现对其的有效干预,成功激活了抗肿瘤免疫应答,显著抑制肿瘤生长。
27.本发明的仿细菌纳米药物递送系统,是采用生物可降解聚合物、阳离子脂质、sirna药物和细菌外膜囊泡为原料制得。其中,生物可降解聚合物中两亲性嵌段共聚物具有良好的生物亲和性及自组装特性,能够在进入机体后自行降解;阳离子脂质可以促进sirna药物的包载;细菌外膜囊泡帮助药物在肿瘤的富集和滞留,实现对树突状细胞和肿瘤细胞的双重靶向。
28.本发明的仿细菌纳米药物递送系统,能够在肿瘤部位高富集长滞留、靶向作用树突状细胞和肿瘤细胞,构建形成的药物递送系统结构稳定,显著提高抗肿瘤药物的作用效果,肿瘤细胞摄取bnms的细胞比例为61.0%,约为摄取对照纳米颗粒(记为nps)的细胞的3.2倍。因此,仿细菌纳米药物递送系统能双重靶向树突状细胞和肿瘤细胞,通过增强肿瘤抗原在dc和肿瘤细胞中的提呈,促进抗原特异性t细胞的交叉激活、提高t细胞对肿瘤细胞的识别和杀伤。
29.本发明的仿细菌纳米药物递送系统,制备过程简单温和,原料易得,所制仿细菌纳米药物递送系统可用作抗肿瘤药物,易大规模生产,具有工业和实际应用的潜力。
30.下面结合附图及具体实施例对本发明作更进一步详细说明。
附图说明
31.图1为本发明实施例8中动态光散射测定nps和bnms的表面电势结果图;
32.图2为本发明实施例8中动态光散射测定nps和bnms的粒径结果图;
33.图3为本发明实施例8中动态光散射测定nps和bnms的血清稳定性结果图;
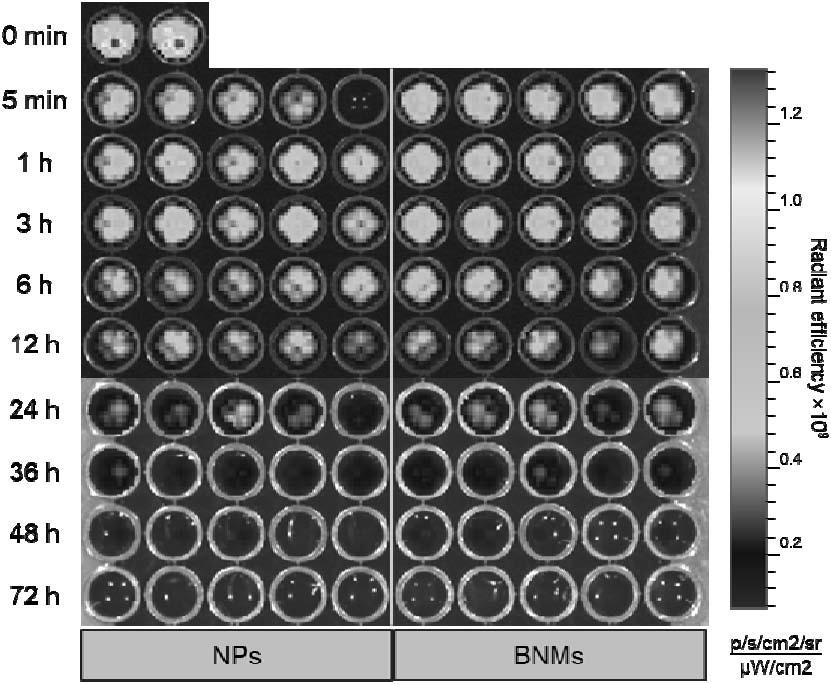
34.图4为本发明实施例8中xenogen ivis成像分析血液中nps或bnms结果图;
35.图5为本发明实施例8中nps或bnms的血液动力学结果图。
36.图6为本发明实施例8中荷瘤小鼠的全身荧光图像;
37.图7为本发明实施例8中荷瘤小鼠的肿瘤部位荧光值量化图;
38.图8为本发明实施例8中荷瘤小鼠的肿瘤、肝脏、脾脏、肺、肾脏及心脏组织荧光图像;
39.图9为本发明实施例8中荷瘤小鼠的肿瘤、肝脏、脾脏、肺、肾脏及心脏组织荧光值量化图;
40.图10为本发明实施例8中小鼠淋巴结中树突状细胞流式细胞术分析结果图;
41.图11为本发明实施例8中小鼠肿瘤组织中树突状细胞流式细胞术分析结果图;
42.图12为本发明实施例8中小鼠肿瘤细胞流式细胞术分析结果图。
具体实施方式
43.实施例1一种仿细菌纳米药物递送系统的制备方法
44.该制备方法包括依次进行的以下步骤:
45.s1.纳米颗粒浓缩液的制备
46.向含有25g peg
5k-plga
11k
(生物可降解聚合物)和2.5g(2,3-二油酰基-丙基)-三甲胺(阳离子脂质)的0.5l氯仿中,加入siythdf1(sirna药物)12.5μmol水溶液(25ml),在冰浴中经第一次超声1min,对超声后所得混合物加5l水,置于冰浴环境,经第二次超声2min,悬蒸除去氯仿,经超滤浓缩至0.5l,得纳米颗粒浓缩液(标记代码为nps);
47.s2.仿细菌纳米药物递送系统的制备
48.细菌外膜囊泡的制备:将减毒沙门氏菌vnp20009接种至lb培养基中,在37℃下200rpm振荡培养12h;将振荡培养后所得培养液按1:100的稀释倍数加入1000l新鲜lb培养基中,培养至菌悬液的od
600
达到1.0;收集培养悬液,4000g离心10min,得上清液;取上清液经0.45μm滤膜过滤,而后进行超滤浓缩至80l;对浓缩液150000g离心分离2h,分离所得沉淀即为细菌外膜囊泡(标记代码为omvs);
49.称取含10g纳米颗粒的纳米颗粒浓缩液和2mg的细菌外膜囊泡混合,冰浴中经第三次超声30min,得仿细菌纳米药物递送系统(标记代码为bnms)。
50.实施例2~7仿细菌纳米药物递送系统的制备方法
51.实施例2~7分别为一种仿细菌纳米药物递送系统的制备方法,它们的制备方法中的工艺步骤与实施例1相似,与实施例1的不同之处仅在于:
52.实施例2中,生物可降解聚合物为peg
5k-pla
25k
;sirna药物为sipd-l1;阳离子脂质为bhem-胆固醇;生物可降解聚合物、阳离子脂质、氯仿、sirna药物和水的比例关系为20g:2g:0.48l:14μmol:4l。
53.实施例3中,生物可降解聚合物为peg
5k-pla
25k
;sirna药物为sipd-l1;生物可降解聚合物、阳离子脂质、氯仿、sirna药物和水的比例关系为23g:3g:0.5l:15μmol:5l。
54.实施例4中,sirna药物为sipd-l1;生物可降解聚合物、阳离子脂质、氯仿、sirna药物和水的比例关系为30g:2.5g:0.4l:12μmol:6l。
55.实施例5中,生物可降解聚合物为peg
5k-pla
25k
;阳离子脂质为bhem-胆固醇;生物可降解聚合物、阳离子脂质、氯仿、sirna药物和水的比例关系为27g:3g:0.57l:10μmol:4l。
56.实施例6中,生物可降解聚合物为peg
5k-pla
25k
;sirna药物为sipd-l1;生物可降解聚合物、阳离子脂质、氯仿、sirna药物和水的比例关系为25g:2.4g:0.58l:14.3μmol:4.3l。
57.实施例7中,阳离子脂质为bhem-胆固醇;生物可降解聚合物、阳离子脂质、氯仿、sirna药物和水的比例关系为20g:2.5g:0.6l:10.67μmol:5.2l。
58.实施例2~7的制备方法中其它部分内容与实施例1相同,或为本领域技术人员根据实施情况的常规调整。
59.实施例8仿细菌纳米药物递送系统性能检测
60.(一)仿细菌纳米药物递送系统的表面电势、粒径和稳定性
61.通过动态光散射测定nps和bnms的表面电势、粒径及结构稳定性。
62.nps和bnms的表面电势结果如图1所示,其中,nps的表面电势约28.33mv,bnms的表面电势约26.67mv。粒径如图2所示,nps和bnms的粒径均为180nm左右。
63.动态光散射测定nps和bnms在生理溶液(含2%fbs的生理盐水)中的颗粒稳定性,如图3所示,nps和bnms在72h内粒径变化较小,表明在生理溶液环境下,本发明的仿细菌纳米药物递送系统结构稳定性好。
64.(二)仿细菌纳米药物递送系统的血液动力学
65.选择10只8周龄雄性icr小鼠,随机分为两组,每组5只,分别注射6μg dir标记的nps或bnms,在注射后的0min、5min、3h、6h、12h、24h、36h、48h和72h,通过眼眶后静脉丛取小鼠静脉血,2350g离心10min收集血浆,采用xenogen ivis成像分析其中dir的相对含量,结果如图4所示,随着时间的延长nps和bnms在血液中的荧光均呈现降低的趋势。统计图4中的荧光强度,如图5所示,nps和bnms在12小时内荧光强度下降超过50%,但是72小时后血液中仍能检测到纳米颗粒荧光。
66.(三)仿细菌纳米药物递送系统的体内分布检测
67.通过检测实施例1制得的仿细菌纳米药物递送系统在肿瘤模型小鼠的体内分布情况,验证仿细菌纳米药物递送系统在肿瘤部位的高富集和长期滞留特性。
68.实验方法:6~8周龄c57bl/6小鼠皮下注射106个mc38细胞,待mc38肿瘤达到100mm3,随机抽取10只荷瘤小鼠,平均分为nps和bnms两组,分别按每只鼠5μg(dir的剂量)静脉注射dir标记的纳米颗粒浓缩液(实施例1制得的nps)或仿细菌纳米药物递送系统(实施例1制得的bnms),在注射后3h、6h、12h、24h、36h、48h和72h,采用xenogen ivis成像系统观察全身荧光图像,抽取1只代表性小鼠拍摄结果进行展示,结果如图6,对各小鼠肿瘤部位荧光值进行量化分析,结果如图7;72h后取材小鼠肿瘤、肝脏、脾脏、肺、肾脏及心脏组织采
用xenogen ivis成像系统进行成像,其中1只代表性小鼠结果如图8,对各小鼠肿瘤和脏器荧光值进行量化分析,结果如图9;
69.结果表明,相较于纳米颗粒浓缩液中的纳米颗粒,本发明实施例1制得的仿细菌纳米药物递送系统在肿瘤组织富集更多,且滞留时间更长,最终在肿瘤部位的富集量约是纳米颗粒的2.1倍。
70.(四)仿细菌纳米药物递送系统的双重靶向活性
71.通过流式细胞术检测树突状细胞(dc,为白细胞的一种)和肿瘤细胞对实施例1制得的纳米颗粒和仿细菌纳米药物递送系统的摄取情况,检测仿细菌纳米药物递送系统的双重靶向活性。
72.实验方法:将按照(一)中方法构建模型小鼠20只,随机分为a、b、c、d四组,每组5只,其中a组静脉注射dio标记的纳米颗粒浓缩液(实施例1制得的nps),b组静脉注射dio标记的仿细菌纳米药物递送系统(实施例1制得的bnms);c组静脉注射did标记的纳米颗粒浓缩液(实施例1制得的nps),d组静脉注射did标记的仿细菌纳米药物递送系统(实施例1制得的bnms);注射剂量为每只小鼠5μg(dio或did的剂量);注射24h后牺牲小鼠,收集肿瘤、腹股沟引流淋巴结,分离得单细胞悬液,用bv510-anti-cd11c、apc-cy7-anti-cd45.2和pe-anti-ia/ie对肿瘤细胞和白细胞进行染色,用于流式细胞术分析。
73.分析结果如图10、图11和图12,结果表明,与纳米颗粒相比,肿瘤和淋巴结中树突状细胞均更多地摄取仿细菌纳米药物递送系统;另一方面,肿瘤细胞摄取bnms的细胞比例为61.0%,约为摄取nps的细胞的3.2倍。因此,仿细菌纳米药物递送系统能双重靶向树突状细胞和肿瘤细胞,通过增强肿瘤抗原在dc和肿瘤细胞中的提呈,促进抗原特异性t细胞的交叉激活、提高t细胞对肿瘤细胞的识别和杀伤。
74.上述结果表明,本发明的仿细菌纳米药物递送系统能够双重靶向树突状细胞和肿瘤细胞,在肿瘤部位高富集和长期滞留,构建形成的药物递送系统结构稳定,显著提高抗肿瘤药物的作用效果。
75.需要说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照上述实施例对本发明进行了详细的说明,对于本领域技术人员来说,其依然可以对上述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明权利要求保护的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1