Shh通路调控生物节律及其相关应用
51211)、gant61、jk184、robotnikinin、sonidegib phoshate或以上化合物的药学上可接受盐。
10.所述vismodegib的化学式如下:
11.所述gant61的化学式如下:
12.所述jk184的化学式如下:
[0013][0014][0015]
所述purmorphamine的化学式如下: [0016]
所述pf-5274857的化学式如下:
[0017]
所述mebendazole的化学式如下:
[0018]
所述hpi-4(ciliobrevin a)的化学式如下: 所述sant-1的化学式如下:
[0019]
所述taladegib(ly2940680)的化学式如下:
[0020][0021]
所述glasdegib(pf-04449913)的化学式如下:
[0022][0023]
所述cyclopamine的化学式如下:
[0024][0025]
所述itraconazole(r 51211)的化学式如下:
[0026]
所述robotnikinin的化学式如下:
[0027]
所述sonidegib phoshate的化学式如下:
[0028][0029]
本发明所述vismodegib(维莫德吉)是一种具有选择性hedgehog信号通路的新型口服类药物。维莫德吉已经由fda批准用于治疗基底细胞癌。本发明所述gant61(nsc 136476)是一种gli1及gli2诱导的转录抑制剂,抑制hedgehog 信号通路。
[0030]
本发明所述jk184是一种有效的hedgehog通路抑制剂,直接抑制gli1及 gli2的转录活性。
[0031]
本发明所述purmorphamine是一种smo受体激动剂。本发明所述pf-5274857 是一种有效的、选择性的、具有口服活性和可透过血脑屏障的smo拮抗剂。
[0032]
本发明所述mebendazole是一种高效广谱驱虫药,同时也被报道是hedgehog 抑制剂。
[0033]
本发明所述hpi-4(ciliobrevin a)是一种hedgehog通路抑制剂,直接影响 gli1的稳定性。
[0034]
本发明所述sant-1是一种有效的smo拮抗剂,能够抑制hedgehog通路。
[0035]
本发明所述taladegib(ly2940680)是一种smo受体拮抗剂,能够抑制 hedgehog通路。
[0036]
本发明所述glasdegib(pf-04449913)是一种有效的,具有口服活性的smo 抑制剂。
[0037]
本发明所述cyclopamine是一种选择性的smo抑制剂,能够拮抗hedgehog 通路。
[0038]
本发明所述itraconazole(r 51211)是是一种三唑类抗真菌药,也是一种有效的口服活性的hedgehog信号通路拮抗剂。
[0039]
本发明所述robotnikinin是一种能够结合smo上游shh信号的小分子抑制剂。
[0040]
本发明所述sonidegib phoshate(cas号:1218778-77-8英文名称:lde-225 diphosphate)是一种有效的、选择性的smo拮抗剂。
[0041]
本发明所述“hedgehog通路抑制剂”也即“hedgehog拮抗剂”,二者为相同含义,可以互换使用。
[0042]
本发明所述“smo通路抑制剂”也即“smo拮抗剂”,二者为相同含义,可以互换使用。
[0043]
本发明所述“生物节律相关疾病”包括睡眠障碍、时差调整、抑郁、代谢紊乱、衰老、血液疾病、糖尿病以及肥胖症等。
[0044]
本发明所述的“调节生物节律”的具体表现包括倒时差的快速适应,例如在光照周期(光照日程)改变时,受试者快速适应新的光照周期。本发明所述的“调节生物节律”还可以包括减轻光照周期改变带来的机体心理和生理功能的异常,使受试者在改变光照周期的情况下更顺利的适应新的光照周期。
[0045]
本文中使用的术语“受试者”是指任何动物(例如,哺乳动物),包括但不限于人、非
人灵长类动物、啮齿类动物等,其将成为特定治疗的接受者。优选地,所述受试者是人。
[0046]
本发明所述“药学上可接受盐”在被施用的量和浓度下是无毒的。在不阻止其发挥生理效应的情况下,通过改变化合物的物理特性,这样的盐的制备可以便于药理学应用。
[0047]
优选地,所述药学上可接受的盐还包括从酸中获得,所述酸可以是有机酸或无机酸;优选地,所述无机酸包括盐酸、氢溴酸、硫酸、硝酸、磷酸;优选地,所述有机酸如甲酸、乙酸、马来酸、琥珀酸、扁桃酸、富马酸、丙二酸、丙酮酸、草酸、乙醇酸、水杨酸、吡喃糖苷酸(pyranosidyl acid)、α-羟基酸如柠檬酸或酒石酸、氨基酸、芳香酸、磺酸。
[0048]
优选地,所述药学上可接受的盐还包括碱加成盐,具体地包括碱金属盐(如钠盐、钾盐等)及碱土金属盐(如钙盐、镁盐等)等。
[0049]
优选地,所述smo抑制剂包括sirna干扰技术、crispr技术、talen技术、zfn技术、cre-loxp重组技术等基因编辑技术在敲除smo的表达时所使用的试剂。
[0050]
优选地,所述smo抑制剂是特异性敲除scn区smo所使用的试剂。
[0051]
优选地,本发明所述smo的抑制剂是cre-loxp重组技术所使用的试剂,所述试剂中包含cre(cre重组酶)和loxp序列,cre重组酶基因编码区序列全长 1029bp(embl数据库登录号x03453),编码由343个氨基酸组成的38kda单体蛋白。它不仅具有催化活性,而且与限制酶相似,能识别特异的dna序列,即loxp位点,使loxp位点间的基因序列被删除或重组。
[0052]
优选地,所述应用是在体外发生的。
[0053]
优选地,所述应用是非治疗目的的。
[0054]
优选地,所述产品包括药物组合物。
[0055]
优选地,所述药物组合物还包括药学上可接受的载体、稀释剂或赋形剂。
[0056]
优选地,所述药学上可接受的载体、稀释剂或赋形剂包括但不限于已经由美国食品和药品管理局或中国食品药品监督管理局批准可用于人或家畜的任何佐剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增味剂、表面活性剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂、表面活性剂或乳化剂。
[0057]
如本发明所述可作为药学上可接受的载体或其组分的一些物质的具体例子是糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,如丙二醇、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,如润湿剂,如月桂基硫酸钠;着色剂;调味剂;压片剂、稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐溶液;和磷酸盐缓冲液等。
[0058]
本发明的组合物可根据需要制成各种剂型,并可由医师根据患者种类、年龄、体重和大致疾病状况、给药方式等因素确定对病人有益的剂量进行施用。给药方式例如可以采用注射或其它治疗方式(例如口服)。
[0059]
优选地,所述注射包括静脉注射、肌肉注射、腹腔注射或皮下注射。
[0060]
更优选地,本发明所述注射是指scn特异性位置的注射。
[0061]
本发明所述剂型包括片剂,丸剂,粉剂,颗粒剂,胶囊剂,锭剂,糖浆剂,液体,乳剂,混悬剂,控制释放制剂,气雾剂,膜剂,注射剂,静脉滴注剂,透皮吸收制剂,软膏剂,洗剂,粘附制剂,栓剂,小药丸,鼻制剂,肺制剂,眼睛滴剂等等。
[0062]
方法
[0063]
另一方面,本发明提供了一种治疗生物节律相关疾病的方法,所述方法包括施用hedgehog通路抑制剂、smo抑制剂。
[0064]
另一方面,本发明提供了一种治疗生物节律相关疾病的药物组合物,所述药物组合物中包括施用hedgehog通路抑制剂、smo抑制剂。
[0065]
另一方面,本发明提供了一种调节生物节律的方法,所述方法包括施用 hedgehog通路抑制剂、smo抑制剂。
[0066]
另一方面,本发明提供了一种调节生物节律的组合物;所述组合物中含有 hedgehog通路抑制剂、smo抑制剂。
[0067]
优选地,所述方法是在体外或体内发生的;
[0068]
更优选地,所述在体外针对细胞进行的。
[0069]
优选地,所述还可以是在受试者体内进行的;
[0070]
本文中使用的术语“受试者”是指任何动物(例如,哺乳动物),包括但不限于人、非人灵长类动物、啮齿类动物等,其将成为特定治疗的接受者。
[0071]
动物模型
[0072]
另一方面,本发明提供了一种生物节律异常的动物模型的构建方法,所述方法包括对模式生物使用hedgehog通路抑制剂、hedgehog通路敲除小鼠。
[0073]
优选地,所述方法包括以下步骤:
[0074]
1)获得scn区特异表达cre的动物模型;
[0075]
2)获得smo-loxp的动物模型;
[0076]
3)将1)和2)的动物模型进行交配。
[0077]
优选地,所述方法还包括将步骤3)所得到的动物模型进行多代繁殖。
[0078]
所述smo-loxp的动物模型即在smo基因第一个外显子的上下游各有一个loxp序列;本发明所述loxp序列即常规cre-loxp重组技术中的位点,loxp(locusof x-overp1)位点长为34bp,包括两个13bp的反向重复序列和一个8bp的间隔区域。其中,反向重复序列是cre重组酶的特异识别位点,而间隔区域决定了loxp 位点的方向。当基因组内存在loxp位点时,一旦有cre重组酶,便会结合到loxp 位点两端的反向重复序列区形成二聚体。此二聚体与其他loxp位点的二聚体结合,进而形成四聚体。随后,loxp位点之间的dna被cre重组酶切下,切口在 dna连接酶的作用下重新连接。两个loxp位点位于同一条dna链上且方向相同,cre重组酶敲除loxp间的序列。
[0079]
优选地,术语“下丘脑视交叉上核”、“scn(suprachiasmatic nucleus)”“视交叉上核”“丘脑区视交叉上核”皆为相同含义,可互换使用。
[0080]
另一方面,本发明提供了上述生物节律异常的动物模型的构建方法所构建的动物模型及其应用。
[0081]
优选地,所述应用包括研究shh通路调节生物节律。
附图说明
[0082]
图1是小鼠跑轮行为代表性结果图。图1a是改变光照周期时的跑轮行为结果图,图1b右是图1b左的相位移动50%时间统计结果图;图1c左为光照日程回复初始状态过程中相
位移动统计结果,图1c右是图1c左的相位移动50%时间统计结果图。
[0083]
图2是对smo敲除小鼠进行的检测结果图,图2a为western blot检测smo敲除效果,图2b是小鼠实物图和体重统计结果;图2c是小鼠大脑实物图和大脑长宽的统计结果;图2d是显微镜下尼式染色的检测结果图,图2e是显微镜下神经元染色的检测结果图。
[0084]
图3是vismodegib对生物节律影响的测试结果图,图3a是vismodegib在组织水平影响scn区节律基因震荡性变化;图3b为小鼠注射vismodegib后,在倒时差模型中小鼠跑轮行为;图3c为3b中小鼠在到光照日程提前8小时后相位移动情况;图3d为scn组织切片加入vismodegib后不同神经元节律基因震荡性变化过程,上方热图中红色和绿色分别代表per2表达量最高峰与最低峰;下方相位分布图为上方热图不同神经元相位统计结果。
[0085]
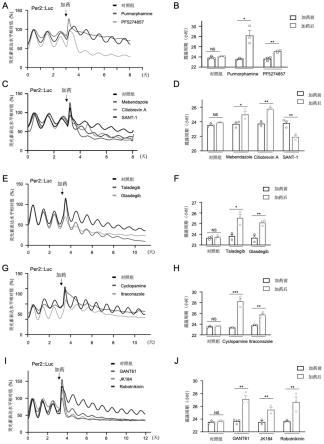
图4是hedgehog通路抑制剂对生物节律影响的结果图,图4a是purmorphamine、 pf5274857在组织水平影响scn区节律基因震荡性变化;图4b是4a震荡周期统计结果;图4c是mebendazole、ciliobrevin a、sant-1在组织水平影响scn 区节律基因震荡性变化;图4d是4c震荡周期统计结果;图4e是taladegib、 glasdegib在组织水平影响scn区节律基因震荡性变化;图4f是4e震荡周期统计结果;图4g是cyclopamine、itraconazole在组织水平影响scn区节律基因震荡性变化;图4h是4g震荡周期统计结果;图4i是gant61、jk184、robotnikinin 在组织水平影响scn区节律基因震荡性变化;图4j是4i震荡周期统计结果。
[0086]
图5是sonidegib phoshate对生物节律影响的结果图,图5a是sonidegib phoshate 在组织水平影响scn区节律基因震荡性变化;图5b是4k震荡周期统计结果。
具体实施方式
[0087]
下面结合实施例对本发明做进一步的说明,以下所述,仅是对本发明的较佳实施例而已,并非对本发明做其他形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例。凡是未脱离本发明方案内容,依据本发明的技术实质对以下实施例所做的任何简单修改或等同变化,均落在本发明的保护范围内。
[0088]
本发明所使用的材料和试剂
[0089]
1、per2::luc小鼠:为北京生命科学研究所张二荃老师赠送。即为记载于“ju et al. chemical perturbations reveal that ruvbl2 regulates the circadian phase inmammals.sci.transl.med.12,eaba0769(2020)”一文中,公众可从申请人处获得,尽可用于重复本发明实验使用,不得他用;smo-loxp小鼠购自jackson lab,货号为004526;nms-cre小鼠购自jackson lab,货号为027205。
[0090]
2、试剂
[0091]
表1、本发明所使用的试剂
[0092] 试剂厂商货号1smo抗体abclonala32742α-tubulin抗体mbl公司pm0543luciferinpromega公司e16024dmem培养基、hbss缓冲液gibco公司21063029、156300805pf-5274857sellecks27776hpi-4(ciliobrevin a)sellecks8249
7itraconazole(r 51211)sellecks24768gant61sellecks80759vismodegib(gdc-0449)sellecks108210jk184sellecks656511taladegib(ly2940680)sellecks215712cyclopaminesellecks114613sant-1sellecks709214glasdegib(pf-04449913)sellecks716015robotnikinin欣博盛ag-cr1-0069-m00116mebendazolemcehy-1759517purmorphamine阿拉丁p12603018sonidegib phoshatemcehy-16582
[0093]
注:以上表格中5-18为shh通路相关小分子药物。
[0094]
通用实验方法
[0095]
1.western blot检测敲除效果
[0096]
收集nms-smo-/-小鼠的scn脑片,研磨成单细胞并提取细胞全蛋白进行 western blot实验以检测敲除效果。
[0097]
(1)sds-page胶配制:根据所要检测的蛋白质的分子量大小,配10%浓度的胶;
[0098]
(2)上样:每孔上样30μg蛋白;
[0099]
(3)电泳:浓缩胶,恒压80v;分离胶,恒压120v。溴酚蓝前沿跑至胶边缘下胶;
[0100]
(4)转印:转印所需滤纸(每块胶4张)、纤维垫、硝酸纤维素膜、sds-page 胶放入1
×
transfer buffer平衡10分钟。(pvdf,为疏水性膜,使用前需特殊处理:甲醇浸湿约10s)。将制备好的转印三明治放入转印电极盒(注意正负极),加入转印缓冲液和冰盒开始转印。转印过程中整个转印槽置于冰浴中,400ma转印 2小时;
[0101]
(5)封闭:转印结束后,将转印三明治取出,用镊子将转印好的硝酸纤维素膜放入事先配制好的封闭液(5%脱脂牛奶)中,室温孵育封闭1小时;
[0102]
(6)一抗:分别用smo、α-tubulin一抗进行孵育,4℃过夜,之后用tbst 洗膜3次,每次5分钟;
[0103]
(7)二抗:用一抗对应的二抗进行孵育,室温孵育1小时,之后用tbst洗膜三次,每次5分钟;
[0104]
(8)显影:洗好的硝酸纤维素膜取出,尽量沥干膜上所带的tbst,正面朝上放于保鲜膜上,将事先分别取出的等量ecl试剂a、b液混匀,逐滴铺于膜上,进行显影;
[0105]
2.小鼠scn脑组织切片分离与培养
[0106]
1.小鼠scn脑组织切片分离
[0107]
a.对8-10周的小鼠进行麻醉,当小鼠失去知觉,但尚未停止了呼吸时,用剪刀迅速断头;
[0108]
b.用剪刀摘掉小鼠眼睛,以防止后续过程视神经激活,进一步破坏scn;
[0109]
c.用剪刀沿着两侧剪开小鼠颅骨,剔除所有的骨骼,直到嗅球中可以看出。避免挤压大脑,防止损害腹侧的scn;
[0110]
d.使用解剖剪刀剪掉嗅球和视神经连接处,确保视神经完全被切掉;
[0111]
e.倒扣头部,让完整的大脑掉到充满装有预冷hbss缓冲液(1
×
hbss,
[0112]
10mm hepes,4.5mm nahco3,1%penicillin-streptomycin)的10cm 培养皿中,保持大脑在hbss 30-60秒,以确保冷却大脑;
[0113]
f.用勺子将大脑转移至一个新的培养皿中,用无菌手术刀片切掉小脑;
[0114]
g.在vibratome振动切片机的切割平台上涂上强力胶;
[0115]
h.用无菌滤纸小心擦掉大脑切口处多余的hbss;
[0116]
i.切口朝下,将脑组织固定在切割平台上,转移至切割台上,并倒入预冷的hbss缓冲液;
[0117]
j.为了快速达到scn区域,800μm厚度快速切割,在开始达到下丘脑时降低速度,在看到视交叉神经时降低至300μm厚度继续切割;
[0118]
k.当scn变得可视化之后,300μm切割该层,用软刷将脑切片转移至装有预冷hbss缓冲液的培养皿中,在显微镜下观察scn区;
[0119]
l.在体视显微镜下切割scn区,去掉视交叉神经(oc),分离出1
×
1mm 极小区域的scn脑片。
[0120]
2.scn脑组织切片体外培养
[0121]
a.将分离出的scn转移至millicell插入式细胞培养皿中培养;
[0122]
b.添加dmem培养基1.2ml(添加100μm luciferin,1%b27无血清添加剂,1%penicillin-streptomycin),放入lymicycle仪中记录。
[0123]
3.scn脑组织单细胞成像
[0124]
a.将分离出的scn转移至millicell插入式细胞培养皿中培养;
[0125]
b.添加dmem培养基1.2ml(添加1mm luciferin,1%b27无血清添加剂,1%penicillin-streptomycin),将培养皿密封并放置在暗室中带有10 倍物镜(尼康eclipse ti-e)的倒置显微镜台上,在整个实验过程中,阶段温度设置为36℃。在-80℃下运行的ccd摄像机(ea4710v-bv,raptor,英国)安装在显微镜上进行图像捕获;
[0126]
c.严格避光,设置曝光时间是60分钟,连续采集图像;
[0127]
d.将2μm ttx或10μm vismodegib溶解并加入预加热新鲜培养基。
[0128]
3.nms-smo-/-缺陷小鼠倒时差实验
[0129]
a.将8周龄的雌性小鼠单独放于配有自主跑轮的笼子里,给予充足的食物以及饮用水;
[0130]
b.12小时光照:12小时黑暗(早07:00开灯,晚19:00关灯)的光照周期驯化小鼠14天,并且记录小鼠的运动情况;
[0131]
c.在第15天,提前开灯8小时,模拟倒时差条件(晚上23:00开灯,上午11:00关灯),评价小鼠适应新光周期的时间长短;
[0132]
d.在新的光周期下记录14天之后,调整光周期至原来的时间(早07:
[0133]
00开灯,晚19:00关灯),评价小鼠适应原来光周期的时间长短。
[0134]
4.smo抑制剂vismodegib能够加快野生型小鼠倒时差的快速适应
[0135]
a.将8周龄的雌性小鼠单独放于配有自主跑轮的笼子里,给予充足的食物以及饮用水;
[0136]
b.12小时光照:12小时黑暗(早07:00开灯,晚19:00关灯)的光照周期驯化小鼠7天,并且记录小鼠的运动情况;
[0137]
c.在第8天,利用脑立体定位仪将smo抑制剂药物通过缓释泵连续输送至scn区,手术后恢复3天,提前开灯8小时,模拟倒时差条件 (晚上23:00开灯,上午11:00关灯),评价小鼠适应新光周期的时间长短。
[0138]
实施例1、scn区特异敲除smo小鼠在光照周期改变中的表现
[0139]
8周龄成年雌鼠被单独置于装有跑轮笼的柜子中饲养,采用clocklab实时记录并分析小鼠的跑轮行为。图1a为对应小鼠跑轮行为代表性结果,小鼠经标准光照周期(早上7:00开灯,晚上19:00关灯)驯化两周后,将光照日程提前8h(晚上23:00开灯,上午11:00关灯),观察15天后再将光照日程回复初始状态,图中小鼠跑轮行为用黑色标记表示,白色背景和灰色背景分别代表光照与黑暗;图1b 为对应小鼠在光照日程提前8h过程中相位移动统计结果;图1c为对应小鼠在光照日程回复初始状态过程中相位移动统计结果。
[0140]
以上结果显示,在光照周期改变后,smo条件敲除小鼠出现倒时差异常表型,可以更快的适应新的光照周期。
[0141]
实施例2、scn区特异敲除smo小鼠鉴定
[0142]
nms-cre为scn区特异表达cre工具鼠,smo为shh信号通路重要的受体,通过将nms-cre小鼠与smo-floxp小鼠交配,经过多代繁殖后得到nms-smo
–
/
–
小鼠。
[0143]
图2a为western blot检测smo敲除效果(smo不仅仅在scn区nms神经元中表达,因此结果显示scn区特异敲除smo后,仍有少量检出);图2b显示smo条件敲除小鼠体重不受影响;图2c显示smo条件敲除小鼠大脑整体轮廓正常;图2d 和2e显示smo条件敲除小鼠scn区神经元分化正常。
[0144]
以上结果证明,成功构建了下丘脑区视交叉神经上核scn区特异敲除smo小鼠,且该小鼠整体发育正常。
[0145]
实施例3、smo抑制剂vismodegib影响小鼠节律行为
[0146]
vismodegib(维莫德吉)是一种具有选择性shh信号通路的新型口服类药物,该结果显示vismodegib能够直接影响节律基因震荡性变化,阻断scn神经元耦合过程,使得小鼠能够更快适应时差变化过程。图3a为节律基因在组织水平影响scn区节律基因震荡性变化,新鲜分离per2::luc小鼠scn区脑片用于体外培养,并用lumicycle持续记录per2表达水平;记录三天后,将培养基换成含有20μm vismodegib的新鲜培养基,观察到vismodegib能够明显抑制per2震荡性变化过程;三天后再将药物撤掉换成新鲜培养基,发现per2震荡性得以恢复,说明vismodegib的效果不是药物毒性所致。图3b为小鼠注射vismodegib后,在倒时差模型中小鼠跑轮行为;图3c为3b中小鼠在到光照日程提前8小时后相位移动情况;图3d为scn组织切片加入vismodegib后不同神经元节律基因震荡性变化过程,上方热图结果展示不同神经元per2表达水平变化过程,红色和绿色分别代表per2表达量最高峰与最低峰,可以看到加药前不同神经元per2 震荡性一致,加药后不同神经元的震荡性逐渐紊乱;下方相位分布图为上方热图不同神经元震荡性变化相位统计结果,每个点代表单个神经元对应相位。
[0147]
以上结果证明,vismodegib能够改善小鼠倒时差行为。
[0148]
实施例4、hedgehog通路抑制剂对生物节律影响
[0149]
新鲜分离per2::luc小鼠scn区脑片用于体外培养,并用lumicycle持续记录per2表达水平;记录三天左右后,将培养基换成含有hedgehog通路抑制剂的新鲜培养基,观察不同hedgehog通路抑制剂对per2表达震荡性变化的影响。
[0150]
图4a是2μm purmorphamine、1μm pf5274857在组织水平影响scn区节律基因震荡性变化;图4b是4a震荡周期的统计结果;
[0151]
图4c是20μm mebendazole、60μm ciliobrevin a、100μm sant-1在组织水平影响scn区节律基因震荡性变化;图4d是4c震荡周期的统计结果;
[0152]
图4e是10μm taladegib、20μm glasdegib在组织水平影响scn区节律基因震荡性变化;图4f是4e震荡周期的统计结果;
[0153]
图4g是20μm cyclopamine、25μm itraconazole在组织水平影响scn区节律基因震荡性变化;图4h是4g震荡周期的统计结果;
[0154]
图4i是10μm gant61、2μm jk184、10μm robotnikinin在组织水平影响 scn区节律基因震荡性变化;图4j是4i震荡周期的统计结果。
[0155]
图5a是不同浓度sonidegib phoshate在组织水平影响scn区节律基因震荡性变化;图5b是4k震荡周期的统计结果。
[0156]
以上结果证明,不同hedgehog通路抑制剂均能影响per2基因震荡性变化过程,有望用于调节生物节律以及节律紊乱疾病治疗过程中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1