一种护肤品原料、化妆品、制备方法及应用与流程
1.本发明涉及一种护肤品原料,具体为以α-甘油葡萄糖苷为主要成分的护肤品原料及其以此为原料的化妆品、制备方法及其应用。
背景技术:
2.行业公认甘油葡萄糖苷拥有优异的保湿能力,尤其是由甘油和通过糖苷键连接的葡萄糖组成的α-甘油葡萄糖苷(α-gg)有保湿、抗氧化和抗衰老等功效,同时该物质具有低热量甜味、益生元特性和蛋白质稳定功能。α-甘油葡萄糖苷(α-gg)分子量小,容易被皮肤吸收。不但有保湿的功效,还可以增强皮肤适应恶劣天气的能力,比如抗干燥、抗冷冻能力;还能够清除α、β射线所产生的自由基,有效保护皮肤免受辐射的伤害。可以阻止蛋白质等活性变性,保持它们的活性。且温和不致敏,保湿性强,能有效地保护表皮细胞膜结构,活化细胞,增加细胞的水化功能,可以改善皮屑增多、燥热、角质硬化等皮肤干燥引起的症状(schagen s k,overhagen s,bilstein a.new data confirm skin revitalizing and stress protection bynatural[j].euro cosmetics,2017,1(2):24-27.)。
[0003]
现有生物转化法生产制备α-甘油葡萄糖苷(α-gg)通常以蔗糖为糖基供体,在反应过程中会不断大量生成果糖副产物,由于多羟基的甘油糖苷与多羟基的果糖其极性较为接近,这使果糖含量较越高得两者之间的分离成本较高。
[0004]
受到现有技术中生产工艺条件等的限制,与α-甘油葡萄糖苷类似功能的生物功效活性分子与的α-甘油葡萄糖苷协同作用以及多种混合物效果性能的研究和技术开发,一直进展缓慢,生物技术的不断发展给行业解决现有问题带来了新的思路和方向。因此,运用生物技术获得性能更好、成本更低的补水锁水的组合物化妆品原料,是近年来本行业的研究热点。
技术实现要素:
[0005]
基于上述情况,我们公开了一种护肤品原料、化妆品、制备方法及应用,解决上述技术问题。
[0006]
阿洛酮糖是具有保湿生理活性的保湿修复功能的生物功效活性分子,本发明结合现有技术中提供一种同时生产甘油葡萄糖苷方法,在所提供的生产甘油葡萄糖苷方法中,以蔗糖和甘油作为直接底物,通过蔗糖磷酸合成酶催化糖基转移反应获得α
‑‑
甘油葡萄糖苷与果糖,然后通过进一步添加d-阿洛酮糖3-差向异构酶催化果糖的异构化反应,使得产物中的果糖进一步形成阿洛酮糖。
[0007]
为了解决上述技术问题,本发明提供如下技术方案:
[0008]
一种护肤品原料,同时含有阿洛酮糖和甘油葡萄糖苷。
[0009]
优选的,所述甘油葡萄糖苷为α-甘油葡萄糖苷。
[0010]
优选的,所述α-甘油葡萄糖苷含量为:52g/l~298g/l,所述阿洛酮糖的含量为:10.6g/l~195g/l。
[0011]
优选的,所述α-甘油葡萄糖苷含量为:52g/l,所述阿洛酮糖的含量为:10.6g/l。
[0012]
优选的,所述α-甘油葡萄糖苷含量为:298g/l,所述阿洛酮糖的含量为:195g/l。
[0013]
优选的,所述的护肤品原料来源于以蔗糖为原料,通过蔗糖磷酸酶和阿洛酮糖差向异构酶两种酶催化所获得酶催化反应液或者其进一步纯化的反应液。
[0014]
优选的,所述纯化包含酶活菌体的去除、脱盐两个工序。
[0015]
优选的,所述酶活菌体的去除后面增加了脱色步骤。
[0016]
优选的,所述任一种护肤品原料的化妆品。
[0017]
优选的,所述的化妆品为保湿水、精华液、保湿霜、润肤乳、面膜原液或者面膜其中任一种。
[0018]
优选的,一种护肤品原料的应用,所述的护肤品原料可用于制备保湿水、精华液、保湿霜、润肤乳、面膜原液或者面膜其中任一种。
[0019]
优选的,一种护肤品原料的制备方法,包括以下步骤:
[0020]
步骤1、以蔗糖和甘油为原料,使用蔗糖磷酸酶催化获得中间产物一;
[0021]
步骤2、以步骤1中的中间产物一为基础,使用阿洛酮糖差向异构酶催化获得中间产物二;
[0022]
步骤3、以步骤2中的中间产物二为基础,使用层析分离法获得终产物;
[0023]
所述蔗糖磷酸酶通过原核表达系统一表达获得,所述蔗糖磷酸酶目的基因序列如seq id no.1所示;
[0024]
所述原核表达系统一表达收集获得的菌体作为蔗糖磷酸酶粗酶;
[0025]
所述步骤1中的初始反应配方按质量比例为:水100份、蔗糖250份、蔗糖磷酸酶粗酶25份、ph 7.0的pb磷酸缓冲液(0.2mol/l)50份、甘油100份、0.25份的tween 80;
[0026]
所述反应条件为:35℃搅拌反应24h,向反应体系内补加10份lpp粗酶,50份甘油,50份水和50份蔗糖,继续反应24h;
[0027]
所述阿洛酮糖差向异构酶通过原核表达系统二表达获得,所述阿洛酮糖差向异构酶目的基因序列如seq id no.2所示;
[0028]
所述原核表达系统二表达收集获得的菌体作为阿洛酮糖差向异构酶;
[0029]
所述步骤2为:阿洛酮糖差向异构酶30份,硼砂118份,之后调整反应温度至55℃,搅拌反应60h,之后使用50%硫酸将反应体系酸至ph 3.0终止反应;
[0030]
步骤4、固液分离:取10l制备的酸化的ph 3.0完成反应液,加入10l纯水和1kg珍珠岩,常温搅拌1h,然后过滤,除去菌体、酶及沉淀的蛋白;
[0031]
步骤5、脱色:加入1kg活性炭搅拌1h脱色,然后过滤去除活性炭,用naoh回调ph至7.0;
[0032]
步骤6、过滤除菌:由无菌滤器过滤后获得终产物。
[0033]
优选的,所述步骤5后,还包括步骤5.1、脱盐:先采用酸性阳离子交换树脂进行脱盐,所述阳离子交换柱床体积20l,流速为1bv/h,45℃,然后利用阴离子交换树脂进行进一步脱盐降低反应液电导率,所述阴离子柱床体积20l,流速1bv/h,45℃,之后复用所述阳离子交换树脂进一步除盐降低电导率阴离子,所述柱床体积20l,流速1bv/h,45℃,每0.5bv取样以hplc-elsd监测流出液中果糖的含量,合并果糖含量低于1g/l的流出液。
[0034]
优选的,所述步骤5.1后,还包括步骤5.2、浓缩:采用真空浓缩釜对脱盐后的合并
pseudomesenteroides,其基因序列如序列1所列,该基因被亚克隆至公开的商业化表达载体pet-30a(+)中(采购自优宝生物,货号vt1212),构建成llp酶的表达质粒pet-30a-lpp。
[0047]
本实施例中所实用的阿洛酮糖差向异构酶(ntdae)基因来自于novibacillus thermophilus,其基因序列如序列2所列,所述的ntdae酶的基因也被亚克隆至表达载体pet-30a(+)中,构建成ntdae酶的表达质粒pet-30a-ntdae。
[0048]
本实施例中的表达质粒pet-30a-lpp与表达质粒pet-30a-ntdae委托金唯智生物科技有限公司完成基因合成并完成亚克隆的构建,制备与纯化。表达质粒dna使用前,按照金唯智生物科技有限公司的质粒产品说明书上所标注的说明,加入指定体积含量的缓冲液,溶解表达质粒dna冻干粉末,获得表达质粒dna溶液。
[0049]
蔗糖磷酸酶与阿洛酮糖差向异构酶的重组酶表达菌株的构建按照以下步骤:
[0050]
(1)制备大肠杆菌感受态细胞
[0051]
从新活化的大肠杆菌bl21(de3)(上海唯地生物技术有限公司生产)平板上挑取一个单菌落,接种于3ml lb培养基的试管中,37℃振荡培养过夜。将过夜培养的菌悬液按照1%w/w接种量转接到液体lb培养基中100ml,37℃振荡扩大培养2~3h,至培养液的od600达到0.3-0.5时停止培养。将培养好的菌液转移到离心管中,冰上放置20min,0℃-4℃离心10min(4000r/min)。之后弃掉上清,管口倒置以便培养液弃除干净。之后加入0.1mol/l冰冷的氯化钙溶液30ml,小心悬浮沉淀细胞,冰浴30min。然后于4℃冷冻离心10min(4000r/min),弃掉上清,用0.1mol/l氯化钙2ml冰浴悬浮细胞(冰上放置)片刻,作为质粒dna转化所用的感受态细胞。
[0052]
(2)质粒dna的转化与重组菌株的构建
[0053]
取步骤(1)中新鲜制备的bl21(de3)感受态细胞200ul,加入1ul所需转化的表达质粒dna(pet-30a-lpp或者pet-30a-ntdae)混匀。冰浴30min,离心管放到42℃保温90s(不要摇动离心管),然后迅速冰浴2min。向离心管加600ul lb液体培养基,37℃振荡培养1h(150rpm)。
[0054]
取上步骤37℃振荡培养后的菌液,涂布在含34μg/ml氨苄抗性的选择性lb培养基上,将培养皿放置在37℃恒温培养箱中,正置30min。等菌液完全被培养基吸收后,倒置培养皿,在37℃恒温培养箱中培养12~16h。挑选培养皿生长的单菌落,进行双酶切验证,选择双酶切后琼脂糖凝胶电泳结果符合阳性克隆的单菌落进行发酵酶活验证。选择双酶切验证通过的单菌落挑选至摇瓶进行重组酶的表达,摇瓶培养采用lb培养基(蛋白胨10g/l、酵母粉5g/l、氯化钠10g/l),将原始酶重组菌株或变体酶重组菌株接种摇瓶后,在37℃培养至浊度od600为0.6-1.0后,添加iptg(异丙基硫代半乳糖苷)的诱导重组酶(lpp或者ntdae)的表达(摇瓶内iptg终浓度为0.4mm),同时降温至25℃培养8-14h。最后,离心收集菌体作为重组酶粗酶。
[0055]
实施例2酶催化过程(对照组)。
[0056]
以实施例1按其步骤分别获得的pet-30a-lpp表达重组菌菌体作为lpp粗酶。
[0057]
甘油葡萄糖苷的生产反应过程参照现有技术中甘油葡萄糖苷的生物过程。
[0058]
其反应过程如下:
[0059]
按表.1所列的甘油葡萄糖苷酶促反应配方表的配方在酶反应罐内添加反应底物,对应份数为质量份数,然后维持35℃反应24h,向反应体系按物料质量补加10份lpp粗酶,50
份甘油,50份水和50份蔗糖,继续反应24h之后,使用50%硫酸将反应体系酸至ph3.0终止反应,反应液可用于后续甘油糖苷的分离及测试。
[0060]
表.1甘油葡萄糖苷酶促反应配方表
[0061][0062][0063]
将反之后的反应液,取样适当稀释后采用hplc-elsd检测(安捷伦1290infinity ii,色谱柱为hi-plex ca usp l19,250
×
4.0mm,流动相:水0.3ml/min,柱温:80℃)。结果如图1所示,反应之后,产物为甘油葡萄糖苷(保留时间5.3min)、残留的蔗糖(保留时间4.5min)以及生成的果糖(保留时间6.4min)。
[0064]
实施例3酶催化过程(双酶工艺)。
[0065]
以实施例1按其步骤分别获得的pet-30a-lpp表达重组菌菌体和pet-30a-ntdae表达重组菌菌体分别作为lpp粗酶和ntdae粗酶。
[0066]
甘油葡萄糖苷的生产反应过程参照本发明技术方案,其反应过程如下:
[0067]
按表.1所列的甘油葡萄糖苷酶促反应配方表的配方在酶反应罐内添加反应底物,然后维持35℃,搅拌反应24h,向反应体系内补加10份lpp粗酶,50份甘油,50份水和50份蔗糖,继续反应24h。
[0068]
之后,进一步向反应体系内投ntade粗酶30份,硼砂118份,之后调整反应罐温度至55℃,进一步搅拌反应60h,之后使用50%硫酸将反应体系酸至ph3.0终止反应,反应液可用于后续甘油糖苷的分离及测试。
[0069]
将双酶工艺催化后的反应液及过程中取样适当稀释后采用hplc-elsd检测(安捷伦1290infinity ii,色谱柱为hi-plex ca usp l19,250
×
4.0mm,流动相:水0.3ml/min,柱温:80℃)。反应终点的色谱图如图2所示,反应过程中三种主要产物含量的变化如图3所示。
[0070]
结果表明在获取lpp粗酶催化完成后,进一步加入ntade粗酶进行果糖异构化反应,继续反应24h(从lpp酶催化反应开始时计算的总时间72h),果糖能够大部分被异构化消耗,在最终产物中甘油葡萄糖苷含量达到425.6g/l,阿洛酮糖为240.4g/l,果糖残余浓度已经低于100g/l为80.7g/l。
[0071]
其次,甘油葡萄糖苷与果糖的保留时间较为接近,分离度较低。而与之相比,甘油葡萄糖苷与阿洛酮糖的保留时间相差较远,分离度较高,更加有利于后续分离。
[0072]
双酶工艺反应液色谱图见图2:双酶工艺反应液中,主要成份为保留时间(rt)5.3min的甘油葡萄糖苷,而果糖(rt6.4min)则大量被消耗,仅余少量残留,另外的主要成分为与甘油葡萄糖苷之间的分离度更高的阿洛酮糖(rt 9.2min)。
[0073]
双酶工艺反应过程中产物含量的变化如图3所示。
[0074]
实施例4果糖异构化对产物分离度的影响。
[0075]
分别对实施例2和实施例3所反应获得的反应液进行分离纯化。分离纯化步骤如下:(1)固液分离:取10l制备的酸化的完成反应液(ph3.0),加入10l纯水和1kg珍珠岩,常温搅拌1h,然后过滤,除去菌体、酶及沉淀的蛋白;(2)脱色:然后加入1kg活性炭搅(sac-02c,福建鑫森炭业)拌脱色搅拌1h脱色,然后过滤去除活性炭,用naoh回调ph至6.0;(3)层析:以20%乙醇再生后的活性炭层析柱(填料为活性炭sac-02c,福建鑫森炭业)进行层析分离,填料柱床体积(bv,bed volume)为25l。再生后的层析柱先使用纯水洗至无乙醇残留。之后将步骤(2)脱色后完成后的反应料进行上样吸附,上样流加速度为0.3bv/h,上样完成后以纯水作为洗脱剂进行清洗除糖,纯水流加速度0.3bv/h,并对流出液中的各糖含量进行检测,至流出液中果糖和阿洛酮糖含量均低于hplc-elsd的最小检出限(本实施例中果糖实际最小检出限0.008mg/ml,阿洛酮糖实际最小检出限为0.01mg/ml)之后,停止清洗。然后采用6%w/w乙醇水溶液进行洗脱,流速0.5bv/h,每流出0.5bv进行检测,合并甘油葡萄糖苷纯度高于99%洗脱液。(4)浓缩干燥,对步骤3合并的洗脱液在真空浓缩釜内60℃减压浓缩,至甘油葡萄糖苷含量约50%w/w,采用冷冻干燥法干燥获得纯度99%的甘油糖苷。
[0076]
分离纯化结果如表2所列,其中实施例2中,反应液中的果糖含量较高,初始果糖含量超过了300g/l,层析柱在洗脱过程中需要消耗11bv(275l)的纯水,才能柱床中的果糖。而对于实施例3中,采用双酶工艺获得反应液中果糖含量较低,其次阿洛酮糖相比于果糖更容易从活性炭柱床中洗出,3.5bv之后,洗杂流出液中已经无阿洛酮糖,4.5bv后可以将洗杂流出液中无测出果糖。
[0077]
相比于实施例2,实施例3所获得的反应液仅需要更少的纯水洗脱过程,就可以将糖从柱床中洗脱,大幅缩短了层析过程中需要的时间(减少21h),同时大幅降低了纯水的消耗量(6.5bv)与相应产生的废水,降低了生产成本。同时由于层析清洗除糖过程中,纯水流经柱床也会照成部分部分甘油糖苷产量的解析流出,因此也会照成产品的损失与收率的降低。
[0078]
表2甘油葡萄糖苷的分离纯化结果对比
[0079][0080]
实施例5阿洛酮糖的分离。
[0081]
为回收实施例3反应液中的阿洛酮糖产品,取实施例3反应获得的反应液,按照实
施例4中的分离步骤进行分离纯化。在步骤(3)层析的清洗除糖步骤中,将第0.5bv开始至3.5bv清洗除糖的洗脱液进行收集合并获得75l含糖洗脱液。含糖洗脱液中阿洛酮糖的色谱含量为82%(峰面积占比,面积归一化法),之后将合并的洗脱液以h2so4调节ph至5.5,采用强酸性阳离子交换树脂(英国漂莱特c100e)进行脱盐(阳离子交换柱床体积20l,流速为1bv/h,45℃)。之后,采用阴离子交换树脂(d301大孔弱碱性阴离子交换树脂,天津允开树脂科技有限公司)进一步脱盐(阴离子柱床体积20l,流速1bv/h,45℃),流出液ph值为6.8。之后采用真空浓缩结晶釜对其进行减压浓缩(相对真空压力-0.085mpa,60℃),待阿洛酮糖含量浓缩至75-80%w/w,缓慢降温至40℃,添加釜内阿洛酮糖质量1%w/w阿洛酮糖粉末作为晶种,搅拌,逐步降温,降温幅度约为2℃/h至温度20℃。之后将4000rpm离心,获得阿洛酮糖晶体,之后真空干燥、粉碎后即获得阿洛酮糖晶体(色谱纯度98%)。
[0082]
实施例6甘油葡萄糖与阿洛酮糖复合物的制备。
[0083]
将按实施例3的所述的方法制备甘油葡萄糖与阿洛酮糖的混合反应液,之后按以下步骤进行分离纯化:(1)固液分离:取10l制备的酸化的完成反应液(ph 3.0),加入10l纯水和1kg珍珠岩,常温搅拌1h,然后过滤,除去菌体、酶及沉淀的蛋白;(2)脱色:然后加入1kg活性炭搅(sac-02c,福建鑫森炭业)拌脱色搅拌1h脱色,然后过滤去除活性炭,用naoh回调ph至5.5;(3)脱盐:先采用酸性阳离子交换树脂(001
×
7,郑州中创净水材料有限公司)进行脱盐(阳离子交换柱床体积20l,流速为1bv/h,45℃),然后利用阴离子交换树脂(d301大孔弱碱性阴离子交换树脂,天津允开树脂科技有限公司)进行进一步脱盐降低反应液电导率(阴离子柱床体积20l,流速1bv/h,45℃),之后复用阳离子交换树脂(d113大孔树脂,天津允开树脂科技有限公司)进一步除盐降低电导率阴离子(柱床体积20l,流速1bv/h,45℃),每0.5bv取样以hplc-elsd监测流出液中果糖的含量,合并果糖含量低于1g/l的流出液。(4)浓缩:采用真空浓缩釜对脱盐后的合并的流出液进行减压浓缩(相对真空压力-0.085mpa,60℃),浓缩至初始体积10l,获得甘油葡萄糖与阿洛酮糖复合液。以hplc-elsd检测甘油葡萄糖与阿洛酮糖复合液中的成分含量:甘油葡萄糖298g/l,阿洛酮糖195g/l,果糖5.2g/l。
[0084]
以本实施例获得的甘油葡萄糖与阿洛酮糖复合液在无菌间中经由无菌滤器过滤后作为锁水复合液a,置于无菌瓶中于4℃保存备用。
[0085]
实施例7简化的甘油葡萄糖与阿洛酮糖复合物的制备。
[0086]
以实施例1按其步骤分别获得的pet-30a-lpp表达重组菌菌体和pet-30a-ntdae表达重组菌菌体分别作为lpp粗酶和ntdae粗酶。
[0087]
按照表3所设立的反应体系及条件进行双酶催化反应,反应之后所获得的催化反应液按照简化的分离纯化工艺进行分离纯化,仅对菌体进行分离。简化的分离纯化工艺如下:(1)固液分离:取10l制备的酸化的完成反应液(ph3.0),加入10l纯水和1kg珍珠岩,常温搅拌1h,然后过滤,除去菌体、酶及沉淀的蛋白;(2)脱色:然后加入1kg活性炭搅(sac-02c,福建鑫森炭业)拌脱色搅拌1h脱色,然后过滤去除活性炭,用naoh回调ph至7.0;(3)过滤除菌,由无菌滤器过滤后作为锁水复合液b,置于无菌瓶中于4℃保存备用。
[0088]
各糖在锁水复合液b中的糖含量由hplc-elsd测得,其中甘油葡萄糖苷52g/l,阿洛酮糖10.6g/l,蔗糖5.4g/l,果糖16.8g/l。
[0089]
表.3实施例7的双酶催化反应体系与反应条件
[0090][0091][0092]
实施例8锁水复合液对aqp3水通道蛋白的激活性能。
[0093]
aqp3水通道蛋白,负责水、甘油及尿素等物质的运输,属于一种转运蛋白因子,主要表达于角质形成细胞和皮肤成纤维细胞。aqp3不仅参与皮肤水合、屏障功能,同时在皮肤损伤和修复、愈合方面,均发挥着重要的作用,是皮肤正常形态和功能维持的重要保障。甘油葡萄糖苷被发现具有提高aqp3水通过蛋白表达水平的功效,在本实施例中,参照文献(doi:10.1159/000338190)effects of glyceryl glucoside on aqp3 expression,barrier function and hydration of human skin中所公开的aqp3水转运蛋白表达量的测试方法进行测试,试验过程如下:
[0094]
模型细胞的培养:以人表皮角质形成细胞(nhek细胞,上海信裕生物科技有限公司),在无血清dmem高糖培养基(sigma-aldrich)贴壁培养(37℃,5%co2),之后按照1传3的
传代比例进行分瓶传代3次,之后接种于24孔细胞培养板内用于实验。
[0095]
aqp3表达量的测定:细胞被未经处理(bk,空白对照)或在实验条件下制备通过向培养基中添加3%不同待测样品到对应的细胞孔板,继续培养24h,之后测定aqp3蛋白表达mrna的表达量。所添加的试剂中,以添加水的细胞孔板作为阴性对照(nc),以实施例6和实施例7所制备的锁水复合液a和锁水复合液b为试验样,同时参照锁水复合液a和锁水复合液b中阿洛酮糖与甘油葡萄糖苷的含量,采用市售的阿洛酮糖与甘油葡萄糖苷原料纯品配置成配置试样1-7也作为测试样。
[0096]
aqp3mrna表达量的测定:按照细胞总rna提取试剂盒产品说明书中的操作步骤(试剂盒型号dp430,天根生化科技(北京)有限公司),提取细胞的总rna。aqp3的表达量采用taqman荧光探针法实时定量pcr法测定,使用taqman one step rt-qpcr试剂盒(solarbio,北京索莱宝科技有限公司),按其说明书中所推荐的步骤进行taqman rt-qpcr。taqmanrt-qpcr以不同实验组细胞所提取的总rna为模板,所采用的引物与荧光探针序列如表5所列,荧光探针5’以6-羧基荧光素标记,3’以荧光萃灭基团tamra。各个实验组标准化的aqp3 mrna的表达量的定量采用ct值比较法(即,2-δδct法),δδct=δct(样品组)-δct(空白对照,bk)。aqp3mrna的循环阈值(cycle threshold,ct值)以各自管家基因18srrna的表达量为内参照,进行标准均一化(normalized),δct表示组内目的基因减去内源看家基因的ct值的差值。不同样品之间的基因表达量差异为2-δδct。
[0097]
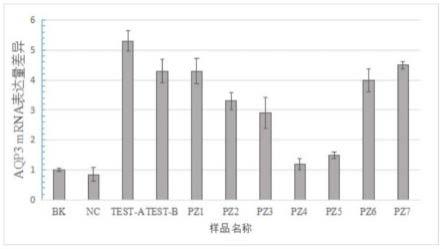
结果如图4所示,采用锁水复合液a(test-a)和锁水复合液b(test-b)处理的nhek细胞其aqp3蛋白的表达量有大幅度提升,提升幅度均超过了400%。同时,采用与之含量相当,但仅含有甘油葡萄糖苷的试剂处理nhek细胞时(pz2和pz3),虽然aqp3蛋白的表达量也提升了约300%,但是要低于两种锁水复合液的促aqp3表达的效果。单独阿洛酮糖(pz4和pz5)也能使得aqp3的表达量略有提高。同时采用与锁水复合液主成分相同的配置溶液,其效果优于单独使用甘油葡萄糖苷的,但低于直接从反应酶液中提取的锁水复合液a和b。
[0098]
表4.功效评价所用的样品及其成分
[0099]
[0100][0101]
表5 taqman one step rt-qpcr所使用的引物及探针序列
[0102][0103]
实施例9对经皮水分丢失的影响。
[0104]
以实施例8中表.4所制备的样品,选择10名年龄25-35岁的志愿者进行了经皮水分丢失的功效性测试。以斑贴(斑贴试验诊断盒,湖北康达医药开发有限公司)作为给药方式,每片斑贴添加不同的样品之后沿着背部脊柱两侧平贴斑贴,每片斑贴的样品添加量为0.03g,以空白斑贴作为空白对照。斑贴给药时间为1h,之后以皮肤水分散失测试仪(tewameter tm nano,courage&khazaka electronic,德国)测试对于斑贴区域的经皮水分
丢失速率进行测试,测试结果如表6所示。
[0105]
结果表明,阿洛酮糖与甘油葡萄糖苷均具备降低对经皮水分丢失的能力,相对而言甘油葡萄糖苷能够大幅提高肌肤的持水能力,降低经皮水分散失幅度要高于阿洛酮糖。而阿洛酮糖的特征是能够较长时间维持一个低水平的经皮水分散失能力,但是其有效维持时间不超过6个小时。当阿洛酮糖与甘油葡萄糖苷协同使用时,其对降低对经皮水分丢失,提高肌肤持水能力有协同的促进作用,且高于两者单独作用之叠加。同时直接使用双酶酶促合成的锁水复合液,其效果优于采用单体化合物原料配置的试样。其中的原因尚不可知,猜测的原因可能是来自酶促过程中复合液中还含有其他的胞溶产物同样起到了协同作用。但是,实验结果表明采用蔗糖磷酸酶和d-阿洛酮糖3-差向异构酶双酶催化蔗糖所获得的酶催化液本身是一种理想的保湿化妆品的功效性原料。
[0106]
表6经皮水分丢失功效评价结果
[0107][0108][0109]
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实
体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0110]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
[0111]
[0112]
[0113]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1