一种改善肿瘤细胞化疗耐药的铁基磁性纳米颗粒
1.本发明涉及纳米材料技术领域,具体涉及一种改善肿瘤细胞化疗药物的耐药性的铁基磁性纳米颗粒。
背景技术:
2.癌症是当今世界上对人类健康与生命危害最大的疾病之一,化疗仍为目前医疗界非手术治疗癌症的主要手段。尽管化疗药物在早期对肿瘤生长有一定的抑制作用,但治疗后肿瘤细胞往往产生耐药性,是导致肿瘤化疗失败的主要原因。多药耐药(multidrug resistance,mdr)是指在反复多次将某种药物治疗肿瘤细胞后,该肿瘤细胞不仅对初次应用的药物产生耐药,还会对作用机制不同、功能相似、结构差异大的其它抗肿瘤药物产生耐药。mdr的主要机制是由于p-糖蛋白(一种atp-binding cassette膜转运蛋白)在肿瘤细胞膜表面过表达,能够将游离的化疗药物泵出细胞,阻止其进入胞内。如何克服肿瘤细胞对化疗药物的耐药性是肿瘤化疗急需解决的问题。
3.鉴于此,有研究使用小干扰rna(sirna)或者microrna(mirna)沉默mdr基因表达从而降低肿瘤细胞耐药蛋白p-糖蛋白的表达(中国专利201910092352.7)来对抗mdr,但存在体内稳定性差、循环时间短、递送至作用靶点效率低、内涵体逃逸困难等问题,导致疗效不显著。有报道以p-糖蛋白抑制剂(如酪氨酸激酶抑制剂)来对抗化疗药物的mdr,但对正常组织产生严重的毒副作用。也有研究报道采取联合药物克服mdr,如将地高辛与顺铂联合的用药策略,提高了化疗药物的治疗效果。然而,上述的解决方案中均是以地高辛诱导了钙网蛋白外翻来刺激免疫系统杀伤肿瘤细胞,实际上并没有解决mdr的问题,而且治疗方案非常复杂。
技术实现要素:
4.针对上述问题,本发明提供了一种增加了肿瘤细胞对化疗药物的敏感性、提高化疗疗效、减轻癌晚期病人的痛苦的铁基磁性纳米颗粒。
5.具体地,本发明提供了一种铁基磁性纳米颗粒,包括铁基磁性纳米颗粒,所述铁基磁性纳米颗粒为fe、feco、fe2c、fept或mfe2o4中的至少一种,其中,m为fe、mn、co、ni或zn,或金属掺杂的铁基磁性纳米颗粒,所述铁基磁性纳米颗粒可降低肿瘤细胞对化疗药物的ic
50
,增加肿瘤细胞对该化疗药物的敏感性,改善耐药肿瘤细胞的耐药性。
6.进一步地,所述铁基磁性纳米颗粒粒径为3~500纳米。
7.进一步地,所述铁基磁性纳米颗粒表面有具有亲水性聚合物以使其能够分散于水溶液中,所述亲水性聚合物包括3,4-二羟基氢化肉桂酸(dhca)、聚乙二醇(peg)、多巴胺(da)。
8.进一步地,所述铁基磁性纳米颗粒表面有具有双亲性聚合物以使其能够分散于水溶液中,所述双亲性聚合物包括十六烷基三甲基溴化铵(ctab),聚乳酸-羟基乙酸共聚物(plga),聚丙烯酸(paa)。
9.进一步地,将所述铁基磁性纳米材料与耐药肿瘤细胞株共孵育后,能够降低耐药肿瘤细胞对抗肿瘤化疗药物的ic
50
。
10.进一步地,所述耐药肿瘤细胞包括对蒽环类抗生素、铂类抗肿瘤药物、紫杉醇、吉西他滨中的至少一种单耐药或多耐药。
11.进一步地,所述耐蒽环类抗生素的耐药细胞包括耐阿霉素、表阿霉素、柔红霉素中的至少一种。
12.进一步地,所述耐铂类抗肿瘤药物的耐药细胞包括耐顺铂、卡铂、奥沙利铂中的至少一种。
13.本发明与现有技术相比的优点在于:将铁基磁性纳米颗粒与耐药肿瘤细胞共孵育,降低了肿瘤细胞对化疗药物的半数抑制浓度剂量(ic
50
),增加了肿瘤细胞对该化疗药物的敏感性,提高化疗疗效;铁基磁性纳米材料,尤其是氧化铁纳米材料(如临床使用的氧化铁纳米颗粒)因具有良好的生物学相容性,被广泛应用于生物医药领域;实施过程不繁琐,有望为已出现肿瘤耐药的患者提供一个普惠治疗的选择,同时减轻癌晚期病人的痛苦,提高生活质量。
附图说明
14.图1a为本发明实施例1的fe3o4纳米颗粒(nps)的透射电镜(tem)图;
15.图1b为本发明实施例2的au nps的tem图;
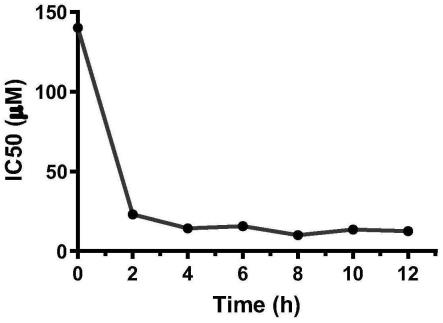
16.图2为本发明实施例1的fe3o
4 nps与mcf-7r共孵育不同时间(0-12h),再与dox孵育24h,测出每个时间段的ic
50
图;
17.图3为本发明实施例2的au nps与mcf-7r共孵育不同时间(0-12h),再与dox孵育24h,测出每个时间段的ic
50
图;
18.图4为本发明实施例3的mcf-7r在不同条件下对dox的内吞量。
具体实施方式
19.下面结合附图对本发明做进一步的详细说明。
20.实施例1
21.1、首先制备15nm dhca修饰超顺磁性氧化铁纳米颗粒(fe3o
4 nps)
22.1)称量1.80g油酸铁,0.285g油酸,加入10g十八烯中,置于50ml三口烧瓶内,升温至110℃排水30min,然后以3℃/min升温320℃保温45min,至溶液呈澄清透亮黑褐色,反应结束,反应结束后停止加热,自然冷却至室温。反应应当在氩气的保护下进行,以避免任何不希望发生的副反应;
23.2)用正己烷作为分散剂,每次加2ml;无水乙醇30ml作为沉淀剂,以每分钟8000转速离心10分钟,反复离心洗涤3次后,最终产物分散于正己烷中;
24.3)取用50ml离心管称取其空管质量并记录;加入1ml fe3o
4 nps,于干燥箱中烘干fe3o
4 nps溶液中的正己烷,称取质量,得到颗粒的质量;
25.4)按20:50的比例,称取相应质量的配体(dhca)加入至50ml三口烧瓶中;用吸管加约5ml的四氢呋喃于三口烧瓶中;
26.5)架起磁力搅拌装置,设置温度为55℃,样品离心管中加入(2-5ml)四氢呋喃,超
声溶解后,待温度升高至55℃后,加入至三口烧瓶,反应5h以上(途中保证液面不能低于温度计探头);
27.6)反应完后,关掉磁力搅拌装置,冷却至室温后,用吸管吸取三口烧瓶液体于离心管中,加入1ml 0.5mol/l氢氧化钠进行离心(5000rpm/10min);离心后去掉上清,分散在2ml水中备用。
28.对所制备的fe3o
4 nps进行表征,取2μl分散有fe3o
4 nps的水溶液滴在镀有碳膜的cu网上,自然干燥后做表征。图1a中可以看出,fe3o
4 nps大小形貌均一,具有单分散性,尺寸在15nm左右。
29.2、多药耐药人乳腺癌细胞mcf-7r获自西北大学。mcf-7r以含有10%fbs、1%青霉素-链霉素的dmem培养基作为生长环境,在37℃、5%co2细胞培养箱中培养,2天更换培养基并传代一次,最后选择状况良好的处于对数生长期细胞用于实验。
30.在细胞培养液中将一定浓度的fe3o
4 nps加入细胞培养液中与mcf-7r细胞共孵育不同时间(0-12h),然后再与dox孵育24h后,测试dox对细胞的杀伤作用。具体为:
31.取对数期生长状况良好的mcf-7r细胞,用含0.25%edta的胰酶消化成单细胞悬液,血球计数板进行细胞计数后,接种于96孔板中,每孔100μl,于37℃、5%co2培养箱中培养24h;细胞贴壁后,除培养基,加入fe3o
4 nps,于培养箱中培养不同时间段(0-12h),在相应的时间点再加入不同浓度的dox,于培养箱中培养24h,然后每孔加入10μl的cck-8溶液于培养箱中孵育4h,采用双波长测定法(检测波长450-490nm,参比波长600-650nm)用酶标仪测定od值。
32.计算细胞活力,存活率=(od实验
–
od对照)/(od对照
–
od空白)
×
100%。
33.依据不同时间点计算出mcf-7r的ic
50
。
34.如图2所示,随着fe3o
4 nps孵育时间的增加,mcf-7r对dox的ic
50
呈下降趋势,且在孵育4h,其ic50下降约5倍,表明fe3o
4 nps降低了mcf-7r对dox的ic
50
,增加了mcf-7r对该dox的敏感性。
35.实施例2
36.15nm金纳米颗粒(au nps)的合成
37.1)取质量分数为1%氯金酸(haucl4)溶液1.7ml和48.3ml的超纯水倒入蒸馏瓶内,设置加热温度(120℃)开始加热,并将转速调至200rpm/min;
38.2)在完全沸腾后,将转速调至400rpm/min,并加入5ml浓度为11.6mg/ml的柠檬酸三钠,在高温下能将haucl4还原而生成au nps,在加入柠檬酸三钠后可以观察到溶液颜色从无色—黑色—褐色—紫色,最后为紫红色;
39.3)加热20min后,停止加热,继续搅拌30min,冷却至室温,防止粒径不均一;
40.4)静置12h后,用滤膜过滤除去反应中的一些杂质,得到粒径约为15nm的au nps,对所制备的au nps进行表征,取2μl分散有au nps的水溶液滴在镀有碳膜的cu网上,自然干燥后做表征。从图1b中可以看出,au nps大小形貌均一,单分散性良好,尺寸约在15nm左右。
41.在细胞培养液中加入用一定浓度的au nps加入细胞培养液中与mcf-7r细胞共孵育不同时间(0-12h),然后再与dox孵育24h后,测试dox对细胞的杀伤作用。结果表明,与mcf-7r孵育0-12h后,再与dox孵育,发现mcf-7r细胞的ic
50
值有上升趋势(如图3)。
42.实施例3
43.mcf-7r在不用条件下对dox的内吞实验
44.取对数期生长状况良好的mcf-7r细胞,用含0.25%edta的胰酶消化成单细胞悬液,血球计数板进行细胞计数后,接种于培养皿中,于37℃、5%co2培养箱中培养细胞生长密度为80%后;设置四组,分别为空白对照、100μm dox、au nps+100μm dox,fe3o
4 nps+100μm dox,每组3个重复;细胞贴壁后,除培养基,其中第三组和第四组细胞分别先与au nps和fe3o
4 nps孵育12h,然后再同第二组加入100μm dox,并孵育24h;使用流式细胞仪测dox的荧光强度后,发现经fe3o
4 nps孵育了12h后,mcf-7r对dox的内吞量提升了0.5倍,而与au nps孵育后,内吞量几乎没有变化,证明了fe3o
4 nps可以促进mcf-7r对dox的内吞能力(如图4),可能是由于fe3o
4 nps使p-糖蛋白表达下调所导致。
45.本发明及其实施方式进行了描述,这种描述没有限制性,附图中所示的也只是本发明的实施方式之一,实际的结构并不局限于此。总而言之如果本领域的普通技术人员受其启示,在不脱离本发明创造宗旨的情况下,不经创造性的设计出与该技术方案相似的结构方式及实施例,均应属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1