一种牡丹籽粕综合利用方法及其应用
1.本发明属于牡丹籽粕活性物质提取技术领域,具体涉及一种牡丹籽粕综合利用方法及其应用。
背景技术:
2.多酚具有预防心血管疾病、降低癌症风险、抑制氧化应激反应和炎症等多种活性。多酚在各种植物中含量丰富,根据其溶解性可分为两类:一类是有机溶剂萃取得到的游离性多酚,另一类是残留在先前萃取物中的结合态多酚,结合态多酚通过醚键、酯键、疏水键或氢键与膳食纤维、蛋白质等相互作用紧密相连,因此,结合态多酚只能通过化学或酶解的方法被释放出来。目前研究主要集中在对游离性多酚的探索上,而对结合态多酚的研究很少,造成大量结合态多酚被丢弃。有研究表明,在各种水果、坚果和谷物中,富含结合态多酚类,该类化合物具有抗氧化、抗肿瘤等活性。在摄食后食物中的结合态多酚通过肠道菌群分解被释放出来,转化为游离性酚类后被吸收入血液,并发挥与游离性多酚类似的活性,因此结合态多酚化合物对人体健康有较高的价值。
3.游离性多酚一般采用溶剂法提取,为了提高得率,先将组织破碎,然后采用超声、微波、超高压等方法辅助,但是提取物还残留着大量结合态多酚和果胶。结合态多酚多采用酸解或者碱解,再用乙酸乙酯萃取,但是采用这种方法在提取牡丹籽粕中结合态多酚时易出现大量凝胶状态的物质,影响萃取效果和得率。
4.果胶是一种碳水化合物聚合物,几乎存在于所有植物中,是自然界中含量最高的水溶性膳食纤维。果胶是人类天然饮食的一部分,被fao/who食品添加剂联合委员会推荐为安全无毒的天然食品添加剂。果胶还具有降血压、缓解便秘、降血脂、降血糖、抑菌、抗癌等生物活性。目前果胶的提取多采用酸提或者超声、微波辅助提取,常因淀粉含量高,会存在过滤困难,引入杂质多,影响果胶的得率和纯度。
5.2011年,国家卫生部批准牡丹籽油为“新资源食品”,油用牡丹得到大面积种植。牡丹籽出油率一般在20%~30%,因此榨油后至少会产生70%的牡丹籽粕,牡丹籽粕中含有许多有益于人体健康的物质,如膳食纤维、蛋白质、磷脂、粗多糖和多酚等。因此,对牡丹籽粕的研究具有重大的现实意义和利用价值。
6.鉴于现有提取方法存在的缺陷和局现性,为了充分利用牡丹籽粕资源,本发明建立同时提取牡丹籽粕中果胶、游离多酚和结合态多酚的方法并对其应用进行研究。
技术实现要素:
7.针对现有技术中存在的问题和不足,本发明的目的旨在提供一种牡丹籽粕综合利用方法及其应用。
8.为实现发明目的,本发明采用的技术方案如下:
9.本发明第一方面提供了一种牡丹籽粕综合利用方法,包括以下步骤:
10.(1)牡丹籽粕进行乙醇浸提,浸提结束进行固液分离,得到浸提液和固相物料,浸
提液经分离提纯后得到游离性多酚提取物;
11.(2)去除步骤(1)得到的固相物料中的乙醇,并将固相物料加入ph值为4~6水中,并加入纤维素酶、风味型蛋白酶、中性蛋白酶、α-淀粉酶,40~60℃保温水解1~3h,煎煮,然后固液分离出沉淀1和上清液1,上清液1经浓缩、醇沉后分离出沉淀2和上清液2,采用乙醇对沉淀2进行洗涤,得到果胶提取物,并收集洗涤液;
12.(3)向沉淀1中加入硫酸乙醇溶液,70~90℃水浴回流0.5~2h后离心分离出上清液3;将上清液3、上清液2和洗涤液混合后去除乙醇,用大孔树脂进行分离,收集乙醇洗脱液,浓缩至干,得到结合态多酚提取物。
13.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述纤维素酶、风味型蛋白酶、中性蛋白酶、α-淀粉酶的用量均为固相物料重量的0.1wt%~1wt%。
14.根据上述的牡丹籽粕综合利用方法,更加优选地,步骤(2)中所述风味型蛋白酶的用量为固相物料重量的0.3wt%;所述中性蛋白酶的用量为固相物料重量的0.3wt%;所述α-淀粉酶的用量为固相物料重量的0.5wt%。
15.根据上述的牡丹籽粕综合利用方法,优选地,步骤(3)中所述硫酸乙醇溶液为浓硫酸和无水乙醇的混合物。
16.根据上述的牡丹籽粕综合利用方法,优选地,所述硫酸乙醇溶液中浓硫酸与无水乙醇的体积比为1:9;所述浓硫酸的质量分数为98%。
17.根据上述的牡丹籽粕综合利用方法,优选地,步骤(3)中所述硫酸乙醇溶液的用量为向每克沉淀1加入3~5ml硫酸乙醇溶液。
18.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述煎煮的煎煮温度为100℃,煎煮时间为20~60min。
19.根据上述的牡丹籽粕综合利用方法,优选地,步骤(3)中所述离心分离为离心,离心速率为4000~5000rpm,离心时间为8~12min,更加优选地,所述离心速率为4500rpm,离心时间为10min。
20.根据上述的牡丹籽粕综合利用方法,优选地,步骤(3)中所述大孔树脂进行分离的分离步骤为:过大孔树脂,2~4个柱体积的水洗后用2~4个柱体积的40~60%乙醇洗脱。
21.根据上述的牡丹籽粕综合利用方法,优选地,步骤(3)中所述大孔树脂为x-5、ab-8、d101和xad-4中的任意一种,更加优选地,所述大孔树脂为d101或ab-8大孔树脂。
22.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述固相物料是将牡丹籽粕经乙醇浸提和固液分离4次后制备的。
23.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述ph值为4~6水的用量是向每克固相物料中加入10~20ml ph值为4~6水中。
24.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述ph值为4~6水可以用盐酸、磷酸等配制。
25.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述固液分离为离心,所述离心速率为4000~5000rpm,离心时间为8~12min,更加优选地,所述离心速率为4500rpm,离心时间为10min。
26.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述浓缩为低温减压浓缩。
27.根据上述的牡丹籽粕综合利用方法,更加优选地,所述低温减压浓缩的温度为40~60℃,压力为0.09~0.1mpa。
28.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述醇沉的具体操作步骤为:是向经浓缩后的上清液1中加入95%乙醇至醇溶液浓度为80%,静置时间为8~12h。
29.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述分离为过滤。
30.根据上述的牡丹籽粕综合利用方法,优选地,步骤(2)中所述洗涤的具体步骤为:用95%乙醇洗涤沉淀2直至乙醇洗涤液无颜色为止。
31.根据上述的牡丹籽粕综合利用方法,优选地,步骤(1)中所述浸提液是牡丹籽粕经乙醇浸提和固液分离4次后合并上清液制备的。
32.根据上述的牡丹籽粕综合利用方法,优选地,步骤(1)中所述分离提纯的具体步骤为:将浸提液浓缩至无乙醇,调节ph值为1~3后用大孔树脂进行分离,收集乙醇洗脱液,浓缩至干。
33.根据上述的牡丹籽粕综合利用方法,优选地,所述ph值可用酸调节。
34.根据上述的牡丹籽粕综合利用方法,更加优选地,所述酸为盐酸、硫酸、磷酸中的一种,更加优选地,所述酸为盐酸。
35.根据上述的牡丹籽粕综合利用方法,优选地,所述用大孔树脂进行分离的具体步骤为:过大孔树脂,先用2~4个柱体积的水洗脱除去多糖等大分子物质后用2~4个柱体积的40%~60%乙醇洗脱。
36.根据上述的牡丹籽粕综合利用方法,优选地,步骤(1)中所述牡丹籽粕是牡丹籽粕经粉碎后过20~40目筛得到的牡丹籽粕粉末。
37.根据上述的牡丹籽粕综合利用方法,优选地,步骤(1)中所述乙醇浸提的具体步骤:按照向每克牡丹籽粕中加入10~20ml 80%乙醇溶液,超声提取20~60min。
38.根据上述的牡丹籽粕综合利用方法,优选地,步骤(1)中所述固液分离为离心分离,所述离心速率为4000~5000rpm,离心时间为8~12min。
39.本发明第二方面还提供了一种利用第一方面提供的牡丹籽粕综合利用方法提取得到的产品,所述产品为如下(a)~(c)中的任意一种:
40.(a)所述产品为利用第一方面提供的牡丹籽粕综合利用方法提取的游离态多酚提取物;
41.(b)所述产品为利用第一方面提供的牡丹籽粕综合利用方法提取的果胶提取物;
42.(c)所述产品为利用第一方面提供的牡丹籽粕综合利用方法提取的结合态多酚提取物。
43.本发明第三方面还提供了第二方面的产品在制备抗凝血、抗血栓产品中的应用。
44.与现有技术相比,本发明取得的积极有益效果:
45.(1)本发明在提取果胶提取物时加入风味型蛋白酶、中性蛋白酶,可以有效除去固相物料中的蛋白质,得到澄清的上清液,无需后续再次脱除蛋白,降低了操作难度,在一定程度上提高了果胶得率、果胶纯度。
46.(2)本发明在提取果胶时发现牡丹籽粕中淀粉含量较高,高温提取时,淀粉容易糊化,造成过滤困难,引入的杂质多,影响果胶纯度和结合态多酚含量,因此本发明先采用α-淀粉酶辅助提取果胶提取物,脱除牡丹籽粕中淀粉,减少果胶的损失,同时采用纤维素酶酶
解细胞壁,以利于果胶的溶出。因此该提取方法既能提高果胶得率和结合态多酚含量又能减少传统酸提带来的环境污染。
47.(3)本发明采用硫酸乙醇法提取结合态多酚提取物,与传统碱法相比,硫酸乙醇法提取结合态多酚提取物,结合态多酚含量提高了2.58倍;与酶法相比,硫酸乙醇法提取结合态多酚提取物,结合态多酚含量提高了66.1倍,因此本发明采用硫酸乙醇法提取结合态多酚提取物即能显著提高结合态多酚含量又能减少传统碱法造成的环境污染。
48.(4)本发明牡丹籽粕综合利用方法能先后得到游离性多酚提取物、果胶提取物、结合态多酚提取物,即充分利用了牡丹籽粕的价值,又进一步扩宽牡丹籽粕的应用前景。
49.(5)本发明牡丹籽粕综合利用方法仅采用乙醇、水和酶等绿色制品,未采用其它有毒有害的有机溶剂,符合环保要求,提取的游离性多酚提取物、果胶提取物和结合态多酚提取物无毒无害,有利于人体健康。
50.(6)本发明采用牡丹籽榨油后所产生的废弃物-牡丹籽粕为原料,既减少了环境污染,又充分利用了废弃物资源。
51.(7)本发明提取的游离性多酚提取物、果胶提取物和结合态多酚提取物具有良好的抗凝血和抗血栓活性,可应用于药物和功能食品等方面。
附图说明
52.图1为实施例2得到的游离性多酚提取物在检测波长230nm时的hplc图;
53.图2为实施例2得到的游离性多酚提取物在检测波长290nm时的hplc图;
54.图3为实施例2得到的结合态多酚提取物在检测波长230nm时的hplc图;
55.图4为实施例2得到的结合态多酚提取物在检测波长290nm时的hplc图;
56.图5为实施例2得到的果胶提取物的红外光谱图。
具体实施方式
57.以下通过具体的实施例对本发明作进一步说明,但并不限制本发明的范围。
58.(一)牡丹籽粕综合利用方法中风味型蛋白酶和中性蛋白酶用量的探讨:
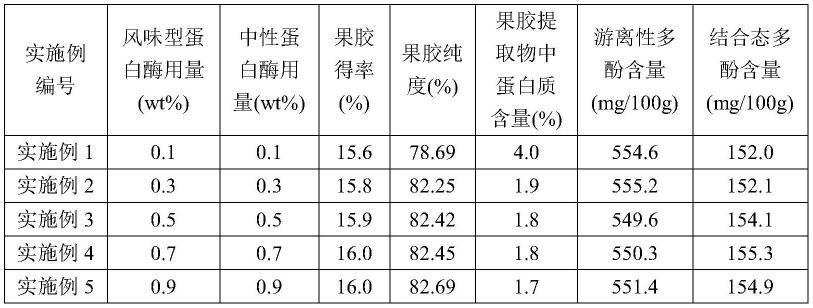
59.为了探讨风味型蛋白酶和中性蛋白酶用量对果胶得率、果胶纯度、果胶提取物中蛋白质含量、游离性多酚含量和结合态多酚含量的影响,发明人分别做了以下实验,即实施例1~5,其对应的风味型蛋白酶和中性蛋白酶的用量均为固相物料重量的0.1wt%、0.3wt%、0.5wt%、0.7wt%、0.9wt%。实验结果见表1。
60.实施例1:
61.(1)向每克凤丹牡丹籽粕中加入10ml 80%乙醇溶液,超声提取20min,4500rpm离心10min,过滤得到沉淀和上清液,将沉淀用同样的乙醇浸提方法再提取3次,得到固相物料留存备用,合并上清液,得到浸提液,将浸提液于60℃和0.09mpa下浓缩除去乙醇,用6mol/l hcl调ph值为1,过d101大孔树脂柱,先用3个柱体积的水洗脱除去多糖等大分子物质后用2个柱体积的40%乙醇洗脱,收集乙醇洗脱液,在60℃和0.09mpa下浓缩至干即得游离性多酚提取物,再用95%乙醇洗脱得到油脂,弃除。
62.(2)将步骤(1)得到的固相物料于40℃挥干乙醇后,向每克固相物料中加入ph值为5.5水(用磷酸配制)、纤维素酶、风味型蛋白酶、中性蛋白酶和α-淀粉酶,ph值为5.5水的用
量为20ml,纤维素酶、风味型蛋白酶、中性蛋白酶、α-淀粉酶的用量分别为固相物料重量的0.1wt%、0.1wt%、0.1wt%、0.5wt%,40℃保温水解2h,100℃煎煮40min,4500rpm离心10min,分离出沉淀1和上清液1,上清液1经减压浓缩至密度为0.9(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于40℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
63.(3)向每克沉淀1中加入3ml硫酸乙醇溶液,其中硫酸乙醇溶液是98%浓硫酸与无水乙醇以体积比1:9制备而成的,70℃水浴回流0.5h,放凉,4500rpm离心10min得到上清液3。将上清液3、上清液2和95%乙醇洗涤液合并减压浓缩至无乙醇,过d101大孔树脂柱,先用2个柱体积的水洗后用2个柱体积的40%乙醇洗脱,收集乙醇洗脱液,在60℃和0.09mpa下浓缩至干即得结合态多酚提取物,再用95%乙醇洗脱得到油脂,弃除。
64.对本实施例得到的游离性多酚提取物、果胶提取物和结合态多酚提取物进行果胶得率、果胶提取物中蛋白质含量、果胶纯度、游离性多酚含量、结合态多酚含量检测,检测方法、计算公式和检测具体步骤如下:
65.检测方法:
66.(1)采用考马斯亮蓝法(牛血清蛋白作为标准品)检测本实施例得到的果胶提取物中蛋白质含量。
67.(2)采用gb25533-2010《食品添加剂:果胶》法检测本实施例得到的果胶提取物中总半乳糖醛酸的含量,果胶纯度以半乳糖醛酸含量计。
68.(3)采用福林酚法检测本实施例得到的游离性多酚提取物中游离性多酚的含量及结合态多酚提取物中结合态多酚的含量。
69.计算公式:
70.(1)果胶得率=果胶提取物重量/牡丹籽粕重量*100%;
71.(2)果胶提取物中蛋白含量=果胶提取物中蛋白质量(g)/果胶提取物质量(g)*100%;
72.(3)游离性多酚含量=游离性多酚提取物中总酚质量(mg)/100g牡丹籽粕重量(干重);
73.(4)结合态多酚含量=结合态多酚提取物中总酚质量(mg)/100g牡丹籽粕重量(干重);
74.检测具体步骤:
75.果胶的纯度以总半乳糖醛酸含量计,总半乳糖醛酸含量检测方法参照gb25533-2010《食品添加剂:果胶》,具体步骤如下:精密称取5g果胶提取物样品,置于烧杯中,加入100ml盐酸-乙醇溶液,搅拌10min。用干燥至恒重的(m0)的g3砂芯漏斗过滤,真空抽吸滤干后用盐酸-乙醇溶液洗涤6次,每次15ml,再用乙醇溶液数次冲洗直至滤出物不含氯离子,最后用20ml无水乙醇冲洗滤干,在105℃下干燥2h,冷却后称重(m1),得到干燥后的样品。精密称取1/10干燥后的样品,移入一个250ml具塞锥形瓶中,用2ml无水乙醇湿润。加入100ml新煮沸并冷却的水,加上瓶塞,不时转动至试样完全溶解,加5滴酚酞指示剂,用0.1mol/l氢氧化钠标准滴定液滴定,滴定至粉红色30s不褪色为终点,记录下所消耗的0.1mol/l氢氧化钠标准滴定液的体积v1(初始滴定度)。加入20.0ml 0.5mol/l氢氧化钠溶液,加上瓶塞,用力振摇后静置15min,加入20.0ml 0.5mol/l盐酸标准滴定液,振摇至粉红色消失,然后用
0.1mol/l氢氧化钠标准滴定溶液滴定,用力振摇至弱粉红色30s不褪色为终点。记录所消耗的0.1mol/l氢氧化钠标准滴定溶液的体积v2(皂化滴定度)。总半乳糖醛酸的含量计算公式:x2=19.41*(v1+v2)*100%/m,其中x2为总半乳糖醛酸的含量,%;v1为初始滴定度,单位为毫升(ml);v2为皂化滴定度,单位为毫升(ml);m为试样干燥并去灰分后总质量的1/10,即[(m
1-m0)/10],单位为毫克(mg)。
[0076]
游离性多酚提取物中总酚质量采用福林酚法检测,具体步骤为:用没食子酸作为标准品绘制标准曲线。绘制标准曲线:精密称取没食子酸标准品0.05g,加水溶解并定容至50ml,得到1g/l的没食子酸标准液,分别移取2、3、4、5、6、7ml上述没食子酸标准液至100ml容量瓶中,加水定容到100ml,分别制成20、30、40、50、60、70μg/ml标准溶液。分别精密量取1ml上述标准溶液及蒸馏水(空白)于10ml具塞比色管中,加入0.5ml1n福林酚试剂,2ml 7.5%碳酸钠溶液,6.5ml蒸馏水,充分摇匀,暗处放置1h,并于765nm处测其吸光度。进行3组平行试验,以没食子酸含量为横坐标,吸光度为纵坐标,绘制标准曲线。将游离性多酚提取物用甲醇定容25ml,测量方法同没食子酸,根据绘制的标准曲线计算游离性多酚提取物中总酚质量,根据游离性多酚提取物中总酚质量计算样品中游离性多酚含量,结果表示为mg/100g牡丹籽粕重量(干重)。
[0077]
结合态多酚提取物中总酚质量同游离性多酚提取物中总酚质量的检测方法,根据绘制的标准曲线计算结合态多酚提取物中总酚质量,根据结合态多酚提取物中总酚质量计算样品中结合态多酚含量。
[0078]
经计算,本实施例得到游离性多酚提取物中游离性多酚含量为554.6mg/100g;果胶得率为15.6%,果胶提取物中蛋白质含量为4.0%,果胶纯度为78.69%,结合态多酚含量为152.0mg/100g。
[0079]
实施例2:
[0080]
实施例2的内容与实施例1基本相同,其不同之处在于:步骤(2)中风味型蛋白酶和中性蛋白酶的用量均为固相物料重量的0.3wt%。
[0081]
实施例3:
[0082]
实施例3的内容与实施例1基本相同,其不同之处在于:步骤(2)中风味型蛋白酶和中性蛋白酶的用量均为固相物料重量的0.5wt%。
[0083]
实施例4:
[0084]
实施例4的内容与实施例1基本相同,其不同之处在于:步骤(2)中风味型蛋白酶和中性蛋白酶的用量均为固相物料重量的0.7wt%。
[0085]
实施例5:
[0086]
实施例5的内容与实施例1基本相同,其不同之处在于:步骤(2)中风味型蛋白酶和中性蛋白酶的用量均为固相重量的0.9wt%。
[0087]
表1风味型蛋白酶和中性蛋白酶用量不同对游离性多酚提取物、果胶提取物和结合态提取物的影响
[0088][0089]
由表1可知,当风味型蛋白酶和中性蛋白酶用量均为0.1wt%时,果胶提取物中蛋白质含量较高;随着风味型蛋白酶和中性蛋白酶用量的增加,果胶提取物中蛋白质含量逐渐降低,当风味型蛋白酶和中性蛋白酶用量均为0.3wt%时,果胶提取物中蛋白质含量为1.9%;进一步再增大风味型蛋白酶和中性蛋白酶用量时,果胶提取物中蛋白质含量基本不变。由此说明,风味型蛋白酶和中性蛋白酶用量均优选为0.3wt%。
[0090]
(二)牡丹籽粕综合利用方法中α-淀粉酶用量的探讨:
[0091]
为了探讨α-淀粉酶用量对果胶得率、果胶纯度和结合态多酚含量以及操作步骤的影响,发明人分别做了以下实验,即实施例6~9,其对应的α-淀粉酶用量分别为固相物料重量的0.1wt%、0.3wt%、0.7wt%、0.9wt%。实验结果见表2。
[0092]
实施例6:
[0093]
实施例6的内容与实施例2基本相同,其不同之处在于:步骤(2)中α-淀粉酶的用量为固相物料重量的0.1wt%。
[0094]
实施例7:
[0095]
实施例7的内容与实施例2基本相同,其不同之处在于:步骤(2)中α-淀粉酶的用量为固相物料重量的0.3wt%。
[0096]
实施例8:
[0097]
实施例8的内容与实施例2基本相同,其不同之处在于:步骤(2)中α-淀粉酶的用量为固相物料重量的0.7wt%。
[0098]
实施例9:
[0099]
实施例9的内容与实施例2基本相同,其不同之处在于:步骤(2)中α-淀粉酶的用量为固相物料重量的0.9wt%。
[0100]
表2α-淀粉酶用量不同对果胶得率、果胶纯度、结合态多酚含量以及操作步骤的影响
[0101][0102]
由表2可知,随着α-淀粉酶用量的增加,果胶得率、果胶纯度和结合态多酚含量逐渐增加,当α-淀粉酶用量为0.5wt%时,果胶得率、果胶纯度和结合态多酚含量分别为15.8%、82.25%和152.1mg/100g,在后续操作时仅用4500rpm离心10min就能使溶液和沉淀充分分离,获得的澄清的上清液1;进一步再增加α-淀粉酶用量时,果胶得率、果胶纯度和结合态多酚含量均基本不变。由此说明,α-淀粉酶用量优选为0.5wt%。
[0103]
(三)结合态多酚提取物的提取方法探讨:
[0104]
为了探讨结合态多酚提取物的提取方法对结合态多酚含量的影响,发明人采用实施例2的提取方法,还做了对比实验,对比例1和对比例2,其对应的结合态多酚提取物的提取方法分别为硫酸乙醇法、碱法和酶法,实验结果见表3。
[0105]
对比例1:
[0106]
对比例1的内容与实施例2基本相同,其不同之处在于:
[0107]
步骤(3)的具体操作为:向每克沉淀1中加入3ml 4mol/l氢氧化钠溶液,室温震荡4h,4500rpm离心10min,得到上清液3。将上清液3、上清液2和95%乙醇洗涤液合并减压浓缩至无乙醇,用6mol/l hcl调ph值至1,过d101大孔树脂柱,先用2个柱体积的水洗后用2个柱体积的40%乙醇洗脱,收集乙醇洗脱液,在60℃和0.09mpa下浓缩至干即得结合态多酚提取物,再用95%乙醇洗脱得到油脂,弃除。
[0108]
对比例2:
[0109]
对比例2的内容与实施例2基本相同,其不同之处在于:
[0110]
步骤(3)的具体操作为:向每克沉淀1中加入ph值为4.8水(用盐酸配置)、纤维素酶、果胶酶、风味型蛋白酶和半纤维素酶,ph值为4.8水的用量为15ml,纤维素酶、果胶酶、风味型蛋白酶、半纤维素酶均为固相物料重量的1wt%,50℃酶解3h,放凉,4500rpm离心10min,得到上清液3。将上清液3、上清液2和95%乙醇洗涤液合并减压浓缩至无乙醇,用6mol/l hcl调ph值至1,过d101大孔树脂柱,先用2个柱体积的水洗后用2个柱体积的40%乙醇洗脱,收集乙醇洗脱液,在60℃和0.09mpa下浓缩至干即得结合态多酚提取物,再用95%乙醇洗脱得到油脂,弃除。
[0111]
表3结合态多酚提取物的不同提取方法对结合态多酚含量的影响
[0112]
编号提取方法结合态多酚含量(mg/100g)实施例2硫酸乙醇法152.1对比例1碱法59.0对比例2酶法2.3
[0113]
由表3可知,与对比例1相比,实施例2得到的结合态多酚提取物中结合态多酚含量提高了2.58倍;与对比文件2相比,实施例2得到的结合态多酚提取物中结合态多酚含量提高了66.1倍;因此,与传统碱法和酶法相比,硫酸乙醇法具有较强的释放牡丹籽粕中的结合态多酚能力。
[0114]
(四)牡丹籽粕综合利用方法中四种酶的探讨:
[0115]
为了探讨纤维素酶、风味型蛋白酶、中性蛋白酶和α-淀粉酶对果胶得率、果胶纯度、果胶提取物中蛋白质含量、游离性多酚含量和结合态多酚含量的影响,发明人采用实施例2的提取方法,同时还做了对比实验,对比实验的内容见对比例3~8,实验结果见表4。
[0116]
对比例3:
[0117]
对比例3的内容与实施例2基本相同,其不同之处在于:
[0118]
步骤(2)的具体操作步骤为:将步骤(1)得到的固相物料于40℃挥干乙醇后,向每克固相物料中加入ph值为5水(用磷酸配制)、纤维素酶和α-淀粉酶,ph值为5水的用量为20ml,纤维素酶、α-淀粉酶的用量分别为固相物料重量的0.1wt%、0.5wt%,100℃煎煮40min,4500rpm离心10min,分离出沉淀1和上清液1;向上清液1中加入sevage试剂(氯仿和正丁醇的体积比为5:1),sevage试剂与上清液1的体积比为1:5,混合,振荡,离心,得到上清液,将上清液用同样的sevage试剂法再除杂3次后得到澄清的上清液,澄清的上清液经减压浓缩至密度为1.0(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于40℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0119]
对比例4:
[0120]
对比例4的内容与实施例2基本相同,其不同之处在于:
[0121]
步骤(2)的具体操作步骤为:将步骤(1)得到的固相物料于40℃挥干乙醇后,向每克固相物料中加入ph值为5水(用磷酸配制)、纤维素酶、风味型蛋白酶和中性蛋白酶,ph值为5水的用量为20ml,纤维素酶、风味型蛋白酶、中性蛋白酶的用量分别为固相物料重量的0.1wt%、0.3wt%、0.3wt%,40℃保温水解2h,100℃煎煮40min,先用100目滤布过滤,得到滤渣和滤液,滤液于4500rpm离心10min,分离出沉淀和上清液1,合并滤渣和沉淀记为沉淀1;上清液1经抽滤减压浓缩至密度为1.0(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于40℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0122]
对比例5:
[0123]
对比例5的内容与实施例2基本相同,其不同之处在于:
[0124]
步骤(2)的具体操作步骤为:将步骤(1)得到的固相物料于40℃挥干乙醇后,向每克固相物料中加入ph值为5水(用磷酸配制)和纤维素酶,ph值为5水的用量为20ml,纤维素酶的用量为固相物料重量的0.1wt%,40℃保温水解2h,100℃煎煮40min,先用100目滤布过滤,得到滤渣和滤液,滤液于4500rpm离心10min,分离出沉淀和上清液1,合并滤渣和沉淀记
为沉淀1;向上清液1中中加入sevage试剂(氯仿和正丁醇的体积比为5:1),sevage试剂与上清液1的体积比为1:5,混合,振荡,离心,得到上清液,将上清液用同样的sevage试剂法再除杂3次后得到澄清的上清液,澄清的上清液经减压浓缩至密度为1.0(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于40℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0125]
对比例6:
[0126]
对比例6的内容与实施例2基本相同,其不同之处在于:
[0127]
步骤(2)的具体操作步骤为:将步骤(1)得到的固相物料于40℃挥干乙醇后,向每克固相物料中加入ph值为5水(用磷酸配制)、风味型蛋白酶和中性蛋白酶,ph值为5水的用量为20ml,风味型蛋白酶、中性蛋白酶的用量分别为固相物料重量的0.3wt%、0.3wt%,40℃保温水解2h,100℃煎煮40min,先用100目滤布过滤,分离出滤渣和滤液,滤液于4500rpm离心10min,分离出沉淀和上清液1,合并滤渣和沉淀记为沉淀1;上清液1经抽滤减压浓缩至密度为1.0(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后沉淀2于40℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0128]
对比例7:
[0129]
对比例7的内容与实施例2基本相同,其不同之处在于:
[0130]
步骤(2)的具体操作步骤为:将步骤(1)得到的固相物料于40℃挥干乙醇后,向每克固相物料中加入ph值为5水(用磷酸配制)和α-淀粉酶,ph值为5水的用量为20ml,α-淀粉酶的用量为固相物料重量的0.5wt%,40℃保温水解2h,100℃煎煮40min,4500rpm离心10min,分离出沉淀1和上清液1;向上清液1中加入sevage试剂(氯仿和正丁醇的体积比为5:1),sevage试剂与上清液1的体积比为1:5,混合,振荡,离心,得到上清液,将上清液用同样的sevage试剂法再除杂3次后得到澄清的上清液,澄清的上清液经减压浓缩至密度为1.0(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于40℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0131]
对比例8:
[0132]
对比例8的内容与实施例2基本相同,其不同之处在于:
[0133]
步骤(2)的具体操作步骤为:将步骤(1)得到的固相物料于40℃挥干乙醇后,向每克固相物料中加入ph值为5水(用磷酸配制),ph值为5水的用量为20ml,40℃保温水解2h,100℃煎煮40min,先用100目滤布过滤,得到滤渣和滤液,滤液于4500rpm离心10min,分离出沉淀和上清液1,合并滤渣和沉淀记为沉淀1;向上清液1中加入sevage试剂(氯仿和正丁醇的体积比为5:1),sevage试剂与上清液1的体积比为1:5,混合,振荡,离心,得到上清液,将上清液用同样的sevage试剂法再除杂3次后得到澄清的上清液,澄清的上清液减压浓缩至密度为1.0(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于40℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0134]
表4纤维素酶、风味型蛋白酶、中性蛋白酶、α-淀粉酶对果胶得率、果胶纯度、果胶提取物中蛋白质含量、游离性多酚含量和结合态多酚含量的影响
[0135][0136][0137]
由表4可知,与实施例2相比,对比例3中未添加风味型蛋白酶和中性蛋白酶,制备得到的上清液1中含有未分解的蛋白质,需要再次脱除蛋白质,才能制备出较纯净的果胶,操作步骤繁杂;对比例4中未添加α-淀粉酶,酶解煎煮后需先用100目滤布过滤再离心才能得到澄清的上清液1,滤布过滤的操作步骤使得果胶和结合态多酚在提取过程中有一定的损失,造成果胶得率和结合态多酚含量分别下降16.5%和11.3%;对比例5中未添加风味型蛋白酶、中性蛋白酶和α-淀粉酶需依次用100目滤布过滤、离心、sevage试剂萃取等方法才能得到澄清的上清液,操作步骤的繁杂化使得果胶和结合态多酚在提取过程中有一定的损失,造成果胶得率、果胶纯度和结合态多酚含量分别下降10.8%、8.51%和17.6%;对比例6中未添加纤维素酶和α-淀粉酶,酶解后离心前需先用100目滤布过滤,滤布过滤的操作步骤使得果胶得率和结合态多酚含量分别下降了29.1%和15.5%;对比例7中未添加纤维素酶、风味型蛋白酶和中性蛋白酶,使得果胶溶出不充分且得到的上清液1中含有未分解的蛋白质,需要再次脱除蛋白质,才能制备出纯净的果胶,操作步骤较繁杂,导致果胶的得率和果胶纯度分别降低了26.6%和7.98%;对比例8中未添加任何酶,果胶溶出不充分,后续需依次用100目滤布过滤、离心、sevage试剂萃取等方法才能得到澄清的上清液,操作步骤的繁杂化使得果胶得率、果胶纯度和结合态多酚含量分别降低了31.0%、7.50%和18.7%。综上所述,采用本发明牡丹籽粕综合利用方法有利于果胶的溶出,减少实验操作步骤,提高果胶得率、果胶纯度和结合态多酚含量。
[0138]
(五)果胶提取物提取方法中是否需要煎煮的探讨
[0139]
为了探讨果胶提取物提取方法中是否煎煮对果胶得率和结合态多酚含量的影响,发明人采用实施例2的提取方法,同时还做了对比实验,对比实验的内容见对比例9,实验结
果见表5。
[0140]
对比例9:
[0141]
对比例9的内容与实施例2基本相同,其不同之处在于:
[0142]
步骤(2)的具体操作步骤为:将步骤(1)得到的固相物料于40℃挥干乙醇后,向每克固相物料中加入ph值为5.5水(用磷酸配制)、纤维素酶、风味型蛋白酶、中性蛋白酶和α-淀粉酶,ph值为5.5水的用量为20ml,纤维素酶、风味型蛋白酶、中性蛋白酶、α-淀粉酶的用量分别为固相物料重量的0.1wt%、0.3wt%、0.3wt%、0.5wt%,40℃保温水解2h,4500rpm离心10min,分离出沉淀1和上清液1,上清液1经减压浓缩至密度为0.9(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于40℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0143]
表5是否煎煮对果胶得率和结合态多酚含量的影响
[0144][0145]
由表5可知,与对比例9相比,实施例2的果胶得率显著提高了56.4%,而结合态多酚提取物中结合态多酚含量几乎不变。因此,酶法辅助提取果胶时,酶解后,再煎煮20~40min,能显著提高果胶得率。
[0146]
实施例10:
[0147]
(1)向每克凤丹牡丹籽粕中加入15ml80%乙醇溶液,超声提取50min,4500rpm离心10min,过滤得到沉淀和上清液,将沉淀用同样的乙醇浸提方法再提取3次,得到固相物料留存备用,合并上清液,得到浸提液,将浸提液于60℃和0.09mpa下浓缩除去乙醇,用6mol/l hcl调ph值至2,过d101大孔树脂柱,先用3个柱体积水洗脱除去多糖等大分子物质后用4个柱体积的50%乙醇洗脱,收集乙醇洗脱液,50℃和0.09mpa浓缩至干即得游离性多酚提取物,再用95%乙醇洗脱得到油脂,弃除。
[0148]
(2)将步骤(1)得到的固相物料于45℃挥发干乙醇后,向每克固相物料中加入ph值为5.5水(用盐酸配制)、纤维素酶、风味型蛋白酶、中性蛋白酶和α-淀粉酶,ph值为5.5水的用量为14ml,纤维素酶、风味型蛋白酶、中性蛋白酶、α-淀粉酶的用量分别为固相物料重量的0.1wt%、0.3wt%、0.3wt%、0.5wt%,50℃保温水解2.5h,100℃煎煮60min,4500rpm离心10min,分离出沉淀1和上清液1,上清液1减压浓缩至密度1.0(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于50℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0149]
(3)向每克沉淀1中加入3ml硫酸乙醇溶液,其中硫酸乙醇溶液是98%浓硫酸与无水乙醇以体积比1:9制备而成的,80℃水浴回流1.5h,放凉,4500rpm离心10min,得到上清液3。将上清液3、上清液2和95%乙醇洗涤液合并减压浓缩至无乙醇,过d101大孔树脂柱,先用4个柱体积的水洗后用3个柱体积的45%乙醇洗脱,收集乙醇洗脱液,在60℃和0.09mpa下浓
缩至干即得结合态多酚提取物,再用95%乙醇洗脱得到油脂,弃除。游离性多酚含量为555.8mg/100g;果胶得率为15.8%;结合态多酚含量为153.3mg/100g。
[0150]
实施例11:
[0151]
(1)向每克紫斑牡丹籽粕中加入15ml 80%乙醇溶液,超声提取40min,4500rpm离心10min,过滤得到沉淀和上清液,将沉淀用同样的乙醇浸提方法再提取3次,得到固相物料留存备用,合并上清液,得到浸提液,将浸提液于50℃和0.09mpa下浓缩除去乙醇,用6mol/l hcl调ph值至3,过ab-8大孔树脂柱,先用4个柱体积的水洗后用4个柱体积的60%乙醇洗脱,收集乙醇洗脱液,在60℃和0.09mpa下浓缩至干即得游离性多酚提取物,再用95%乙醇洗脱得到油脂,弃除。
[0152]
(2)将步骤(1)得到的固相物料于40℃挥干乙醇后,向每克固相物料中加入ph值为6水(用盐酸配制)、纤维素酶、风味型蛋白酶、中性蛋白酶和α-淀粉酶,ph值为6水的用量为20ml,纤维素酶、风味型蛋白酶、中性蛋白酶、α-淀粉酶的用量分别为固相物料重量的0.1wt%、0.3wt%、0.3wt%、0.5wt%,50℃保温水解3h,100℃煎煮60min,4500rpm离心10min,分离出沉淀1和上清液1;上清液1经减压浓缩至密度为1.0(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于60℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0153]
(3)向每克沉淀1中加入3ml硫酸乙醇溶液,其中硫酸乙醇溶液是98%浓硫酸与无水乙醇以体积比1:9制备而成的,90℃水浴回流2h,放凉,4500rpm离心10min得到上清液3。将上清液3、上清液2和95%乙醇洗涤液合并减压浓缩至无乙醇,过ab-8大孔树脂柱,先用4个柱体积的水洗后用4个柱体积的60%乙醇洗脱,收集乙醇洗脱液,在40℃和0.09mpa下浓缩至干即得结合态多酚提取物,再用95%乙醇洗脱得到油脂,弃除。游离性多酚含量为550.3mg/100g;果胶得率为15.7%;结合态多酚含量为156.8mg/100g。
[0154]
实施例12:
[0155]
(1)向每克凤丹牡丹籽粕中加入15ml 80%乙醇溶液,超声提取25min,4500rpm离心10min,过滤得到沉淀和上清液,将沉淀用同样的乙醇浸提方法再提取3次,得到固相物料留存备用,合并上清液,得到浸提液,将浸提液于40℃和0.09mpa下浓缩除去乙醇,用6mol/l hcl调ph值至2,过d101大孔树脂柱,先用3个柱体积的水洗后用4个柱体积的50%乙醇洗脱,收集乙醇洗脱液,在50℃和0.09mpa下浓缩至干即得游离性多酚提取物,再用95%乙醇洗脱得到油脂,弃除。
[0156]
(2)将步骤(1)得到的固相物料于45℃挥干乙醇后,向每克固相物料中加入ph值为5.5水(用盐酸配制)、纤维素酶、风味型蛋白酶、中性蛋白酶和α-淀粉酶,ph值为5.5水的用量为14ml,纤维素酶、风味型蛋白酶、中性蛋白酶、α-淀粉酶的用量分别为固相物料重量的0.1wt%、0.3wt%、0.3wt%、0.5wt%,50℃保温水解1.5h,100℃煎煮60min,4500rpm离心10min,分离出沉淀1和上清液1;上清液1经减压浓缩至密度为0.9(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于50℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0157]
(3)向每克沉淀1中加入3ml硫酸乙醇溶液,其中硫酸乙醇溶液是98%浓硫酸与无水乙醇以体积比1:9制备而成的,80℃水浴回流1.5h,放凉,4500rpm离心10min得到上清液3。将上清液3、上清液2和95%乙醇洗涤液合并减压浓缩至无乙醇,过d101大孔树脂柱,先用
4个柱体积的水洗后用3个柱体积的45%乙醇洗脱,收集乙醇洗脱液,在40℃和0.09mpa下浓缩至干即得结合态多酚提取物,再用95%乙醇洗脱得到油脂,弃除。游离性多酚含量为549.3mg/100g;果胶得率为15.7%;结合态多酚含量为149.7mg/100g。
[0158]
实施例13:
[0159]
(1)向每克紫斑牡丹籽粕中加入16ml 80%乙醇溶液,超声提取30min,4500rpm离心10min,过滤得到沉淀和上清液,将沉淀用同样的乙醇浸提方法再提取3次,得到固相物料留存备用,合并上清液,得到浸提液,将浸提液于40℃和0.09mpa下浓缩除去乙醇,用6mol/l hcl调ph值至2.5,过ab-8大孔树脂柱,先用3个柱体积的水洗后用4个柱体积的50%乙醇洗脱,收集乙醇洗脱液,在50℃和0.09mpa下浓缩至干即得游离性多酚提取物,再用95%乙醇洗脱得到油脂,弃除。
[0160]
(2)将步骤(1)得到的固相物料于55℃挥干乙醇后,向每克固相物料中加入ph值为6水(用磷酸配制)、纤维素酶、风味型蛋白酶、中性蛋白酶和α-淀粉酶,ph值为6水的用量为15ml,纤维素酶、风味型蛋白酶、中性蛋白酶、α-淀粉酶的用量分别为固相物料重量的0.1wt%、0.3wt%、0.3wt%、0.5wt%,55℃保温水解2h,100℃煎煮50min,4500rpm离心10min,分离出沉淀1和上清液1;上清液1经减压浓缩至密度为0.9(25℃),加95%乙醇至醇溶液浓度为80%,静置12h,过滤得到沉淀2和上清液2,用95%乙醇洗涤沉淀2至乙醇洗涤液无颜色为止,将洗涤后的沉淀2于55℃烘干即得果胶提取物,95%乙醇洗涤液留存备用。
[0161]
(3)向每克沉淀1中加入3ml硫酸乙醇溶液,其中硫酸乙醇溶液是98%浓硫酸与无水乙醇以体积比1:9制备而成的,80℃水浴回流1h,放凉,4500rpm离心10min得到上清液3。将上清液3、上清液2和95%乙醇洗涤液合并减压浓缩至无乙醇,过ab-8大孔树脂柱,先用4个柱体积的水洗后用3个柱体积的60%乙醇洗脱,收集乙醇洗脱液,在40℃和0.09mpa下浓缩至干即得结合态多酚提取物,再用95%乙醇洗脱得到油脂,弃除。游离性多酚含量为555.6mg/100g;果胶得率为16.0%;结合态多酚含量为150.2mg/100g。
[0162]
本发明游离性多酚提取物、结合态多酚提取物和果胶提取物的性能测试实验
[0163]
一、游离性多酚提取物、结合态多酚提取物的hplc表征测试:
[0164]
对本发明实施例2得到的游离性多酚提取物分别在230nm和290nm处进行hplc分析,hplc分析的检测条件为:agilent 1260infinityⅱ高效液相色谱仪,色谱柱采用agilent eclipse xdb-c18(250
×
4.6mm,5μm);流动相:乙腈(a)-0.1%甲酸水溶液(b);梯度洗脱:0~30min,a 5%~15%;30~55min,a 30%。检测波长分别为230、290nm;流速为1.0ml
·
min-1;柱温35℃;进样量10μl,结果如图1和图2所示。
[0165]
对本发明实施例2得到的结合态多酚提取物分别在230nm和290nm处进行hplc分析,hplc分析的检测条件为:agilent 1260infinityⅱ高效液相色谱仪,色谱柱采用agilent eclipse xdb-c18(250
×
4.6mm,5μm);流动相:乙腈(a)-0.1%甲酸水溶液(b);梯度洗脱:0~30min,a 5%~15%;30~55min,a 30%。检测波长分别为230、290nm;流速为1.0ml
·
min-1
;柱温35℃;进样量10μl,结果如图3和图4所示。
[0166]
二、果胶提取物的红外光谱分析
[0167]
对本发明实施例2得到的果胶提取物做傅里叶变换红外光谱分析,结果如图5所示。
[0168]
由图5可知,本实施例2提取得到的果胶提取物在400~4000cm-1
范围内具有果胶的
特征吸收峰。3431.63cm-1
出现的峰是由分子内或分子间o-h伸缩振动引起,2926.34cm-1
处的吸收峰是由于ch2基团的c-h伸缩振动引起的,1743.27cm-1
处的吸收峰是由于半乳糖醛酸中的酯基上c=o伸缩振动引起的,1654.32cm-1
处的吸收峰归因于游离羧基的酯基c=o伸缩振动引起的。
[0169]
三、对本发明实施例2得到的游离性多酚提取物、结合态多酚提取物和果胶提取物进行抗血栓测试。
[0170]
a样品溶液的配制:
[0171]
(1)游离性多酚提取物溶液的配制:精密称取实施例2得到的游离性多酚提取物0.1g,加入2ml二甲基亚砜(dmso)混匀,得到混合溶液,将混合溶液转移到100ml容量瓶中,用生理盐水定容,配制成1mg/ml的游离性多酚提取物溶液;
[0172]
(2)结合态多酚提取物溶液的配制:结合态多酚提取物溶液的配制方法同游离性多酚提取物溶液。
[0173]
(3)果胶提取物溶液的配制:果胶提取物溶液的配制方法同游离性多酚提取物溶液。
[0174]
b阳性对照溶液的配制:精密称取肝素钠,加入生理盐水溶解,配制成5u/l的肝素钠溶液。
[0175]
c阴性对照溶液:生理盐水。
[0176]
d实验对象及培养条件:獭兔,雄性,体重2.0-2.5kg(由河南大学提供);动物适应性饲养一周,温度25
±
2℃,光照12小时/天,湿度在40~45%,自由饮水摄食。
[0177]
(一)游离性多酚提取物、结合态多酚提取物和果胶提取物体外抗凝血作用
[0178]
本发明采用aptt、pt、tt检测游离性多酚提取物溶液、结合态多酚提取物溶液和果胶提取物溶液的体外抗凝血作用,aptt、pt、tt检测方法如下,结果见表5。
[0179]
(1)aptt检测方法:獭兔耳缘静脉取血3.6ml,将其置于400μl、0.109mol/l枸橼酸钠溶液的离心管中,混匀,3000rpm离心15min,分离出上清液备用,在离心管中加入25μl样品溶液、100μl血浆和100μl aptt试剂(37℃),混匀,于37℃孵育5min后加入100μl、0.025mol/l cacl2溶液(37℃),记录凝固时间,即为aptt值,每组平行测定10次。
[0180]
(2)pt检测方法:獭兔耳缘静脉取血3.6ml,将其置于400μl、0.109mol/l枸橼酸钠溶液的离心管中,混匀,3000rpm离心15min,分离出上清液备用,在离心管中加入25μl的样品溶液、100μl血浆,混匀,于37℃孵育3min后加入200μl pt试剂(37℃),记录凝固时间,即为pt值,每组平行测定10次。
[0181]
(3)tt检测方法:獭兔耳缘静脉取血3.6ml,将其置于400μl、0.109mol/l枸橼酸钠溶液的离心管中,混匀,3000rpm离心15min,分离出上清液备用,在离心管中加入50μl样品溶液和200μl血浆,于37℃孵育3min后加入200μl tt试剂(37℃),记录凝固时间,即为tt值,每组平行测定10次。
[0182]
表6游离性多酚提取物、结合态多酚提取物和果胶提取物体外抗凝血作用(n=10)
[0183][0184]
由表6可知,与阴性对照组相比,游离性多酚提取物溶液、结合态多酚提取物溶液和果胶提取物溶液的aptt、pt和tt值均增加,说明游离性多酚提取物、结合态多酚提取物和果胶提取物均具有体外抗凝血作用;与结合态多酚提取物溶液和果胶提取物溶液相比,游离性多酚提取物溶液的aptt、pt和tt值均增加,说明游离性多酚提取物具有更好的体外抗凝血作用。
[0185]
(二)游离性多酚提取物、结合态多酚提取物和果胶提取物体外抗血栓作用
[0186]
(1)游离性多酚提取物、结合态多酚提取物和果胶提取物体外溶栓作用
[0187]
1)测试方法:
[0188]
a样品组:家兔颈总动脉采血于试管中,按体积比为1:9加入38g/l的枸橼酸钠溶液,然后依次加入20μl每毫升血中含0.5%纤维蛋白原溶液、55.5g/l cacl2溶液20μl和1
×
105u/l凝血酶20μl,快速混匀后用一次性塑料注射器将血液快速注入内径为8mm的试管中,放入37℃水浴20min后,将血栓取出,切成0.5cm小段,分别称其质量后放入2ml样品溶液管中,将样品溶液管放入37℃水浴中,分别在4h、12h、24h和48h将剩余血栓段取出称其质量,重复实验10次,结果见表6。
[0189]
b阳性对照组:阳性对照组的处理方法同样品组。
[0190]
c阴性对照组:阴性对照组的处理方法同样品组。
[0191]
2)溶栓百分率的计算方法:溶栓百分率=[(血栓初始质量-药物作用后各时间点血栓质量)]
×
100%/血栓初始质量。
[0192]
表7游离性多酚提取物、结合态多酚提取物和果胶提取物体外溶栓作用(n=10)
[0193][0194]
由表7可知,随着测试时间的不断增加,血栓溶解率逐渐增大;在48h时,阳性对照组中血栓全部溶解,阴性对照组和样品组中血栓均未全部溶解,且样品组中血栓溶解率均大于阴性对照组,说明游离性多酚提取物溶液、结合态多酚提取物溶液和果胶提取物溶液均具有体外溶栓作用;在4h、12h、24h和48h时,与结合态多酚提取物溶液和果胶提取物溶液
相比,游离性多酚提取物溶液的血栓溶解率均大于结合态多酚提取物溶液和果胶提取物溶液的血栓溶解率,表明游离性多酚提取物具有更好的体外溶栓作用。
[0195]
(2)游离性多酚提取物、结合态多酚提取物和果胶提取物体外对全血凝块的溶解作用
[0196]
1)测试方法:
[0197]
a样品组:家兔颈总动脉采血20ml置于表面皿中,自然凝固后切成0.3cm3的全血凝块,用生理盐水淋洗3遍备用。取样品溶液和去离子水各2ml并加入西林瓶中,每组5个小瓶,再向各瓶中随机加入2个全血凝块,将西林瓶于37℃水浴保温,观察血块溶解情况,并分别于0h、12h、24h、48h分别测全血凝块的质量,结果见表7。
[0198]
b阳性对照组:阳性对照组的处理方法与样品组基本相同,其不同之处在于:取5u/l的肝素钠溶液和去离子水各2ml并加入西林瓶中。
[0199]
c阴性对照组:阴性对照组的处理方法与样品组基本相同,其不同之处在于:取去离子水4ml并加入西林瓶中。
[0200]
2)全血凝块溶解率的计算方法:全血凝块溶解率=(全血凝块初始质量-药物作用后各时间点全血凝块质量)
×
100%/全血凝块初始质量。
[0201]
表8游离性多酚提取物、结合态多酚提取物和果胶提取物体外对全血凝块的溶解作用(n=10)
[0202][0203]
由表8可知,随着测试时间的不断增加,全血凝块溶解率不断增大;在48h时,阳性对照组中全血凝块能全部溶解,样品组的全血凝块溶解率均大于阴性对照组,说明样品组具有对全血凝块的溶解作用,即游离性多酚提取物溶液、结合态多酚提取物溶液和果胶提取物溶液均具有对全血凝块的溶解作用;与结合态多酚提取物溶液和果胶提取物溶液相比,在12h、24h和48h时游离性多酚提取物溶液对全血凝块溶解率均大于结合态多酚提取物溶液和果胶提取物溶液对全血凝块溶解率,说明游离性多酚提取物对全血凝块的溶解作用最强。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1