一种抑制尿酸盐转运蛋白1的甘松提取物及其制备方法与应用
1.本发明属于天然提取物领域,具体涉及一种抑制尿酸盐转运蛋白1的甘松提取物及其制备方法与应用。
背景技术:
2.高尿酸血症是一种由嘌呤代谢障碍所致的慢性代谢性疾病,以高水平的血清尿酸为特征,与高血压、糖尿病、高血脂、冠心病等疾病呈显著正相关,严重危害人们的健康和生活。尿酸排泄障碍是引起高尿酸血症的重要因素,尿酸盐转运蛋白1是负责肾脏重吸收尿酸的关键靶点,参与尿酸盐的重吸收,而高水平的尿酸盐转运蛋白1可能会引起高尿酸血症或痛风。目前市场上促进尿酸排泄的药物尽管疗效显著,但均有严重的肝和肾毒性,因此迫切需要开发安全(低毒)、有效的尿酸盐转运蛋白1抑制剂。
3.甘松(nardostachys jatamansi dc.),属败酱科多年生草本植物,其干燥根及根茎可入药,含有丰富的萜类、黄酮类、香豆素类、木脂素类和多糖等生物活性物质,安全且毒副作用较低。现代药理研究表明甘松具有镇静、抗癫痫、抗抑郁、降血压、抗心律失常、抑菌、抗疟和抗氧化等多种药理活性,是一种优质的生物资源。
4.目前,对甘松的加工工艺分为两大类,一种是将含有甘松的中药组合物进行煎煮或醇提、过滤后取滤液或干燥后得药粉制成药剂;另一种是采用超声法醇提后浓缩、用有机溶剂萃取得提取物。但目的导向为高纯度、高活性甘松提取物的研究目前还比较少。
5.另外,甘松的应用以复配为主,佐以多种药材或活性成分以实现特殊功效,针对单一甘松提取物的应用研究还较少。近年来,有部分研究人员开始关注甘松提取物的活性应用。比如,甘松提取物中具有抗衰老活性成分,将其作为皮肤外用剂;甘松提取物用于治疗胃溃疡;甘松中的多种化合物具有调节5-羟色胺转运体的生物活性,具有抗抑郁的功效。但甘松提取物在抑制尿酸盐转运蛋白1中的应用未见公开报道。
6.
技术实现要素:
针对现有技术的不足,本发明提供了一种抑制尿酸盐转运蛋白1的甘松提取物及其制备方法与应用。本发明制备的甘松提取物,产品纯度高,尿酸盐转运蛋白1抑制活性高。
7.为实现上述发明目的,本发明采用以下技术方案予以实现:本发明提供了一种抑制尿酸盐转运蛋白1的甘松提取物的制备方法,包括以下步骤:(1)粉碎干燥甘松,向得到的甘松粉中加入水和复合酶进行酶解,得到甘松酶解液;(2)向步骤(1)的甘松酶解液中加入乙醇,进行超声提取,收集提取液,并重复提取,合并得到提取液;(3)将步骤(2)的提取液减压浓缩,得到浓缩液;(4)将步骤(3)的浓缩液经大孔树脂吸附,得到的洗脱液干燥后,得到甘松提取物
粗品;(5)将步骤(4)的甘松提取物粗品溶解到沸腾的有机溶剂中,加入活性炭吸附,得到的滤液快速降至低温,收集重结晶产物,将重结晶产物干燥后,得到甘松提取物。
8.进一步的,所述步骤(1)中复合酶是由纤维素酶与果胶酶以1~5:1的重量比混合而成的;所述复合酶的添加量为甘松粉重量的0.05%~2%。
9.优选的,所述步骤(1)中复合酶是由纤维素酶与果胶酶以2:1的重量比混合而成的;所述复合酶的添加量为甘松粉重量的2%。
10.进一步的,所述步骤(1)中酶解的条件为:温度38~58℃,ph = 3.5~6.5,保温反应1~3小时。
11.优选的,所述步骤(1)中酶解的条件为:温度48℃,ph = 5,保温反应2小时。
12.进一步的,所述步骤(1)中所述水的体积是甘松粉质量的5~10倍。
13.进一步的,所述步骤(1)中粉碎的是甘松的根和根茎。
14.进一步的,所述步骤(2)中超声提取条件为:超声功率80 w ~200w,提取温度40℃~65℃,提取时间20 min ~60 min。
15.优选的,所述步骤(2)中超声提取条件为:超声功率160w,提取温度50℃,提取时间40 min。
16.进一步的,所述步骤(3)中减压浓缩的温度为45℃~65℃,减压浓缩至提取液原体积的1/10 ~ 1/20,得到浓缩液。
17.进一步的,所述步骤(4)大孔吸附树脂包括ab-8、hpd100、xad-4、xad-7大孔树脂;洗脱条件为:先用2 ~ 6倍柱体积的35 ~ 55%乙醇进行洗脱,再用5 ~ 8倍柱体积的70 ~ 85%乙醇进行洗脱。
18.进一步的,所述步骤(5)中有机溶剂为甲醇、乙醇、正丙醇、异丙醇中的至少一种;所述活性炭的重量是甘松提取物粗品的1-3%,吸附5~10分钟;所述滤液以10 ~15℃/ min的速度快速降温至0℃~ 8℃。
19.综上,一种抑制尿酸盐转运蛋白1的甘松提取物的制备方法,包括以下步骤:(1)将干燥甘松的根和根茎粉碎,得到甘松粉;向甘松粉中加入5~10倍体积水,然后加入甘松粉重量的0.05%~2%,由纤维素酶与果胶酶以1~5:1的重量比混合而成的复合酶,控制温度38~58℃,ph = 3.5~6.5,保温反应1~3小时,得甘松酶解液;(2)向甘松酶解液中加入乙醇至乙醇浓度为50% ~ 80%,进行超声提取,设置超声功率80 w ~200w,在40℃~65℃温度条件下提取20min~60 min,收集提取液,重复提取2次,合并得到提取液;(3)将步骤(2)的提取液在45℃~65℃减压浓缩至原体积的1/10 ~ 1/20 ,得到浓缩液;(4)将步骤(3)的浓缩液经过大孔吸附树脂吸附,先用2 ~ 6倍柱体积的35%~ 55%乙醇进行洗脱,再用5 ~ 8倍柱体积的70%~ 85%乙醇进行洗脱,收集洗脱液,干燥后,得到甘松提取物粗品;(5)将步骤(4)的甘松提取物粗品溶解到加热至沸腾的有机溶剂中,加入粗品重量1%-3%的活性炭吸附5~10分钟,趁热过滤溶液,取滤液以10℃/ min ~15℃/ min的速度快速降温至0 ℃~ 8℃,过滤收集重结晶产物,将重结晶产物干燥后,得到甘松提取物。
20.本发明还提供了所述的制备方法制备得到的甘松提取物,所述甘松提取物具有尿酸盐转运蛋白1抑制活性,且总黄酮含量大于55%,金合欢素在总黄酮中含量大于5%。
21.进一步的,所述甘松提取物抑制尿酸盐转运蛋白1的ic
50
为1.7 mg/ml。
22.本发明还提供了所述的甘松提取物在用于制备甘松金合欢素中的应用。
23.本发明还提供了所述的甘松提取物或者所述的甘松金合欢素在用于制备尿酸盐转运蛋白1抑制剂中的应用。
24.进一步的,所述甘松提取物的使用浓度为1.5 mg/ml ~ 2.5 mg/ml。
25.进一步的,所述甘松金合欢素的使用浓度为50
µ
m ~ 150
ꢀµ
m。
26.本发明还提供了所述的甘松提取物在用于制备防治高尿酸血症的药物和/或保健品中的应用。
27.进一步的,所述高尿酸血症是由尿酸盐转运蛋白1高表达引起的高尿酸血症。
28.现有技术相比,本发明的优点和有益效果是:1、本发明利用超声辅助复合酶法提取、大孔吸附树脂结合重结晶纯化的甘松提取物制备方法,提取到甘松提取物,并有效提高甘松提取物产率,最高可达4.31%;而且本发明制备的甘松提取物杂质少、纯度高,其总黄酮含量高达60.05%,金合欢素在总黄酮中含量可达6.06%。
29.2、本发明提取的甘松提取物首次验证具有尿酸盐转运蛋白1抑制活性,并从甘松提取物提取得到甘松金合欢素,两者均能够为尿酸盐转运蛋白1抑制剂开发提供新资源,同时开辟了甘松提取物的新用途,实现甘松资源高值化利用。
30.3、甘松提取物作为一种天然植物来源的活性产物,与已有药物相比具有对人体副作用小、绿色安全的优势,在制备具有尿酸盐转运蛋白1抑制活性的食品、药品中明显的优势和广阔的应用前景。
附图说明
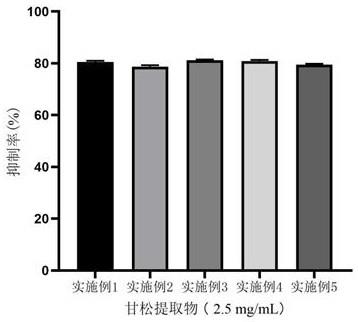
31.图1 为不同实施例制备的甘松提取物对尿酸盐转运蛋白1的抑制作用,其中横坐标为不同实施例制备的甘松提取物,纵坐标为抑制率。
32.图2 为甘松提取物对尿酸盐转运蛋白1的ic
50
,其中横坐标为甘松提取物的浓度,纵坐标为抑制率。
33.图3为金合欢素的hplc图,其中横坐标为保留时间,纵坐标为峰高。
34.图4 为金合欢素对尿酸盐转运蛋白1抑制的ic
50
,其中横坐标为样品浓度,纵坐标为抑制率。
具体实施方式
35.下面将结合具体实施方式进一步说明本发明,但本发明要求保护的范围并不局限于下列实施方式。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
36.1、总黄酮含量测定:采用芦丁标准品经30%乙醇配制不同浓度的标准溶液,于510 nm处测定吸光度,绘制标准曲线;将甘松提取物采用同芦丁标准品同样的处理方法进行测定,然后计算得总黄酮含量。
37.计算公式:总黄酮含量=总黄酮质量浓度
×
总黄酮提取物溶液体积
×
稀释倍数
÷
样品质量。
38.2、金合欢素含量测定:采用hplc法测定金合欢素含量。具体方法如下:色谱柱为zorbax sb-c18柱(250 mm
×
4.6 mm,5μm);流动相为1%甲酸(a)-甲醇(b),梯度洗脱(0~5 min,30%b;5~25 min,30%b
→
90%b;30~32min,30%b);检测波长365 nm;流速1.0 ml/min;柱温30℃;进样量为20μl(浓度0.25mm);检测波长:365nm。设定的色谱条件下进样,以金合欢素标准品浓度(mmol/l)为横坐标,峰面积(a)为纵坐标,绘制标准曲线。根据标准曲线计算供试品中金合欢素的含量。
39.实施例1、制备甘松提取物取2kg干燥甘松的根和根茎粉碎,得甘松粉。向甘松粉中加入5倍体积水,然后加入1%的重量比1:1的纤维素酶和果胶酶,控制温度58℃,ph = 6,保温反应2小时,得甘松酶解液。向甘松酶解液中加入乙醇至乙醇浓度为70%,进行超声提取,设置超声功率80w,在55℃条件下提取30 min,收集提取液,重复提取2次,合并得提取液;将所得提取液在50℃下减压浓缩至原体积的1/10,得浓缩液。将浓缩液经过hpd100型大孔吸附树脂进行吸附分离,先采用6倍柱体积的35%乙醇进行洗脱,再用8倍柱体积的70%乙醇进行洗脱,收集洗脱液,将洗脱液干燥得甘松提取物粗品。然后将所得甘松提取物粗品溶解到加热至沸腾的乙醇溶液中,加入粗品重量1%的活性炭吸附10分钟,趁热过滤溶液,取滤液以10 ~15℃/ min的速度快速降温至0 ~ 8℃,过滤收集重结晶产物,干燥得甘松提取物80.6g,甘松提取物的得率为4.03%。然后采用芦丁标准品作为对照测得甘松提取物的总黄酮含量为59.82%。经hplc检测,金合欢素在总黄酮中含量为5.74%。
40.实施例2、制备甘松提取物取1kg干燥甘松根和根茎粉碎,得甘松粉。向甘松粉中加入8倍体积水,然后加入0.5%的重量比1.5:1的纤维素酶和果胶酶,控制温度45℃,ph =4.5,保温反应1小时,得甘松酶解液。向甘松酶解液中加入乙醇至乙醇浓度为75%,进行超声提取,设置超声功率120w,在65℃条件下提取40 min,收集提取液,重复提取2次,合并得提取液,将所得提取液在50℃下减压浓缩至原体积的1/12,得浓缩液。将浓缩液经过ab-8型大孔树脂进行吸附分离,先采用2倍柱体积的55%乙醇进行洗脱,再用6倍柱体积的80%乙醇进行洗脱,收集洗脱液,干燥得甘松提取物粗品。然后将所得甘松提取物粗品溶解到加热至沸腾的正丙醇溶液中,加入粗品重量3%的活性炭吸附5分钟,趁热过滤溶液,取滤液以10 ~15℃/ min的速度快速降温至0 ~ 8℃,过滤收集重结晶产物,干燥得甘松提取物42.1g,甘松提取物的得率为4.21%。然后采用芦丁标准品作为对照测得甘松提取物的总黄酮含量为57.51%。经hplc检测,金合欢素在总黄酮中含量为5.28%。
41.实施例3、制备甘松提取物取4kg干燥甘松根和根茎粉碎,得甘松粉。向甘松粉中加入10倍体积水,然后加入2%的重量比4:1的纤维素酶和果胶酶,控制温度50℃,ph =5,保温反应3小时,得甘松酶解液。向甘松酶解液中加入乙醇至乙醇浓度为65%,进行超声提取,设置超声功率140w,在45℃条件下提取60 min,收集提取液,重复提取2次,合并得提取液,将所得提取液在50℃下减压浓缩至原体积的1/15,得浓缩液。将浓缩液经过xad-4型大孔树脂进行吸附分离,先采用4倍柱体积的40%乙醇进行洗脱,再用6倍柱体积的75%乙醇进行洗脱,收集洗脱液,干燥得甘松
提取物粗品。然后将所得甘松提取物粗品溶解到加热至沸腾的甲醇溶液中,加入粗品重量1.2%的活性炭吸附6分钟,趁热过滤溶液,取滤液以10 ~15℃/ min的速度快速降温至0 ~ 8℃,过滤收集重结晶产物,干燥得甘松提取物172.00g,甘松提取物的得率为4.31%。然后采用芦丁标准品作为对照测得甘松提取物的总黄酮含量为60.05%。经hplc检测,金合欢素在总黄酮中含量为6.06%。
42.实施例4、制备甘松提取物取3kg干燥甘松根和根茎粉碎,得甘松粉。向甘松粉中加入7倍体积水,然后加入0.05%的重量比5:1的纤维素酶和果胶酶,控制温度42℃, ph =3.5,保温反应2.5小时,得甘松酶解液。向甘松酶解液中加入乙醇至乙醇浓度为80%,进行超声提取,设置超声功率200w,在40℃条件下提取50 min,收集提取液,重复提取2次,合并得提取液,将所得提取液在50℃下减压浓缩至原体积的1/20,得浓缩液。将浓缩液经过xad-7型大孔树脂进行吸附分离,先采用3倍柱体积的50%乙醇进行洗脱,再用5倍柱体积的85%乙醇进行洗脱,收集洗脱液,干燥得甘松提取物粗品。然后将所得甘松提取物粗品溶解到加热至沸腾的异丙醇溶液中,加入粗品重量2%的活性炭吸附8分钟,趁热过滤溶液,取滤液以10 ~15℃/ min的速度快速降温至0 ~ 8℃,过滤收集重结晶产物,干燥得甘松提取物123.83g,甘松提取物的得率为4.13%。然后采用芦丁标准品作为对照测得甘松提取物的总黄酮含量为55.39%。经hplc检测,金合欢素在总黄酮中含量为5.42%。
43.实施例5、制备甘松提取物取5kg干燥甘松根和根茎粉碎,得甘松粉。向甘松粉中加入9倍体积水,然后加入1.5%的重量比1:1的纤维素酶和果胶酶,控制温度38℃,ph =5.0,保温反应1.5小时,得甘松酶解液。向甘松酶解液中加入乙醇至乙醇浓度为50%,进行超声提取,设置超声功率160w,在60℃条件下提取30 min,收集提取液,重复提取2次,合并得提取液,将所得提取液在50℃下减压浓缩至原体积的1/15,得浓缩液。将浓缩液经过hpd100型大孔树脂进行吸附分离,先采用5倍柱体积的35%乙醇进行洗脱,再用7倍柱体积的75%乙醇进行洗脱,收集洗脱液,干燥得甘松提取物粗品。然后将所得甘松提取物粗品溶解到加热至沸腾的乙醇溶液中,加入粗品重量1.5%的活性炭吸附5分钟,趁热过滤溶液,取滤液以10 ~15℃/ min的速度快速降温至0 ~ 8℃,过滤收集重结晶产物,干燥得甘松提取物205.69g,甘松提取物的得率为4.11%。然后采用芦丁标准品作为对照测得甘松提取物的总黄酮含量为59.62%。经hplc检测,金合欢素在总黄酮中含量为5.81%。
44.实施例6、不同提取条件对制备甘松提取物的影响基本工艺:取2kg干燥甘松的根和根茎粉碎,得甘松粉。向甘松粉中加入8倍体积水,然后加入1%的重量比2:1的纤维素酶和果胶酶,控制温度45℃,ph = 5,保温反应2小时,得甘松酶解液。向甘松酶解液中加入乙醇至乙醇浓度为75%,进行超声提取,设置超声功率100w,在50℃条件下提取40 min,收集提取液,重复提取2次,合并得提取液;将所得提取液在50℃下减压浓缩至原体积的1/10 ,得浓缩液。将浓缩液经过hpd100型大孔吸附树脂进行吸附分离,先采用4倍柱体积的40%乙醇进行洗脱,再用6倍柱体积的80%乙醇进行洗脱,收集洗脱液,将洗脱液干燥得甘松提取物粗品。然后将所得甘松提取物粗品溶解到加热至沸腾的乙醇溶液中,加入粗品重量2%的活性炭吸附10分钟,趁热过滤溶液,取滤液以10 ~15℃/ min的速度快速降温至0 ~ 8℃,过滤收集重结晶产物,干燥得甘松提取物。计算甘松提取物
提取率,检测甘松提取物总黄酮含量和总黄酮中金合欢素含量。
45.(1)加酶量对制备甘松提取物的影响在上述基本工艺的基础上,分别添加质量比0%,0.025%,0.05%,0.5%,1%,2%,4%,8%的复合酶(纤维素酶:果胶酶=2:1),其它工艺条件不变,研究不同加酶量对制备甘松提取物的影响。
46.表1:不同加酶量对制备甘松提取物的影响加酶量%00.0250.050.51248提取率/%2.052.633.954.084.164.314.304.29总黄酮含量/%31.4247.6356.1757.3858.3560.0159.1559.32金合欢素含量/%2.623.385.125.375.875.965.945.89结果如表1:0-0.25% 甘松提取物提取率低,总黄酮、金合欢素含量低,在0.05-2%范围内,随着加酶量增加,提取率、高总黄酮、金合欢素含量逐步升高,继续增加到4%~8%,提取率、总黄酮含量、金合欢素含量增加不明显,综合考虑,选择加酶量0.05-2%。
47.(2)酶解温度对制备甘松提取物的影响在上述基本工艺的基础上,加入1%的重量比2:1的纤维素酶和果胶酶,分别控制温度28℃,38℃,48℃,58℃,68℃,其它工艺条件不变,研究不同酶解温度对制备甘松提取物的影响。
48.表2:不同酶解温度对制备甘松提取物的影响温度/℃2838485868提取率/%1.634.124.284.051.27总黄酮含量/%25.6050.2759.6852.1520.06金合欢素含量/%1.965.075.965.181.36结果如表2:28~48℃范围内随着温度升高,甘松提取物提取率,总黄酮含量、金合欢素含量逐渐升高,48~68℃范围内随着温度升高,甘松提取物提取率,总黄酮含量、金合欢素含量逐渐降低,最适提取温度为48℃,在38℃~58℃范围内提取率,总黄酮含量、金合欢素含量均保持在较高的水平,因此,选择反应温度38℃~58℃。
49.(3)超声功率对制备甘松提取物的影响在上述基本工艺的基础上,分别设置超声功率0w,40w,80w,120w,160w,200w,240w,280w,其它工艺条件不变,研究不同酶解温度对制备甘松提取物的影响。
50.表3:不同酶解温度对制备甘松提取物的影响超声功率/w04080120160200240280提取率/%2.853.324.024.154.274.183.622.53总黄酮含量/%32.1541.8351.3754.3759.8655.6246.2730.01金合欢素含量/%2.573.985.225.545.955.624.262.63结果如表3:不采用微波辅助提取时,甘松提取物的提取率仅为2.85%,总黄酮及金合欢素含量分别为32.15%和2.57%,均较低;在微波辅助提取功率40w-160w范围内,随着微波功率升高,提取率、总黄酮及金合欢素含量逐步升高,在160w时最高,提取率为4.27%,总黄酮及金合欢素含量分别为59.86%和5.95%,微波功率超过160w,提取率、总黄酮及金合欢素含量逐渐降低,当功率为280w时显著降低,可能时高功率破坏了黄酮结构,导致提取率及
含量均较低。因此,选择超声功率80w-200w。
51.实施例7、甘松提取物对尿酸盐转运蛋白1抑制活性采用以下方法测定甘松提取物对尿酸盐转运蛋白1吸收6-羧基荧光素(6-cfl)的抑制活性:(1)hek-293t细胞以dmem为培养基,培养基中包含10%胎牛血清(fbs)、青霉素(100 iu/ml)和链霉素(100 μg/ml)。细胞转染采用胰酶常规消化收集细胞,待细胞贴壁且密度达到70-80%左右时,通过lipofectamine 3000试剂盒进行转染。
52.(2)用0.25%胰酶将转染pcdna3.1-egfp-slc22a12质粒和未转染的293t细胞进行消化,制备成约4
×
10
4 细胞/孔的细胞悬液,每孔100 μl加入到96孔白色荧光板中,设置实验组,对照组,每组设6个复孔。
53.(3)48 h后,吸走孔内旧的培养基,以hbss(无cl-)溶液100 μl/孔清洗一次,再加入每孔100 μl的hbss溶液,放入培养箱孵育10 min。
54.(4)孵育期间,进行溶液配制。实验组:用hbss溶液配制239.5 μmol/l的6-cfl,用6-cfl溶液配制相应浓度的待测物和阳性药物,每孔体系为100 μl,超声10 min保证化合物溶解均一;对照组:加入6-cfl且不含待测化合物,每孔加入100 μl。
55.(5)培养箱孵育10 min后,吸走hbss溶液,分别加入各组配制好的相应溶液,然后放置培养箱内孵育1 h。
56.(6)1 h后,吸走孵育溶液,每孔加入37℃水浴锅恒温处理的100 μl bss溶液洗涤,共3次。每孔加入100 μl 0.1mol/l的naoh溶液,室温裂解30 min,在酶标仪中震荡5 min后,在激发和发射光分别为490 nm和525 nm的条件下进行读数。按照如下公式计算抑制率。
57.抑制率=(对照组-实验组)/(对照组-空白组)
×ꢀ
100%(7)梯度稀释甘松提取物及苯溴马隆溶液,以hbss作为空白对照,按上述方法测定样品对细胞中尿酸盐转运蛋白1吸收6-cfl的抑制率,计算ic
50
值。
58.分别测定实施例1-5制备的甘松提取物对尿酸盐转运蛋白1的抑制活性,结果见图1,由图可知,实施例1-5制备的甘松提取物均能显著地抑制尿酸盐转运蛋白1对6-cfl的吸收,抑制率最高为81.54%(实施例3制得),最低为78.20%(实施例2制得)。结果表明本发明制备的甘松提取物具有良好的尿酸盐转运蛋白1抑制活性。
59.选择实施例3制备的对尿酸盐转运蛋白1抑制活性最高的甘松提取物,分别测定不同浓度甘松提取物对尿酸盐转运蛋白1的抑制活性。结果见图2,由图可知,在1.5 ~ 2.5 mg/ml浓度范围内甘松提取物对尿酸盐转运蛋白1具有良好的抑制活性, ic
50
值为1.7 mg/ml。
60.实施例8、金合欢素的分离制备及金合欢素对尿酸盐转运蛋白1抑制活性在本实施例中,采用以下步骤从甘松提取物中分离制备金合欢素,并测定金合欢素对尿酸盐转运蛋白1吸收6-羧基荧光素(6-cfl)的抑制活性:(1)取实施例1中所得甘松提取物40g,用乙酸乙酯溶解,加入适量硅胶拌匀,用旋转蒸发仪减压蒸干,采用干法上样,进行硅胶柱层析,以二氯甲烷︰甲醇体积比30︰1的比例混合在一起作为洗脱液进行洗脱,旋干;再水溶上toyopearlhw-40,依次用体积浓度95%、75%、55%、35%含水甲醇梯度洗脱;70%洗脱部分上sephadexlh-20、ods、silicagel、mclgelchp-20柱进一步分离,结合制备高效液相和重结晶的方法分离纯化,得甘松金合欢
素1.36g。经hplc检测,所得金合欢素纯度大于99%(见图3)。
61.(2)金合欢素对尿酸盐转运蛋白1吸收6-羧基荧光素(6-cfl)的抑制活性测定方法同实施例7,不同浓度金合欢素对尿酸盐转运蛋白1活性抑制效果见图4。由图可知,金合欢素在50 ~ 150
ꢀµ
m浓度范围内对尿酸盐转运蛋白1具有良好的抑制活性,ic
50
值为57.3
ꢀµ
m。该结论进一步证实了甘松提取物具有尿酸盐转运蛋白1抑制活性。甘松提取物具有作为天然活性产物进一步开发具有尿酸盐转运蛋白1抑制活性的特殊医学用途配方食品、保健食品、功能性食品的潜力。
62.以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1