一种响应型水凝胶载药系统及其制备方法和用途
1.本发明属于生物医药领域,具体涉及一种响应型水凝胶载药系统及其制备方法和用途。
背景技术:
2.目前,慢性感染性伤口已成为当前社会最严重的影响社会经济发展和人类健康的一类疾病。皮肤慢性感染伤口的产生,主要是由于伤口愈合过程被打乱,其诱因通常包括反复的组织损伤或特定的疾病如糖尿病、恶性肿瘤、细菌感染等引起慢性感染性伤口的原因很多,如外伤、感染、糖尿病、压疮等。尤其对老年人来说,自身抵抗力弱、营养不良,更容易激发慢性感染性伤口的发生。慢性感染伤口给患者带来巨大的痛苦及经济负担,全世界范围内,与慢性伤口有关的治疗护理费用,每年超过50亿美元,细菌感染是延迟伤口愈合的重要原因。目前临床中,针对慢性感染性伤口的治疗手段极其有限,主要包括换药(定期更换清洁敷料)、手术治疗(清创)以及负压吸引装置(vac)(即将具有负压吸引功能的海绵敷料覆盖于伤口表面,持续负压吸引,持续吸出渗出液及坏死组织,起到慢性伤口修复的作用)。普通换药治疗存在治疗效果差、周期长、患者痛苦等弊端,手术治疗以及负压吸引等方式存在经济花费高、组织损伤大等问题,因此,临床中针对慢性感染伤口,亟需一种能够避免上述劣势,同时又可以有效治疗慢性感染伤口的新方法。
3.水凝胶是一种以水为分散介质的凝胶。具有交联结构的水溶性高分子中引入一部分疏水基团而形成能遇水膨胀的交联聚合物。是一种高分子网络体系。水凝胶的出现为慢性感染性伤口的治疗提供了新的实现方案。随着人们对水凝胶材料的深入研究和探索,具有可注射、可降解、自愈的水凝胶材料不断出现并且应用于各种领域。可注射水凝胶不但拥有普通水凝胶固有的优良生物相容性、渗透性、吸水性、可降解性、载药控释等特性,而且可以通过粒子间可逆的交联方式实现剪切变稀-自愈的特性实现水凝胶的可注射性能,是在慢性伤口修复中水凝胶材料的不二之选。但是,单纯的水凝胶材料应用于慢性伤口修复具有一定的局限性,仅仅起到保护伤口和保湿的作用。慢性伤口的愈合通常需要经过止血、炎症、增殖和重塑等不同的时期。因此,水凝胶材料往往还需要兼具止血、抗菌、抗炎等功能,才可以真正从多层面、多维度的协同作用,最终起到慢性感染伤口修复的作用。
4.尽管随着近年来人们对水凝胶材料的深入了解,水凝胶材料的研究百花齐放,但是,针对慢性感染性伤口治疗的“止血-抗菌-抗炎”的特定策略,真正实现有效的慢性伤口治疗的水凝胶敷料仍鲜有报道,现有的尚在研究中的诸多伤口敷料仍没有实现真正的临床应用。
5.因此,研发一种与慢性伤口愈合阶段相适应的伤口敷料材料,仍具有重要的意义与临床应用价值。
技术实现要素:
6.本发明提供了一种响应型水凝胶载药系统,它由水凝胶基体、抗菌剂、抗炎剂构
成;
7.所述水凝胶基体含有对ph和ros敏感的化学键;
8.所述抗炎剂由抗炎药物和对ph敏感的载药胶束构成,所述抗炎药物包载在载药胶束中。
9.进一步地,所述水凝胶基体、抗菌剂、抗炎剂的质量比为(70~75)∶(0.5~1)∶(0.5~1),优选为75∶1∶1。
10.进一步地,上述水凝胶基体中对ph和ros敏感的化学键为硼酸酯键、席夫碱键或离子螯合作用键,优选为硼酸酯键。
11.更进一步地,上述水凝胶基体由改性明胶和聚乙烯醇制成,所述改性明胶由交联剂和明胶制成,所述交联剂为苯硼酸或其衍生物,优选为苯硼酸衍生物3-羧基苯硼酸。
12.更进一步地,上述明胶和交联剂的质量比为(1~5)∶1,优选为2.5∶1;所述改性明胶和聚乙烯醇的质量比为(1~5)∶1,优选为2∶1。
13.进一步地,上述抗菌剂为抗生素、抗菌肽、银纳米球、银纳米簇中的至少一种,优选地,为银纳米簇和抗生素;更优选地,所述抗生素为万古霉素。
14.更进一步地,上述银纳米簇和抗生素的摩尔比例为(0.5~2)∶1,优选为1∶1。
15.进一步地,上述抗炎剂中的抗炎药物为非甾体类抗炎药,优选为阿司匹林、乙酰氨基酚、双氯芬酸、吲哚美辛、奇诺力、布洛芬、萘普生、氟比洛芬酯、美洛昔康、吡罗昔康、普洛昔康、保泰松、羟基保泰松、安乃近、塞来昔布、依托考昔和/或尼美舒利,更优选为尼美舒利;
16.上述抗炎剂中对ph敏感的载药胶束由具有ph敏感性的嵌段聚合物mpeg
45-pasp(dip)
60-pphe
30
构成,所述mpeg
45-pasp(dip)
60-pphe
30
的结构为:
[0017][0018]
更进一步地,上述抗炎剂中抗炎药物和载药胶束的质量比为1∶(5~15),优选为1∶10。
[0019]
本发明还提供了上述载药系统的制备方法,包括如下步骤:
[0020]
(1)合成改性明胶:明胶和交联剂按比例溶解于溶剂中,在缩合剂的作用下反应,得到改性明胶;
[0021]
(2)合成抗菌剂:银纳米簇与万古霉素在溶剂中,在酸性条件和缩合剂作用下反应,得到抗菌剂;
[0022]
(3)合成抗炎剂:将嵌段聚合物mpeg
45-pasp(dip)
60-pphe
30
与抗炎药物溶于有机溶剂中,再滴加到水中,得到抗炎剂;
[0023]
(4)将改性明胶溶解于水中,ph为中性条件下加入抗菌剂、抗炎剂,混匀形成溶液a;另将聚乙烯醇溶解于水中得到溶液b,将溶液a和溶液b混匀,即得。
[0024]
本发明还提供了上述的载药系统在制备止血材料、伤口敷料材料中的应用。
[0025]
本发明水凝胶载药系统具有如下有益效果:
[0026]
1、可注射,具有可塑性,针对伤口形状不规则的情况也能够实现完整覆盖,自愈能力强、价格低廉。
[0027]
2.在慢性伤口的炎性环境中(低ph和高ros)可以程序性裂解并且释放包载在其中的抗菌剂、抗炎剂体系,从而实现抗菌和抗炎的作用。
[0028]
3.慢性感染性伤口的治疗策略应当是先止血、再抗菌、再抗炎,针对这一特殊的治疗策略,本发明水凝胶以明胶作为基质材料,明胶本身具有rgd序列,可以促进红细胞和血小板粘附,很好地实现了第一步——止血;其次,在炎性环境中,水凝胶裂解,释放出其中的抗菌基和包裹抗炎药物的胶束,抗菌剂率先实现杀菌作用;包裹抗炎药物的胶束在ph低的酸性环境下裂解,释放出抗炎药物,最终实现抗炎作用;完全与慢性伤口的愈合阶段需求相适应。各活性物质协同增效,最终实现优异的促伤口修复的作用。
[0029]
本发明的术语解释:
[0030]“对ph和ros敏感的化学键”是指在特定的ph范围内或者在活性氧自由基(ros)的作用下,会发生断裂的化学键。
[0031]“对ph敏感的载药胶束”是指在特定的ph范围内会发生裂解,释放出包载的药物的胶束。
[0032]“苯硼酸或其衍生物”是指:苯硼酸以及苯硼酸结构中的氢原子或原子团被其他原子或原子团取代而衍生的产物。
[0033]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0034]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
[0035]
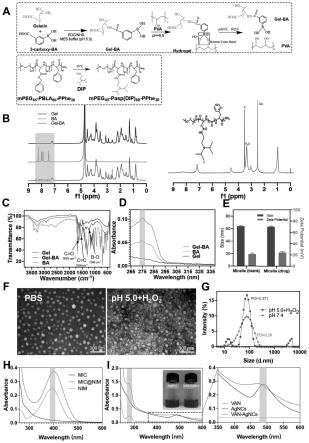
图1:a上代表了gel-ba和水凝胶制备分子图示,水凝胶通过gel-ba分子和pva分子交联形成,形成的硼酯键在ph和ros存在的条件下发生断裂。a下代表了具有ph响应的胶束制备过程,加入dip基团后,在酸性环境下,dip基团质子化,致使胶束裂解,释放出其中的nim药物;
[0036]
b为gel-ba、mpeg
45-pasp(dip)
60-pphe
30
的nmr扫描结果;c为gel-ba的ftir扫描结果(纵坐标:透射比;横坐标:波长);d为gel-ba的uv吸收峰结果(纵坐标:吸光度;横坐标:波长);e mic@nim及mic(空载的mic)的粒径和电位结果(左纵坐标:粒径,右纵坐标:电位;横坐标:胶束分组);f为mic@nim透射电镜(tem)扫描结果;g为粒径分析结果(纵坐标:密度;横坐标:粒径);h为mic@nim的uv分析结果(纵坐标:吸光度;横坐标:波长);i为van-agncs的uv分析结果(纵坐标:吸光度;横坐标:波长)。
[0037]
图2:a为加入pva前的gel-ba溶液,后位加入pva交联后的水凝胶;b为sem扫描的水凝胶内部结构;c为水凝胶的的自愈性能验证;d为水凝胶的可注射性验证;e-g为水凝胶的流变学测试结果(纵坐标:弹性模量和损耗模量;横坐标:e,角速度;f,应变;g,时间)。
[0038]
图3:a为水凝胶的溶胀性能测试结果(纵坐标:溶胀率;横坐标:时间);b为水凝胶体外降解结果(纵坐标:剩余率;横坐标:时间);c为水凝胶在不同环境下的裂解情况;d-f为不同环境下,水凝胶装载药物的体外释放结果(纵坐标:释放率;横坐标:时间)。
[0039]
图4:a为各组水凝胶和空白组体外凝血指数观察结果(纵坐标:凝血指数;横坐标:时间);b为不同组水凝胶吸附红细胞效果示意图;c为建立大鼠肝脏出血模型后各组水凝胶的止血效果示意图;d为建立大鼠肝脏出血模型后应用各组水凝胶的出血量(纵坐标:失血量;横坐标:不同组水凝胶);e为建立大鼠肝脏出血模型后应用各组水凝胶的凝血时间(纵坐标:凝血时间;横坐标:不同组水凝胶)。
[0040]
图5:a为不同组水凝胶浸提液与金黄色葡萄球菌s.aureus共培养结果(纵坐标:存活率;横坐标:不同组水凝胶),b为不同组水凝胶浸提液与绿脓杆菌p.aeruginosa共培养结果(纵坐标:存活率;横坐标:不同组水凝胶);c为不同组水凝胶培养细菌后涂板结果;d为不同组水凝胶浸提液与细菌培养后ive/dead染色结果。
[0041]
图6:a、b为不同组水凝胶溶血实验结果(纵坐标:溶血率;横坐标:不同组水凝胶);c、d、e为不同组水凝胶浸提液与l929成纤维细胞共培养后活死细胞染色和cck-8染色结果(纵坐标:生存率;横坐标:不同组水凝胶,时间);f,g为l929成纤维细胞划痕实验结果(纵坐标:爬行率;横坐标:时间)。
[0042]
图7:对照组和本发明水凝胶处理后的炎症因子表达结果。a(纵坐标:生存率;横坐标:不同组水凝胶,时间);b western-blot结果;c,d elisa及rt-pcr结果(纵坐标:表达量;横坐标:不同组水凝胶);e免疫荧光染色结果
[0043]
图8:a,b为不同时间点不同组治疗伤口愈合情况(纵坐标:伤口直径;横坐标:伤口直径);c为伤口面积计算结果(纵坐标:愈合率;横坐标:时间);d、e为伤口细菌共培养结果(纵坐标:菌落数;横坐标:不同组水凝胶)。
[0044]
图9:大鼠感染伤口组织he(a),mason(b)及免疫荧光染色结果(c)及统计结果。d上皮厚度统计(纵坐标:上皮厚度;横坐标:不同组水凝胶);e(纵坐标:胶原沉积量;横坐标:不同组水凝胶);f(纵坐标:新生血管密度;横坐标:不同组水凝胶)
具体实施方式
[0045]
除另有说明外,本发明所用原料与设备均为已知产品,通过购买市售产品所得。
[0046]
实施例1、本发明响应型水凝胶载药系统的制备
[0047]
1、明胶接枝苯硼酸(gel-ba)分子的合成
[0048]
称取5g明胶(明胶a,取自猪皮,300bloom,iep≈9)溶解于500ml mes缓冲液中。称取edc(4.8g,25mmol),nhs(1.15g,10mmol/l)和3-羧基苯硼酸(2g,12.5mmol/l)并溶解与明胶溶液中,37℃充分搅拌48h。过滤杂质后,加入透析袋持续透析3d,每天换水3-6次。透析完成后冻干,如图1a上所示。
[0049]
2、抗菌剂:银纳米簇(agncs)及万古霉素-银纳米簇复合体(van-agncs)的合成
[0050]
制备nabh4溶液(112mm),称取43mg nabh4溶解于2ml naoh溶液(1m)中,再加入8ml去离子水。同时配制并取gsh溶液(50mm)125ul和agno3溶液(20mm)125ul,溶解于4,85ml去离子水中充分搅拌。逐滴加入50ul配置完成的nabh4溶液,剧烈搅拌5分钟后静置4h,再次逐滴加入nabh4溶液50ul,剧烈搅拌5分钟后静置8h,超滤管反复离心后制得最终agncs溶液
(根据icp检测结果,浓度为1mm)。调整agncs溶液ph致5-6,加入万古霉素(van)溶液(2mm)125ul,edc(400mm)100ul,nhs(100mm)100ul,磁力搅拌2h,再次超滤离心纯化3次,制得van-agncs(根据tga结果,van与agncs摩尔比为1∶1)。
[0051]
3、抗炎剂:制备装载尼美舒利(nim)的胶束(mic@nim)的合成
[0052]
称取双亲分子mpeg
45-pbla
60-pphe
30
(购买于双桥生物公司,中国)0.3g溶解于1ml dmf溶液,加入4ml dip溶液,35℃搅拌加热24h后,充分冻干,制备具有ph响应的mpeg
45-pasp(dip)
60-pphe
30
双亲分子(图1a下)。称取20mg mpeg
45-pasp(dip)
60-pphe
30
和2mg nim溶解于1ml dmso溶液中,加热致37℃,超声搅拌同时逐滴加入10ml去离子水中,持续透析48h,直径为0.22um的滤嘴过滤后制得mic@nim。
[0053]
4、制备具有ph/ros双响应的载药水凝胶
[0054]
gel-ba分子充分溶解于去离子水中(5%w/v),调整ph为中性,加入已制备成功的van-agncs及mic@nim。溶解pva制备质量浓度为10%w/v的pva溶液。吸取相同体积的上述两种溶液充分搅拌,即刻制成水凝胶hydrogel@van-agncs&mic,gel-ba与pva形成的水凝胶基体和van-agncs、mic@nim的质量比为75∶1∶1。
[0055]
按照上述同样的方法,不加入van-agncs及mic@nim,制备得到不载药的gel-ba/pva空白水凝胶。
[0056]
以下通过实验例证明本发明的有益效果。
[0057]
实验例1、验证制备的gei-ba聚合物,van-agncs及mic@nim的理化特性
[0058]
1、实验方法
[0059]
对gel-ba聚合物进行hnmr、ftir、紫外光谱检测,对mpeg
45-pasp(dip)
60-pphe
30
进行hnmr检测,对制备的mic@nim及不载药的空载胶束mic进行粒径和电位检测、透射电镜(tem扫描)以及紫外光谱分析,对van-agncs进行紫外光谱分析。
[0060]
2、实验结果
[0061]
如图1所示。
[0062]
图1b为nmr扫描结果,说明通过酰胺反应,3-羧基苯硼酸已成功接枝于明胶分子侧链;并且已成功制备mpeg
45-pasp(dip)
60-pphe
30
双亲分子。
[0063]
图1c为ftir扫描结果,结果提示合成的gel-ba分子在c=o c=c b-o特征峰都有明显趋势,说明gel-ba分子合成成功。
[0064]
图1d为uv吸收峰结果,提示合成的gel-ba在275nm处有明显的吸收峰,提示gel-ba分子合成成功。
[0065]
图1e为制备的mic@nim及mic(空载的mic)的粒径和电位结果,结果提示装载药物后mic的粒径及电位变化不明显。粒子直径约62nm,电位+23mv。
[0066]
图1f为mic@nim透射电镜(tem)扫描结果,结果提示mic@nim在pbs(ph 7.4)中表现为均一的圆形颗粒,在酸性环境下粒子裂解,释放出装载药物。
[0067]
图1g为粒径分析结果,结果提示在中性环境下,粒子直径表现为均一的单锋(正态分布),在酸性环境下,表现为多峰(即大小分布不均);
[0068]
图1h为mic@nim的uv分析结果,结果提示装载药物后的mic@nim表现出与nim相同的特征吸收峰,提示药物装载成功。
[0069]
图1i为van-agncs的uv分析结果,结果提示van-agncs具有明显的特征峰,提示van
接枝成功。
[0070]
实验例2、验证gel-ba/pva水凝胶的理化性能及微观结构
[0071]
1、实验方法
[0072]
对实施例1的水凝胶的宏观结构、可注射性能进行验证,并且通过扫描电镜sem观察水凝胶内部结构。进一步进行流变学测试对水凝胶的流变性能进行验证。
[0073]
2、实验结果
[0074]
如图2所示。
[0075]
图2a为加入pva前的gel-ba溶液,后位加入pva交联后的水凝胶;
[0076]
图2b为sem扫描的水凝胶内部结构,说明水凝胶内部为大小均一的多孔结构;图2c证实了本发明水凝胶具有良好的自愈性能,图2d证实本发明水凝胶具有优秀的可注射性能。
[0077]
图2e-g为水凝胶的流变学结果,结果提示加入两种药物的水凝胶流变性能与空白水凝胶表现出相似的流变属性,具有良好的剪切变稀和自愈性能弹性模量可达到2000pa左右,说明抗菌剂和抗炎剂的负载不会影响本发明水凝胶的流变性质,即不会影响可注射和自愈合性能。
[0078]
实验例3、检测装载两种药物的水凝胶(hydrogel@van-agncs&mic)的溶胀、体外降解及ph/ros响应性能
[0079]
1、实验方法
[0080]
溶胀率测试:称取质量为m0的冻干水凝胶,充分浸泡于pbs溶液中,于不同时间点取出水凝胶并称重(mt),每一时间点溶胀率r=mt/m0。
[0081]
降解测试:称取质量为m0的水凝胶置于装有10ml的不同条件pbs中(ph=5及h2o2),37℃下持续摇床震荡,于不同时间点(1-7天)取出水凝胶并称重(mt),每一时间点剩余率r=mt/m0。
[0082]
体外释放测试:制备等量最终装载浓度的完全水凝胶,透析袋包裹后,置于装有10ml的不同条件pbs中(ph=5及h2o
2
),37℃下持续摇床震荡,于不同时间点取出2ml上清液并通过icp及高效液相色谱检测不同时间点agncs,万古霉素及nim的浓度,并计算释放率。
[0083]
2、实验结果
[0084]
如图3所示。从图3a可以看出,本发明实施例1的水凝胶亲水性好,在6h内快速溶胀,溶胀率达500%。降解测试结果发现,水凝胶在pbs中降解速率慢,完全降解约需要7d,但当调整ph及ros含量后,水凝胶将在3d内快速降解。水凝胶在ph及ros存在时,几乎完全裂解,呈液态(图3b、3c)。说明本发明水凝胶表现出对ph和ros很好的相应性。
[0085]
体外释药结果显示,agncs与van可以快速释放,并且释放速率相当,nim在48h内释放量明显少,并且释放速率显著减慢(图3d-f),可以证明,本发明水凝胶成功实现抗菌-抗炎的程序药物释放的效果,符合慢性伤口愈合的需求规律。
[0086]
实验例4、止血效果评估
[0087]
1、实验方法
[0088]
体外止血实验:抽取大鼠新鲜血液,制备等量水凝胶并置于孔板底部,预热后逐滴加入1ml全血于各组水凝胶表面,不同时间点pbs小心冲洗未凝固游离血液,不同时间点取上清液行540nm紫外测试吸光度,凝血指数(bci)=is/ir.is:样品吸光度;ir:对照组吸光
度。
[0089]
其余操作步骤同前,滴入全血于不同组水凝胶表面后4min,pbs充分洗涤未凝固血液,不同浓度酒精梯度脱水后,2.5%戊二醛固定10min,冷冻干燥后sem观察红细胞吸附微观结构。
[0090]
体内止血试验:取250-300g新西兰大鼠麻醉后,解剖游离肝脏下缘,切取等量肝脏下缘建立大鼠肝脏出血模型。于出血肝脏断端应用商用水凝胶gel(对照组),完全水凝胶(实验组)及不使用水凝胶(空白组)处理。于肝脏下方无菌滤纸吸附出血,并称量不同组出血量(mg),观察出血时间(s)并对比行统计分析。
[0091]
2、实验结果
[0092]
如图4所示,图4a为空白组,商用水凝胶(gel),空白水凝胶(按照实施例1所述的gel-ba/pva水凝胶制备,作为control hydrogel)及装载药物的水凝胶(实施例1制备的hydrogel@van-agncs&mic水凝胶)体外凝血指数观察结果,结果提示gel-ba/pva水凝胶具有良好的凝血特性,装载抗菌及抗炎药物后不会对水凝胶的止血效果产生影响。
[0093]
图4b为不同组水凝胶吸附红细胞效果示意图,结果提示本发明实施例1的水凝胶红细胞吸附能力较强,更有利于止血。
[0094]
图4c-e为体内研究,建立大鼠肝脏出血模型后,本发明实施例1的水凝胶止血效果最佳,出血量与凝血时间相对于其他组,显著减少。
[0095]
以上结果说明,本发明的水凝胶具有非常优异的止血效果。
[0096]
实验例5、抗菌效果评估
[0097]
1、实验方法
[0098]
取1ml相同浓度金黄色葡萄球菌(s.aures)及绿脓杆菌(p.aeruginosa)(1*106cfu/ml)于24孔板中并加入等量不同组水凝胶浸提液,充分培养12小时后,取1ml菌液行分光光度计检测od值(600nm),计算细菌存活率(细菌存活率=实验组od
600
/空白组od
600
),并取等量菌液均匀涂抹于lb培养基表面并继续培养12小时,拍照并计算菌落数。活死染色菌液细菌并于荧光显微镜下采图计算活死率。
[0099]
2、实验结果
[0100]
如图5所示,图5a~5d可以看出,装载van-agncs后的水凝胶具有良好的抗菌效果,抑菌率达90%,但仅装载抗炎药nim及空白组水凝胶抗菌效果不明显。
[0101]
上述结果说明,装载抗菌剂van-agncs的本发明水凝胶具有良好的抗菌效果。
[0102]
实验例6、生物相容性检测
[0103]
1、实验方法
[0104]
溶血实验:取大鼠全血充分离心10min并pbs洗涤,稀释3倍。取等量不同组动感水凝胶并研磨成粉末,等量稀释。取0.5ml水凝胶溶液及500ul红细胞悬液加入3ml离心管并于37℃震荡1小时,充分离心。取上清后再次离心,去除水凝胶颗粒,并将上清液与分光光度计测定540nm吸光度。0.1%triton x-100溶液为阳性对照组,pbs为阴性对照组。溶血率=(ap-ab)/(at-ab),ap为实验组上清液吸光度,at为阳性对照组吸光度,ab为阴性对照组吸光度。
[0105]
cck-8实验:培养l929细胞,并于完全培养基中加入等量不同组水凝胶浸提液,培养24及48h后,通过cck-8试剂盒检测不同水凝胶浸提液对l929细胞生存率的影响,并计算
细胞生存率。
[0106]
l929成纤维细胞划痕实验:接种l929细胞于24孔板,待融合率达90%作用,用10ul枪尖快速划过孔板制造细胞划痕,pbs冲洗后更换不同组水凝胶浸提液孵育0-48h,光镜下观察细胞爬行及划痕愈合情况,计算愈合率。
[0107]
2、实验结果
[0108]
如图6所示,从图6a、6b可以看出,相对于细胞裂解液trizon,包括本发明实施例1的水凝胶在内的其他水凝胶组具有良好的血液相容性。图6c-6e的结果可以看出,本发明水凝胶无细胞毒性,图6f、6g可以看出划痕处理后l929细胞在不同水凝胶浸提液孵育下有差异,本发明实施例1的载抗炎药物及抗菌药物的水凝胶组划痕面积显著降低,l929细胞具有最佳的爬行效果。
[0109]
上述结果说明,本发明水凝胶的生物相容性优异。
[0110]
实验例7、抗炎效果检测
[0111]
1、实验方法
[0112]
raw264.7细胞通过lps(10ug/m1)预处理2h后,加入2ml包含不同组水凝胶浸提液的完全培养基培养24h后,通过cck-8试剂盒计算细胞生存率,rt-pcr及western-blot检测抗炎因子il-10及促炎因子tnf-α基因及蛋白表达差异,elisa试剂盒检测细胞上清液上述两种细胞因子的蛋白表达量。免疫荧光染色raw 264.7细胞,观察上述两种蛋白染色结果。
[0113]
2、实验结果
[0114]
如图7所示,巨噬细胞raw264.7经过lps处理后,用不同组水凝胶浸提液孵育,后通过cck-8,western-blot,elisa,rt-pcr及免疫荧光染色鉴定抗炎因子il-10及tnf-α表达情况,结果发现本发明实施例1的水凝胶具有显著的抗炎效果。il-10表达最高,tnf-α表达显著受抑制。
[0115]
上述结果说明,本发明水凝胶具有优异的抗炎效果。
[0116]
实验例8、大鼠糖尿病慢性感染伤口治疗效果体内鉴定
[0117]
1、实验方法
[0118]
大鼠尾静脉注射链脲霉素(60μg/g)并检测血糖超过16.7mm,提示成功建立大鼠糖尿病模型,充分麻醉后,打孔器于大鼠背部皮肤打孔(直径1.2cm),于伤口中滴入金黄色葡萄球菌菌液200ul(1
×
108cfu/ml),慢性糖尿病感染性伤口模型建立完成。并于不同伤口植入不同组水凝胶模型,连续换药14天后观察大鼠慢性感染伤口修复结果,计算伤口面积,并取大鼠感染伤口组织进行he、mason及免疫荧光染色。
[0119]
其中第7天时于不同组大鼠伤口表面提取分泌物并稀释,取菌液于lb培养及表面均匀涂抹,37℃培养12小时后观察菌落并计算菌落数。
[0120]
2、实验结果
[0121]
如图8所示,图8a,8b为不同时间点不同组治疗伤口愈合情况,伤口面积计算结果如图8c,结果提示14天时本发明实施例1的水凝胶组伤口基本愈合,愈合效果显著优于其他组。通过第七天时伤口细菌培养结果(图d,e),提示装载抗炎药物后的水凝胶,伤口细菌数量明显少于其他组。
[0122]
如图9所示,第14天时,大鼠感染伤口组织he,mason及免疫荧光染色结果提示本发明实施例1的水凝胶具有良好的组织修复效果,组织内出现明显的新生血管及毛囊(图9a),
胶原沉积厚度明显高于其他组(图9b,9d,9e),促炎因子il-6级tnf-α显著低于对照组,血管内皮特异抗体vegf,cd31显著多于对照组,大量新生血管形成(图9c,9f)。
[0123]
上述结果说明,本发明水凝胶能够促进血管和毛囊生成,减少炎症反应和细菌感染,实现良好的组织修复,有效治疗创伤。
[0124]
综上,本发明提供了一种具有ph、ros响应性的可注射水凝胶载药系统,具有优异的止血效果,并且能够在慢性伤口炎性环境的刺激下,程序性裂解,实现慢性伤口的序贯性“止血-抗菌-抗炎”的效果,各活性物质协同增效,有效促进创伤修复,避免手术带来的风险和巨大的经济花费,在临床具有非常重要的应用价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1