一种Vistusertib在制备用于抗腺病毒感染的药物中的用途的制作方法
一种vistusertib在制备用于抗腺病毒感染的药物中的用途
技术领域
1.本发明属于生物医学技术领域,尤其涉及一种vistusertib在制备用于抗腺病毒感染的药物中的用途。
背景技术:
2.目前,人腺病毒(human adenovirus,hadv)属于腺病毒科的哺乳动物腺病毒属。腺病毒是一种无包膜有二十面体核衣壳的dna病毒,病毒基因组的核心是线状双链dna分子,约36kb,且其基因组是被高度浓缩包装的,并被数百个类似组蛋白的蛋白vii和类似鱼精蛋白的蛋白mu(亦称为蛋白x)组织成染色质。腺病毒的衣壳有240个六邻体蛋白(hexon),且二十面体衣壳的12个顶端是五聚体蛋白(penton)和三聚体蛋白(fiber)构成的复合物。12个fiber蛋白以penton蛋白为基底由衣壳表面伸出,fiber顶端形成头节区(knob)。penton蛋白和fiber蛋白的knob区可与细胞表面的病毒受体结合,在病毒感染细胞过程中起着非常重要的作用。较小的衣壳蛋白iiia,vi,viii和ix嵌入衣壳中,其中衣壳蛋白vi位于衣壳的内表面,并通过衣壳蛋白v将衣壳连接到包含病毒基因组的核心。衣壳中还有少量衣壳蛋白iva2参与基因组包装和腺病毒蛋白酶(avp)形成。
3.腺病毒感染可以在任何季节发生,但往往冬季和早春是病毒感染的高峰季节。基于血清中和、血凝表位、基因组序列和功能,人腺病毒分为a,b,c,d,e,f和g七个种,共57个血清型。我国流行的腺病毒类型主要有1型、3型、4型、5型、7型、11型、14型、40型、41型、55型,其中以3型和5型腺病毒流行为主。研究发现各型腺病毒除hexon,fiber,penton基因外,基因组高度保守,并且极少发生种内重组。因此有利于克服药物对腺病毒型别特异性的限制,通常针对腺病毒进入以后阶段的抗病毒药物都在腺病毒种内具有广谱抗腺病毒活性。
4.腺病毒感染有多种临床症状和疾病表现,这在很大程度上取决于腺病毒的类型,宿主的免疫状态和感染部位。腺病毒常见的感染部位包括呼吸道、角膜上皮和肠道。90%的病毒性结膜炎病例由腺病毒感染引起,通常和b、d或e型腺病毒感染有关,常以咽结膜炎或流行性角膜结膜炎(ekc)的形式出现于入伍的新兵中。b、d或e型腺病毒还常常引起急性呼吸道疾病和病毒性肺炎。呼吸道腺病毒感染的两个更严重的后果是肺炎,这在儿童中可能是致命的。以及急性呼吸窘迫综合征,在应征入伍者中更常见。a,f和g型腺病毒与胃肠道感染有关。腺病毒感染是儿童胃肠炎的主要原因,仅次于诺如病毒和轮状病毒。总体而言,腺病毒对所有人群易感,其中在感染的新生儿、儿童和免疫功能低下人群(造血干细胞和器官移植患者)中往往能造成更严重的疾病甚至死亡。
5.目前尚无批准用于治疗腺病毒感染的抗病毒药物。被批准用于治疗其他病毒感染的某些dna/rna合成抑制抗病毒药物(如西多福韦、更昔洛韦和利巴韦林)已通过拓展适应症作为试验用药用于临床治疗严重的腺病毒感染。然而,这些药物大多疗效有限且不良反应严重。因此,有必要开发其它更安全和更有效的抗腺病毒药物。
6.vistusertib(azd2014)为治疗淋巴瘤、实体瘤、小细胞肺癌、脑膜瘤和乳腺癌的潜在新型治疗剂,是一种新型且有效的mtor抑制剂,可抑制多种人类肿瘤细胞系的增殖。
vistusertib通过抑制肿瘤细胞异常激活的pi3k/akt/mtor信号通路,进而抑制肿瘤细胞的迁移、侵袭和上皮间质转化,同时还参与调控肿瘤微环境(tme)内的血管生成和免疫反应,从而使肿瘤消退。然而,目前并未发现任何关于vistusertib治疗腺病毒感染的相关报道。
7.通过上述分析,现有技术存在的问题及缺陷为:
8.(1)目前并未有关于vistusertib治疗腺病毒感染的相关报道。
9.(2)现有技术有关治疗腺病毒感染药物药效低,效果差。
技术实现要素:
10.针对现有技术存在的问题,本发明提供了一种vistusertib在制备用于抗腺病毒感染的药物中的用途。
11.本发明是这样实现的,一种vistusertib在制备用于缓解和/或预防和/或治疗腺病毒感染的药物中的用途。
12.进一步,所述vistusertib结构式如下:
[0013][0014]
进一步,所述腺病毒包括b型腺病毒adv3亚型、c型腺病毒adv5亚型。
[0015]
进一步,所述腺病毒为人腺病毒1型、3型、4型、5型、7型、11型、14型、40型、41型和55型中的一种或多种。
[0016]
进一步,所述用于缓解和/或预防和/或治疗腺病毒感染的药物通过抑制腺病毒复制的活性起作用。
[0017]
进一步,所述用于缓解和/或预防和/或治疗腺病毒感染的药物包括vistusertib和药学上可接受的载体。
[0018]
进一步,所述用于缓解和/或预防和/或治疗腺病毒感染的药物的剂型为任意一种临床可接受的口服给药剂型、注射给药剂型或外用给药剂型。
[0019]
进一步,所述用于缓解和/或预防和/或治疗腺病毒感染的药物为片剂、胶囊、颗粒剂、口服液、注射剂。
[0020]
本发明的另一目的在于提供一种vistusertib在制备腺病毒抑制剂中的用途。
[0021]
结合上述的技术方案和解决的技术问题,请从以下几方面分析本发明所要保护的技术方案所具备的优点及积极效果为:
[0022]
第一、针对上述现有技术存在的技术问题以及解决该问题的难度,紧密结合本发明的所要保护的技术方案以及研发过程中结果和数据等,详细、深刻地分析本发明技术方案如何解决的技术问题,解决问题之后带来的一些具备创造性的技术效果。具体描述如下:
[0023]
本发明针对现有技术没有腺病毒感染的抗病毒药物的现状,结合研发过程中vistusertib在vero细胞中低细胞毒性和对两种腺病毒高抗病毒活性等实验数据,提供了一种新型抗腺病毒药物-vistusertib,提供了腺病毒感染的抗病毒药物的新技术,为治疗
腺病毒感染引发疾病提供全新的疗法和更多的治疗选择。
[0024]
本发明提供了一种小分子化合物vistusertib在制备治疗腺病毒感染药物中的用途,为临床上腺病毒的治疗提供一种安全有效的小分子化合物。vistusertib在无毒性范围内能够有效地抑制腺病毒的复制,可进一步开发为治疗腺病毒感染引发疾病的药物,具有广泛的用途前景。
[0025]
本发明的vistusertib是小分子化合物,其对vero细胞的cc
50
(半数致死浓度)为4.05μm。vistusertib对两种腺病毒(adv3和adv5)都能够剂量依赖地抑制病毒复制。其在vero细胞中对adv3的ic
50
(半数抑制浓度)仅为0.02μm,对adv5的ic
50
为0.07μm。通过计算,vistusertib的选择指数(si)在adv3和adv5上分别为171.31和56.82,说明vistusertib具有广谱的抗腺病毒复制的活性。
[0026]
第二,把技术方案看做一个整体或者从产品的角度,本发明所要保护的技术方案具备的技术效果和优点,具体描述如下:
[0027]
本发明提供了一种新型抗腺病毒药物-vistusertib,弥补了现有技术没有针对腺病毒感染的抗病毒药物的技术缺陷。
[0028]
本发明的vistusertib作为研发中的新型抗肿瘤药物,顺利通过了i期临床实验,目前处在到ii期临床试验。表明该药物的安全性好。若将其适应症拓展到治疗腺病毒感染用药,其用药周期更短,预期安全性更好。
[0029]
第三,作为本发明的权利要求的创造性辅助证据,还体现在以下几个重要方面:
[0030]
(1)本发明的技术方案转化后的预期收益和商业价值为:本发明以满足临床需求为导向,聚焦核心治疗领域,立足于临床价值,药物经济学价值,产品的商业价值,具有巨大的商业价值和转化后的预期收益
[0031]
(2)本发明的技术方案填补了国内外业内技术空白:本发明提供了针对腺病毒感染的抗病毒药物的新技术。
附图说明
[0032]
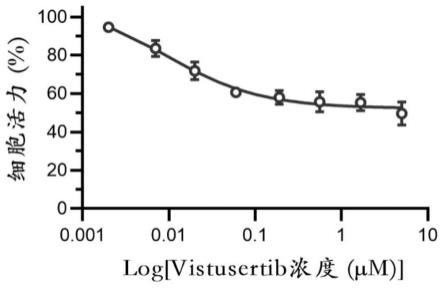
图1是本发明实施例提供的vero细胞与不同浓度梯度的vistusertib在37℃含5%co2的培养箱孵育48小时后,测定的vero细胞相对于未加药物处理细胞的细胞活力示意图;
[0033]
图2是本发明实施例提供的vero细胞中加入不同浓度梯度的vistusertib,以moi 0.55感染adv3,在37℃孵育48小时后,不同药物浓度梯度处理后vero细胞相对病毒感染后未加药物细胞的对adv3的抑制率百分比示意图;
[0034]
图3是本发明实施例提供的vero细胞中加入不同浓度梯度的vistusertib,以moi 1.1感染adv5,在37℃孵育48小时后,不同药物浓度梯度处理后vero细胞相对病毒感染后未加药物细胞的对adv5的抑制率百分比示意图。
具体实施方式
[0035]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0036]
一、解释说明实施例。为了使本领域技术人员充分了解本发明如何具体实现,该部
分是对权利要求技术方案进行展开说明的解释说明实施例。
[0037]
本发明实施例提供的vistusertib在制备用于缓解和/或预防和/或治疗腺病毒感染的药物、腺病毒抑制剂中的用途。
[0038]
本发明实施例提供的vistusertib化学结构式如下:
[0039][0040]
本发明实施例提供的腺病毒可为人腺病毒1型、3型、4型、5型、7型、11型、14型、40型、41型和55型中的任意一种或多种。
[0041]
本发明实施例提供的用于缓解和/或预防和/或治疗腺病毒感染的药物通过抑制腺病毒复制的活性起作用。
[0042]
本发明实施例提供的用于缓解和/或预防和/或治疗腺病毒感染的药物包括vistusertib和药学上可接受的载体。
[0043]
本发明实施例提供的用于缓解和/或预防和/或治疗腺病毒感染的药物的剂型为任意一种临床可接受的口服给药剂型、注射给药剂型或外用给药剂型。
[0044]
本发明实施例提供的用于缓解和/或预防和/或治疗腺病毒感染的药物为片剂、胶囊、颗粒剂、口服液、注射剂。
[0045]
二、应用实施例。为了证明本发明的技术方案的创造性和技术价值,该部分是对权利要求技术方案进行具体产品上或相关技术上的应用实施例。
[0046]
将本发明实施例提供的vistusertib用途于制备用于缓解和/或预防和/或治疗腺病毒感染的药物、腺病毒抑制剂。vistusertib在无毒性范围内能够有效地抑制腺病毒的复制,可进一步开发为治疗腺病毒感染引发疾病的药物,具有广泛的用途前景。鉴于目前尚没有用于腺病毒感染治疗的药物批准上市,本发明为腺病毒感染的治疗提供了新技术。
[0047]
三、实施例相关效果的证据。本发明实施例在研发或者使用过程中取得了一些积极效果,和现有技术相比的确具备很大的优势,下面内容结合试验过程的数据、图表等进行描述。
[0048]
本发明在非洲绿猴肾细胞系vero上检测了vistusertib对细胞的毒性,同时测定了vistusertib在vero细胞系中的对3型腺病毒(adv3),以及5型腺病毒(adv5)这两种型腺病毒的抑制作用。结果显示小分子化合物vistusertib对adv3和adv5都具有显著的剂量依赖的抗腺病毒活性。因此,本发明的vistusertib是一种新型针对腺病毒的抗病毒药物,具备安全性好、选择指数高且广谱抗腺病毒等优点,可以用于开发治疗腺病毒感染的药物,具有广阔的用途前景。
[0049]
1、实验材料:
[0050]
(1)实验所需细胞系、实验动物及病毒
[0051]
vero细胞购自美国菌种保藏中心(atcc);
[0052]
所用毒株:b型腺病毒adv3、c型腺病毒adv5。
[0053]
实验所需药物:vistusertib购自selleck chemicals公司;细胞实验时,药物用dmso溶解。
[0054]
实验所需试剂:
[0055]
dmem培养基,胎牛血清(fbs)均购自于gibco公司;
[0056]
celltiter-glo细胞增殖检测试剂盒购自promega公司。
[0057]
(2)实验所需仪器
[0058]
enspire多功能酶标仪购自perkinelmer公司;
[0059]
co2细胞培养箱购自thermo公司;
[0060]
operetta cls高内涵成像分析系统购自perkinelmer公司。
[0061]
2、实验方法
[0062]
2.1vistusertib的细胞毒性检测如下:
[0063]
(1)将非洲绿猴肾细胞系vero以2
×
104每孔铺至96孔板中,培养24h。
[0064]
(2)加入用培养基稀释成不同梯度浓度的vistusertib,于37℃含5%co2的培养箱内继续培养48h。
[0065]
(3)检测不同浓度药物处理后的细胞活力,以检测vistusertib的细胞毒性。
[0066]
(4)用graphpad以细胞相对细胞活力(cell viability)对药物浓度的对数作图,计算药物的半数细胞毒性浓度(cc
50
)。
[0067]
2.2在细胞模型中评价vistusertib对腺病毒adv3的抗病毒活性包括:
[0068]
(1)将非洲绿猴肾细胞系vero以2
×
104每孔铺至96孔板中,培养24h。为了检测其抗病毒药效,用0.55moi(感染复数)的腺病毒adv3感染vero细胞。
[0069]
(2)同时加入用培养基稀释成不同梯度浓度的vistusertib,于37℃含5%co2的培养箱内继续培养48h。
[0070]
(3)用间接免疫荧光实验(indirect immunofluorescence assay,ifa)检测药物处理组与未处理组细胞孔中感染病毒的阳性细胞数(hexon阳性细胞数),以评估不同浓度vistusertib处理后,腺病毒adv3的复制水平。
[0071]
(4)用graphpad以抑制率(inhibition rate)对药物浓度的对数作图,计算药物对腺病毒adv3的半数抑制浓度(ic
50
)。计算vistusertib在vero细胞系上对腺病毒adv3的选择指数。
[0072]
2.3在细胞模型中评价vistusertib对腺病毒adv5的抗病毒活性如下:
[0073]
1)将非洲绿猴肾细胞系vero以2
×
104每孔铺至96孔板中,培养24h。为了检测其抗病毒效果,用1.1moi(感染复数)的腺病毒adv5感染vero细胞。
[0074]
2)同时加入用培养基稀释成不同梯度浓度的vistusertib,于37℃含5%co2的培养箱内继续培养48h。
[0075]
3)用间接免疫荧光实验(indirect immunofluorescence assay,ifa)检测药物处理组与未处理组细胞孔中感染病毒的阳性细胞数(hexon阳性细胞数),以评估不同浓度vistusertib处理后,腺病毒adv5的复制水平。
[0076]
4)用graphpad以抑制率(inhibition rate)对药物浓度的对数作图,计算药物对腺病毒adv5的半数抑制浓度(ic
50
)。计算vistusertib在vero细胞系上对腺病毒adv5的选择指数。
[0077]
2.4vistusertib在vero细胞系中的细胞毒性的评价
[0078]
(1)细胞培养
[0079]
取冻存复苏后的细胞经过2次传代后,用含10%胎牛血清和双抗(青霉素100u/ml,链霉素100μg/ml)的dmem培养基扩增培养,接种密度不低于1x104cell/ml,传代密度不高于5x10
4 cell/ml。
[0080]
(2)药物处理细胞
[0081]
vero细胞按1
×
104细胞/孔(体积100μl)接种于96孔细胞培养板中,培养24h至细胞孔汇合度达到80%;用每孔200μl培养基液(dmem培养基+2%血清+双抗)配制药物,并加入相应细胞孔中混匀。药物设定8个浓度梯度,每个梯度浓度设2个复孔,其终浓度为0.002μm、0.007μm、0.02μm、0.06μm、0.19μm、0.56μm、1.67μm和5μm,于37℃含5%co2的培养箱内继续培养48h。
[0082]
(3)计算各检测孔中药物对细胞的毒性
[0083]
去除上清液,并向每个孔中加入100μl celltiter-试剂,将板在室温下孵育10分钟以稳定发光信号。用enspire酶标仪检测化学发光读数,计算细胞存活率。
[0084]
细胞存活率(%)=药物处理组/未处理对照组*100%
[0085]
结果如图1所示,vistusertib以最高浓度5μm处理vero细胞48h后,细胞活力与对照组相比有略微差别,说明vistusertib在此浓度下对细胞有轻微毒性,其半数毒性浓度cc
50
为4.05μm。
[0086]
2.5vistusertib在vero细胞系中的抗adv3腺病毒活性的评价
[0087]
(1)细胞培养
[0088]
取冻存复苏后的细胞经过2次传代后,用含10%胎牛血清和双抗(青霉素100u/ml,链霉素100μg/ml)的dmem培养基扩增培养,接种密度不低于1x104cell/ml,传代密度不高于5x10
4 cell/ml。
[0089]
(2)药物处理细胞
[0090]
vero细胞按1
×
104细胞/孔(体积100μl)接种于96孔细胞培养板中,培养24h至细胞孔汇合度达到80%;感染组加入0.55moi(感染复数)的adv3病毒,同时加入各梯度浓度的药物(以5μm为起始浓度,连续3倍梯度稀释8个梯度,每梯度两个复孔)至总体积200μl的培养液(dmem培养基+2%血清+双抗),于细胞培养箱中37℃培养48h。
[0091]
(3)间接免疫荧光法检测特异性荧光标记的病毒
[0092]
细胞培养板用细胞用pbs溶液洗涤两次,并在室温下用4%多聚甲醛(4%pfa的pbs溶液)固定20分钟。固定的样品用pbst(0.05%tween 20的pbs溶液)洗涤3次,然后在封闭缓冲液(3%bsa、0.3%triton x-100和10%fbs的pbs溶液)中室温孵育1小时。然后在针对腺病毒病毒六邻体蛋白的小鼠单克隆抗体(稀释1:200)的结合缓冲液(3%bsa,0.3%triton x-100的pbs溶液)中4℃下过夜孵育。用pbst漂洗3次后,将样品在与山羊fitc偶联的抗小鼠二抗(稀释度1:1000)和dapi(稀释度1:10000)的结合缓冲液中室温下在黑暗中孵育1小时。用pbst漂洗3次后,使用cls
tm
高内涵分析系统观察样品,然后拍摄并分析图像。
[0093]
(4)计算各检测孔中药物对病毒的抑制率
[0094]
细胞通过dapi染色标记,fitc染色强度代表病毒复制水平。在未感染的对照细胞中测量fitc背景荧光值。fitc强度超过对照细胞三倍的细胞被定义为腺病毒感染阳性细
胞。计算腺病毒感染阳性细胞在总细胞中的比率。
[0095]
抑制率(%)=100%-(药物处理孔-空白对照)/(病毒对照孔-空白对照)*100%
[0096]
结果如图2所示,vistusertib明显抑制了腺病毒adv3的复制,并且呈剂量依赖关系,其半数有效浓度ic
50
为0.02μm。
[0097]
(5)药物选择指数计算
[0098]
药物选择指数(si)用于判断药物效果的安全范围,选择指数大于3以上为有效,指数越大安全范围越大。其计算公式为:si=cc
50
/ic
50
[0099]
结合上述数据,vistusertib在vero上对腺病毒adv3的选择指数为171.31,具备有效的抗腺病毒adv3活性。
[0100]
2.6vistusertib在vero细胞系中的抗adv5腺病毒活性的评价
[0101]
(1)细胞培养
[0102]
取冻存复苏后的细胞经过2次传代后,用含10%胎牛血清和双抗(青霉素100u/ml,链霉素100μg/ml)的dmem培养基扩增培养,接种密度不低于1x104cell/ml,传代密度不高于5x10
4 cell/ml。
[0103]
(2)药物处理细胞
[0104]
vero细胞按1
×
104细胞/孔(体积100μl)接种于96孔细胞培养板中,培养24h至细胞孔汇合度达到80%;感染组加入1.1moi(感染复数)的adv5病毒,同时加入各梯度浓度的药物(以5μm为起始浓度,连续3倍梯度稀释8个梯度,每梯度两个复孔)至总体积200μl的培养液(dmem培养基+2%血清+双抗),于细胞培养箱中37℃培养48h。
[0105]
(3)间接免疫荧光法检测特异性荧光标记的病毒
[0106]
细胞培养板用细胞用pbs溶液洗涤两次,并在室温下用4%多聚甲醛(4%pfa的pbs溶液)固定20分钟。固定的样品用pbst(0.05%tween 20的pbs溶液)洗涤3次,然后在封闭缓冲液(3%bsa、0.3%triton x-100和10%fbs的pbs溶液)中室温孵育1小时。然后在针对腺病毒病毒六邻体蛋白的小鼠单克隆抗体(稀释1:200)的结合缓冲液(3%bsa,0.3%triton x-100的pbs溶液)中4℃下过夜孵育。用pbst漂洗3次后,将样品在与山羊fitc偶联的抗小鼠二抗(稀释度1:1000)和dapi(稀释度1:10000)的结合缓冲液中室温下在黑暗中孵育1小时。用pbst漂洗3次后,使用cls
tm
高内涵分析系统观察样品,然后拍摄并分析图像。
[0107]
(4)计算各检测孔中药物对病毒的抑制率
[0108]
细胞通过dapi染色标记,fitc染色强度代表病毒复制水平。在未感染的对照细胞中测量fitc背景荧光值。fitc强度超过对照细胞三倍的细胞被定义为腺病毒感染阳性细胞。计算腺病毒感染阳性细胞在总细胞中的比率。
[0109]
抑制率(%)=100%-(药物处理孔-空白对照)/(病毒对照孔-空白对照)*100%
[0110]
结果如图3所示,vistusertib明显抑制了腺病毒adv5的复制,并且呈剂量依赖关系,其半数有效浓度ic
50
为0.07μm。
[0111]
(5)药物选择指数计算
[0112]
药物选择指数(si)用于判断药物效果的安全范围,选择指数大于3以上为有效,指数越大安全范围越大。其计算公式为:si=cc
50
/ic
50
[0113]
结合上述数据,vistusertib在vero上对腺病毒adv5的选择指数为56.82,具备有效的抗腺病毒adv5活性。
[0114]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1