临床研究数据采集方法和装置、电子设备和存储介质与流程
1.本技术属于数据库技术领域,具体涉及一种临床研究数据采集方法和装置、电子设备和存储介质。
背景技术:
2.临床试验数据电子采集(electric data capture,edc)系统是适用于药物临床试验、医学随机对照试验和医学队列研究的核心信息化系统,其主要功能之一在于汇聚受试者的临床研究数据,并实现数据的存储、管理、递交等功能。目前市场上的edc系统种类繁多,通常需要由临床协调员(clinical research coordinator,crc)手动在edc系统中进行临床研究数据的录入,效率低下,无法做到实时,也容易出错,客户监察不方便。
3.公开于该背景技术部分的信息仅仅旨在增加对本技术的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
4.本技术的目的在于提供一种临床研究数据采集方法,其用于解决edc系统临床研究数据录入效率低下且容易出错的问题。
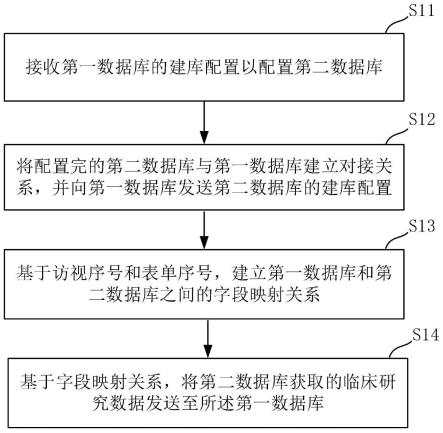
5.为实现上述目的,本技术提供了一种临床研究数据采集方法,所述方法包括:
6.接收第一数据库的建库配置以配置第二数据库,其中,所述第二数据库的配置内容包括访视、表单、字段组、字段、字典、单位;
7.将配置完的所述第二数据库与第一数据库建立对接关系,并向所述第一数据库发送所述第二数据库的建库配置;
8.基于访视序号和表单序号,建立所述第一数据库和第二数据库之间的字段映射关系;
9.基于所述字段映射关系,将所述第二数据库获取的临床研究数据发送至所述第一数据库。
10.在本技术的一个或多个实施例中,将配置完的所述第二数据库与第一数据库建立对接关系,具体包括:
11.发送所述第二数据库的对接指令至中转平台,以供所述中转平台生成对接标识和秘钥,其中,所述第一数据库基于所述对接标识和秘钥与所述第二数据库建立对接关系。
12.在本技术的一个或多个实施例中,将配置完的所述第二数据库与第一数据库建立对接关系,具体包括:
13.根据所述第二数据库的对接指令生成对接标识和秘钥;
14.将所述对接标识和秘钥发送至所述第一数据库,以供所述第一数据库与第二数据库建立对接关系。
15.在本技术的一个或多个实施例中,基于访视序号和表单序号,建立所述第一数据库和第二数据库之间的字段映射关系,具体包括:
16.基于访视序号和表单序号,确定所述第一数据库和第二数据库之间的字段映射顺序;
17.以字段的对象标识符为映射标识,并基于所述字段映射顺序,建立所述第一数据库和第二数据库之间的字段映射关系。
18.在本技术的一个或多个实施例中,接收第一数据库的建库配置以配置第二数据库,具体包括:
19.基于所述第一数据库的建库配置以对所述第二数据库进行通用配置和专用配置,其中,所述通用配置包括试验类别和访视组别的创建、字典保存、表单定义保存和字段组字段增量保存、访视任务全量更新、以及访视流程全量更新或新增。
20.在本技术的一个或多个实施例中,基于所述字段映射关系,将所述第二数据库获取的临床研究数据发送至所述第一数据库,具体包括:
21.预处理所述第二数据库获取的临床研究数据为标准格式,其中,所述标准格式为所述第一数据库认可的数据格式;
22.基于所述字段映射关系,将预处理后的所述临床研究数据发送至中转平台,其中,所述第一数据库从所述中转平台接收预处理后的所述临床研究数据。
23.在本技术的一个或多个实施例中,所述第一数据库的建库配置为odm文件格式。
24.本技术还提供一种临床研究数据采集装置,所述临床研究数据采集装置包括:
25.配置模块,用于接收第一数据库的建库配置以配置第二数据库,其中,所述第二数据库的配置内容包括访视、表单、字段组、字段、字典、单位;
26.对接模块,用于将配置完的所述第二数据库与第一数据库建立对接关系,并向所述第一数据库发送所述第二数据库的建库配置;
27.映射关系建立模块,用于基于访视序号和表单序号,建立所述第一数据库和第二数据库之间的字段映射关系;
28.数据发送模块,用于基于所述字段映射关系,将所述第二数据库获取的临床研究数据发送至所述第一数据库。
29.本技术还提供一种电子设备,包括:
30.至少一个处理器;以及
31.存储器,所述存储器存储指令,当所述指令被所述至少一个处理器执行时,使得所述至少一个处理器执行如上所述的临床研究数据采集方法。
32.本技术还提供一种机器可读存储介质,其存储有可执行指令,所述指令当被执行时使得所述机器执行如上所述的临床研究数据采集方法。
33.与现有技术相比,根据本技术的临床研究数据采集方法,通过基于第一数据库的建库配置对第二数据库进行访视、表单、字段组、字段、字典、单位的配置,并建立第一数据库和第二数据库的对接关系,第一数据库和第二数据库进而可以基于访视序号和表单序号建立字段映射关系,这样,第二数据库获取的临床研究数据可以发送至第一数据库,以实现edc系统对临床研究数据的采集。
34.在另一个方面,第二数据库可以与院内、院外随访以及研究病历等数据进行对接,实时地将这些数据基于字段映射关系传输至第一数据库,提高edc系统对临床研究数据采集的时效性,在提高数据采集效率的同时降低数据录入成本。
附图说明
35.图1是根据本技术一实施例临床研究数据采集方法和装置的应用场景示意图;
36.图2是根据本技术一实施例临床研究数据采集方法的流程图;
37.图3是根据本技术一实施例临床研究数据采集方法的交互图;
38.图4是根据本技术一实施例临床研究数据采集方法中,第一数据库和第二数据库的字段映射顺序图;
39.图5是根据本技术一实施例临床研究数据采集装置的模块图;
40.图6是根据本技术一实施方式电子设备的硬件结构图。
具体实施方式
41.以下将结合附图所示的各实施方式对本技术进行详细描述。但该等实施方式并不限制本技术,本领域的普通技术人员根据该等实施方式所做出的结构、方法、或功能上的变换均包含在本技术的保护范围内。
42.本技术的说明书和权利要求书及上述附图中的术语“第一”、“第二”、“第三”、“第四”等(如果存在)是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本技术的实施例例如能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“对应于”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
43.药物的临床试验指的是在人体进行的药物系统性研究,以确定药物的疗效和安全性。药物临床试验阶段分为i期、ii期、iii期临床试验、iv期临床试验。i期主要是涉及初步的临床药理学及人体安全性评价试验。ii期可以理解为治疗作用初步评价阶段,主要涉及初步评价药物对目标适应症患者的治疗作用和安全性,也包括为iii期临床试验研究设计和给药剂量方案的确定提供依据。iii期可以理解为治疗作用确证阶段,主要进一步验证药物对目标适应症患者的治疗作用和安全性,评价利益与风险关系,最终为药物注册申请的审查提供充分的依据。iv期主要是药物上市后的临床试验,在药物上市后,可以继续追踪在广泛使用条件下的药物的疗效和不良反应,以评价在普通或者特殊人群中使用的利益与风险关系以及改进给药剂量等。
44.在临床试验过程中,会产生大量的临床研究数据,包括院内、院外随访以及研究病历等数据。以院内数据为例,可以包括实验室信息管理系统(laboratory information management system,lis)、医院信息系统(hospital information system,his)、医学影像存档与通讯系统(picture archiving and communication systems,pacs)、放射信息管理系统(radioiogy information system,ris)等系统数据。
45.参图1,在本技术的一个应用场景中,可以针对这些临床研究数据提供一个统一的数据管理系统,该数据管理系统可以与不同的edc系统进行对接,并将临床研究数据自动地发送至edc系统中,以实现edc系统对这些临床研究数据的采集。其中,临床研究数据可以是被该数据管理软件实时或按照指定的周期进行抓取,又或者,临床研究数据可以是按照需求被转移存储至数据管理系统配置的存储空间。
46.参图2,介绍本技术临床研究数据采集方法的一实施例。在本实施例中,该方法包括:
47.s11、接收第一数据库的建库配置以配置第二数据库。
48.配合参图3,第一数据库可以对应于edc系统,edc系统在完成第一数据库的建库后,可以将建库配置以设定的格式导出。
49.一实施例中,这里导出的第一数据库的建库配置为操作数据模型(operational data model,odm)文件格式。odm是cdisc(the clinical data interchange standardsconsortium,临床数据交换标准协会)公布的标准之一。临床试验数据的规范化和标准化可推动和提高实际工作的效率和可靠性,因此,若干生物技术和药物开发公司组建了cdisc。odm是基于xml,用于获取、交换、报告或递交,以及对基于病例报告表(crf)的临床研究数据归档的内容和格式标准。
50.第二数据库可以对应于数据管理系统,数据管理系统可以导入上述第一数据库的建库配置以进行第二数据库的配置。对于临床研究数据而言,这里第一数据库和第二数据库的配置内容可以都包括访视、表单、字段组、字段、字典、单位等。
51.以一个临床试验项目(study)为例,会涉及多个受试者(subject),每个受试者都会有多个访视周期(event),每个访视周期下会产生多个表单(form)的数据,每个表单下可能会有一个或多个字段组(itemgroup),每个字段组下对应到具体的字段(item);对于每个字段而言,其可以有对应的说明信息,说明信息可以包括在edc系统界面上展示的名称、数据类型、字段的含义、字段对应的业务规则以及字段在导出表中的呈现方式等,例如,可以从药物警戒专业书籍、药物警戒工作的标准作业程序(standard operating procedure,sop)文件等资料中提取字段以及对应的解释信息,这样的信息被称为字典。而上述的这些内容组合起来可以成为一条完整的临床研究数据(clinical data)。
52.可以看出,通过对访视、表单、字段组、字段、字典、单位等的配置,可以构建数据库对临床研究数据的承载基础。
53.在具体的配置过程中,可以基于第一数据库的建库配置以对第二数据库进行通用配置和专用配置。
54.通用配置包括试验类别和访视组别的创建、字典保存、表单定义保存和字段组字段增量保存、访视任务全量更新、以及访视流程全量更新或新增。其中,对于不同的配置内容可能会存在相同的配置字段,故在进行字段组字段的配置时,并不执行全量的更新,而只在对应配置内容中进行增量保存。
55.例如,在试验类别和访视组别的创建中,可以包括对第一数据库的建库配置中单位的导入。具体的单位导入的元素对应关系如表i。
56.表i
57.第一数据库第二数据库oid单位oidname单位名称translatedtext单位项的值=单位项的符号
58.字典保存中字典导入的元素对应关系如表ii。
59.表ii
60.第一数据库第二数据库oid字典oidname字典名称datatype不处理sasformatname不处理codedvalue字典项值ordernumber字典项排序translatedtext字典项名称
61.表单定义保存和字段组字段增量保存包括表单定义导入、字段组关键字导入、字段组定义导入、字段关键字导入、字段定义导入、以及数据类型导入。
62.表iii:表单定义导入的元素对应关系。
[0063][0064]
表iv:字段组关键字导入的元素对应关系。
[0065][0066][0067]
表v:字段关键字导入的元素对应关系。
[0068][0069]
表vi:字段关键字导入的元素对应关系。
[0070][0071]
表vii:字段定义导入的元素对应关系。
[0072][0073][0074]
表viii:数据类型导入的元素对应关系。
[0075][0076][0077]
表ix:访视任务导入的元素对应关系。
[0078][0079]
可以看出,以上的通用配置可以是基于第一数据库的建库配置的一部分。在对第二数据库进行通用配置后,还可以基于第一数据库的建库配置的剩余部分,对第二数据库进行专用配置。
[0080]
s12、将配置完的所述第二数据库与第一数据库建立对接关系,并向所述第一数据库发送所述第二数据库的建库配置。
[0081]
在一实施例中,第二数据库可以是通过一个中转平台与第一数据库建立对接关系。
[0082]
具体地,可以发送第二数据库的对接指令至该中转平台,中转平台可以根据接收到的对接指令生成对接标识和秘钥。对接标识用于供第一数据库“识别”与其对接的对象,而秘钥可以保证只有被允许的数据库与第二数据库建立对接关系。中转平台将对接标识和秘钥发送至第一数据库后,第一数据库基于该对接标识和秘钥与第二数据库建立对接关系。
[0083]
在这样的实施例中,通过一个中转平台作为两个系统数据库之间的对接媒介,且该中转平台可以适配于多种不同系统之间的对接,使得软件产品的开发模块化且适应不同场景。
[0084]
在一实施例中,第二数据库也可以是不通过中转平台而直接与第一数据库建立对接关系。
[0085]
在这样的实施例中,相当于将上一实施例中的中转平台的功能集成在第二数据库对应的系统(例如数据管理系统)中。也即,可以根据第二数据库的对接指令直接生成对接标识和秘钥,并将该对接标识和秘钥发送至第一数据库,以供第一数据库与第二数据库建立对接关系。
[0086]
在建立对接关系时,还会向第一数据库发送第二数据库的建库配置。第二数据库的建库配置基于上述的访视、表单、字段组、字段、字典、单位等建库内容形成。由于在本技术的应用场景中,是基于第二数据库对应的数据管理系统进行临床研究数据的获取,这些临床研究数据会先被处理成第二数据库可承载的存储结构,通过将第二数据库的配置回传
给第一数据库,可以使第一数据库获得对第二数据库传输的临床研究数据的识别能力。
[0087]
s13、基于访视序号和表单序号,建立所述第一数据库和第二数据库之间的字段映射关系。
[0088]
在临床试验中,会设计临床试验方案(protocol)描述试验的目的、设汁、方法学、统计学和组织实施等内容。临床试验方案详细描述了应当如何实施一项临床试验,如应入组某种类型的患者(入组/排除标准)、试验的设计和目的、如何服用试验用药品、怎样进行数据分析以及如何处理不良反应等。以下的表x示范了临床实验方案中一种常见的研究流程图。
[0089]
表x。
[0090][0091][0092]
表x中包括了基线、访视日期(1周、2周、4周、8周)以及最终步骤等周期访视信息,每次访视下会对应有对应的访视任务,例如人口统计/医疗史、伴随治疗、血常规、皮损计数、总体改进、不良事件以及生活质量等。对于每次访视下的访视任务,都会有对应的表单以记录相关的具体检查项等。
[0093]
示范性地,访视序号可以是依照这里周期访视的信息确定,例如,按照基线-1周-2周-4周-8周-最终步骤的先后顺序,确定各访视对应的序号。对应地,表单序号可以是依照每次访视下的访视任务确定,例如,按照人口统计/医疗史-伴随治疗-血常规-皮损计数-总体改进-不良事件以-生活质量的先后顺序,确定各访视任务对应的表单序号。
[0094]
当然,在本技术的实施例中,访视序号和表单序号的确定可以是不以上述示范的研究流程图的信息而确定。也即,访视序号和表单序号可以是按照各自预设的规则而确定,而不需要具有“根据研究流程图的信息再确定相应序号”的步骤。
[0095]
基于访视序号和表单序号,可以确定第一数据库和第二数据之间的字段映射顺序。例如,对于血常规对应的字段而言,其可能出现在多张表单中(不同时间点),而表单又
可能出现在多个访视下,通过访视序号和表单序号的二维顺序定位,可以为多个血常规对应的字段进行排序,以此类推,可以确定第一数据库和第二数据之间所有字段的映射顺序。
[0096]
配合参图4,例如依照上述的示范确定了访视1至访视m、以及表单1至表单n。则访视1-表单1确定第一个映射的血常规字段:字段映射1,访视1-表单2确定第二个映射的血常规字段:字段映射2,以此类推,直至第m*n个映射的血常规字段:字段映射m*n。
[0097]
一实施例中,在第一数据库和第二数据库之间的映射关系建立中,可以选择字段的对象标识符(object identifier,oid)为映射标识,并基于确定的字段映射顺序建立。
[0098]
s14、基于所述字段映射关系,将所述第二数据库获取的临床研究数据发送至所述第一数据库。
[0099]
对于数据管理系统而言,第二数据库获取的临床研究数据可能来自院内、院外随访和研究病历等多种途径,这些数据的格式可能并不被采集方(例如edc系统)的第一数据库所认可。以时间信息为例,数据管理系统获取的原始时间数据可能为“日期:2020年12月25日,时间:17点52分”,而对应到edc系统中,时间信息是以时间戳的形式进行保存。因此,数据管理系统会先将第二数据库获取的临床研究数据进行预处理,以转换成数据采集方的第一数据库认可的数据格式,也即标准格式。
[0100]
一实施例中,可以基于字段映射关系,将预处理后的临床研究数据发送至中转平台,中转平台可以对数据执行预览等操作,随后通过中转平台将临床研究数据间接发送至第一数据库。
[0101]
当然,在替换的实施例中,数据管理系统也可以是将第二数据库获取的临床研究数据预处理后,直接发送至第一数据库,而不必经过中转平台的转发。
[0102]
参图5,介绍本技术临床研究数据采集装置的一实施例。在本实施例中,该临床研究数据采集装置包括配置模块21、对接模块22、映射关系建立模块23以及数据发送模块24。
[0103]
配置模块21用于接收第一数据库的建库配置以配置第二数据库,其中,第二数据库的配置内容包括访视、表单、字段组、字段、字典、单位;对接模块22用于将配置完的第二数据库与第一数据库建立对接关系,并向第一数据库发送第二数据库的建库配置;映射关系建立模块23用于基于访视序号和表单序号,建立第一数据库和第二数据库之间的字段映射关系;数据发送模块24用于基于字段映射关系,将第二数据库获取的临床研究数据发送至第一数据库。
[0104]
一实施例中,对接模块22具体用于发送第二数据库的对接指令至中转平台,以供中转平台生成对接标识和秘钥,其中,第一数据库基于对接标识和秘钥与第二数据库建立对接关系。
[0105]
一实施例中,对接模块22具体用于根据第二数据库的对接指令生成对接标识和秘钥;以及将对接标识和秘钥发送至第一数据库,以供第一数据库与第二数据库建立对接关系。
[0106]
一实施例中,映射关系建立模块23具体用于基于访视序号和表单序号,确定第一数据库和第二数据库之间的字段映射顺序;以及以字段的对象标识符为映射标识,并基于字段映射顺序,建立第一数据库和第二数据库之间的字段映射关系。
[0107]
一实施例中,配置模块21具体用于基于第一数据库的建库配置以对第二数据库进行通用配置和专用配置,其中,通用配置包括试验类别和访视组别的创建、字典保存、表单
定义保存和字段组字段增量保存、访视任务全量更新、以及访视流程全量更新或新增。
[0108]
一实施例中,数据发送模块24具体用于预处理第二数据库获取的临床研究数据为标准格式,其中,标准格式为第一数据库认可的数据格式;以及基于字段映射关系,将预处理后的临床研究数据发送至中转平台,其中,第一数据库从中转平台接收预处理后的临床研究数据。
[0109]
一实施例中,配置模块21具体用于接收第一数据库odm文件格式的建库配置以配置第二数据库。
[0110]
如上参照图1到图4,对根据本说明书实施例临床研究数据采集方法进行了描述。在以上对方法实施例的描述中所提及的细节,同样适用于本说明书实施例的临床研究数据采集装置。上面的临床研究数据采集装置可以采用硬件实现,也可以采用软件或者硬件和软件的组合来实现。
[0111]
图6示出了根据本说明书的实施例的电子设备的硬件结构图。如图6所示,电子设备30可以包括至少一个处理器31、存储器32(例如非易失性存储器)、内存33和通信接口34,并且至少一个处理器31、存储器32、内存33和通信接口34经由总线35连接在一起。至少一个处理器31执行在存储器32中存储或编码的至少一个计算机可读指令。
[0112]
应该理解,在存储器32中存储的计算机可执行指令当执行时使得至少一个处理器31进行本说明书的各个实施例中以上结合图1-图4描述的各种操作和功能。
[0113]
在本说明书的实施例中,电子设备30可以包括但不限于:个人计算机、服务器计算机、工作站、桌面型计算机、膝上型计算机、笔记本计算机、移动电子设备、智能电话、平板计算机、蜂窝电话、个人数字助理(pda)、手持装置、消息收发设备、可佩戴电子设备、消费电子设备等等。
[0114]
根据一个实施例,提供了一种比如机器可读介质的程序产品。机器可读介质可以具有指令(即,上述以软件形式实现的元素),该指令当被机器执行时,使得机器执行本说明书的各个实施例中以上结合图1-图5描述的各种操作和功能。具体地,可以提供配有可读存储介质的系统或者装置,在该可读存储介质上存储着实现上述实施例中任一实施例的功能的软件程序代码,且使该系统或者装置的计算机或处理器读出并执行存储在该可读存储介质中的指令。
[0115]
在这种情况下,从可读介质读取的程序代码本身可实现上述实施例中任何一项实施例的功能,因此机器可读代码和存储机器可读代码的可读存储介质构成了本说明书的一部分。
[0116]
可读存储介质的实施例包括软盘、硬盘、磁光盘、光盘(如cd-rom、cd-r、cd-rw、dvd-rom、dvd-ram、dvd-rw、dvd-rw)、磁带、非易失性存储卡和rom。可选择地,可以由通信网络从服务器计算机上或云上下载程序代码。
[0117]
本领域技术人员应当理解,上面公开的各个实施例可以在不偏离发明实质的情况下做出各种变形和修改。因此,本说明书的保护范围应当由所附的权利要求书来限定。
[0118]
需要说明的是,上述各流程和各系统结构图中不是所有的步骤和单元都是必须的,可以根据实际的需要忽略某些步骤或单元。各步骤的执行顺序不是固定的,可以根据需要进行确定。上述各实施例中描述的装置结构可以是物理结构,也可以是逻辑结构,即,有些单元可能由同一物理客户实现,或者,有些单元可能分由多个物理客户实现,或者,可以
由多个独立设备中的某些部件共同实现。
[0119]
以上各实施例中,硬件单元或模块可以通过机械方式或电气方式实现。例如,一个硬件单元、模块或处理器可以包括永久性专用的电路或逻辑(如专门的处理器,fpga或asic)来完成相应操作。硬件单元或处理器还可以包括可编程逻辑或电路(如通用处理器或其它可编程处理器),可以由软件进行临时的设置以完成相应操作。具体的实现方式(机械方式、或专用的永久性电路、或者临时设置的电路)可以基于成本和时间上的考虑来确定。
[0120]
上面结合附图阐述的具体实施方式描述了示例性实施例,但并不表示可以实现的或者落入权利要求书的保护范围的所有实施例。在整个本说明书中使用的术语“示例性”意味着“用作示例、实例或例示”,并不意味着比其它实施例“优选”或“具有优势”。出于提供对所描述技术的理解的目的,具体实施方式包括具体细节。然而,可以在没有这些具体细节的情况下实施这些技术。在一些实例中,为了避免对所描述的实施例的概念造成难以理解,公知的结构和装置以框图形式示出。
[0121]
本公开内容的上述描述被提供来使得本领域任何普通技术人员能够实现或者使用本公开内容。对于本领域普通技术人员来说,对本公开内容进行的各种修改是显而易见的,并且,也可以在不脱离本公开内容的保护范围的情况下,将本文所对应的一般性原理应用于其它变型。因此,本公开内容并不限于本文所描述的示例和设计,而是与符合本文公开的原理和新颖性特征的最广范围相一致。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1