靶向递送重楼皂苷I的细胞膜仿生纳米粒、制备及其应用
靶向递送重楼皂苷i的细胞膜仿生纳米粒、制备及其应用
技术领域
1.本发明涉及生物材料技术领域。更具体地,涉及一种靶向递送重楼皂苷i 的细胞膜仿生纳米粒、制备及其应用。
背景技术:
2.恶性肿瘤已被认为开发了多种逃避免疫检测的机制,该机制与肿瘤免疫抑制微环境密切相关。cgas-sting通路最初作为细胞内的dna模型识别受体被报道,近些年来的研究表明cgas-sting通路在抗肿瘤免疫反应过程中同样发挥着至关重要的作用。一方面,肿瘤细胞可通过sting信号通路的失活来逃逸免疫应答,另一方面,当激活肿瘤细胞中的cgas-sting信号通路时,可诱导i型ifn等细胞因子的表达,促进dc和t细胞等免疫细胞的成熟、迁移和活化,进而启动抗肿瘤免疫。此外,一些能够特异诱导激活 cgas-sting通路的纳米载体或者有机物也能够通过dc介导抗肿瘤免疫反应。比如研究发现,锰离子(mn
2+
)可使细胞中的cgas-sting通路处于超活化的状态,同时mn
2+
又可作为纳米递送系统的免疫佐剂,可被远端的 dc、巨噬细胞和淋巴细胞摄取,促进dc成熟为抗原提呈细胞,提高肿瘤中 cd8
+
阳性t细胞的浸润。
3.重楼皂苷i(ppi)是重楼中含量最大的皂苷,味苦,性微寒,有小毒,具有清热解毒、消肿镇痛、止血抗炎、抗肿瘤和免疫调节的功效。迄今为止,有研究表明,重楼皂苷ⅱ和重楼皂苷ⅲ有明确的抗乳腺癌作用,但重楼皂苷i的抗乳腺癌作用尚未有研究报道,并且重楼皂苷i发挥免疫调节作用与 cgas-sting通路的相关性也未有报道。虽然重楼有效成分ppi的抗癌效果得到了广泛的关注,但是临床使用不便,究其原因,很大程度上受到了其自身理化性质的限制,因其几乎不溶于水,体内代谢快,生物利用度很低,并且其在体内无选择性分布,绝大部分药物不能够真正到达肿瘤组织,这也是受限于临床应用的主要原因。
4.近年来,随着纳米技术在医学领域的广泛应用,可以克服中药单体药代动力学差、渗透性低、易被机体快速清除的特点,将药物运输至靶器官,再通过对药物的缓释作用,达到对病灶的持久高效治疗。其中,锰基金属有机骨架(mn-mof)纳米粒因其高载药量、可控释药等特点而受到越来越多的关注,并且可具有释放mn
2+
的特性,从而激活cgas-sting通路,被广泛的用于癌症治疗领域。同时,研究发现当利用生物仿生技术,即用具有生物活性的红细胞膜(rbc)包被载药纳米粒,用于体内抗肿瘤治疗时,可显著提高其生物相容性和体内有效循环时间,增加免疫应答频率,重塑肿瘤免疫抑制微环境,并产生免疫“热”乳腺肿瘤基因,最终促进乳腺癌治疗。
5.因此,设计开发一种生物利用度高、水溶性好、靶向性好、可激活 cgas-sting通路的重楼皂苷i纳米药物以解决上述问题。
技术实现要素:
6.基于以上缺陷,本发明的第一个目的在于提供一种靶向递送重楼皂苷i 的细胞膜仿生纳米粒。经过mn-mof负载的重楼皂苷i克服了传统药物溶解度低、毒性大等问题,有效
提高了重楼皂苷i的生物利用度,增强了疗效,实现了纳米药物在肿瘤组织的聚集,发挥了mn
2+
与重楼皂苷i协同激活cgas
‑ꢀ
sting通路的目的,并且在红细胞膜的包裹下,实现了生物伪装,可进一步提高其生物相容性和体内循环时间。
7.本发明的第二个目的在于提供一种制备细胞膜仿生纳米粒的方法。
8.本发明的第三个目的在于提供一种利用如上细胞膜仿生纳米粒在制备抗肿瘤药物中的应用。
9.本发明的第四个目的在于提供一种利用如上细胞膜仿生纳米粒在制备激活cgas-sting通路的药物中的应用。该细胞膜仿生纳米粒制备的抗癌药物是通过激活cgas-sting通路的方式来免疫杀伤癌细胞的。
10.为达到上述第一个目的,本发明采用下述技术方案:
11.本发明公开一种靶向递送重楼皂苷i的细胞膜仿生纳米粒,所述细胞膜仿生纳米粒由外壳和所述外壳包覆的内核组成,所述外壳为红细胞膜,所述内核为载药纳米粒,所述药物成分为重楼皂苷i,所述纳米粒载体选自mn
‑ꢀ
mof。
12.本发明提供的一种新型细胞膜仿生纳米粒具有多种功能,用以解决重楼皂苷i单体水溶性差、生物利用度低、疗效差、毒性大、靶向性差、代谢快等问题。首先,通过将重楼皂苷i负载在mn-mof纳米粒载体上,克服了传统药物的诸多问题,一旦进入癌细胞及癌组织时,由于周围环境的ph值是在酸性范围内,可导致抗癌药物重楼皂苷i的快速释放,并且还将红细胞膜包裹mn-mof纳米粒载体,实现了生物伪装,对于纳米药物的疗效和生物利用度均是有利的,可以明显提高药物的药学效应。其次是该新型细胞膜仿生纳米粒能够在水溶液中通过自组装的方式形成纳米尺寸的药物,这种纳米尺寸的药物可以通过肿瘤组织的高通透性及高保留性效应(epr)蓄积在肿瘤组织中,从而实现被动靶向的作用。更重要的是,发明人还发现重楼皂苷i与mn
‑ꢀ
mof结合后,可产生协同作用,增强激活cgas-sting通路的效果,增加 cd8
+
阳性t细胞的浸润,避免了肿瘤细胞的免疫逃逸,进而发挥免疫治疗的作用。
13.进一步,所述纳米粒载体的粒径为80
±
20nm;得到的细胞膜仿生纳米粒为球形,平均粒径为80
±
20nm,在纳米粒载体选择时,也可以选用其他含锰的多孔材料,在mn
2+
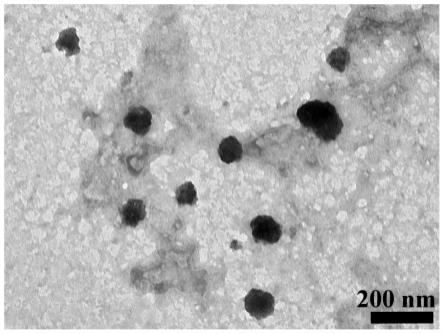
可激活cgas-sting通路的前提下,其治疗癌症效果也是很好的。
14.为达到上述第二个目的,本发明采用下述技术方案:
15.本发明提供一种制备如上细胞膜仿生纳米粒的方法,包括如下步骤:
16.s1、将mncl2·
4h2o、聚乙烯吡咯烷酮溶于溶剂中,加入naoh水溶液,再加入重楼皂苷i混合均匀,得溶液a;
17.s2、将二甲基咪唑溶于水溶液中,加naoh水溶液,得到溶液b;
18.s3、将溶液a和溶液b混合后,磁力搅拌充分反应,得到负载有重楼皂苷i的锰基金属有机框架mn-mof/ppi;
19.s4、将负载有重楼皂苷i的锰基金属有机框架与红细胞膜超声融合,过膜,离心,得到细胞膜仿生纳米粒rbc@mn-mof/ppi。
20.进一步,所述四水合氯化锰、聚乙烯吡咯烷酮、二甲基咪唑和重楼皂苷i 的摩尔比为:400-500:1:2700-3300:15-20;所述mn-mof/ppi和红细胞膜的质量比为20:1。
21.进一步,溶液a中mncl2·
4h2o的浓度为4-12mg/ml,溶液a中用 naoh调ph到10。
22.进一步,溶液b中二甲基咪唑的浓度为10-30mg/ml,溶液b中用 naoh调ph到10。
23.进一步,所述磁力搅拌的转速为500-5000rpm,反应时间为10-60min;当转速为700rpm,反应时间20分钟时制备得到的mn-mof/ppi效果最好。
24.进一步,所述超声处理条件为功率100w,频率为35-45khz的超声处理 5-10min,过膜是采用膜孔径为200nm的多孔过滤器过滤20-30次。
25.在一个具体实施方式中,步骤4每次进行离心洗涤操作时,转速控制在 4000-40000转/分之间,优选6000-10000转/分钟,洗涤的溶剂可以选用甲醇和水。
26.进一步,在红细胞膜的制备过程中可采用常规技术得到,其中一种方式为取新鲜动物全血,分别用预冷的pbs(1x)除去血浆、白细胞层,进行多次离心洗涤,直至上清液没有颜色,再将沉淀物置于预冷的pbs(0.25x) 中,使红细胞充分溶血,进行多次离心洗涤,去除血红蛋白,得到浅粉色红细胞膜。
27.为达到上述第三个目的,本发明提供一种利用如上细胞膜仿生纳米粒在制备抗肿瘤药物中的应用。
28.进一步,本发明提供一种利用如上所述细胞膜仿生纳米粒在制备乳腺癌肿瘤治疗药物中的应用。
29.为达到上述第四个目的,本发明提供一种利用如上细胞膜仿生纳米粒在制备激活cgas-sting通路的药物中的应用。
30.本发明的有益效果如下:
31.本发明利用mn-mof高的比表面积和孔隙率、重楼皂苷i和mn
2+
的协同效应以及红细胞膜仿生的特点成功制备出一种细胞膜仿生纳米粒rbc@mn
‑ꢀ
mof/ppi,可有效改善药物单体重楼皂苷i水溶性差、生物利用度低、疗效差、毒性大、靶向性差、代谢快等问题,其具备以下优势:
32.(1)水溶性好:该纳米粒采用锰基金属有机框架为纳米粒载体,较高的比表面积和孔隙率使重楼皂苷i负载在纳米粒载体上,改善了水溶解性差的问题,同时,再结合红细胞膜仿生技术,进一步提高了药物的溶解性。
33.(2)可控释放:由于纳米粒载体mn-mof具有酸敏感的肿瘤微环境响应特征,提高了纳米粒对药物成分的控制释放能力,减小重楼皂苷i的全身毒副作用。
34.(3)协同激活cgas-sting通路:重楼皂苷i与纳米粒载体mn-mof释放的mn
2+
可协同激活cgas-sting通路,增加cd8
+
阳性t细胞的浸润,避免了肿瘤细胞的免疫逃逸,进而发挥免疫治疗的作用。
35.(4)高生物安全性:所得的纳米粒具有优良的生物相容性,具有良好的抗肿瘤效果。
36.(5)治疗机制互补:该纳米粒提供的免疫治疗可与其他治疗方式实现治疗机制互补。
37.(6)靶向性强:该细胞膜仿生纳米粒能够在水溶液中通过自组装的方式形成纳米尺寸的药物,这种纳米尺寸的药物可以通过肿瘤组织的高通透性及高保留性效应(epr)蓄积在肿瘤组织中,从而实现被动靶向的作用,进而增强肿瘤细胞的摄入性能。
附图说明
38.下面结合附图对本发明的具体实施方式作进一步详细的说明。
39.图1示出实施例制备的细胞膜仿生纳米粒rbc@mn-mof/ppi的高效液相色谱图;
40.其中,a为重楼皂苷i标准品的hplc色谱图,b为实施例的hplc色谱图。
41.图2示出实施例制备的锰基纳米金属-有机框架(mn-mof)的透射电子显微镜(tem)图。
42.图3示出实施例制备的细胞膜仿生纳米粒rbc@mn-mof/ppi的透射电子显微镜(tem)图。
43.图4示出实施例制备的细胞膜仿生纳米粒rbc@mn-mof/ppi的模拟肿瘤酸性微环境ph响应降解的透射电子显微镜(tem)图。
44.图5示出实施例制备的细胞膜仿生纳米粒rbc@mn-mof/ppi对小鼠 4t1乳腺癌细胞的体外增殖能力的影响。
45.图6示出不同测试组的体内抗肿瘤作用对比图。
46.图7示出不同测试组对小鼠肿瘤组织cgas-sting通路相关蛋白表达的影响。
47.图8示出不同测试组对小鼠肿瘤组织cd8
+
阳性t细胞浸润的影响。
48.图9示出不同测试组对小鼠体重随时间的变化。
49.图10示出不同测试组对小鼠相关血清学指标的影响。
50.图11示出不同测试组对小鼠各脏器的影响。
51.图12示出rbc@mn-mof/ppi的靶向分布和药物代谢图。
52.图13示出rbc@mn-mof/ppi在巨噬细胞raw264.7中的免疫逃逸作用。
具体实施方式
53.为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。应当明确,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
54.本发明利用重楼皂苷i、mn-mof和rbc的优点,提供了一种新型细胞膜仿生纳米粒rbc@mn-mof/ppi及制备方法和用途,利用mn-mof高的比表面积和孔隙率的特点,克服了现有技术中重楼皂苷i作为中药单体难溶于水、体内代谢快,生物利用率差等问题,同时也可以释放mn
2+
与重楼皂苷i 发挥协同作用,用于激活cgas-sting通路以实现抗肿瘤免疫治疗;另外也利用了红细胞膜的仿生的特点,提高了体内循环时间,提高了治疗效率。
55.实施例
56.取6-8周balb/c小鼠眼眶全血,用肝素抗凝管收集动物血液,在4℃, 6000rpm下离心5min,除去血浆、白细胞层,用冷却的pbs(1x)洗涤三次;然后,将rbc分散到pbs(0.25x)溶液中,冰浴中静置2h,使红细胞充分溶血,然后在13000rpm下离心5min,去除血红蛋白,用pbs(1x)洗涤三次,得到rbc膜,储存在4℃,备用;
57.将18mg mncl2·
4h2o与10mg聚乙烯吡咯烷酮溶解到2.5ml去离子水中,滴加naoh溶液调ph至10,再滴加3mg重楼皂苷i(用200ul dmso溶解),超声5分钟(功率100w,频率为35-45khz)得溶液a;
58.将10mg二甲基咪唑溶解到0.5ml去离子水,滴加naoh溶液调ph至 10,超声10分钟,超声5分钟(功率100w,频率为35-45khz),得溶液 b;
59.常温下,将溶液b加入到a液,在转速700rpm/min下,反应20分钟,随后,离心10分钟,沉淀依次用甲醇、水洗涤,最后得到5mg负载有重楼皂苷i的锰基金属有机框架mn-mof/ppi。将100mg负载有重楼皂苷i的锰基金属有机框架与5mg的红细胞膜超声融合,采用膜孔径为200nm的多孔过滤器过滤20-30次,离心,洗涤,得到细胞膜仿生纳米粒rbc@mn
‑ꢀ
mof/ppi。
60.图1示出了制备的细胞膜仿生纳米粒rbc@mn-mof/ppi的高效液相色谱图(hplc),用于测量重楼皂苷i的载药率(dl)。在测定重楼皂苷i之前,取上述得到的细胞膜仿生纳米粒rbc@mn-mof/ppi 3mg溶于1ml超纯水中,用盐酸调节ph至5,4℃震荡12h,用甲醇溶解样品,稀释40倍,过滤样品,用0.45μm的有机过滤膜除去杂质,用装有紫外检测器的高效液相色谱(hplc)系统(elite,大连)和c18柱(250mm
×
4.6mm,5μm)以测量重楼皂苷 i的浓度。流动相由乙腈和水(55:45,v/v)组成,进样量为20ul,并以l.0ml/min的流速洗脱重楼皂苷i。将203nm设定为检测波长,重楼皂苷i的保留时间约为10.8分钟。然后精确称量重楼皂苷i标准品1.87mg,用纯甲醇溶解,逐级稀释,过滤,以x轴为重楼皂苷i药物浓度,y轴为峰面积绘制标准曲线为y=3.5758x-2.4895(r2=1)。载药率(dl)由公式计算:载药量=重楼皂苷i在纳米粒中质量
×
100%/(重楼皂苷i和纳米材料的质量总和)。图1 中的a图为重楼皂苷i标准品的hplc色谱图,此处显示的重楼皂苷i的标准品的浓度为23.38ug/ml,b图显示的是甲醇稀释40倍后的细胞膜仿生纳米粒 rbc@mn-mof/ppi的hplc色谱图,根据标准曲线计算得其中重楼皂苷i的浓度为238.09ug/ml,因此计算得到的重楼皂苷i纳米粒载药率为7.94%。
61.图2示出了锰基纳米金属-有机框架(mn-mof)的tem图,从中可以看出它的平均粒径大小在80
±
20之间;图3显示细胞膜仿生纳米粒 rbc@mn-mof/ppi的平均粒径大小在80
±
20之间;图4是基于的模拟肿瘤酸性微环境ph降解的透射电子显微镜(tem)图,经观察细胞膜仿生纳米粒 rbc@mn-mof/ppi在ph 6.5的酸性条件下,12h开始发生降解,24h降解比较明显,降解时间相对较长,表明该药物可以充分的聚集于肿瘤微环境后发挥效用;图5是基于rbc@mn-mof/ppi对小鼠4t1乳腺癌细胞体外增殖能力影响的实验,结果表明,rbc@mn-mof/ppi对4t1细胞具有明显的抑制作用,作用的半数抑制浓度(ic50)为39.2μg/ml。
62.试验例
63.对实施例制备的细胞膜仿生纳米粒rbc@mn-mof/ppi进行小鼠体内实验:
64.(1)体内抗肿瘤作用:
65.选取balb/c小鼠(共25只),18-20g/只,雌性,当4t1细胞传代至第三代,待细胞融合达70%以上时制备成单细胞悬液,调整细胞浓度为2
×
107个/ml,抽取0.05ml悬液接种于小鼠右后肢处。当肿瘤长到约100mm3时,将小鼠随机分为5组,分别为
①
pbs处理组(空白对照);
②
ppi处理组;
③
mn-mof处理组;
④
mn-mof/ppi处理组;
⑤
rbc@mn-mof/ppi处理组。每2天尾静脉给药一次(共给药5次)。结果如图6所示,pbs处理组的肿瘤快速生长,而其他处理组的肿瘤生长则受到不同程度的抑制:pbs处理组肿瘤生长速度最快,肿瘤平均体积为615.9
±
413.3mm3,表明pbs对肿瘤没有治疗效果;ppi处理组在治疗后其肿瘤平均体积为343.7
±
190.4mm3;mn-mof 处理组的肿瘤体积为412.4
±
248.6mm3;当mn-mof负载ppi后,形成mn
‑ꢀ
mof/ppi,ppi与mn
2+
可以发挥协同抗肿瘤作用,肿瘤的体积为 226.6
±
90.4mm3,表明
当ppi被纳米载体负载之后可以明显地增强其抗肿瘤效果;为了增强体内长循环,利用仿生技术在纳米载体表面包裹上红细胞膜,经治疗后肿瘤的体积为159.3
±
40.05mm3,肿瘤形态学图也表明其肿瘤形态最小,抗肿瘤效果最好。
66.(2)对体内肿瘤组织cgas-sting通路相关蛋白表达的影响:
67.重楼皂苷i能引起dna的损伤,但其诱导的dna损伤能否引起cgas
‑ꢀ
sting信号通路的活化,从而调控机体免疫功能发挥抗乳腺癌作用尚不可知。因此对小鼠构建乳腺癌模型,并进行药物干预,当尾静脉注射5次之后,处死小鼠剥离各组瘤组织,进行western blotting检测,所得结果见图 7。结果表明,重楼皂苷i可显著激活cgas-sting通路,促进下游irf3的磷酸化,同时将中药单体重楼皂苷i装载于纳米传递系统中,如rbc@mn
‑ꢀ
mof/ppi处理组所示,可充分利用其药效,进一步激活cgas-sting通路。
68.(3)对体内肿瘤组织cd8
+
阳性t细胞的影响
69.cd8
+
阳性t细胞的浸润增加可以改善肿瘤免疫抑制微环境,避免肿瘤免疫逃逸。同样的,通过对小鼠构建乳腺癌模型,并进行药物干预,尾静脉注射5次之后,处死小鼠剥离各组瘤组织,消化,制备单细胞悬液,进行荧光 cd3
+
、cd4
+
和cd8
+
共染标记,利用流式细胞术检测cd8
+
阳性t细胞的表达,所得结果见图8。结果表明,重楼皂苷i和纳米载体mn-mof中的mn
2+
均可促进cd8
+
阳性t细胞的活化,与pbs组相比有差异,但能力有限。当重楼皂苷i装载于纳米载体mn-mof之后,即mn-mof/ppi处理组,可显著促进乳腺肿瘤组织中的cd8
+
阳性t细胞的表达,与pbs处理组相比有明显差异 (p<0.005)。但是具备仿生性能并且兼具长循环能力的rbc@mn-mof/ppi 促进阳性t细胞活化的平均水平为43.9
±
3.02,其能力最强(p<0.001)。
70.(4)生物安全性评估:
71.i、对小鼠体重的影响
72.通过动物实验评价多功能细胞膜仿生纳米粒rbc@mn-mof/ppi的体内毒性,所得结果见图9,在进行长达2周的小鼠乳腺癌治疗过程中,比较给予 rbc@mn-mof/ppi治疗的小鼠体重和pbs对照组小鼠体重,发现两组小鼠体重未见明显差异,间接说明细胞膜仿生纳米粒rbc@mn-mof/ppi具有较好地生物相容性,毒性作用小。
73.ii、对相关血清学指标的影响
74.评价小鼠的肝肾功能,所得结果见图10,发现各处理组的小鼠肝脏和肾脏血清学指标未见明显地异常,选择的五个肝肾功能指标,分别为alt(谷丙转氨酶)、ast(谷草转氨酶)、alp(碱性磷酸酶)、urea(尿素氮) 和crea(肌酐),在pbs组、ppi组、mn-mof组、mn-mof/ppi组和 rbc@mn-mof/ppi组均未见到明显的异常,说明细胞膜仿生纳米粒 rbc@mn-mof/ppi对小鼠的肝脏和肾脏功能没有损伤作用。
75.iii、对小鼠各脏器的影响
76.使用he染色的方法评价细胞膜仿生纳米粒rbc@mn-mof/ppi对小鼠主要脏器心、肝、脾、肺、肾的影响,发现各主要的脏器未见到明显的形态学异常,也未见到脏器的出血、坏死或其他炎性改变,说明细胞膜仿生纳米粒 rbc@mn-mof/ppi对小鼠主要脏器基本上没有损伤作用,具有良好的生物安全性。
77.(5)对体内肿瘤组织的靶向性
78.该新型细胞膜仿生纳米粒能够在水溶液中通过自组装的方式形成纳米尺寸的药
物,这种纳米尺寸的药物可以通过肿瘤组织的高通透性及高保留性效应(epr)蓄积在肿瘤组织中,从而实现被动靶向的作用,进而增强肿瘤细胞的摄入性能。为了验证该纳米药物的靶向性,另选取balb/c小鼠(共3 只),18-20g/只,雌性,当4t1细胞传代至第三代,待细胞融合达70%以上时制备成单细胞悬液,调整细胞浓度为2
×
107个/ml,抽取0.05ml悬液接种于小鼠左后肢处。当肿瘤长到约100mm3时,将小鼠随机分为3组,分别为
①ꢀ
pbs处理组(空白对照);
②
mn-mof/ppi组;
③
rbc@mn-mof/ppi组。尾静脉注射被cy5.5结合的纳米粒,然后分别在2h、4h、6h、8h、24h、32h 进行小动物成像,观察药物在动物体内的靶向聚集情况,如图12a所示。可以看到与pbs组相比较,纳米药物mn-mof/ppi组和rbc@mn-mof/ppi通过epr被动靶向效应均具有很好的肿瘤组织靶向性,其中荧光强度在6h达到最强,后随着时间流逝逐渐减弱,其中,rbc@mn-mof/ppi组的荧光强度一直高于mn-mof/ppi组。观察结束后,麻醉处死小鼠,解剖脏器,再次进行荧光成像,如图12b所示,可以看到纳米粒主要在肾脏代谢,且rbc@mn
‑ꢀ
mof/ppi组在肿瘤组织的荧光强度高于mn-mof/ppi组,再次提示 rbc@mn-mof/ppi组具有很好的肿瘤组织靶向性。
79.(7)rbc@mn-mof/ppi纳米粒的免疫逃逸作用
80.发明人构建的该仿生rbc@mn-mof/ppi纳米粒具有免疫逃逸作用,为了验证该作用,首先用荧光染料羧基cy5.5结合制备的纳米药物,然后考察其在吞噬细胞raw264.7细胞内分布结果(图13所示)。将吞噬细胞 raw264.7与pbs、cy5.5、mn-mof/ppi和rbc@mn-mof/ppi共同孵育 6h,后进行免疫荧光检测。结果发现,与mn-mof/ppi组相比,rbc@mn
‑ꢀ
mof/ppi组只有少量包裹cy5.5的纳米粒进入细胞,表明其具有很好的免疫逃逸作用,可以增加其体内的循环时间,从而提高抗癌效率。
81.上述试验结果以及实际使用情况表明,该高载药量的重楼皂苷i纳米药物能明显抑制肿瘤生长,具有很好的抗肿瘤作用,且可以克服重楼皂苷i自身理化性质的限制,使其充分的发挥抗肿瘤效应,同时协助mn
2+
发挥协同激活 cgas-sting通路的作用,改善肿瘤免疫抑制微环境,增加cd8
+
阳性t细胞的浸润,避免免疫逃逸。该制剂可以通过静脉注射或者肌肉注射使用,且对其他器官没有损失,有良好的生物相容性。
82.显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1