基于NTR及AzoR响应的双模态成像纳米探针及制备方法、应用与流程
基于ntr及azor响应的双模态成像纳米探针及制备方法、应用
技术领域
1.本发明涉及生物医学的技术领域,尤其是涉及一种基于ntr及azor响应的双模态成像探针及制备方法、应用。
背景技术:
2.现有技术中的用于肿瘤乏氧成像的荧光探针,通过不同的技术实现了对肿瘤乏氧情况的成像,联合调节酶检测缺氧的近红外荧光探针通过双酶响应实现了荧光强度进一步的放大,但是这类技术受限于荧光的穿透深度,荧光成像目前在临床上通常用于术中的引导成像,而基于术前评估的荧光成像目前尚未在临床上大规模应用;此外,荧光成像无法进行大范围的全面检测,在临床中,ct或mr等成像方式仍是不可或缺的。
3.现有技术中的基于硝基咪唑的正电子发射断层(pet)显像是一种可应用于临床的无创乏氧评成像手段,但是其需要使用放射性标记物,因此存在放射性损伤的缺陷,不能用于乏氧水平的长期监测;此外,有研究比较了多种基于硝基咪唑的pet成像探针对肿瘤乏氧情况成像的效果,发现乏氧成像区域存在一定的差异,因此,当使用这类技术进行肿瘤乏氧成像并对乏氧区域进行勾画时,准确度较差。
4.现有技术中的低氧激活的超小氧化铁纳米粒子自组装平台可以通过mr/荧光双模态对肿瘤乏氧情况成像,其mr成像是因为超小氧化铁纳米粒子自组装后表现出更大的t2弛豫率,故用t2加权成像进行评估,该技术的缺陷在于只能通过检测ntr评估肿瘤的乏氧情况,但是单一酶体系有可能出现假阳性或假阴性的情况。
5.现有技术中的用于肿瘤乏氧成像的ct造影剂,该技术仅通过ct单模态成像对肿瘤乏氧情况进行评估,然而ct成像存在一定的辐射伤害,在对肿瘤乏氧情况进行长期监测时,将会对患者造成过多的电离辐射伤害;此外,相对于荧光成像而言,通过ct值对乏氧情况进行评估时,其灵敏度略低。
6.现有技术中的用于肿瘤乏氧成像的钆类mr造影剂,该技术通过mr成像对肿瘤乏氧情况进行评估。这项技术通过t1wi对肿瘤乏氧情况进行评估,而肿瘤在注射钆类造影剂后,进行t1wi时通常会显示出不同程度的强化,肿瘤自身的强化可能会对乏氧情况的判断造成一定干扰。此外,钆类造影剂修饰位点少,只能连接一个硝基咪唑分子,可能导致造影剂不能在肿瘤内很好的积累;此外,mr成像评价乏氧情况的灵敏度不如荧光成像。
7.有鉴于此,特提出本发明。
技术实现要素:
8.本发明的目的之一在于提供一种基于ntr及azor响应的双模态成像纳米探针,能够对肿瘤乏氧情况行mr/荧光双模态成像评估,有助于减少假阳性或假阴性事件的发生,而且有助于构建更为准确的肿瘤乏氧区域图。
9.本发明的目的之二在于提供一种所述的基于ntr及azor响应的双模态成像纳米探针的制备方法,工艺简单,易于操作且高效。
10.本发明的目的之三在于提供一种所述的基于ntr及azor响应的双模态成像纳米探针的应用,能够精准构建肿瘤放疗靶区。
11.为了实现本发明的上述目的,特采用以下技术方案:
12.第一方面,一种基于ntr及azor响应的双模态成像纳米探针,包括由超顺磁性氧化铁纳米粒子所构成的内核,以及连接在内核表面上的配体和近红外荧光团;
13.所述超顺磁性氧化铁纳米粒子的表面由带羧基的聚合物所包覆;
14.所述配体包括硝基咪唑衍生物;
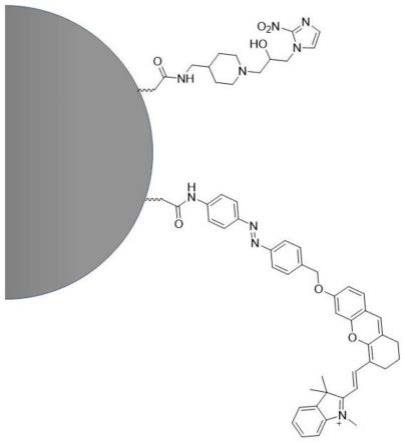
15.所述近红外荧光团的结构为:
[0016][0017]
所述配体和所述近红外荧光团通过酰胺键与所述内核连接。
[0018]
进一步的,所述硝基咪唑衍生物的结构为:
[0019][0020]
进一步的,所述硝基咪唑衍生物的制备方法包括以下步骤:
[0021]
a、2-硝基咪唑和环氧氯丙烷反应,再经碱溶液处理,得到环氧基取代的硝基咪唑;
[0022]
b、苯甲醛和4-氨甲基哌啶进行醛胺缩合反应,得到缩合产物;
[0023]
c、步骤a得到的环氧基取代的硝基咪唑和步骤b得到的缩合产物反应,再经酸溶液处理,得到所述硝基咪唑衍生物。
[0024]
进一步的,步骤a中的碱溶液包括氢氧化钠溶液,优选为4mol/l的氢氧化钠溶液;
[0025]
优选地,步骤b中醛胺缩合反应的温度为80-120℃;
[0026]
优选地,步骤c中反应的温度为80-120℃;
[0027]
优选地,步骤c中的酸溶液包括盐酸;
[0028]
优选地,步骤c中酸溶液处理的温度为30-50℃,优选为40℃。
[0029]
进一步的,所述超顺磁性氧化铁纳米粒子的粒径为2-12nm。
[0030]
进一步的,所述带羧基的聚合物包括丙烯酸类的聚合物;
[0031]
优选地,所述丙烯酸类的聚合物包括聚丙烯酸和聚甲基丙烯酸中的至少一种。
[0032]
进一步的,所述近红外荧光团的制备方法包括以下步骤:
[0033]
(a)4-氨基苯甲酸甲酯与过氧单磺酸钾反应,得到4-亚硝基苯甲酸甲酯;
[0034]
(b)4-亚硝基苯甲酸甲酯与对苯二胺反应生成偶氮键,得到偶氮化合物;
[0035]
(c)偶氮化合物上的羧酸酯经还原形成羟基,再被卤素取代,得到取代产物;
[0036]
(d)取代产物与半菁反应,得到所述近红外荧光团;
[0037]
所述半菁的结构为:
[0038][0039]
第二方面,一种上述任一项所述的基于ntr及azor响应的双模态成像纳米探针的制备方法,包括以下步骤:
[0040]
(a)表面包覆有带羧基聚合物的超顺磁性氧化铁纳米粒子溶解于含edc和nhs的mes缓冲液中进行反应以活化羧基,之后再分散于pbs缓冲液中,并加入所述硝基咪唑衍生物进行缩合反应形成酰胺键,得到连接有配体的超顺磁性氧化铁纳米粒子;
[0041]
(b)连接有配体的超顺磁性氧化铁纳米粒子溶解于含edc和nhs的mes缓冲液中进行反应以活化羧基,之后再分散于pbs缓冲液中,并加入所述近红外荧光团进行缩合反应形成酰胺键,得到所述双模态成像纳米探针。
[0042]
进一步的,步骤(a)中mes缓冲液的ph为5-7,优选为6;
[0043]
优选地,步骤(a)中活化羧基的反应温度为室温,反应时间为1-3小时,优选为2小时;
[0044]
优选地,步骤(a)中pbs缓冲液的的ph为6-8,优选为7.4;
[0045]
优选地,步骤(a)中缩合反应的温度为室温,反应时间为20-30小时,优选为24小时;
[0046]
优选地,步骤(b)中mes缓冲液的ph为5-7,优选为6;
[0047]
优选地,步骤(b)中活化羧基的反应温度为室温,反应时间为1-3小时,优选为2小时;
[0048]
优选地,步骤(b)中pbs缓冲液的的ph为6-8,优选为7.4;
[0049]
优选地,步骤(b)中缩合反应的温度为室温,反应时间为20-30小时,优选为24小时。
[0050]
第三方面,一种上述任一项所述的双模态成像纳米探针在构建肿瘤放疗靶区中的应用。
[0051]
与现有技术相比,本发明至少具有如下有益效果:
[0052]
本发明提供的基于ntr及azor响应的双模态成像纳米探针,包括由超顺磁性氧化铁纳米粒子(简称为spion)所构成的内核,以及连接在内核表面上的特定硝基咪唑衍生物配体(简称为2-ntz-d)和特定近红外荧光团(near-infrared fluorophore,简称为nir-f);本发明提供的纳米探针在分散状态下具有较高的t1弛豫率,因此在成像早期可以实现临床常规的增强t1加权成像,用于肿瘤的常规增强t1加权成像评估;本发明的纳米探针在进入肿瘤乏氧环境后,与内核偶联的特定近红外荧光团上的偶氮键能够被偶氮还原酶(azor)还原并断裂,进而释放出荧光团,此时荧光团开启,可以通过荧光强度对肿瘤乏氧水平进行评价,而且超顺磁性氧化铁纳米粒子(spion)在进入肿瘤乏氧环境后,内核表面的硝基咪唑分子能够被硝基还原酶(ntr)还原,并进一步与细胞大分子加合,使探针在肿瘤乏氧区域积累,并向较高的t2弛豫率转换,此时可通过t2加权成像对肿瘤乏氧水平进行评价,实现磁共振评估。由此,本发明提供的探针能够联合mr及荧光乏氧成像图,进而构建更为准确的肿瘤乏氧区域图。综上所述,本发明提供的探针,能够基于两种乏氧相关酶类(ntr和azor)对肿瘤乏氧情况行mr/荧光双模态成像评估,有助于减少假阳性或假阴性事件的发生,而且联合两种酶类的乏氧成像图勾画放射靶区,将会更加的准确。
[0053]
本发明提供的基于ntr及azor响应的双模态成像纳米探针的制备方法,工艺简单,易于操作且高效。
[0054]
本发明提供的基于ntr及azor响应的双模态成像纳米探针的应用,能够精准构建肿瘤放疗靶区。
附图说明
[0055]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0056]
图1为本发明一种实施方式提供的硝基咪唑衍生物的合成反应式图;
[0057]
图2为本发明一种实施方式提供的近红外荧光团的合成反应式图;
[0058]
图3为本发明一种实施方式提供的基于ntr及azor响应的双模态成像纳米探针的制备示意图;
[0059]
图4为本发明实施例1提供的基于ntr及azor响应的双模态成像纳米探针的结构图;
[0060]
图5为本发明试验例1得到的实施例1的基于ntr及azor响应的双模态成像纳米探针电镜图;
[0061]
图6为本发明试验例1得到的实施例1的基于ntr及azor响应的双模态成像纳米探针在不同浓度下的磁共振成像图;
[0062]
图7为本发明试验例2得到的实施例1的基于ntr及azor响应的双模态成像纳米探针在小鼠体内注射8h后的荧光成像图。
具体实施方式
[0063]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实
施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0064]
根据本发明的第一个方面,提供了一种基于ntr及azor响应的双模态成像纳米探针,包括由超顺磁性氧化铁纳米粒子所构成的内核,以及连接在内核表面上的配体和近红外荧光团;
[0065]
其中,超顺磁性氧化铁纳米粒子的表面由带羧基的聚合物所包覆,配体包括硝基咪唑衍生物;
[0066]
近红外荧光团的结构为:
[0067][0068]
配体和近红外荧光团通过酰胺键与超顺磁性氧化铁纳米粒子内核连接。
[0069]
本发明提供的基于ntr及azor响应的双模态成像纳米探针,不仅在分散状态下具有较高的t1弛豫率,因此在成像早期可以实现临床常规的增强t1加权成像,用于肿瘤的常规增强t1加权成像评估;本发明的纳米探针在进入肿瘤乏氧环境后,与内核偶联的特定近红外荧光团上的偶氮键能够被偶氮还原酶(azor)还原并断裂,进而释放出荧光团,此时荧光团开启,可以通过荧光强度对肿瘤乏氧水平进行评价,而且超顺磁性氧化铁纳米粒子(spion)在进入肿瘤乏氧环境后,内核表面的硝基咪唑分子能够被硝基还原酶(ntr)还原,并进一步与细胞大分子加合,使探针在肿瘤乏氧区域积累,并向较高的t2弛豫率转换,此时可通过t2加权成像对肿瘤乏氧水平进行评价,实现磁共振评估。
[0070]
综上所述,本发明提供的纳米探针,能够基于两种乏氧相关酶类(ntr和azor)对肿瘤乏氧情况行mr/荧光双模态成像评估,有助于减少假阳性或假阴性事件的发生,而且联合两种酶类的乏氧成像图勾画放射靶区,将会更加的准确。
[0071]
在一种优选的实施方式中,本发明的硝基咪唑衍生物(2-ntz-d)的结构为:
[0072][0073]
本发明提供的基于ntr及azor响应的双模态成像纳米探针,由特定结构的硝基咪
唑衍生物(2-ntz-d)作为乏氧特异响应部分,能够有效实现通过mr成像对肿瘤内ntr浓度进行评估,进而有效评估肿瘤乏氧水平,提高评估效果。
[0074]
在一种优选的实施方式中,本发明的硝基咪唑衍生物(2-ntz-d)的制备方法包括以下步骤:
[0075]
a、2-硝基咪唑和环氧氯丙烷反应,再经碱溶液处理,得到环氧基取代的硝基咪唑;
[0076]
b、苯甲醛和4-氨甲基哌啶进行醛胺缩合反应,得到缩合产物;
[0077]
c、步骤a得到的环氧基取代的硝基咪唑和步骤b得到的缩合产物反应,再经酸溶液处理,得到所述硝基咪唑衍生物。
[0078]
本发明提供的硝基咪唑衍生物(2-ntz-d)的制备方法,工艺简单,高效,而且产物易于纯化,收率高。
[0079]
在一种优选的实施方式中,步骤a中的碱溶液包括但不限于氢氧化钠溶液,优选为4mol/l的氢氧化钠溶液,此步骤中,使用4m的氢氧化钠溶液进行反应,可以避免层析柱提纯,产物可直接进行下一步反应;步骤b中醛胺缩合反应的温度为80-120℃,其典型但非限制性的温度例如为70℃、75℃、80℃、85℃、90℃、95℃、100℃、105℃、110℃、115℃、120℃,步骤b中所用的溶剂可以为甲苯、乙醇以及正丁醇中的至少一种,但不限于此,溶剂为甲苯或乙醇时的回流温度优选为80℃,回流时间可以为15-60分钟,溶剂为正丁醇时的回流温度优选为120℃,回流时间可以为15-60分钟;步骤c中反应的温度为80-120℃,其典型但非限制性的温度例如为70℃、75℃、80℃、85℃、90℃、95℃、100℃、105℃、110℃、115℃、120℃,步骤c中所用的溶剂可以为乙醇和正丁醇中的至少一种,但不限于此,溶剂为乙醇时的回流温度优选为80℃,回流时间可以为20-90分钟,溶剂为正丁醇时的回流温度优选为120℃,回流时间可以为20-90分钟;步骤c中的酸溶液包括但不限于盐酸;步骤c中酸溶液处理的温度为30-50℃,其典型但非限制性的温度例如为30℃、35℃、40℃、45℃、50℃,优选为40℃。
[0080]
本发明以上所选择的反应温度及时间,以及酸、碱溶液,更有助于提高反应物的反应效果、产物的纯化效果以及收率。
[0081]
一种硝基咪唑衍生物的典型的制备方法,见图1,包括以下步骤:
[0082]
(a)硝基咪唑、环氧氯丙烷和碳酸钾的混合物在回流条件下反应,过滤后得到黄色固体;
[0083]
再将黄色固体溶于乙酸乙酯,并加入氢氧化钠溶液,在室温下搅拌;
[0084]
再用乙酸乙酯萃取有机相,并用无水硫酸钠干燥有机相,除去乙酸乙酯后得到固体2-硝基-1-(环氧-2-甲基)-1氢-咪唑,即化合物1,无需进一步纯化即可进行下一步使用;
[0085]
(b)将无水硫酸钠加入到苯甲醛、4-氨甲基哌啶以及无水甲苯的混合物中,回流反应,过滤除去无机盐,有机相在真空中浓缩,得到黄油状产物(e)-n-亚苄基-1-(哌啶-4-基)甲烷胺,即化合物2,无需进一步纯化即可进行下一步使用;
[0086]
(c)将化合物1和化合物2混合于无水乙醇中,回流下反应,然后减压浓缩,随后加入盐酸,并加热搅拌;
[0087]
再用二氯甲烷萃取反应物,再将水相ph值调节至11,然后用二氯甲烷萃取,最终得到硝基咪唑衍生物(2-ntz-d),即化合物3。
[0088]
本发明提供的硝基咪唑衍生物的制备方法,工艺简单,高效,而且产物易于纯化,收率高。
[0089]
在本发明中,超顺磁性氧化铁纳米粒子的粒径为2-12nm,其典型但非限制性的粒径例如为2nm、4nm、6nm、8nm、10nm、12nm,粒径在此范围内,使得超顺磁性氧化铁纳米粒子能够在分散状态下具有高的t1弛豫率,因此在成像早期可以实现临床常规的增强t1加权成像,用以肿瘤的分期评估。
[0090]
在一种优选的实施方式中,本发明的带羧基的聚合物包括但不限于丙烯酸类的聚合物;其中,丙烯酸类的聚合物可以为聚丙烯酸和聚甲基丙烯酸中的至少一种,但不限于此,其平均分子量可以为1800g/mol。带羧基的聚合物包覆在超顺磁性氧化铁纳米粒子的表面,用以实现配体和近红外荧光团通过酰胺键与超顺磁性氧化铁纳米粒子的连接。
[0091]
在本发明中,表面包覆有带羧基的聚合物的超顺磁性氧化铁纳米粒子的制备方法,带羧基的聚合物以聚丙烯酸为例,包括以下步骤:
[0092]
将聚丙烯酸溶于去离子水中并用氮气鼓泡,再除氧,随后将溶液加热;同时,将六水合氯化铁和四水合氯化亚铁溶于盐酸溶液中;
[0093]
然后,在氮气气氛下快速将铁溶液注入聚合物溶液当中,随后滴加浓氨溶液将ph值调节至9-10,并在回流条件下反应,之后冷却,再将溶液浓缩,然后用去离子水透析,除去杂质,得到表面包覆有聚丙烯酸的超顺磁性氧化铁纳米粒子。
[0094]
本发明提供的表面包覆有带羧基的聚合物的超顺磁性氧化铁纳米粒子的制备方法,能够成功制备目标产物,易于操作,成功率高。
[0095]
在一种优选的实施方式中,本发明的近红外荧光团的制备方法包括以下步骤:
[0096]
(a)4-氨基苯甲酸甲酯与过氧单磺酸钾反应,得到4-亚硝基苯甲酸甲酯;
[0097]
(b)4-亚硝基苯甲酸甲酯与对苯二胺反应生成偶氮键,得到偶氮化合物;
[0098]
(c)偶氮化合物上的羧酸酯经还原形成羟基,再被卤素取代,得到取代产物;
[0099]
(d)取代产物与半菁反应,得到近红外荧光团;
[0100]
其中,半菁的结构为:
[0101][0102]
本发明提供的近红外荧光团的制备方法,工艺简单,高效,而且产物易于纯化,收率高。
[0103]
一种近红外荧光团的典型的制备方法,如图2所示,包括以下步骤:
[0104]
s1:将过氧单磺酸钾的水溶液加入到4-氨基苯甲酸甲酯的二氯甲烷溶液中,室温下进行搅拌直到有机相变成深绿色;
[0105]
之后,分离有机相,并用hcl溶液洗涤,然后用无水硫酸钠干燥有机相,得到4-亚硝
基苯甲酸甲酯;
[0106]
将4-亚硝基苯甲酸甲酯溶于二氯甲烷和四氢呋喃中,然后加入对苯二胺和乙酸,混合物在室温下搅拌进行反应,之后减压条件下除去溶剂,得到粗产物,其经硅胶层析柱纯化,得到黄色固体产物,为化合物4;
[0107]
s2:将化合物4溶于无水二氯甲烷中并冷却到约为0℃,再加入溶于四氢呋喃中的锂铝氢化物,室温下搅拌进行反应,然后淬灭反应,再用饱和碳酸氢钠溶液洗涤,之后用无水硫酸钠干燥,再蒸干溶剂,得到粗产物;
[0108]
粗产物用硅胶层析柱进一步纯化,得到黄色固体产物,为化合物5;
[0109]
s3:将化合物5和三乙胺溶于0℃左右的无水二氯甲烷中,再加入氯化亚砜,室温下搅拌进行反应,随后用饱和碳酸氢钠溶液洗涤,并用无水硫酸钠干燥,再蒸干溶剂,得到粗产物;
[0110]
粗产物经硅胶层析柱进一步纯化,得到黄色固体产物,为化合物6;
[0111]
s4:将半菁和碳酸钾溶于无水乙腈中得到混合物,在氮气保护下,该混合物于室温下搅拌一段时间,之后再加入化合物6的乙腈溶液,并加热搅拌进行反应,之后蒸干溶剂,得到粗产物;
[0112]
粗产物经硅胶层析柱进一步纯化,得到绿色固体产物,为化合物7,即为本发明的近红外荧光团(near-infrared fluorophore,简称为nir-f)。
[0113]
本发明提供的近红外荧光团的制备方法,工艺简单,成功率高,而且产物易于纯化,收率高。
[0114]
本发明提供的基于ntr及azor响应的双模态成像纳米探针,包括由超顺磁性氧化铁纳米粒子所构成的内核,以及连接在内核表面上的特定硝基咪唑衍生物配体和特定近红外荧光团;该特定结构的纳米探针在成像早期可以实现临床常规的增强t1加权成像,用于肿瘤的常规增强t1加权成像评估;本发明的纳米探针在进入肿瘤乏氧环境后,与内核偶联的特定近红外荧光团上的偶氮键能够被偶氮还原酶(azor)还原并断裂,进而释放出荧光团,此时荧光团开启,可以通过荧光强度对肿瘤乏氧水平进行评价,而且超顺磁性氧化铁纳米粒子(spion)在进入肿瘤乏氧环境后,内核表面的硝基咪唑分子能够被硝基还原酶(ntr)还原,并进一步与细胞大分子加合,使探针在肿瘤乏氧区域积累,并向较高的t2弛豫率转换,此时可通过t2加权成像对肿瘤乏氧水平进行评价,实现磁共振评估。因此,本发明提供的纳米探针能够实现联合mr及荧光乏氧成像图的效果,进而构建更为准确的肿瘤乏氧区域图。
[0115]
根据本发明的第二个方面,提供了一种基于ntr及azor响应的双模态成像纳米探针的制备方法,包括以下步骤:
[0116]
(a)表面包覆有带羧基聚合物的超顺磁性氧化铁纳米粒子溶解于含edc和nhs的mes缓冲液中进行反应以活化羧基,之后再分散于pbs缓冲液中,并加入硝基咪唑衍生物进行缩合反应形成酰胺键,得到连接有配体的超顺磁性氧化铁纳米粒子;
[0117]
(b)连接有配体的超顺磁性氧化铁纳米粒子溶解于含edc和nhs的mes缓冲液中进行反应以活化羧基,之后再分散于pbs缓冲液中,并加入近红外荧光团进行缩合反应形成酰胺键,得到双模态成像纳米探针。
[0118]
本发明提供的基于ntr及azor响应的双模态成像纳米探针的制备方法,工艺简单,
易于操作且高效,成功率高。
[0119]
在本发明中,步骤(a)中mes缓冲液的ph为5-7,可进一步优选为6;步骤(a)中活化羧基的反应温度为室温,反应时间为1-3小时,可进一步优选为2小时;步骤(a)中pbs缓冲液的的ph为6-8,可进一步优选为7.4;步骤(a)中缩合反应的温度为室温,反应时间为20-30小时,可进一步优选为24小时。
[0120]
在本发明中,步骤(b)中mes缓冲液的ph为5-7,可进一步优选为6;步骤(b)中活化羧基的反应温度为室温,反应时间为1-3小时,可进一步优选为2小时;步骤(b)中pbs缓冲液的的ph为6-8,可进一步优选为7.4;步骤(b)中缩合反应的温度为室温,反应时间为20-30小时,可进一步优选为24小时。
[0121]
本发明以上所选择的缓冲溶液的ph、活化羧基的温度及时间,以及缩合反应的温度及时间,有利于羧基的充分活化,有利于酰胺键的生成,能够实现特定的硝基咪唑衍生物配体、特定的近红外荧光团与超顺磁性氧化铁纳米粒子的充分连接,得到理想的、效果佳的双模态成像纳米探针。
[0122]
一种基于ntr及azor响应的双模态成像纳米探针的典型的制备方法,见图3,包括以下步骤:
[0123]
s1:将表面包覆有聚丙烯酸(paa)的超顺磁性氧化铁纳米粒子(spion)溶解在含有edc和nhs的mes缓冲液(ph为6.0)中,用以活化spion的表面羧基,具体为,在室温下搅拌2小时后再通过超滤除去未反应的试剂,并用去离子水洗涤3次,得到活化的纳米颗粒溶液;
[0124]
s2:将步骤s1活化的纳米颗粒溶液分散在pbs缓冲液(ph为7.4)中,并加入硝基咪唑衍生物(2-ntz-d),室温下反应24小时,之后通过超滤除去未反应的试剂,得到连接有配体的纳米颗粒;
[0125]
s3:再次以s1的方式活化步骤s2得到的连接有配体的纳米颗粒,之后将其分散在pbs缓冲液(ph为7.4)中,并加入近红外荧光团(near-infrared fluorophore,nir-f),室温下反应24小时,之后通过超滤除去未反应的试剂,得到基于ntr及azor响应的双模态成像纳米探针。
[0126]
本发明提供的基于ntr及azor响应的双模态成像纳米探针的制备方法,工艺简单,易于操作,且成功率高。
[0127]
根据本发明的第三个方面,提供了一种基于ntr及azor响应的双模态成像纳米探针在构建肿瘤放疗靶区中的应用。
[0128]
本发明提供的基于ntr及azor响应的双模态成像探针的应用,能够精准构建肿瘤放疗靶区。
[0129]
下面通过实施例对本发明作进一步说明。如无特别说明,实施例中的材料为根据现有方法制备而得,或直接从市场上购得。
[0130]
实施例1
[0131]
一种基于ntr及azor响应的双模态成像纳米探针,结构见图4,包括由超顺磁性氧化铁纳米粒子所构成的内核,以及连接在内核表面上的硝基咪唑衍生物配体和近红外荧光团;
[0132]
其中,超顺磁性氧化铁纳米粒子的表面由聚丙烯酸所包覆,超顺磁性氧化铁纳米粒子的平均粒径为4.6nm;
[0133]
硝基咪唑衍生物配体的结构为:
[0134][0135]
近红外荧光团的结构为:
[0136][0137]
硝基咪唑衍生物配体和近红外荧光团通过酰胺键与内核连接。
[0138]
实施例2
[0139]
本实施例为实施例1的基于ntr及azor响应的双模态成像纳米探针的制备方法,包括以下步骤:
[0140]
表面包覆有聚丙烯酸的超顺磁性氧化铁纳米粒子(spion)的制备:
[0141]
将聚丙烯酸(paa,5.56mmol,3000g/mol)溶于去离子水中并用氮气鼓泡40分钟,除氧,随后将溶液加热至80℃;同时,将六水合氯化铁(0.540mmol)和四水合氯化亚铁(0.279mmol)溶于盐酸溶液(2ml,1m);
[0142]
然后,在氮气气氛下快速将铁溶液注入聚合物溶液当中,随后滴加浓氨溶液将ph值调节至9-10,并在回流条件下加热1小时15分钟后冷却;在72n m-2
的减压条件下将所得溶液浓缩至10ml,然后用去离子水透析72小时,除去杂质,得到表面包覆有聚丙烯酸的超顺磁性氧化铁纳米粒子,记为fe3o4@paa;
[0143]
硝基咪唑衍生物的合成:
[0144]
(a)将硝基咪唑(250mg,2.21mmol)、环氧氯丙烷(5ml)和碳酸钾(31mg,0.22mmol)的混合物在回流条件下加热20分钟,过滤得到黄色固体;
[0145]
随后,将黄色固体溶于乙酸乙酯(5ml)并加入氢氧化钠溶液(5ml,4m)在室温下搅拌1小时;
[0146]
然后,用乙酸乙酯(3
×
5ml)萃取有机相,并用无水硫酸钠干燥有机相,再旋转蒸发乙酸乙酯,得到固体2-硝基-1-(环氧-2-甲基)-1氢-咪唑,即化合物1,无需进一步纯化即可进行下一步使用;
[0147]
(b)将无水硫酸钠(2.5g,17.6mmol)加入到苯甲醛(1.06g,10mmol)、4-氨甲基哌啶
(1.14g,10mmol)及无水甲苯(20ml)的混合物中,在80℃下回流搅拌15分钟,过滤除去无机盐,有机相在真空中浓缩,得到黄油状产物(e)-n-亚苄基-1-(哌啶-4-基)甲烷胺,即化合物2,无需进一步纯化即可进行下一步使用;
[0148]
(c)将化合物1(217mg,1.54mmol)和化合物2(310mg,1.54mmol)混合于无水乙醇(8ml)中,在80℃下回流搅拌60分钟,然后减压浓缩至1ml;随后在反应物加入盐酸(2ml,1.2n)并在40℃下加热搅拌4小时;
[0149]
然后,用二氯甲烷(4
×
10ml)萃取反应物,再用40%的氢氧化钠水溶液将水相ph值调节至11,然后用二氯甲烷(4
×
10ml)萃取,最终得到硝基咪唑衍生物(2-ntz-d),即化合物3,其核磁氢谱的归属为:1h nmr(600mhz,methanol-d4)δ7.49(s,1h),7.12(s,1h),4.77(dd,j=13.8,3.1hz,1h),4.30(dt,j=13.9,6.9hz,1h),4.15
–
4.08(m,1h),2.97(d,j=10.9hz,1h),2.88(d,j=11.0hz,1h),2.55(d,j=6.6hz,2h),2.44
–
2.35(m,2h),2.03(q,j=12.0hz,2h),1.72(d,j=12.2hz,2h),1.40
–
1.36(m,1h),1.25
–
1.19(m,2h);
[0150]
近红外荧光团的合成:
[0151]
s1:将过氧单磺酸钾(9.7g,16mmol)的水溶液(50ml)加入到4-氨基苯甲酸甲酯(1.5g,10mmol)的二氯甲烷(20ml)溶液中,室温下搅拌两相混合物5小时,直到有机相变成深绿色;
[0152]
再分离有机相,并用hcl溶液(0.1n,3
×
15ml)洗涤,然后用无水硫酸钠干燥有机相,得到4-亚硝基苯甲酸甲酯;
[0153]
将4-亚硝基苯甲酸甲酯溶于二氯甲烷(15ml)和四氢呋喃(5ml)中,然后加入对苯二胺(1.1g,10mmol)和乙酸(2.84ml,50mmol),反应混合物在室温下搅拌16h,减压条件下除去溶剂,粗产物经硅胶层析柱(二氯甲烷)纯化,得到黄色固体产物,为化合物4;
[0154]
s2:将化合物4(269mg,1mmol)溶于无水二氯甲烷(10ml)中并冷却到0℃,再加入溶于四氢呋喃(5ml)中的锂铝氢化物(40mg,1mmol),在室温下搅拌反应混合物4h,然后滴加2ml水淬灭反应,再用饱和碳酸氢钠溶液(3
×
5ml)洗涤,之后用无水硫酸钠干燥,再蒸干溶剂,得到粗产物;
[0155]
粗产物用硅胶层析柱(二氯甲烷:甲醇,80:1)进一步纯化,得到黄色固体产物,为化合物5;
[0156]
s3:将化合物5(227mg,1mmol)和三乙胺(303mg,3mmol)溶于0℃的无水二氯甲烷(20ml)中,再加入氯化亚砜(119mg,1mmol),混合物在室温下搅拌反应4h,随后用饱和碳酸氢钠溶液(3
×
10ml)洗涤,并用无水硫酸钠干燥,再蒸干溶剂,得到粗产物;
[0157]
粗产物经硅胶层析柱(石油醚:乙酸乙酯,10:1)柱层析进一步纯化,得到黄色固体产物,为化合物6;
[0158]
s4:将半菁(511mg,1mmol)和碳酸钾(276mg,2mmol)溶于无水乙腈(5ml)中得到混合物,在氮气保护下,该混合物于室温下搅拌20分钟,之后再加入化合物6(368mg,1.5mmol)的乙腈(1ml)溶液,并在70℃下加热搅拌4h,之后蒸干溶剂,得到粗产物;
[0159]
粗产物用硅胶层析柱(二氯甲烷:甲醇,30:1)进一步纯化,得到绿色固体产物,为化合物7,即为近红外荧光团;
[0160]
基于ntr及azor响应的双模态成像纳米探针的合成:
[0161]
s1:将表面包覆有聚丙烯酸的超顺磁性氧化铁纳米粒子(spion;1.6mg fe)溶解在
mes缓冲液(ph为6,4ml)中,随后加入含有edc(15.2mg,80μmol)和nhs(9.2mg,80μmol)的mes缓冲液(0.25ml)中,用以活化spion的表面羧基,具体为,在室温下搅拌2小时后再通过超滤除去未反应的试剂,并用去离子水洗涤3次,得到活化的纳米颗粒溶液;
[0162]
s2:将步骤s1活化的纳米颗粒溶液分散在pbs缓冲液(ph为7.4,4ml)中,并加入硝基咪唑衍生物(2-ntz-d;283μg,1μmol),室温下反应24小时,之后通过超滤除去未反应的试剂,得到连接有配体的纳米颗粒;
[0163]
s3:再次以s1的方式活化步骤s2得到的连接有配体的纳米颗粒,之后将其分散在pbs缓冲液(4ml)中,并加入近红外荧光团(720μg,1μmol),室温下反应24小时,之后通过超滤除去未反应的试剂,得到基于ntr及azor响应的双模态成像纳米探针。
[0164]
实施例3
[0165]
本实施例与实施例1的区别在于,本实施例的四氧化三铁纳米粒子的粒径为7nm,其余均与实施例1相同,得到基于ntr及azor响应的双模态成像纳米探针。
[0166]
实施例4
[0167]
本实施例与实施例1的区别在于,本实施例的四氧化三铁纳米粒子的粒径为12nm,其余均与实施例1相同,得到基于ntr及azor响应的双模态成像纳米探针。
[0168]
实施例5
[0169]
本实施例与实施例1的区别在于,本实施例的四氧化三铁纳米粒子的表面是由聚甲基丙烯酸所包覆,其余均与实施例1相同,得到基于ntr及azor响应的双模态成像纳米探针。
[0170]
实施例6
[0171]
本实施例与实施例2的区别在于,本实施例中的基于ntr及azor响应的双模态成像纳米探针的合成,包括以下步骤:
[0172]
s1:将表面包覆有聚丙烯酸的超顺磁性氧化铁纳米粒子(spion;2.4mg fe)溶解在mes缓冲液(ph为6,4ml)中,随后加入含有edc(22.8mg mg,120μmol)和nhs(13.8mg,120μmol)的mes缓冲液(0.25ml)中,用以活化spion的表面羧基,具体为,在室温下搅拌1.5小时后再通过超滤除去未反应的试剂,并用去离子水洗涤3次,得到活化的纳米颗粒溶液;
[0173]
s2:将步骤s1活化的纳米颗粒溶液分散在pbs缓冲液(ph为7.4,4ml)中,并加入硝基咪唑衍生物(2-ntz-d;424.5μg,1.5μmol),室温下反应16小时,之后通过超滤除去未反应的试剂,得到连接有配体的纳米颗粒;
[0174]
s3:再次以s1的方式活化步骤s2得到的连接有配体的纳米颗粒,之后将其分散在pbs缓冲液(4ml)中,并加入近红外荧光团(1080μg,1.5μmol),室温下反应16小时,之后通过超滤除去未反应的试剂,得到基于ntr及azor响应的双模态成像纳米探针;
[0175]
其余步骤和参数均与实施例2相同。
[0176]
实施例7
[0177]
本实施例与实施例2的区别在于,本实施例中的基于ntr及azor响应的双模态成像纳米探针的合成,包括以下步骤:
[0178]
s1:将表面包覆有聚丙烯酸的超顺磁性氧化铁纳米粒子(spion;3.2mg fe)溶解在mes缓冲液(ph为6,4ml)中,随后加入含有edc(30.4mg,160μmol)和nhs(18.4mg,160μmol)的mes缓冲液(0.25ml)中,用以活化spion的表面羧基,具体为,在室温下搅拌2.5小时后再通
过超滤除去未反应的试剂,并用去离子水洗涤3次,得到活化的纳米颗粒溶液;
[0179]
s2:将步骤s1活化的纳米颗粒溶液分散在pbs缓冲液(ph为7.4,4ml)中,并加入硝基咪唑衍生物(2-ntz-d;566μg,2μmol),室温下反应32小时,之后通过超滤除去未反应的试剂,得到连接有配体的纳米颗粒;
[0180]
s3:再次以s1的方式活化步骤s2得到的连接有配体的纳米颗粒,之后将其分散在pbs缓冲液(4ml)中,并加入近红外荧光团(1440μg,2μmol),室温下反应32小时,之后通过超滤除去未反应的试剂,得到基于ntr及azor响应的双模态成像纳米探针;
[0181]
其余步骤和参数均与实施例2相同。
[0182]
实施例8
[0183]
本实施例与实施例2的区别在于,本实施例中的基于ntr及azor响应的双模态成像纳米探针的合成,包括以下步骤:
[0184]
s1:将表面包覆有聚丙烯酸的超顺磁性氧化铁纳米粒子(spion;4mg fe)溶解mes缓冲液(ph为6,4ml)中,随后加入含有edc(38mg,200μmol)和nhs(23mg,200μmol)的mes缓冲液(0.25ml),在室温下搅拌1.5小时用以活化spion的表面羧基,再通过超滤除去未反应的试剂,并用去离子水洗涤3次,得到活化的纳米颗粒溶液;
[0185]
s2:将步骤s1活化的纳米颗粒溶液分散在pbs缓冲液(ph为7.4,4ml)中,并加入硝基咪唑衍生物(2-ntz-d;707.5μg,2.5μmol)进行偶联,室温下反应20小时,之后通过超滤除去未反应的试剂,得到连接有配体的纳米颗粒;
[0186]
s3:再次以步骤s1的方式活化步骤s2得到的连接有配体的纳米颗粒,之后将其分散在pbs缓冲液(4ml)中,并加入近红外荧光团(1800μg,2.5μmol),室温下反应20小时,之后通过超滤除去未反应的试剂,得到基于ntr及azor响应的双模态成像纳米探针;
[0187]
其他步骤及其参数均与实施例2相同。
[0188]
实施例9
[0189]
本实施例与实施例2的区别在于,本实施例中的基于ntr及azor响应的双模态成像纳米探针的合成,包括以下步骤:
[0190]
s1:将表面包覆有聚丙烯酸的超顺磁性氧化铁纳米粒子(spion;4.8mg fe)溶解mes缓冲液(ph为6,4ml)中,随后加入含有edc(45.6mg,240μmol)和nhs(27.6mg,240μmol)的mes缓冲液(0.25ml),在室温下搅拌4小时用以活化spion的表面羧基,再通过超滤除去未反应的试剂,并用去离子水洗涤3次,得到活化的纳米颗粒溶液;
[0191]
s2:将步骤s1活化的纳米颗粒溶液分散在pbs缓冲液(ph为7.4,4ml)中,并加入硝基咪唑衍生物(2-ntz-d;849μg,3μmol)进行偶联,室温下反应35小时,之后通过超滤除去未反应的试剂,得到连接有配体的纳米颗粒;
[0192]
s3:再次以步骤s1的方式活化步骤s2得到的连接有配体的纳米颗粒,之后将其分散在pbs缓冲液(4ml)中,并加入近红外荧光团(2160μg,3μmol),室温下反应35小时,之后通过超滤除去未反应的试剂,得到基于ntr及azor响应的双模态成像纳米探针;
[0193]
其他步骤及其参数均与实施例2相同。
[0194]
实施例10
[0195]
本实施例与实施例2的区别在于,本实施例中的基于ntr及azor响应的双模态成像纳米探针的合成,包括以下步骤:
[0196]
s1:将表面包覆有聚丙烯酸的超顺磁性氧化铁纳米粒子(spion;6.4mg fe)溶解mes缓冲液(ph为6,4ml)中,随后加入含有edc(60.8mg,320μmol)和nhs(36.8mg,320μmol)的mes缓冲液(0.25ml),在室温下搅拌6小时用以活化spion的表面羧基,再通过超滤除去未反应的试剂,并用去离子水洗涤3次,得到活化的纳米颗粒溶液;
[0197]
s2:将步骤s1活化的纳米颗粒溶液分散在pbs缓冲液(ph为7.4,4ml)中,并加入硝基咪唑衍生物(2-ntz-d;1132μg,4μmol)进行偶联,室温下反应40小时,之后通过超滤除去未反应的试剂,得到连接有配体的纳米颗粒;
[0198]
s3:再次以步骤s1的方式活化步骤s2得到的连接有配体的纳米颗粒,之后将其分散在pbs缓冲液(4ml)中,并加入近红外荧光团(2880μg,4μmol),室温下反应40小时,之后通过超滤除去未反应的试剂,得到基于ntr及azor响应的双模态成像纳米探针;
[0199]
其他步骤及其参数均与实施例2相同。
[0200]
对比例1
[0201]
联合调节酶检测缺氧的近红外荧光探针(文献为tian x,li z,sun y,wang p,ma h.near-infrared fluorescent probes for hypoxia detection via joint regulated enzymes:design,synthesis,and application in living cells and mice.anal chem.2018.90(22):13759-13766),其荧光团受限于穿透深度,目前在临床肿瘤术前评估中较少应用,而本发明提供的探针通过mr/荧光双模成像对肿瘤乏氧情况进行评估,具有更广的适用性。
[0202]
对比例2
[0203]
基于硝基咪唑的pet显像(文献为dubois lj,lieuwes ng,janssen mh,et al.preclinical evaluation and validation of[18f]hx4,a promising hypoxia marker for pet imaging.proc natl acad sci u s a.2011.108(35):14620-5),需要使用放射性标记物,因此存在放射性损伤的缺陷,不能用于乏氧水平的长期监测,而本发明提供的探针通过mr/荧光成像进行评估,可以避免放射性损伤,此外,基于多种乏氧相关蛋白联合构建的氧供应图相较于单一蛋白构建具有更高的准确性;而同时检测多个生物标志物也可以显著提高诊断的准确性。
[0204]
对比例3
[0205]
低氧激活的超小氧化铁纳米粒子自组装平台(文献为zhou h,guo m,li j,et al.hypoxia-triggered self-assembly of ultrasmall iron oxide nanoparticles to amplify the imaging signal of a tumor.j am chem soc.2021;143(4):1846-1853.doi:10.1021/jacs.0c10245),其基于单个肿瘤相关的过表达蛋白酶检测的成像方式可能产生假阳性或假阴性结果,将会限制肿瘤乏氧状态的识别,而本发明提供的探针基于两种相关酶类进行成像,通过联合评估,有助于减少假阳性或假阴性结果的出现。
[0206]
对比例4
[0207]
肿瘤缺氧成像的功能性ct造影剂(文献为shi h,wang z,huang c,et al.a functional ct contrast agent for in vivo imaging of tumor hypoxia.small.2016;12(29):3995-4006.doi:10.1002/smll.201601029),其通过ct单模态成像对肿瘤乏氧情况进行评估,然而ct成像存在一定的辐射伤害,在对肿瘤乏氧情况进行长期监测时,将会对患者造成过多的电离辐射伤害。
[0208]
而本发明提供的探针通过mr成像无电离辐射伤害,同时拥有良好的组织分辨率及空间分辨率,是一种更加安全医学成像方式;同时,结合荧光成像,进一步提高了乏氧水平评估的灵敏度。
[0209]
对比例5
[0210]
肿瘤缺氧成像的钆类mr造影剂(文献为gulaka pk,rojas-quijano f,kovacs z,mason rp,sherry ad,kodibagkar vd.gddo3ni,a nitroimidazole-based t1 mri contrast agent for imaging tumor hypoxia in vivo.j biol inorg chem.2014;19(2):271-279.doi:10.1007/s00775-013-1058-5),其通过mr成像对肿瘤乏氧情况进行评估,这项技术通过t1wi对肿瘤乏氧情况进行评估,而肿瘤在注射钆类造影剂后,进行t1wi时通常会显示出不同程度的强化,肿瘤自身的强化可能会对乏氧情况的判断造成一定干扰;此外,钆类造影剂修饰位点少,只能连接一个硝基咪唑分子,可能导致造影剂不能在肿瘤内很好的积累;而且,mr成像评价乏氧情况的灵敏度不如荧光成像。
[0211]
而本发明探针中的超小氧化铁纳米颗粒是一种良好的t1、t2对比造影剂,相比于钆类造影剂的单一成像模式(增强t1wi),本发明的成像探针可通过t2wi对肿瘤乏氧水平进行评估,减少了增强t1wi的干扰;同时,超小氧化铁纳米粒子表面拥有更多的修饰位点,可以修饰数个甚至数十个硝基咪唑分子,加强了纳米探针在肿瘤中的积累;乏氧通常出现在肿瘤的中心区域,因为此处的供血血管多较少,而钆基造影剂在这种情况下很难进入肿瘤的乏氧区域,而超小氧化铁纳米粒子则具有良好的肿瘤渗透效应,可以深入肿瘤中心区域,到达肿瘤乏氧区域进行成像。
[0212]
试验例1
[0213]
实施例1提供的基于ntr及azor响应的双模态成像纳米探针的透射电镜(美国fei,tecnai f20,200kv)图见图5。
[0214]
实施例1提供的基于ntr及azor响应的双模态成像探针的磁共振成像图见图6,其为不同浓度下的磁共振成像图,以fe计,浓度依次为0,0.032mmol/l,0.0625mmol/l,0.125mmol/l,0.25mmol/l,0.5mmol/l。
[0215]
由此可见,本发明提供的双模态成像纳米探针在成像早期可以实现临床常规的增强t1加权成像,用于肿瘤的常规增强t1加权成像评估;当其进入肿瘤乏氧环境后,氧化铁内核表面的硝基咪唑分子被ntr还原并进一步与细胞大分子加合,探针在肿瘤乏氧区域积累,并向较高的t2弛豫率转换,此时可通过t2加权成像对肿瘤乏氧水平进行评价(基于硝基还原酶);同时,与氧化铁内核偶联的荧光团的偶氮键也能被azor还原并断裂,释放出荧光团,此时荧光团开启,此时可通过荧光强度对肿瘤乏氧水平进行评价(基于偶氮还原酶)。因此,本发明提供的探针能够实现联合mr及荧光乏氧成像图的效果,进而构建更为准确的肿瘤乏氧区域图。
[0216]
试验例2
[0217]
建立ht-29荷瘤小鼠模型,通过尾静脉注射实施例1提供的纳米探针20mg/kg,并在注射8h后对肿瘤模型进行荧光成像,使用珀金埃尔默ivis lumina xrms设备进行成像(参数:激发波长=670nm;发射波长=706nm),得到相应的肿瘤荧光成像图,见图7,可以看到在注射纳米探针8h后,纳米探针在小鼠体内逐渐代谢,而在肿瘤部分实现聚集。
[0218]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽
管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1