一种耐酸性的糖脂修饰脂质体及其应用的制作方法
1.本发明属于生物制剂领域,具体涉及一种耐酸性的糖脂修饰脂质体及其应用。
背景技术:
2.幽门螺旋杆菌是一种革兰氏阴性、螺旋状、微需氧、多鞭毛的细菌。幽门螺旋杆菌感染与多种胃病密切相关,包括胃炎、消化性溃疡和胃癌。由于幽门螺旋杆菌日益增长的耐药性,患者对抗生素疗法的低依从性,药物在胃酸环境的不稳定性等限制因素,使得临床普遍应用的标准三联疗法或铋剂四联疗法对幽门螺旋杆菌感染的根除率逐渐下降,且复发率明显增加,因此迫切需要寻找幽门螺旋杆菌的新型抗菌策略。
3.纳米药物载体正开始改变抗菌药物输送的格局。尽管在实验室研究阶段,纳米药物载体能有效清除幽门螺旋杆菌,然而暂无应用于临床治疗幽门螺旋杆菌感染的纳米制剂。脂质体作为成熟的药物递送载体之一,具有可同时包载亲水性药物与疏水性药物,配方易调整,生物相容性高等优势。脂质体是目前唯一可商品化的纳米制剂,是最具应用于临床治疗幽门螺旋杆菌潜力的纳米载体。然而,脂质体在外部环境的不稳定性限制了其作为口服制剂的应用。因此,仍然需要研究能够克服胃酸环境的破坏和胃粘液层的障碍的口服药物纳米载体。
技术实现要素:
4.本发明提供了一种耐酸性的糖脂修饰脂质体及其应用。本发明利用大豆卵磷脂、胆固醇和糖脂制备了在胃酸中稳定的复合脂质体(liposc-melb),并使其包载抗生素阿莫西林制成脂质体制剂,该脂质体及其制备的制剂在体内具有显著抑制幽门螺旋杆菌的作用。
5.为实现上述发明目的,本发明采用以下技术方案予以实现:本发明提供了一种耐酸性的糖脂修饰脂质体,所述糖脂修饰脂质体包括以下组分:大豆卵磷脂、胆固醇和糖脂;所述大豆卵磷脂、胆固醇和糖脂的质量比为1~5:1:1~5。
6.进一步的,所述糖脂修饰脂质体的粒径为70 nm-90 nm;其能够耐受的ph为3.0-7.0。
7.进一步的,所述糖脂包括甘露糖赤藓糖醇脂-b、鼠李糖脂、槐糖脂、海藻糖脂、纤维二糖脂。
8.进一步的,所述糖脂修饰脂质体由大豆卵磷脂、胆固醇和甘露糖赤藓糖醇脂-b以5:1:4的质量比制备而成。
9.进一步的,所述糖脂修饰脂质体通过以下制备方法制得:(1)将大豆卵磷脂、胆固醇、糖脂按比例溶于三氯甲烷中,60℃~80℃水浴5min~10min,至形成一层脂质层;(2)加入水相利用超声波重悬脂质层,得到1mg/ml粗脂质体溶液;(3)将粗脂质体溶液冰水浴下超声处理,得到糖脂修饰脂质体。
10.进一步的,所述步骤(3)中超声的条件为:工作2 s,间隔2 s,功率40%;超声时间为5 min~15min。
11.本发明还提供了所述的糖脂修饰脂质体在用于制备治疗幽门螺旋杆菌感染引起的疾病的药物中的应用。
12.进一步的,所述糖脂修饰脂质体的使用方法为:直接使用;或者利用所述糖脂修饰脂质体包载具有抑制幽门螺旋杆菌作用的抗生素,制备得到脂质体制剂。
13.进一步的,所述脂质体制剂中糖脂与抗生素的浓度比为60~330: 1进一步的,所述脂质体制剂中mel-b与抗生素的浓度比为60~330: 1。
14.进一步的,所述脂质体制剂的使用剂量为每人不高于2 g/kg。
15.进一步的,所述脂质体制剂中所包载的抗生素的浓度为5mg/ml~50 mg/ml。
16.进一步的,所述抗生素为阿莫西林。
17.进一步的,在所述脂质体制剂中阿莫西林的浓度为14 mg/ml。
18.进一步的,所述糖脂修饰脂质体能够直接清除幽门螺旋杆菌生物膜,或者通过在酸性环境中对抗生素的保护作用以及对幽门螺旋杆菌生物膜的穿透作用,来提高抗生素的抑制幽门螺旋杆菌效果和生物利用度,进而达到治疗幽门螺旋杆菌感染引起的疾病的作用。
19.本发明与现有技术相比,具有以下优点和有益效果:(1)本发明经过配方优化,制备出性能良好的mel-b修饰脂质体,脂质体为单室结构,粒径80 nm,分散性良好,具有较高的包封率。mel-b的掺入与脂质体组分之间通过形成较强的氢键作用,赋予了脂质体良好的ph稳定性。在体外释药试验中,liposc-melb4在模拟胃液中无突释现象,具有良好的缓释能力,确定其是一种良好的用于胃部的药物递送载体。
20.(2)本发明经实验验证liposc-melb4能显著提高阿莫西林(amx)的抑菌活性和清除生物膜能力。此外,liposc-melb4具有良好的胃滞留效果、良好的粘液层与幽门螺旋杆菌生物膜渗透效果,同时liposc-melb4作为口服脂质体具有有效的安全性。
21.(3)本发明经实验验证liposc-melb4/amx组体内根除幽门螺旋杆菌感染的效果优于amx组,并能更好的治疗幽门螺旋杆菌感染引起的相关病症。
22.综上所述,本发明成功制备了具有酸稳定性的mel-b修饰脂质体,其可以实现胃酸环境下有效的持续缓释药物,并且具备胃滞留、穿透粘液屏障和幽门螺旋杆菌生物膜的功能,从而显著提高了阿莫西林的生物利用度。这有利于根除幽门螺旋杆菌感染,促进幽门螺旋杆菌相关性胃炎和胃溃疡的治疗。
附图说明
23.图1为liposc-melb4载药后的粒径大小。
24.图2为不同配方脂质体在不同ph环境的稳定性,其中a:liposc-melb4;b:liposc-ses1170;c:liposc-tw80;d:liposc。
25.图3为amx在不同缓释液中的累计释放曲线。
26.图4为单独组分及不同配方脂质体的红外光谱分析,其中a:单独组分脂质体;b:不同配方脂质体。
27.图5为傅里叶变换红外光谱中羟基拉伸区(ν o-h)。
28.图6为3100
‑ꢀ
3600 cm
−1范围内的羟基红外光谱的曲线拟合结果。
29.图7为不同脂质体的氢键分数。
30.图8为liposc-melb4透射电镜图及粒径分布图,其中比例尺为200 nm,其中a:liposc-melb4透射电镜图;b:粒径分布图。
31.图9为amx与liposc-melb4体外抑菌活性结果。
32.图10为liposc-melb4/amx清除幽门螺旋杆菌生物膜的体外评价结果。
33.图11为活体成像观察小鼠胃滞留能力,其中a:活体成像图;b:离体胃部成像图。
34.图12为clsm观察胃组织冷冻切片荧光分布。
35.图13为脂质体的papp与粘蛋白聚集率。
36.图14为激光共聚焦荧光显微镜观察liposc-melb4粘液渗透效果。
37.图15为激光共聚焦荧光显微镜观察liposc-melb4生物膜渗透效果。
38.图16为小鼠对liposc-mel-b4的急性毒性反应。
39.图17为健康小鼠与水浸法诱导小鼠胃组织直观图,其中a,胃溃疡模型小鼠;b,健康小鼠。
40.图18为通过h&e染色评价小鼠幽门螺旋杆菌感染,比例尺为250 μm,其中a:健康组胃组织;b:感染组胃组织。
41.图19为快速脲酶实验检测各组小鼠胃组织中幽门螺旋杆菌定植情况,其中a:胃组织快速脲酶试验,g1,pbs组;g2,健康组;g3,liposc-melb4组;g4,amx组;b:快速脲酶实验clo评分图。
42.图20为通过giemsa染色评价各实验组小鼠幽门螺旋杆菌定植程度,原始图比例尺为25μm,局部放大图比例尺为50μm。
43.图21为通过h&e染色评价各实验组小鼠幽门螺旋杆菌定植程度,原始图比例尺为100μm,局部放大图比例尺为50μm。
44.图22为健康组和幽门螺旋杆菌定植模型小鼠经过pbs, amx, liposc/melb-amx治疗后促炎细胞因子il-1β(a)和tnf-α(b)的表达水平。
45.图23为参与小鼠胃粘膜上皮修复的occludin-1和zo-1蛋白的荧光染色图像,比例尺为100μm,其中a-d:健康组;e-h:liposc-melb4/amx处理组;i-l:amx组;m-p:pbs组。
具体实施方式
46.结合以下具体实例对本发明的技术方案作进一步详细的说明。
47.下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从生物或化学试剂公司购买。
48.实施例1、表面活性剂修饰脂质体的制备与表征1、空载脂质体的制备和表征(1)脂质体骨架(liposc)的构建将大豆卵磷脂(sl),胆固醇(chol)按照不同质量比(1: 1,2: 1,3: 1,4: 1,5: 1)溶于三氯甲烷中,在通风柜70℃水浴条件下蒸发氯仿5 min,形成一层薄的脂质层。加入纯水作为水相,使用超声波清洗器重悬脂质层,得到1 mg/ml的粗脂质体溶液。将所得的粗脂质体悬浮液在冰水浴下超声10 min(工作2 s,间隔2 s,功率40%)得到最终脂质体悬浮液。
利用马尔文粒度仪检测不同质量比大豆卵磷脂与胆固醇制备的脂质体粒径,聚合物多分散性指数(pdi)大小。
49.结果如表1所示,大豆卵磷脂与胆固醇的质量比对liposc的粒径和pdi具有显著影响,随着胆固醇的掺入比例减少,liposc的粒径减小,在sl: chol = 5: 1时,脂质体的粒径最小(116.5 nm),此时其pdi为0.22。根据粒径和pdi确定制备liposc时大豆卵磷脂与胆固醇的最佳质量比为5:1,并以该比例进行后续实验。
50.表1 不同质量比大豆卵磷脂和胆固醇形成脂质体的粒径、多分散指数(pdi) (2)甘露糖赤藓糖醇脂-b(mel-b)修饰脂质体(liposc-melb)的制备根据上述实验确定的最佳配方比进行后续liposc-melb的制备,为了确定mel-b的最佳添加比例,将不同质量mel-b与最佳质量比的大豆卵磷脂,胆固醇同时溶于三氯甲烷中,实现大豆卵磷脂/胆固醇/mel-b(w/w/w)为5: 1: 1,5: 1: 2, 5: 1: 3, 5: 1: 4,并按照上述方法制备liposc-melb。利用马尔文粒度仪检测粒径和pdi大小,确定最佳mel-b掺入比。
51.最后根据最佳mel-b掺入比,在liposc配方中加入相同质量比的吐温80(tw80)与蔗糖酯(ses-1170)。并按照上述方法制备liposc-tw80和liposc-ses1170。
52.结果如表2所示,脂质体的粒径随表面活性剂掺入有所减小。mel-b可以以高负载率掺入到脂质体等纳米结构中并对脂质体性质具有显著影响,随着mel-b的掺入比例增加,脂质体粒径减小。当质量比sl/chol/mel-b = 5: 1: 4时,脂质体粒径最小(79.45
ꢀ±ꢀ
0.07 nm),此时pdi为0.361。此外,随着mel-b的加入,脂质体体系zeta电位的绝对值增加,脂质体电位由-30.5 mv增大到-40.2 mv。据报道,电位绝对值大于30 mv的脂质体体系由于脂质体颗粒间的斥力增大可以更好的维持脂质体悬浮液的静电稳定,因此电位绝对值更大的脂质体配方具有更好的稳定性。
53.另外,本实施例制备了两种化学合成的非离子表面活性剂(tween80和蔗糖酯s-1170)修饰脂质体(liposc-tw80,liposc-ses1170)与mel-b修饰脂质体(liposc-melb)进行性能对比。如表2所示,将tween80加入脂质体体系中,可得到粒径最小、电位绝对值较低的脂质体(63.36
ꢀ±ꢀ
0.132 nm,-6.93 mv)。蔗糖酯的结构与糖脂表面活性剂相似,在脂质体体系中加入蔗糖酯s-1170也能使脂质体粒径略有减小(102.5
ꢀ±ꢀ
0.1 nm)。zeta电位测定显示,liposc-ses1170具有绝对值小于30 mv的负电荷(
‑ꢀ
24.0 mv)。
54.综上所述,综合粒径和表面电荷,选择质量比sl/chol/mel-b = 5: 1: 4的mel-b修饰脂质体(liposc-melb4),与lipos,liposc-tw80,liposc-ses1170进行后续的性能对比。
55.表2 不同配方脂质体的粒径、多分散性指数(pdi)和zeta电位 2、载阿莫西林(amx)脂质体的制备将amx溶于纯水中,替换上述制备过程中使用的纯水作为水相,确定加入amx的质量,使药物占脂质体质量的10%或20%,使用超声细胞破碎仪制备载amx脂质体。
56.3、测定包封率和载药量将上述制备四种载amx的表面活性剂修饰脂质体(liposc,liposc-melb4,liposc-tw80,liposc-ses1170),各吸取1 ml脂质体悬浮液于离心管中,10000 rpm下离心10 min,离心结束后小心吸取上清液。将各组上清液重复进样三次,记录峰面积,根据amx标准曲线得出上清液游离amx的浓度,分别计算四种脂质体的包封率与载药量。
57.计算公式如下:包封率=(脂质体中amx的质量/添加amx的总质量)
×
100%载药量=(脂质体中amx的质量/脂质体的质量)
×
100%如表3所示,liposc-tw80的包封率与其余三种脂质体相比略有降低(58%),但四种脂质体的包封率无显著性差异。同时,载药量为相同趋势。这一数据表明,表面活性剂的修饰对脂质体的药物包封效率无显著影响,而粒径大小是影响脂质体包封率的主要因素。值得一提的是,liposc-melb4的包封率(65%)要大于mel-a-pc(mel-a/pc=5: 5)对花青素的包封率(52%)。
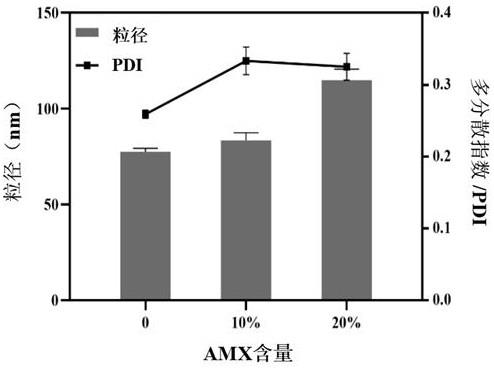
58.表3 不同配方脂质体的包封率(ee%)和载药量(dl%)本发明后续检测了liposc-melb4包封amx后脂质体的粒径大小变化。如图1所示,由于药物的加入,liposc-melb4的粒径有所增加,在药物添加量占脂质体质量的10%时,liposc-melb4粒径增大到84 nm,pdi虽略有增加但仍小于0.4,这说明脂质体载药后粒径仍较为均一。随着药物添加的比例增大,脂质体粒径也随之增大,在药物添加比例达到20%时,脂质体粒径增加了40.3%,说明药物的成功包载。
[0059] 4、脂质体的ph稳定性分别检测四种脂质体(liposc,liposc-melb4,liposc-tw80,liposc-ses1170)的
melb4悬浮液至透射电镜专用铜网上,静置晾干后使用磷钨酸染色剂对其染色,晾干后利用透射电镜观察脂质体形态。并根据电镜图像计算粒径分布。
[0074]
如图8所示,经透射电镜观察,脂质体为球形或椭球形,分散性良好,粒径大小大多分布在70-90 nm之间。由电镜观察结果计算出来的粒径大小为81.9 nm左右,这与马尔文粒度仪测量出的结果相符。由于透射电镜是在干燥的情况下观察,因此脂质体表面出现轻微皱缩。
[0075]
实施例2、liposc-melb4用于胃部药物递送系统性能评价1、游离amx与liposc-melb4/amx抑菌效果的体外评价利用肉汤稀释法评价游离amx与liposc-melb4/amx抑菌效果。 幽门螺旋杆菌使用bhi固体血平板培养,菌种取自实验室菌种库。
[0076]
将活力良好的幽门螺旋杆菌重悬于含有5%胎牛血清和0.2% dent的液体无菌bhi培养基中,通过紫外分光光度计调整od
600
= 0.1。在无菌96孔板中将药物稀释后将幽门螺旋杆菌悬浮液接种于96孔板中与其混合,使每孔中药物的终浓度达到预设浓度。另设只加液体bhi培养基或幽门螺旋杆菌悬浮液的孔作为对照。以上操作均在无菌操作台中进行。将96孔板置于微需氧的条件下,在37℃、100 rpm转速的恒温摇床中摇动培养24 h。24 h后使用酶标仪读取各孔在od
600
下的吸光度。采用公式计算抑菌率,将抑制90%细菌生长的浓度定义为mic90。
[0077]
细菌活力(%) = (is
ꢀ–ꢀ
ib) / (ic
ꢀ‑ꢀ
ib)
ꢀ×ꢀ
100 %,ic代表对照组的od
600
(无药物处理的菌液),ib代表空白组的od
600
(无处理的bhi培养基),is代表实验组的od
600
(不同浓度药物处理的菌液)。
[0078]
图9显示了游离amx和liposc-melb4/amx(加入等量amx)的抗菌活性,此时脂质体中的mel-b与amx的浓度比为320:1。结果表明游离amx的mic90(杀灭90%细菌时的浓度)为0.625 g/ml,而liposc-melb4/amx的抗菌活性得到了改善,以amx浓度计,mic90为0.078-0.156 μg/ml,大大小于amx单独作用时的mic90,说明使用liposc-melb4可以提高抗生素的抑菌效果,减少抗生素的使用剂量。
[0079]
2、游离amx,mel-b与liposc-melb4/amx清除成熟生物膜的体外评价生物膜的形成是幽门螺旋杆菌产生抗生素耐药性的原因之一,生物膜是一种表面附着的细菌群落,它包裹在由多糖,蛋白质,dna等组成的胞外聚合物(eps)基质中,起到保护屏障的作用,因此,有效清除幽门螺旋杆菌生物膜将大大提高细菌根除率。
[0080]
(1)体外培养幽门螺旋杆菌生物膜使用无菌96孔板培养幽门螺旋杆菌生物膜,将活力良好的幽门螺旋杆菌重悬于含有2%胎牛血清和0.2%dent的液体无菌bhi培养基中,通过紫外分光光度计调整菌液od
600
=0.1.将菌液接种于无菌96孔板,每孔接种200 μl。96孔板放置于在37℃,微需氧的条件下培养72 h得到幽门螺旋杆菌生物膜。
[0081]
(2)评估liposc-melb4/amx清除幽门螺旋杆菌生物膜效果制备载amx mel-b修饰脂质体,在liposc-melb4/amx中,将amx浓度设置为5 μg/ml,此时mel-b相对浓度为313 μg/ml。同时设置amx实验组,对比得出liposc-melb4对抗生素清除成熟生物膜的增强效果。生物膜经过药物处理12 h后,进行生物膜生物量的测定。
[0082]
结果如图10所示,将mel-b加入到脂质体载体中会大大提高生物膜清除率,包载
5.0 μg/ml amx的liposc-melb4/amx能够有效清除成熟的幽门螺旋杆菌生物膜,其清除率约为98.5%,而相同浓度的单独amx的清除率仅为54.7%。
[0083]
3、胃滞留实验为了验证liposc-melb4的胃部滞留效果,选择荧光染料alexa fluor tm 594 cadaverine(fl594),将其封装到liposc-melb4中,并将制备的liposc-melb4/fl594对健康小鼠进行灌胃。准备四组六周龄c57bl/6小鼠,每组设为三只,实验前小鼠经过12小时的断食处理,一组灌胃pbs缓冲液作为对照,另外三组灌胃等量1 mg/ml liposc-melb4/fl594悬浮液,每只小鼠口饲灌胃量为100μl,分别在指定时间点(0.5 h,2 h,4 h)对小鼠进行活体成像,观察荧光所在位置。随后处死小鼠,分离出胃部,沿着胃大弯将胃部剪开,除去胃部内容物以及未黏附上去的多余的脂质体,将其置于一次性平板中,随后在活体成像仪下观察胃部荧光成像。
[0084]
活体成像结果表明(图11),作为对照的pbs组无可检测的荧光。0.5 h和2 h时,脂质体的荧光强度集中于小鼠胃部;4 h时,荧光开始由胃部排空,仍大量集中在胃部。以上结果说明脂质体可以在胃中停留4小时,比小鼠胃排空时间(2 h)更长,因此,表明脂质体在胃壁中可以有效保留。随后,被灌胃的小鼠被处死,解剖出胃组织,将它们的胃沿着胃大弯打开,除去胃内容物,置于活体成像仪中观察胃部荧光剩余情况。离体胃部成像(图11)也显示在0.5 h,2 h和4 h时,胃中剩余较强的荧光,而对照组的荧光很弱。观察结果表明,liposc-melb4在胃中至少保留了4小时。
[0085]
最后对胃组织进行冷冻切片,使用共聚焦荧光显微镜观察,更直观的得到包载荧光脂质体在胃黏膜的滞留与分布。结果如图12所示,在明场中能清楚的观察到胃粘膜,从同一样品获得的荧光场图像显示了滞留于胃粘膜表面的脂质体数量。psb对照组(a-c)收集的胃组织粘膜在荧光场中没有发现荧光,而4 h时(d-f)可以在胃组织粘膜表面观察到连续的荧光,由于荧光染料分子量较小,因此荧光略有向组织内渗透。以上结果证明了脂质体liposc-melb4可以在胃黏膜表面长时间滞留。
[0086]
4、粘液渗透实验胃滞留时间是脂质体穿透粘液层的关键,在评价了胃滞留效果后,因此继续评估了liposc-melb4的粘液穿透能力。
[0087]
(1)激光共聚焦荧光显微镜观察脂质体粘液渗透效果制备载荧光素钠(flna)mel-b修饰脂质体用于脂质体粘液渗透效果的研究,脂质体制备流程如实施例1所示。将从新鲜猪胃中刮取的胃粘液储存于-80℃直至使用,实验前将冷冻的粘液放置37℃培养箱解冻。将解冻后的猪胃黏液置于具有3 μm孔径聚碳酸酯膜的transwell插入物上,均匀平铺,粘液厚度约为1 mm,将100 μl载荧光素钠mel-b修饰脂质体(1 mg/ml)轻柔的滴加于粘液层表面,同时加入dapi进行荧光对比。将装有粘液的transwell小室放置于共聚焦荧光显微镜下观察,在指定时间点,观察同一深度下荧光渗透量。
[0088]
(2)表观渗透率(papp)的测定制备载liposc-melb4/flna与liposc/flna用于papp的测定和比较,脂质体制备流程如实施例1所示。
[0089]
将解冻后的猪胃黏液置于具有3 μm孔径聚碳酸酯膜的transwell插入物上,均匀
平铺,粘液厚度约为1 mm,transwell 插入物置于24孔板中,受体室中加入0.8 ml pbs缓冲液,然后将0.2 ml包载荧光的liposc-melb4与liposc悬浮液缓慢添加到粘液表面,并将整个孔板避光放置于37℃,60 rpm 转速的摇床中孵育。3 h后从受体室中取出样品,测量样品中的荧光强度(ex:491 nm,em:512 nm)。最后加入甲醇破坏样品中的脂质体,测量荧光强度。表观渗透系数(papp)的计算方法如下: dq/dt为包载荧光的脂质体从供体一侧到受体一侧的通量,c0为脂质体在供体腔内的初始浓度,a 为膜面积(cm2)= 1.12 cm2。
[0090]
(3)粘蛋白结合率的测定配制0.2%粘蛋白溶液:将粘蛋白固体溶解到蒸馏水中,经过滤去除不溶性固体,得到0.2%的粘蛋白溶液。
[0091]
将liposc-melb4/flna和liposc/flna分别与粘蛋白溶液混合,取等量脂质体与等量蒸馏水混合做为对照组,同时避光孵育3 h 后,取混合物以3000 rpm 离心5 min,收集上清液测量荧光强度(ex:491 nm,em:512 nm)。脂质体与粘蛋白的聚集率计算公式如下:其中,fi1:脂质体孵育后上清液的荧光强度;fi0:脂质体孵育前的荧光强度。
[0092]
结果如图13所示,liposc与粘蛋白的聚集率较高达到37%,而liposc-melb4的聚集率为27.25%,减小了10%,说明mel-b的掺入可能会减少脂质体与粘蛋白的相互作用。这与电位测量结果一致,liposc-melb4的负电位绝对值要高于liposc。带负电荷的纳米颗粒有利于避免与粘蛋白的弱相互作用,并有助于脂质体逃避粘液层的捕获。并且,liposc-melb4的papp为11.1
ꢀ×
10-7 cm/s,这一数值高于研究报道的带负电荷表面聚乙二醇化脂质(鼠李糖脂)包覆壳聚糖纳米粒子的,而粒径较大、负电荷密度较低的liposc具有较低的papp值(4.1
×
10-7 cm/s)。这是由于liposc-melb4与liposc相比具有更小的粒径。
[0093]
如图14所示,在0.5 h时,少数脂质体穿过粘液层,大部分脂质体仍处于粘液层上部。在3 h时,dapi均匀分布于粘液层内部,大多数脂质体在粘液间穿透。4 h时,大部分脂质体穿透粘液层。综上所述,liposc-melb4能够克服粘液层屏障,并将负载的药物输送到幽门螺旋杆菌定植的粘膜上皮表面。
[0094]
5、生物膜渗透实验幽门螺旋杆菌生物被膜是抗生素治疗的另一障碍。因此,我们研究了liposc-melb4在体外与幽门螺旋杆菌生物膜接触后的行为。
[0095]
制备包载尼罗红mel-b脂质体(liposc-melb4/nile red)用于生物膜渗透的研究,脂质体制备流程如实施例1所示。在无菌24孔板中培养幽门螺旋杆菌生物膜。使用dapi对生物膜进行避光染色1 h,随后将100 μl liposc-melb4/nile red滴加于幽门螺旋杆菌生物膜表面,置于共聚焦显微镜下观察,在指定时间点,观察同一深度下荧光渗透量。
[0096]
如图15所示,liposc-melb4在30分钟内能有效进行生物被膜的穿透,这是值得注
melb4/amx(以amx量计,amx量与阳性对照组相同),amx(14 mg/ml)为阳性对照,1
ꢀ×ꢀ
pbs为阴性对照。此外,健康的小鼠被用作比较。治疗7天后进行疗效评价。最后一次给药48小时后处死小鼠,小鼠处死前使用水合氯醛麻醉,并进行眼球取血并随后分离血清。
[0106]
小鼠剖腹取出胃部。打开胃部,除去胃内容物,用0.9%无菌nacl溶液洗涤。将胃组织分为两部分,一部分进行快速脲酶实验,另一部分使用多聚甲醛溶液(4%)对胃组织进行固定,后续进行石蜡包埋,并制作成5 μm的切片。石蜡切片分别进行h&e染色,giemsa染色,zo-1和occludin-1蛋白免疫荧光染色,使用dxm1200f显微镜观察染色切片,分析组织的炎症水平,幽门螺旋杆菌密度,和胃粘膜的完整性。
[0107]
血清的提取:小鼠处死前进行眼部取血,血液在冰盒中放置30 min-1 h,在4℃的条件下3000 rpm离心20 min,吸取上层血清,-80℃保存以进行后续各组炎症因子的测定。
[0108]
血清中炎症因子的测定:使用试剂盒检测小鼠血清中炎症因子(白细胞介素-1β和肿瘤坏死因子-α)的水平。
[0109]
快速脲酶试剂的配制:检验试剂中含有10%尿素,0.01%酚红,配制时保证无菌,配制完成后放入4℃冰箱中短暂保存,在使用前配制。
[0110] (1)快速脲酶的结果如图19所示,pbs组具有显著的脲酶反应,说明组织中存在大量幽门螺旋杆菌。根据颜色反应计算分数,可表征脲酶反应的程度。liposc-melb4/amx组与amx组相比,clo分数较低,说明liposc-melb4/amx对幽门螺旋杆菌的清除率更高。
[0111]
(2)giemsa染色结果如图20所示,giemsa染色进一步证明,在liposc-melb4/amx处理组和健康小鼠粘膜组织中几乎看不到h. pylori菌体的存在,但单独amx处理组仍有幽门螺旋杆菌存在,pbs组处理组的组织中幽门螺旋杆菌数量尤其明显。根据giemsa结果进行h. pylori定植及密度观察并判断等级。结果如表5所示,将h. pylori感染密度定为 +,++ 以及 +++ 级,“+”:偶见或小于标本全长1/3有少量h. pylori;“++”:h. pylori分布超过全长1/3,未在标本全长2/3或似连续性或稀疏地存在于上皮表面;“+++”:h. pylori成堆存在,基本分布于标本全长。这些数据表明,liposc-melb4/amx是一种有效的抗菌药物,liposc-mel4可以有效增强amx的清除幽门螺旋杆菌的效果。
[0112]
表5 各实验组黏膜表面幽门螺旋杆菌密度(3)h&e染色结果评估幽门螺旋杆菌感染引起的胃炎的治疗效果。
[0113]
结果如图21所示,与健康组相比,pbs组的胃粘膜中存在明显的单核细胞聚集和浸润的炎症性病理改变。胃黏膜组织出现病变,包括由结构改变复杂的不规则腺体组成的高度异形增生(圈中)和大量炎症细胞浸润(箭头所指)。给药amx后,小鼠胃粘膜炎症略有减轻,但仍可观察到。liposc-melb4/amx给药后,小鼠胃黏膜炎症消失,与健康组无明显组织学差异。说明liposc-melb4可以提高amx在体内减轻幽门螺旋杆菌定植导致的胃部炎症的效果。
[0114]
(4)小鼠血清中促炎因子tnf-α、il-1β的表达水平可反映小鼠胃炎症的严重程度,
促炎因子在幽门螺旋杆菌感染期间表达上调。因此,我们后续分析了tnf-α和il-1β水平来评估胃粘膜炎症。如图22所示,liposc-melb4/amx治疗有效地降低了促炎细胞因子的表达,显示出了与健康小鼠促炎因子相似的水平。然而,在amx和pbs治疗组中,tnf-α和il-1β的表达水平显著升高,表明liposc-melb4/amx具有更强的治疗胃炎的能力。
[0115]
(5)最后评估了各实验组对胃黏膜溃疡的治疗情况。紧密连接是上皮粘膜屏障的重要组成部分,由多种蛋白组成,包括跨膜蛋白、外周膜蛋白和细胞骨架蛋白。occludin-1蛋白是跨膜蛋白的重要成员,负责调节紧密连接的通透性和维持细胞极性,而zo-1蛋白在胃粘膜修复中发挥关键作用。如图23所示,occludin-1和zo-1在健康组和liposc-melb4/amx处理组的粘膜上皮和腺上皮膜以及膜近端胞浆区均有阳性表达,表现出较强的荧光。amx组的粘膜处occludin-1、zo-1表达显著下调。而pbs组粘膜处的occludin-1和zo-1阳性表达最弱。上述结果说明liposc-melb4/amx可以通过有效清除幽门螺旋杆菌促使胃黏膜的修复,从而促进胃黏膜修复蛋白的表达,并且liposc-melb4/amx对胃溃疡的治疗效果要显著优于单独的amx。
[0116]
以上研究结果证实了liposc-melb4/amx对幽门螺旋杆菌感染及其相关性的体内治疗效果良好。因为liposc-melb4在胃酸环境中对amx的保护作用,liposc-melb4表现出的对药物的持续释放,以及其胃滞留、黏液和幽门螺旋杆菌生物膜的穿透作用,都增强了amx的生物利用度。综合对相关性胃炎和胃溃疡治疗效果考虑,liposc-melb4对幽门螺旋杆菌感染的治疗效果优于现有的亚麻酸脂质体。
[0117]
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1