一种兔圆小囊转移因子的制备方法与流程
1.本发明属于生物制品领域,具体涉及一种兔圆小囊转移因子的制备方法。
背景技术:
2.转移因子(transfer factor,tf)是由具有免疫活性的t淋巴细胞释放的一种细胞因子,由多肽和低聚核苷酸组成,分子量小于10千道尔顿(kilodalton,kda),不含蛋白,无种属特异性、无抗原性、无毒副作用,是一种新型免疫佐剂。tf具有广泛的免疫调节活性,一方面具有非特异性,从无特定抗原刺激的供体可分离获得非特异性tf(nonspecific tf,ntf),ntf可通过影响受体ifn-γ、il-2、il-4、tlr-2、tlr-4和camp的表达,进而增强同种或异种受体动物的非特异性免疫力;另一方面具有特异性,从受抗原刺激的供体可分离获得特异性tf(specific tf,stf),stf可通过抗原特异性t淋巴细胞受体β链的一部分、肽序列和s100a9蛋白等致敏淋巴细胞的特异性免疫信息,介导激活受体的巨噬细胞和抑制性t淋巴细胞,进而将供体特异性细胞免疫功能转移给同种或异种受体动物,激发特异性免疫,其反应强度与机体二次接触同类病原所产生的免疫反应相当,如:抗乙型肝炎猪脾tf。tf对于目前抗体或者抗生素无法有效控制的传染病及免疫缺陷疾病的预防起到重要作用。
3.tf是具有生物学活性的分子量范围分布广泛的非均一性小分子混合物,有学者认为tf是具有约44个氨基酸长度的蛋白质,通常具有约3kda至约5kda的分子量,但是tf分子可能具有该范围外的分子量,并且还认为tf包括三个功能部分(诱导部分、免疫抑制部分和抗原特异性部分),其中每个部分包括不同分子量的tf分子。也有许多学者认为tf还包括核苷部分,其可以连接蛋白分子或与其分开,该核苷部分可以提高tf诱导动物免疫系统二次免疫应答的能力,也可以是tf的诱导部分或抑制部分中的一部分。另有学者研究显示tf主要包含至少581种不同分子量的多肽、核糖、na、zn、k、mg、ca等金属元素和游离氨基酸等。
4.tf来源于动物脾脏、胎盘、圆小囊等组织器官,兔圆小囊是加工过程中的废弃物,原料来源广泛,有着极广的应用开发前景。兔圆小囊被认为是法氏囊在哺乳动物的等同物,是兔重要的肠相关淋巴组织。有学者研究提出,无法氏囊的脊椎动物中,法氏囊的等同器官可能是肠相关淋巴组织。另有研究发现,肠相关淋巴组织的分化并不依赖肠内容物中可识别抗原的刺激,而是依赖某些必须的因子。因此,认为兔的肠相关淋巴组织是哺乳动物的中枢免疫器官,其控制体液免疫细胞系的发生与发展。兔圆小囊组织各区的细胞成分中,t细胞的数量及比例均较高,而上皮内淋巴细胞中浆细胞含量较多,通过组织化学、免疫组织化学以及超微结构观察初步确定兔圆小囊淋巴组织中存在有弥散神经内分泌系统的细胞,此类细胞在受到抗原刺激后数量明显增多。可见兔圆小囊为兔子特有的器官,集消化、免疫和神经内分泌为一体的重要器官。
5.目前,关于兔圆小囊转移因子的制备方法存在以下不足:
6.(1)tf是具有生物学活性的分子量小于10kda且分子量范围分布广泛的非均一性小分子混合物,包括三个功能部分(诱导部分、免疫抑制部分和抗原特异性部分),其中每个部分包括不同分子量的tf分子。不同分子量的tf具有不同的生物学活性,因此,tf的组份分
子量不同,其生物学活性、制备质量、使用剂量、临床应用均有不同。现有tf制造技术缺乏有效的tf分离浓缩技术、小分子纯化技术,不具备不同分子量tf的制备方法,导致无法获得不同分子量组成的tf。这些限制了tf的生物学活性研究、作用机理研究及有效临床应用。
7.(2)由于技术水平的限制,目前还可能存在着未能发现或了解其特性的兔源病毒。在兔圆小囊tf的制备中,兔圆小囊中潜在的未知病毒依然使兔圆小囊tf面临病毒安全风险。因此,去除/灭活病毒工艺是保证兔圆小囊tf安全性的重要、必要手段。现有tf制造技术多采用5-10kda超滤膜超滤或透析袋透析后直接获得tf成品,工艺流程没有采用去除/灭活病毒方法处理,而超滤膜超滤和透析袋透析尽管都具有一定程度的截留去除病毒作用,但是限于超滤膜和透析袋的滤膜结构特点和过滤工艺性质,超滤膜超滤和透析袋透析均不是安全可靠和容易验证的去除/灭活病毒方法,导致所制备tf存在较大的病毒安全风险。此外,另有tf制造技术仅采用一种去除/灭活病毒方法,如:多采用甲醛灭活法或β-丙内酯灭活法,由于单一病毒去除/灭活方式的局限性,存在对有些病毒不能完全去除的可能性,不能绝对保证tf的安全。
8.(3)兔圆小囊是加工过程中的废弃物,其资源化利用,具有重要的现实意义和极广的应用开发前景。现有技术中tf原料主要来动物脾脏和胎盘,未见从兔圆小囊中提取分离tf的报道。尽管兔圆小囊的原料来源广泛,但是兔圆小囊依然不属于无限供应的原料资源。现有制造技术对tf原料的使用效率较差,仅在匀浆液离心后选取离心上清液用于制备tf,而舍弃了离心沉淀物。
技术实现要素:
9.本发明的目的在于克服背景技术的不足,提供一种无病毒安全风险的兔圆小囊转移因子的制备方法,该方法可以获得特定分子量的兔圆小囊转移因子。
10.为了实现上述目的,本发明采用以下技术方案:
11.一种兔圆小囊转移因子的制备方法,包括以下步骤:
12.1)选取健康兔的圆小囊,去除兔圆小囊表面的筋膜、肌肉、脂肪组织,用注射用水洗净后,经绞肉机绞碎,将注射用水与绞碎后的兔圆小囊混合,经胶体磨匀浆获得匀浆液;
13.2)匀浆液经细胞破碎后,进行离心分别获得一次上清液和一次沉淀物;将一次沉淀物与经盐酸调节ph值为4.0-5.0的注射用水混合,经胶体磨匀浆获得匀浆液,加入0.01%-0.05%浓度的胃蛋白酶于37℃搅拌浸提水解1-5h后,进一步进行细胞破碎,离心获得二次上清液。将一次、二次上清液合并,然后将收获的离心上清液,采用0.22-0.65μm滤膜进行切向流过滤,收集透过物;
14.3)小于10kda兔圆小囊转移因子粗制品的制备:将步骤2)中透过物采用10kda滤膜进行切向流过滤,收集透过物,即为小于10kda兔圆小囊转移因子粗制品;
15.4)小于8kda兔圆小囊转移因子粗制品的制备:将步骤2)中透过物采用8kda滤膜进行切向流过滤,收集透过物,即为小于8kda兔圆小囊转移因子粗制品;
16.5)小于5kda兔圆小囊转移因子粗制品的制备:将步骤2)中透过物采用5kda滤膜进行切向流过滤,收集透过物,即为小于5kda兔圆小囊转移因子粗制品;
17.6)8至10kda兔圆小囊转移因子粗制品的制备:将步骤3)中小于10kda兔圆小囊转移因子粗制品,采用8kd滤膜进行切向流过滤,收集截留物,即为8至10kda兔圆小囊转移因
子粗制品;
18.7)5至10kda兔圆小囊转移因子粗制品的制备:将步骤3)中小于10kda兔圆小囊转移因子粗制品,采用5kd滤膜进行切向流过滤,收集截留物,即为5至10kda兔圆小囊转移因子粗制品;
19.8)3至10kda兔圆小囊转移因子粗制品的制备:将步骤3)中小于10kda兔圆小囊转移因子粗制品,采用3kd滤膜进行切向流过滤,收集截留物,即为3至10kda兔圆小囊转移因子粗制品;
20.9)1至10kda兔圆小囊转移因子粗制品的制备:将步骤3)中小于10kda兔圆小囊转移因子粗制品,采用1kd滤膜进行切向流过滤,收集截留物,即为1至10kda兔圆小囊转移因子粗制品;
21.10)5至8kda兔圆小囊转移因子粗制品的制备:将步骤4)中小于8kda兔圆小囊转移因子粗制品,采用5kd滤膜进行切向流过滤,收集截留物,即为5至8kda兔圆小囊转移因子粗制品;
22.或者,将步骤7)中5至10kda兔圆小囊转移因子粗制品,采用8kd滤膜进行切向流过滤,收集透过物,即为5至8kda兔圆小囊转移因子粗制品;
23.11)3至8kda兔圆小囊转移因子粗制品的制备:将步骤4)中小于8kda兔圆小囊转移因子粗制品,采用3kd滤膜进行切向流过滤,收集截留物,即为3至8kda兔圆小囊转移因子粗制品;
24.或者,将步骤8)中3至10kda兔圆小囊转移因子粗制品,采用8kd滤膜进行切向流过滤,收集透过物,即为3至8kda兔圆小囊转移因子粗制品;
25.12)1至8kda兔圆小囊转移因子粗制品的制备:将步骤4)中小于8kda兔圆小囊转移因子粗制品,采用1kd滤膜进行切向流过滤,收集截留物,即为1至8kda兔圆小囊转移因子粗制品;
26.或者,将步骤9)中1至10kda兔圆小囊转移因子粗制品,采用8kd滤膜进行切向流过滤,收集透过物,即为1至8kda兔圆小囊转移因子粗制品;
27.13)3至5kda兔圆小囊转移因子粗制品的制备:将步骤5)中小于5kda兔圆小囊转移因子粗制品,采用3kd滤膜进行切向流过滤,收集截留物,即为3至5kda兔圆小囊转移因子粗制品;
28.或者,将步骤8)中3至10kda兔圆小囊转移因子粗制品或步骤11)中3至8kda兔圆小囊转移因子粗制品,采用5kd滤膜进行切向流过滤,收集透过物,即为3至5kda兔圆小囊转移因子粗制品;
29.14)1至5kda兔圆小囊转移因子粗制品的制备:将步骤5)中小于5kda兔圆小囊转移因子粗制品,采用1kd滤膜进行切向流过滤,收集截留物,即为1至5kda兔圆小囊转移因子粗制品;
30.或者,将步骤9)中1至10kda兔圆小囊转移因子粗制品或步骤12)中1至8kda兔圆小囊转移因子粗制品,采用5kd滤膜进行切向流过滤,收集透过物,即为1至5kda兔圆小囊转移因子粗制品;
31.15)小于3kda兔圆小囊转移因子粗制品的制备:将步骤3)中小于10kda兔圆小囊转移因子粗制品、步骤4)中小于8kda兔圆小囊转移因子粗制品、或步骤5)中小于5kda兔圆小
囊转移因子粗制品,采用3kd滤膜进行切向流过滤,收集透过物,即为小于3kda兔圆小囊转移因子粗制品;
32.或者,将步骤2)中透过物采用30-500kda滤膜进行切向流过滤,收集透过物并采用3kd滤膜进行切向流过滤,收集透过物,即为小于3kda兔圆小囊转移因子粗制品;
33.16)1至3kda兔圆小囊转移因子粗制品的制备:将步骤15)中小于3kda兔圆小囊转移因子粗制品,采用1kd滤膜进行切向流过滤,收集截留物,即为1至3kda兔圆小囊转移因子粗制品;
34.或者,将步骤9)中1至10kda兔圆小囊转移因子粗制品、步骤12)中1至8kda兔圆小囊转移因子粗制品或步骤14)中1至5kda兔圆小囊转移因子粗制品,采用3kd滤膜进行切向流过滤,收集透过物,即为1至3kda兔圆小囊转移因子粗制品。
35.17)小于1kda兔圆小囊转移因子粗制品的制备:将步骤3)中小于10kda兔圆小囊转移因子粗制品、步骤4)中小于8kda兔圆小囊转移因子粗制品、步骤5)中小于5kda兔圆小囊转移因子粗制品或步骤15)中小于3kda兔圆小囊转移因子粗制品,采用1kd滤膜进行切向流过滤,收集透过物,即为小于1kda兔圆小囊转移因子粗制品;
36.或者,将步骤2)中透过物采用30-300kda滤膜进行切向流过滤,收集透过物并采用1kd滤膜进行切向流过滤,收集透过物,即为小于1kda兔圆小囊转移因子粗制品。
37.18)将步骤3)至步骤17)中至少一种分子量范围的兔圆小囊转移因子粗制品混合,即为兔圆小囊转移因子初制品。
38.19)对兔圆小囊转移因子初制品,采用去除/灭活病毒方法进行除病毒后,调节ph至6.5-7.5,渗透压调节至280-320mosm/kg,采用0.1-0.22μm除菌过滤器除菌,即获得兔圆小囊转移因子。
39.进一步地,步骤1)中,健康兔经疫苗免疫或抗原刺激后抗体阳性,则步骤19)获得该疫苗或抗原特异性的兔圆小囊转移因子;反之,健康兔未经疫苗免疫或抗原刺激而抗体阴性,则步骤19)获得非特异性的兔圆小囊转移因子。
40.进一步地,步骤2)中,细胞破碎方法包括至少一种下述方法:
①
反复冻融破碎;
②
高压均质机破碎;
③
超声波细胞破碎仪破碎。
41.进一步地,步骤19)中,去除/灭活病毒方法包括至少两种下述方法:
①
低ph孵放法(ph 2.0-4.0时4-25℃反应2h-1d);
②
膜过滤法(15-45nm除病毒过滤器过滤);
③
β-丙内酯灭活法(0.001%-0.025%浓度时4℃灭活6-24h后37℃水解2-8h);
④
甲醛灭活法(0.01%-0.05%浓度时37℃灭活6-12h)。
42.制备的兔圆小囊转移因子成品中,分子量3至5kda兔圆小囊转移因子体积比为40%-70%时,特别适合用于提高动物特异性免疫水平。
43.与现有技术相比,本发明的有益效果在于:
44.1.本发明采用逐级切向流过滤,建立了精确有效的兔圆小囊tf分离浓缩技术、小分子纯化技术,选取截留孔径分子量不同的滤膜按照不同的工艺技术流程可制备出小于10kda兔圆小囊转移因子粗制品、小于8kda兔圆小囊转移因子粗制品、小于5kda兔圆小囊转移因子粗制品、8至10kda兔圆小囊转移因子粗制品、5至10kda兔圆小囊转移因子粗制品、3至10kda兔圆小囊转移因子粗制品、1至10kda兔圆小囊转移因子粗制品、5至8kda兔圆小囊转移因子粗制品、3至8kda兔圆小囊转移因子粗制品、1至8kda兔圆小囊转移因子粗制品、3
至5kda兔圆小囊转移因子粗制品、1至5kda兔圆小囊转移因子粗制品、小于3kda兔圆小囊转移因子粗制品、1至3kda兔圆小囊转移因子粗制品、小于1kda兔圆小囊转移因子粗制品,将至少一种上述不同分子量兔圆小囊转移因子粗制品按不同比例混合,进行去除/灭活病毒处理、ph和渗透压调节后除菌,即获得兔圆小囊转移因子。
45.不同分子量的转移因子具有不同的生物学活性。对比现有转移因子制造技术所制备转移因子,本发明所制备兔圆小囊转移因子的不同分子量组份的占比不同,包含不同体积比例的小于10kda、小于8kda、小于5kda、8至10kda、5至10kda、3至10kda、1至10kda、5至8kda、3至8kda、1至8kda、3至5kda、1至5kda、小于3kda、1至3kda或小于1kda兔圆小囊转移因子。本发明所制备不同分子量组份组成的兔圆小囊转移因子,在诱导功能、免疫抑制功能和抗原特异性功能等主要功能方面具有不同的生物学活性,使用剂量和临床效果也不同,为tf的生物学活性研究、作用机理研究及有效临床应用提供了技术基础。
46.2.兔圆小囊经过切向流过滤等工艺过程制得兔圆小囊转移因子粗制品,兔圆小囊转移因子粗制品仍然有可能被误入的外源病毒或潜在的未知病毒污染。为了排除兔圆小囊转移因子粗制品可能存留的外源病毒,防止病毒进入兔圆小囊转移因子成品,须对兔圆小囊转移因子粗制品进行去除/灭活病毒方法处理。现有转移因子制造技术多采用安全可靠性不足且较难验证的超滤膜超滤或透析袋透析截留去除病毒,或者至多采用单一病毒去除/灭活方式(如:多采用甲醛灭活法或β-丙内酯灭活法),存在对有些病毒不能完全去除的可能性,不能绝对保证tf的安全,导致所制备tf存在较大的病毒安全风险。本发明通过对兔圆小囊tf的去除/灭活病毒方法进行验证与评价研究,从巴斯德消毒法、干热法、有机溶剂/去污剂(s/d)处理法、膜过滤法、低ph孵放法、β-丙内酯灭活法、甲醛灭活法、二乙烯亚胺灭活法、辛酸处理法、光化学法、深度过滤、色谱技术等方法中筛选并建立了灭活病毒范围广、效果好、验证合格且可保持兔圆小囊tf效力和稳定性的去除/灭活病毒方法。对比现有转移因子制造技术,本发明包括至少两种下述去除/灭活病毒方法:
①
低ph孵放法(ph 2.0-4.0时4-25℃反应2h-1d);
②
膜过滤法(15-45nm除病毒过滤器过滤);
③
β-丙内酯灭活法(0.001%-0.025%浓度时4℃灭活6-24h后37℃水解2-8h);
④
甲醛灭活法(0.01%-0.05%浓度时37℃灭活6-12h)。明确了在兔圆小囊tf生产过程中,必须分别采用两种或两种以上不同机理的去除/灭活病毒方法,共同保证病毒的彻底灭活/去除,以保证兔圆小囊tf的安全。
47.3.兔圆小囊是加工过程中的废弃物,其资源化利用,具有重要的现实意义和极广的应用开发前景。现有技术中tf原料主要来动物脾脏和胎盘,未见从兔圆小囊中提取分离tf的报道。本发明首次从兔圆小囊中制备出无病毒安全风险的兔圆小囊转移因子。
48.4.尽管兔圆小囊的原料来源广泛,但是兔圆小囊依然不属于无限供应的原料资源。现有制造技术对tf原料的使用效率较差,仅在匀浆液离心后选取离心上清液用于制备tf,而舍弃了离心沉淀物。本发明中,对离心沉淀物进行了二次提取:进一步将离心沉淀物与经盐酸调节ph值为4.0-5.0的注射用水混合,经胶体磨匀浆获得匀浆液,加入0.01%-0.05%浓度的胃蛋白酶于37℃搅拌浸提水解1-5h后,进一步进行细胞破碎,离心获得离心上清液,用于制备兔圆小囊tf。本发明在对离心沉淀物的提取时采用经盐酸调节ph值为4.0-5.0的注射用水,用于离心沉淀物的混合、匀浆,有利于抑制酶活性和兔圆小囊tf的高效率提取,并为后续激活胃蛋白酶的活性提供了良好的液体溶剂环境,实现了离心沉淀物
的二次提取,提高了兔圆小囊tf的收获率。
具体实施方式
49.实施例1
50.一种兔圆小囊转移因子的制备方法,包括以下步骤:
51.1)选取健康兔的圆小囊,去除兔圆小囊表面的筋膜、肌肉、脂肪组织,用注射用水洗净后,经绞肉机绞碎,将注射用水与绞碎后的兔圆小囊混合,经胶体磨匀浆获得匀浆液。
52.2)匀浆液经细胞破碎后,进行离心分别获得一次上清液和一次沉淀物。进一步将一次沉淀物与经盐酸调节ph值为4.0的注射用水混合,经胶体磨匀浆获得匀浆液,加入0.05%浓度的胃蛋白酶于37℃搅拌浸提水解5h后,进一步进行细胞破碎,离心获得二次上清液,合并一次、二次上清液,将收获的上清液,采用0.22μm滤膜进行切向流过滤,收集透过物。
53.其中,细胞破碎方法为反复冻融破碎。
54.3)小于10kda兔圆小囊转移因子粗制品的制备:将步骤2)中透过物采用10kda滤膜进行切向流过滤,收集透过物,即为小于10kda兔圆小囊转移因子粗制品。
55.4)小于5kda兔圆小囊转移因子粗制品的制备:将步骤2)中透过物采用5kda滤膜进行切向流过滤,收集透过物,即为小于5kda兔圆小囊转移因子粗制品。
56.5)3至5kda兔圆小囊转移因子粗制品的制备:将步骤4)中小于5kda兔圆小囊转移因子粗制品,采用3kd滤膜进行切向流过滤,收集截留物,即为3至5kda兔圆小囊转移因子粗制品。
57.6)将步骤3)至步骤5)中所制备不同分子量范围的兔圆小囊转移因子粗制品混合,混合比例为:小于10kda兔圆小囊转移因子粗制品占混合液体积比30%,3至5kda兔圆小囊转移因子粗制品占混合液体积比70%,即为兔圆小囊转移因子初制品。
58.7)对兔圆小囊转移因子初制品,采用去除/灭活病毒方法进行除病毒后(先后为以下两种,低ph孵放法:ph 2.0时25℃反应1d;甲醛灭活法:0.01%浓度时37℃灭活6h),调节ph至7.5,渗透压调节至320mosm/kg,采用0.22μm除菌过滤器除菌,即获得兔圆小囊转移因子。
59.步骤1)中,健康兔经猪瘟病毒疫苗免疫后猪瘟病毒抗体阳性,因此,步骤7)获得的是猪瘟病毒特异性的兔圆小囊转移因子。
60.本实施例的产品尤其适用于提高动物特异性免疫水平(分子量3至5kda兔圆小囊转移因子体积比为40%-70%之间)。
61.实施例2
62.一种兔圆小囊转移因子的制备方法,包括以下步骤:
63.1)选取健康兔的圆小囊,去除兔圆小囊表面的筋膜、肌肉、脂肪组织,用注射用水洗净后,经绞肉机绞碎,将注射用水与绞碎后的兔圆小囊混合,经胶体磨匀浆获得匀浆液。
64.2)匀浆液经细胞破碎后,进行离心分别获得一次上清液和一次沉淀物,进一步将一次沉淀物与经盐酸调节ph值为5.0的注射用水混合,经胶体磨匀浆获得匀浆液,加入0.01%浓度的胃蛋白酶于37℃搅拌浸提水解1h后,进一步进行细胞破碎,离心获得二次上清液,合并一次、二次上清液。将收获的离心上清液,采用0.45μm滤膜进行切向流过滤,收集
透过物。
65.其中,细胞破碎方法为:第一次细胞破碎采用高压均质机破碎,第二次细胞破碎采用超声波细胞破碎仪破碎。
66.3)小于10kda兔圆小囊转移因子粗制品的制备:将步骤2)中透过物采用10kda滤膜进行切向流过滤,收集透过物,即为小于10kda兔圆小囊转移因子粗制品。
67.4)小于5kda兔圆小囊转移因子粗制品的制备:将步骤2)中透过物采用5kda滤膜进行切向流过滤,收集透过物,即为小于5kda兔圆小囊转移因子粗制品。
68.5)8至10kda兔圆小囊转移因子粗制品的制备:将步骤3)中小于10kda兔圆小囊转移因子粗制品,采用8kd滤膜进行切向流过滤,收集截留物,即为8至10kda兔圆小囊转移因子粗制品。
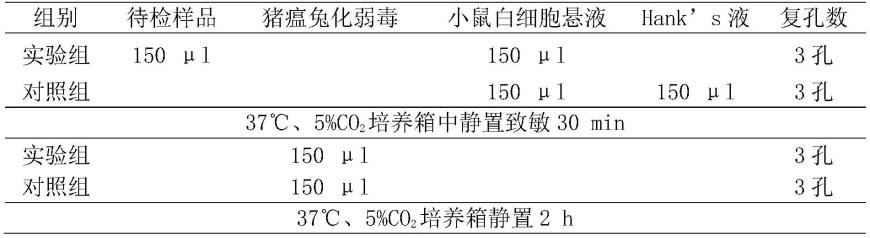
69.6)3至5kda兔圆小囊转移因子粗制品的制备:将步骤4)中小于5kda兔圆小囊转移因子粗制品,采用3kd滤膜进行切向流过滤,收集截留物,即为3至5kda兔圆小囊转移因子粗制品。
70.7)将步骤4)至步骤6)中所制备不同分子量兔圆小囊转移因子粗制品混合,混合比例为:小于5kda兔圆小囊转移因子粗制品占混合液体积比30%,8至10kda兔圆小囊转移因子粗制品占混合液体积比30%,3至5kda兔圆小囊转移因子粗制品占混合液体积比40%,即为兔圆小囊转移因子初制品。
71.8)对兔圆小囊转移因子初制品,采用去除/灭活病毒方法进行除病毒后(先后为以下两种,β-丙内酯灭活法:0.025%浓度时4℃灭活24h后37℃水解2h;膜过滤法:采用45nm除病毒过滤器过滤),调节ph至6.5,渗透压调节至282mosm/kg,采用0.1μm除菌过滤器除菌,即获得兔圆小囊转移因子。
72.步骤1)中,健康兔经猪瘟病毒疫苗免疫后猪瘟病毒抗体阳性,因此,步骤8)获得的是猪瘟病毒特异性的兔圆小囊转移因子。
73.本实施例的产品尤其适用于提高动物特异性免疫水平(分子量3至5kda兔圆小囊转移因子体积比为40%-70%之间)。
74.实施例3
75.一种兔圆小囊转移因子的制备方法,其包括以下步骤:
76.1)选取健康兔的圆小囊,去除兔圆小囊表面的筋膜、肌肉、脂肪组织,用注射用水洗净后,经绞肉机绞碎,将注射用水与绞碎后的兔圆小囊混合,经胶体磨匀浆获得匀浆液。
77.2)匀浆液经细胞破碎后(超声波细胞破碎仪破碎),进行离心分别获得离心上清液和离心沉淀物。将收获的离心上清液,采用0.65μm滤膜进行切向流过滤,收集透过物。
78.3)小于5kda兔圆小囊转移因子粗制品的制备:将步骤2)中透过物采用5kda滤膜进行切向流过滤,收集透过物,即为小于5kda兔圆小囊转移因子粗制品。
79.4)3至5kda兔圆小囊转移因子粗制品的制备:将步骤3)中小于5kda兔圆小囊转移因子粗制品,采用3kd滤膜进行切向流过滤,收集截留物,即为3至5kda兔圆小囊转移因子粗制品。
80.5)小于1kda兔圆小囊转移因子粗制品的制备:将步骤2)中透过物采用300kda滤膜进行切向流过滤,收集透过物并采用1kd滤膜进行切向流过滤,收集透过物,即为小于1kda兔圆小囊转移因子粗制品。
81.6)将步骤4)至步骤5)中所制备不同分子量兔圆小囊转移因子粗制品混合,混合比例为:3至5kda兔圆小囊转移因子粗制品占混合液体积比55%,小于1kda兔圆小囊转移因子粗制品占混合液体积比45%,即为兔圆小囊转移因子初制品。
82.7)对兔圆小囊转移因子初制品,采用去除/灭活病毒方法进行除病毒后(先后为以下两种,低ph孵放法:ph 3.0时21℃反应1d;β-丙内酯灭活法:0.001%浓度时4℃灭活6h后37℃水解8h),调节ph至7.2,渗透压调节至310mosm/kg,采用0.22μm除菌过滤器除菌,即获得兔圆小囊转移因子。
83.步骤1)中,健康兔经鸡新城疫病毒疫苗免疫后新城疫病毒抗体阳性,因此,步骤7)获得的是新城疫病毒特异性的兔圆小囊转移因子。
84.本实施例的产品尤其适用于提高动物特异性免疫水平(分子量3至5kda兔圆小囊转移因子体积比为40%-70%之间)。
85.以下通过对比例1-3,将本发明制备的兔圆小囊转移因子与现有兔圆小囊转移因子进行对比试验。
86.对比例1
87.将本发明实施例1制备的兔圆小囊转移因子与现有兔圆小囊转移因子进行白细胞粘附抑制法特异性效力的对比实验
88.本试验中所用到的现有兔圆小囊转移因子制备方法如下:
89.将经猪瘟病毒疫苗免疫后猪瘟病毒抗体阳性的健康兔的圆小囊绞碎,与注射用水混合匀浆,反复冻融后离心,取离心上清液,先后经0.22μm滤膜、10kda滤膜过滤,取透过液,调节ph至7.2,渗透压调节至290mosm/kg,除菌过滤,即为现有兔圆小囊转移因子。
90.本试验采用白细胞粘附抑制法,检测不同兔圆小囊转移因子的特异性效力。白细胞粘附抑制法系根据猪瘟病毒特异性的兔圆小囊转移因子可使非致敏白细胞获得猪瘟病毒特异性免疫信息进而转变为致敏白细胞。在猪瘟病毒的作用下,致敏白细胞在玻璃或塑料器皿表面的粘附作用受到抑制,根据未粘附白细胞数计算抑制指数(non-adhesion inhibition index,nai)来测定兔圆小囊转移因子的特异性活力。
91.1溶液配制
92.1.1hank’s液将0.3%磷酸二氢钾溶液,0.76%磷酸氢二钠溶液,2%氯化钾溶液及20%氯化钠溶液依次按20:20:20:40比例混合,加葡萄糖1g,溶解混匀,用水稀释至1000ml,并用4%碳酸氢钠溶液调节ph值至7.2~7.3(临用时配制)。
93.1.2分离液为淋巴细胞分离液。
94.1.3 2%台盼蓝染色液称取0.4g台盼蓝置研钵中加少许纯化水反复研磨,加纯化水至100ml,1500r/min离心10min,取上清即为4%台盼蓝水溶液。使用前用1.8%nacl溶液稀释1倍,即为2%台盼蓝染色液。
95.2操作法
96.2.1小鼠白细胞悬液的制备选择体重22~25g健康小鼠,断颈处死,无菌取出新鲜脾脏,以hank’s洗去表面血水,去除脂肪并轻轻压碎,加适量hank’s液使成细胞悬液,经100目筛过滤,1500r/min离心3~5min,弃去上清液,加入少量hank’s液打匀,将此溶液加入已具有1/2滤液量的分离液的离心管中,以2000r/min离心20min,小心吸出中间层的脾脏细胞,放入另一离心管中,加适量hank’s液洗涤,摇匀,以1500r/min离心3~5min,弃去上清
液,重复洗涤一次后,在沉淀物中加入适量hank’s液,混匀,再用hank’s液适当稀释并计数,使最终浓度为每1ml中含(1.0
×
107)~(2.0
×
107)个细胞,为小鼠白细胞悬液。
97.2.2待检样品的制备取本发明实施例1兔圆小囊转移因子与现有兔圆小囊转移因子,用hank’s液配制成每1.0ml中含1.0mg多肽的待检样品。
98.2.3病毒液制备取用猪瘟兔化弱毒细胞毒,用hank’s液适当稀释,使猪瘟兔化弱毒滴度为50 000rid/0.1ml。
99.2.4测定法
100.取24孔微孔板,微孔板内设实验组和对照组,每组均制备3个重复孔。实验组孔分别加入150μl待检样品和150μl小鼠白细胞悬液,对照组孔分别加入150μl hank’s液和150μl小鼠白细胞悬液,于37℃、5%co2培养箱中静置致敏,30min后每组各孔均加入150μl猪瘟兔化弱毒,继续于37℃、5%co2培养箱静置2h。然后,将此微孔板置于振荡器振荡1min,将未粘附小鼠白细胞摇起,并分别吸出每组各孔上清。微孔板内每组各孔再分别加入450μl hanks’液,于振荡器继续振荡1min,将未粘附小鼠白细胞摇起,并分别吸出每组各孔上清。合并2次所吸出的每组各孔上清(如表1)。
101.表1白细胞粘附抑制法操作术式
[0102][0103]
2.5计数
[0104]
合并后的每组各孔上清分别加入50μl 2%台盼蓝染色液,混匀,静置4min,计数,共数计数板64个大方格上所有活白细胞的个数。
[0105]
3结果计算
[0106]
按下式计算结果:nai=(s-c)/c
×
100%
[0107]
式中,nai:未粘附白细胞抑制指数;
[0108]
s:实验组平均未粘附白细胞数;
[0109]
c:对照组平均未粘附白细胞数。
[0110]
4结果
[0111]
白细胞粘附抑制试验结果显示(如表2),本发明实施例1兔圆小囊转移因子的nai值明显高于现有兔圆小囊转移因子,分别为51.8%和36.5%。结果表明,本发明实施例1兔圆小囊转移因子的白细胞粘附抑制法特异性效力明显高于现有兔圆小囊转移因子。
[0112]
表2白细胞粘附抑制试验结果
[0113][0114]
对比例2
[0115]
本发明实施例2制备的兔圆小囊转移因子与现有兔圆小囊转移因子进行对猪瘟疫苗免疫抗体影响的对比实验
[0116]
本试验中所用到的现有兔圆小囊转移因子制备方法如下:
[0117]
选取经猪瘟病毒疫苗免疫后猪瘟病毒抗体阳性的健康兔的圆小囊,清洗、破碎,沸水浴处理,经5%乙酸溶液浸提后离心,取上清液,调节ph至7.0,离心,取上清液,经sephadex g100分离柱分离后,采用10kd滤膜过滤,经紫外线监测,收集10kd以下的峰值样品,即为现有兔圆小囊转移因子。
[0118]
本试验采用猪瘟间接血凝抗体检测方法,检测本发明实施例2兔圆小囊转移因子与现有兔圆小囊转移因子对猪瘟疫苗免疫抗体的影响。
[0119]
1试验材料
[0120]
1.1动物4~5周龄猪瘟抗体阴性的健康杜长大仔猪。
[0121]
1.2试剂猪瘟间接血凝抗体检测试剂盒。
[0122]
1.3制品猪瘟活疫苗(细胞源)。
[0123]
2试验方法
[0124]
取健康仔猪24头随机分成4组,每组6头。其中,实验组1以本发明实施例2兔圆小囊转移因子2.0ml稀释1头份猪瘟活疫苗进行联合免疫,实验组2以现有兔圆小囊转移因子2.0ml稀释1头份猪瘟活疫苗进行联合免疫,对照组以生理盐水2.0ml稀释1头份猪瘟活疫苗进行单独免疫,并设立空白组(仅注射生理盐水)。各组均采用颈部肌肉注射,剂量均为2.0ml/头,其中,实验组和对照组均免疫猪瘟活疫苗1头份/头(如表3)。各组于免疫后第7d、14d、28d和56d采血并分离血清,检测各组猪的猪瘟间接血凝抗体效价。所得数据用单因素方差分析和最小显著性差法(lsd)分析,p《0.05为差异显著。
[0125]
表3试验设计
[0126][0127]
3结果
[0128]
结果显示(如表4),猪瘟活疫苗免疫后第7d、14d、28d和56d,实验组1、实验组2的猪
瘟间接血凝抗体滴度(log2)显著高于对照组(p《0.05),实验组1的猪瘟间接血凝抗体滴度(log2)比对照组分别提高了1.50、2.33、2.00和1.33,实验组2的猪瘟间接血凝抗体滴度(log2)比对照组分别提高了1.33、1.33、1.00和1.17。
[0129]
免疫后第14d和28d,实验组1的猪瘟间接血凝抗体滴度(log2)显著高于实验组2(p《0.05),均分别提高了1.00。结果表明,兔圆小囊转移因子可明显提高猪瘟疫苗免疫抗体,且本发明实施例2兔圆小囊转移因子的免疫增强作用明显高于现有兔圆小囊转移因子。
[0130]
表4试验结果
[0131][0132]
注:上标不同的小写字母表示差异显著(p《0.05);差值为各实验组分别与对照组的差。
[0133]
对比例3
[0134]
本发明实施例3制备的兔圆小囊转移因子与现有兔圆小囊转移因子进行对鸡新城疫疫苗免疫抗体影响的对比实验
[0135]
本试验中所用到的现有兔圆小囊转移因子制备方法如下:
[0136]
将经鸡新城疫病毒疫苗免疫后新城疫病毒抗体阳性的健康兔的圆小囊脏绞碎,与注射用水混合匀浆,超声波细胞破碎仪破碎后离心,取离心上清液,先后经0.45μm滤膜、5kda滤膜过滤,取透过液,调节ph至7.0,渗透压调节至310mosm/kg,经0.1μm除菌过滤器除菌,即为现有兔圆小囊转移因子。
[0137]
本试验通过鸡新城疫血凝抑制试验,检测本发明实施例3兔圆小囊转移因子与现有兔圆小囊转移因子对鸡新城疫疫苗免疫抗体的影响。
[0138]
1试验材料
[0139]
1.1动物21~28日龄spf鸡。
[0140]
1.2疫苗鸡新城疫活疫苗(la sota株)。
[0141]
1.3试剂鸡新城疫病毒血凝抑制试验抗原、鸡新城疫病毒血凝抑制试验阳性血清(hi抗体效价为8log2)、spf鸡血清。
[0142]
1.4配液
[0143]
1.4.1阿氏液取氯化钠0.420g,柠檬酸钠(2h2o)0.800g,葡萄糖2.050g,加蒸馏水溶解并稀释至100ml。溶解后,以10%柠檬酸调节ph至6.1,高压灭菌。
[0144]
1.4.2 ph 7.0~7.2,0.01mol/l pbs甲液(0.2mol/l磷酸氢二钠):磷酸氢二钠(12h2o)71.64g,氯化钠8.50g,加蒸馏水至1000ml;乙液(0.2mol/l磷酸二氢钠):磷酸二氢钠(2h2o)31.21g,氯化钠8.50g,加蒸馏水至1000ml。量取甲液72.0ml,乙液28.0ml,混合后用0.85%氯化钠溶液20倍稀释,高压灭菌,至室温或4℃保存。
[0145]
1.4.3 1%鸡红细胞(rbcs)采集spf鸡血,放入等量阿氏液中摇匀,置4℃冰箱中保存备用。临用前用pbs洗涤3次~5次,每次以2000r/min离心5min,将血浆、白细胞充分洗去至上清液清亮,用pbs配成体积分数为1%rbcs悬液,4℃保存备用。
[0146]
2试验方法
[0147]
2.1试验设计
[0148]
取spf鸡45羽随机分成3组,每组15羽。其中,实验组1点眼免疫鸡新城疫活疫苗(la sota株)1羽份/羽,同时肌肉注射本发明实施例3兔圆小囊转移因子0.1ml/羽;实验组2点眼免疫鸡新城疫活疫苗(la sota株)1羽份/羽,同时肌肉注射现有兔圆小囊转移因子0.1ml/羽;并设立免疫对照组(仅点眼免疫鸡新城疫活疫苗(la sota株)1羽份/羽,不注射兔圆小囊转移因子),如表5。
[0149]
各组于免疫后第7d、14d、21d及28d采血,检测hi抗体(log2),所得数据用单因素方差分析和最小显著性差异法(lsd)分析,p《0.05为差异显著。
[0150]
表5试验设计
[0151][0152]
2.2鸡新城疫疫苗免疫抗体测定
[0153]
2.2.1血凝试验
[0154]
(1)在v型微量血凝板中每孔加25μl pbs溶液。
[0155]
(2)第1孔加入25μl鸡新城疫病毒血凝抑制试验抗原。
[0156]
(3)将鸡新城疫病毒血凝抑制试验抗原在反应板上做25μl的系列倍比稀释。第12孔不加鸡新城疫病毒血凝抑制试验抗原,为红细胞为对照孔。
[0157]
(4)每孔加25μl pbs溶液。
[0158]
(5)每孔加入25μl 1%rbcs。
[0159]
(6)轻叩微量血凝板混合反应物,4℃静置60min,在对照孔的rbcs显著呈钮扣状时判定结果。
[0160]
(7)血凝试验判定时,应将反应板倾斜,观察rbcs有无呈泪珠样流淌,完全凝集(无泪珠样流淌)的病毒最大稀释倍数为鸡新城疫病毒血凝抑制试验抗原的血凝滴度,表示1个血凝单位(hau),再根据开始的稀释倍数精确计算血凝滴度。
[0161]
2.2.2 4hau鸡新城疫病毒血凝抑制试验抗原根据“2.2.1.1血凝试验”测定的效价,计算4hau鸡新城疫病毒血凝抑制试验抗原的稀释倍数。
[0162]
2.2.3血凝抑制试验
[0163]
(1)在v型微量反应板中每孔加25μl pbs溶液。
[0164]
(2)第一孔加25μl血清样品。
[0165]
(3)在血凝板上将血清作横向的25μl的倍比稀释。
[0166]
(4)每孔加入25μl 4hau抗原,4℃静置不少于60min。
[0167]
(5)每孔加入25μl 1%rbcs,轻晃混匀后,4℃静置约60min,当对照孔rbcs呈显著钮扣状时判断结果。
[0168]
(6)每次测定应设已知滴度的阳性血清、阴性血清和红细胞对照。
[0169]
2.2.4结果判定
[0170]
(1)当阳性血清的hi抗体(log2)与已知抗体误差不超过1个滴度,阴性血清抗体不高于2log2,红细胞对照无自凝现象,试验方可成立,否则重检。
[0171]
(2)以完全抑制4hau鸡新城疫病毒血凝抑制试验抗原的最高血清稀释倍数判为该血清的hi抗体。
[0172]
3结果
[0173]
结果显示(如表6),免疫后第14d和21d,实验组1和实验组2的鸡新城疫hi抗体均显著高于免疫对照组(p《0.05),其中,实验组1的鸡新城疫hi抗体比免疫对照组均分别提高了2.8,实验组2的鸡新城疫hi抗体比免疫对照组分别提高了1.3和1.5。
[0174]
免疫后第7d、14d、21d及28d,实验组1的鸡新城疫hi抗体均显著高于实验组2(p《0.05),分别提高了1.0、1.5、1.3和1.7。结果表明,兔圆小囊转移因子可明显提高鸡新城疫疫苗免疫抗体,且本发明实施例3兔圆小囊转移因子的免疫增强作用明显高于现有兔圆小囊转移因子。
[0175]
表6试验结果
[0176][0177]
注:上标不同的小写字母表示差异显著(p《0.05)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1