组合药物金属有机杂化纳米组装体及其应用
1.本发明属于生物医药技术领域,具体涉及一类组合药物金属有机杂化纳米组装体及其应用。
背景技术:
2.近十年来的临床实践和探索性研究表明,单一的治疗方式无法有效治疗一些生理复杂的难治疾病。因此,难治性疾病的治疗方法已经从单一疗法向联合治疗方向转变,提高可用治疗方案的效率。联合治疗是一种广泛应用的疾病治疗策略,通过联合使用已有的疾病缓解疗法或新药物来增加可能的治疗增益,具有可接受的理论依据、良好的安全性和有效性特征。联合疗法可以改变不同的生物学途径、减少所需的有效治疗剂量、降低耐药性以及降低治疗的总体成本。
3.慢性乙型肝炎是由乙肝病毒感染引起的慢性疾病,目前仍无法治愈。持续的乙肝病毒感染会引起肝脏炎症,导致肝纤维化和肝硬化,最终会发展为肝癌造成生命危险。临床上广泛使用的核苷类抗病毒药物可长期有效抑制病毒的复制而抑制乙肝疾病的恶化,但对于病毒侵袭已产生的慢性炎症无效。临床上间隔服用抗病毒药物和保肝药物并非一种理想的联合给药方式,仍有待改善。将抗病毒和抗炎保肝的药物组合共递送用于慢性乙型肝炎的联合治疗可以改善现有治疗策略的不足。
4.恶性肿瘤是一类严重威胁人类健康和生命的重大疾病,肿瘤干样细胞(cscs)是肿瘤组织中一类具有自我更新和自我分化能力的异质性细胞。研究表明,cscs是导致肿瘤化疗耐药、复发和转移的重要因素。为了克服肿瘤耐药性,化疗增敏剂的和化疗药物的联合治疗策略利用化疗增敏剂降低耐药肿瘤的化疗抗性,显示出增强的治疗效果。
5.联合药物治疗的实现需要将多种治疗药物在单个载体中有效整合,而不是简单的混合,才能产生有利的协同的治疗作用,并维持联合治疗的特异性和持久性。快速发展的生物材料和纳米技术为联合药物共递送提供了研究基础,使几种药物通过简单物理吸附或化学相互作用共负载到一个递送载体中而不损失药物活性成为可能。纳米载体可以延长药物的体内半衰期,有助于递送药物到达病灶部位,增强治疗效果并降低毒副作用。将两个药物共负载于一个纳米载体中,能够使不同药物在治疗过程中在空间和时间上的一致,具有同步的药代动力学和生物分布,从而能够达到协同的治疗效果。虽然目前一些纳米载体(包括脂质体、聚合物纳米粒、树状大分子、无机纳米粒)被开发用于药物联合递送,但实际存在的载药率低、合成/制备方法复杂等问题限制了其在组合药物递送中的应用。
6.因此,仍需开发制备方法简单、载药率高且能够负载不同组合药物的载体平台,用于组合药物共递送。
技术实现要素:
7.本发明的目的是提供一种由组合药物与金属离子共组装的杂化纳米组装体。
8.本发明的另一目的是提供上述杂化纳米组装体在制备慢性乙型肝炎或肿瘤治疗
药物中的应用。
9.为了实现上述目的,本发明采用以下技术方案:
10.组合药物金属有机杂化纳米组装体,由组合药物与金属离子通过正负离子相互作用形成;
11.所述组合药物为抗病毒药物与抗炎保肝药物的组合,或化疗药物与化疗增敏剂的组合;
12.所述金属离子选自mg
2+
、ca
2+
、zro
2+
、hfo
2+
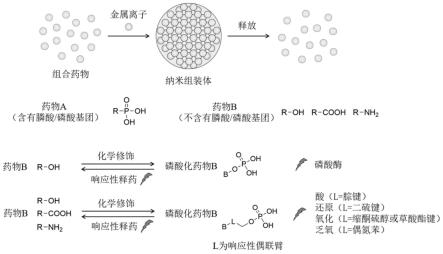
、mn
2+
、fe
2+
、fe
3+
、cu
2+
、cu
+
、zn
2+
、pt
2+
、pt
4+
、pt
6+
、gd
3+
、gdo
+
或ag
+
;
13.所述抗病毒药物、抗炎保肝药物、化疗药物、化疗增敏剂的药物分子含有膦酸基团-po3h2或磷酸基团-opo3h2,或者修饰有磷酸基团-opo3h2。
14.在一些实施例中,所述抗病毒药物选自替诺福韦、恩替卡韦、拉夫米定、替比夫定或阿德福韦。
15.在一些实施例中,所述抗炎保肝药物选自甘草酸、甘草次酸、异甘草酸镁、甘草酸铵、甘草酸二铵、水飞蓟素、双环醇、硫普罗宁或青霉胺。
16.在一些实施例中,所述化疗药物选自喜树碱、10-羟基喜树碱、7-乙基-10-羟基喜树碱、伊立替康、拓扑替康、长春碱、长春新碱、长春瑞滨、长春地辛、阿糖胞苷、吉西他滨、安西他滨、5-氟尿嘧啶、氟代脱氧尿苷酸、6-巯基嘌呤、甲氨蝶呤、阿霉素、表阿霉素、阿柔比星、柔红霉素、米托蒽醌、紫杉醇、多西紫杉醇、尼莫司汀、替尼泊苷、依托泊苷、氨鲁米特或美法仑。
17.在一些实施例中,所述化疗增敏剂选自全反式维甲酸、1,3-顺式维甲酸、9-顺式维甲酸、视黄醇、视黄醛、维莫德吉、三氧化二砷、硫化砷、戈洛帕米、奎尼丁、维拉帕米、氯丙嗪、环孢菌素a、利血平、地高辛、胺碘酮、黄体酮、木黄酮、他莫昔芬、非洛地平、硝苯地平、红霉素、氟芬那酸、地尔硫卓、伐司朴达、比立考达、依克立达、唑喹达、洛伐他汀、辛伐他汀、阿托伐他汀、瑞舒伐他汀、姜黄素、人参皂苷、艾曲波帕、烟曲霉毒素c、拉帕替尼、新生霉素、柳氮磺胺吡啶或非布索坦。
18.在一些实施例中,所述抗病毒药物、抗炎保肝药物、化疗药物、化疗增敏剂的药物分子与修饰的磷酸基团-opo3h2之间有响应性连接臂。
19.在一些实施例中,所述组合药物金属有机杂化纳米组装体还含有药学上可接受的辅料。
20.在一些具体实施例中,所述辅料选自聚乙二醇、聚乙烯基吡咯烷酮、泊洛沙姆、聚乙烯醇、聚噁唑啉、维生素e聚乙二醇琥珀酸酯、胆固醇、大豆卵磷脂、igepal co-520或十六烷基三甲基溴化铵。
21.本发明还提供上述组合药物金属有机杂化纳米组装体在制备慢性乙型肝炎治疗药物中的应用,以用于慢性乙型肝炎的抗病毒和抗炎保肝联合治疗。
22.本发明还提供上述组合药物金属有机杂化纳米组装体在制备肿瘤治疗药物中的应用,以用于治疗普通肿瘤或干性相关耐药肿瘤。
23.金属有机杂化纳米组装体是由有机分子与金属离子通过离子相互作用组装形成的纳米粒,本发明将组合药物作为有机成分与金属离子通过简单混合制备杂化纳米组装体,具有载药量高、制备简单等优势。由于磷酸有机分子和金属离子作用力强,易形成杂化
纳米组装体。为了将组合药物共载在杂化纳米组装体中,需要药物带有膦酸基团(-po3h2)或磷酸基团(-opo3h2),或者通过化学修饰磷酸基团(-opo3h2),使其能够与金属离子组装形成组合药物的杂化纳米组装体。如图1所示。
24.将组合药物共载于纳米组装体中,不仅能够延长药物的体内半衰期,提升药物在病灶部位的浓度,还能够维持固定的药物比例,实现同步的药动学和组织分布,从而增强组合药物的协同治疗效果。同时,在病灶微环境生理信号(如高表达磷酸酶、乏氧、酸、高氧化/还原)刺激下,化学修饰的磷酸基团发生响应性降解而脱落,释放原型药物,保证药物活性的发挥。
附图说明
25.图1为组合药物杂化纳米组装体的制备及其响应性释药原理。
26.图2为实施例1中tfv/gap/na(zr)的透射电子显微镜(tem)和高角度环形暗场扫描透射电子显微镜(haadf-stem)表征。
27.图3为实施例1中afv/smp/na(fe)的tem表征。
28.图4为实施例1中tfv/gap/na(zr)、afv/gap/na(mg)、afv/smp/na(fe)和tfv/smp/na(cu)的体外释药。
29.图5为实施例1中tfv/gap/na(zr)和afv/smp/na(fe)的体外安全性。
30.图6为实施例1中tfv/gap/na(zr)和afv/smp/na(fe)的体外抗炎活性。
31.图7为实施例1中tfv/gap/na(zr)和afv/smp/na(fe)的体外抗病毒活性。
32.图8为实施例1中tfv/gap/na(zr)和afv/smp/na(fe)的体内药物肝组织分布。
33.图9为实施例1中tfv/gap/na(zr)和afv/smp/na(fe)的体内抗病毒活性。
34.图10为实施例1中tfv/gap/na(zr)和afv/smp/na(fe)的体内抗炎活性。
35.图11为实施例2中lamp/smp/na(hf)的tem表征。
36.图12为实施例2中tfv/gap/na(hf)和etvp/smp/na(hf)的体外释药。
37.图13为实施例2中tfv/gap/na(hf)和etvp/smp/na(hf)的体外安全性。
38.图14为实施例2中tfv/gap/na(hf)和etvp/smp/na(hf)的体外抗炎活性。
39.图15为实施例2中tfv/gap/na(hf)和etvp/smp/na(hf)的体外抗病毒活性。
40.图16为实施例2中tfv/gap/na(hf)和etvp/smp/na (hf)的体内药物肝组织分布。
41.图17为实施例2中tfv/gap/na(hf)和etvp/smp/na(hf)的体内抗病毒活性。
42.图18为实施例2中tfv/gap/na(hf)和etvp/smp/na(hf)的体内抗炎活性。
43.图19为实施例3中r-atrap/fdump/na(hf)的tem和haadf-stem表征。
44.图20为实施例3中r-atrap/fdump/na(hf)和r-crap/r-cptp/na(hf)的体外响应性释药。
45.图21为实施例3中r-atrap/fdump/na(hf)和r-crap/r-cptp/na(hf)的体外响应性释药。
46.图22为实施例3中r-atrap/fdump/na(hf)和r-crap/r-cptp/na(hf)的体外抗肿瘤活性。
47.图23为实施例3中r-atrap/fdump/na(hf)和r-crap/r-cptp/na(hf)的体内抗肿瘤活性。
48.图24为实施例4中r-verp/r-cptp/na(hf)的tem表征。
49.图25为实施例4中r-verp/r-cptp/na (hf)和r-csap/r-doxp/na(hf)的体外响应性释药。
50.图26为实施例4中r-verp/r-cptp/na(hf)和r-csap/r-doxp/na(hf)的体外响应性释药。
51.图27为实施例4中r-verp/r-cptp/na(hf)和r-csap/r-doxp/na(hf)的体外抗肿瘤活性。
52.图28为实施例4中r-verp/r-cptp/na(hf)和r-csap/r-doxp/na(hf)的体内抗肿瘤活性。
具体实施方式
53.下面结合附图和具体实施例对本发明作进一步详细说明,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
54.实施例1
55.用于慢性乙肝联合治疗的组合药物杂化纳米组装体
56.一、抗病毒药物和抗炎保肝药物的修饰
57.将抗病毒药物恩替卡韦、拉夫米定或替比夫定(1.9mmol)溶于5ml磷酸三甲酯,加入到氮气保护反应管中,三氯氧磷(0.33ml,3.8mmol)逐滴加入上述溶液中,在4℃下反应16h。反应结束后,反应液中加入10ml水猝灭反应,搅拌30min,反应液用乙酸乙酯萃取10次,收集水相并与甲醇混合旋干,得到油状产物。柱层析纯化,得到磷酸化的恩替卡韦、拉夫米定或替比夫定产物。
58.取250ml的反应瓶进行无水干燥并置换氮气保护,三氯氧磷(2ml,14.6mmol)溶于60ml无水四氢呋喃并加入反应瓶中,将抗炎保肝药物甘草次酸、水飞蓟素或双环醇(6.45mmol)溶于5.1ml无水吡啶和30ml无水四氢呋喃的混合溶液在冰浴条件下逐滴加入,保持0℃反应30min,转移到室温条件下反应2h。反应结束后,反应液减压旋蒸出去溶剂,油状残留物溶于100ml二氯甲烷,用1m的盐酸溶液洗涤,水洗,饱和食盐水洗,收集有机相,无水硫酸钠干燥。过滤,有机相旋蒸除去溶剂得到油状粗产物,柱层析纯化得到磷酸化的甘草次酸、水飞蓟素或双环醇产物。
59.二、组合药物杂化纳米组装体的制备
60.将抗病毒药物与抗炎药物在水溶液中共同与金属离子混合组装形成组合药物杂化纳米组装体。
61.将替诺福韦(tfv)、阿德福韦(afv)或磷酸化的恩替卡韦(etvp)溶于2%的f-68水溶液配制成21mm的溶液a,将磷酸化的甘草次酸(gap)或磷酸化的水飞蓟素(smp)溶于四氢呋喃配制成18mm的溶液b。将1ml的溶液a和0.2ml的溶液b共同滴加到1ml的18mm氧氯化锆2%f-68水溶液中,搅拌15min后,制备得到组合药物杂化纳米组装体tfv/gap/na(zr)、afv/gap/na(zr)、etvp/gap/na(zr)、tfv/smp/na(zr)、afv/smp/na(zr)或etvp/smp/na(zr)。将纳米组装体溶液置于透析袋中,在去离子水中透析过夜除去残留的小分子药物和有机溶
剂。透析后,将溶液加入离心管中,高速离心,弃上清液,加入去离子水洗涤(重悬+洗涤)两次。最后,纳米组装体重悬浮于生理盐水中,采用粒径分析仪对组装体的粒径和多分散系数(pdi)进行表征,结果如表1所示。选取tfv/gap/na(zr)通过透射电子显微镜(tem)进行形貌表征和高角度环形暗场扫描透射电子显微镜(haadf-stem)进行元素mapping表征,结果如图2所示。
62.表1组合药物杂化纳米组装体的粒径表征
[0063][0064]
将tfv、afv或etvp溶于3ml水配制成0.3mm的溶液,加入到70ml氯仿中,加入1.82g的十六烷基三甲基溴化铵和3ml正己醇,将gap或smp溶于1ml四氢呋喃配制成0.2mm的溶液加入到上述溶液中,35℃搅拌30min,加入1.6ml浓度为0.5m的mgcl2(或cacl2、cucl2、fecl3)水溶液,形成组合药物的杂化纳米组装体tfv/gap/na(mg)、afv/gap/na(mg)、etvp/gap/na(ca)、tfv/smp/na(cu)、afv/smp/na(fe)、etvp/smp/na(fe),室温继续搅拌12h,连续离心并重悬浮洗涤三次。最后,杂化纳米组装体重悬浮于生理盐水中,用粒径分析仪对组装体的粒径和pdi进行表征,结果如表2所示。选取afv/smp/na(fe)通过tem进行形貌表征(图3)。
[0065]
表2组合药物杂化纳米组装体的粒径表征
[0066][0067]
三、组合药物杂化纳米组装体的药物释放
[0068]
带有乙肝病毒的肝脏中磷酸酶水平升高,为了模拟肝脏部位的药物释放条件,将1ml的组合药物杂化纳米组装体(tfv/gap/na(zr)、afv/gap/na(mg)、afv/smp/na(fe)或tfv/smp/na(cu))加入透析袋,同时加入1u/ml的磷酸酶(模拟乙肝高磷酸酶环境),将透析袋密封好后浸润在40ml含有吐温80的pbs释放介质中,固定时间点取样,用lc-ms/ms测相应药物浓度,并计算药物释放量。药物释放曲线如图4所示。在模拟肝脏高磷酸酶水平条件下,
磷酸酶水解磷酸基团,杂化纳米组装体中的抗病毒药物和抗炎保肝药物能够快速释放出来。
[0069]
四、组合药物杂化纳米组装体的体外安全性和抗炎活性测定
[0070]
1.组合药物杂化纳米组装体的体外安全性考察
[0071]
分别将raw264.7细胞和l-02细胞按每孔4
×
104个细胞的密度接种于96孔板中,培养24h后,吸出培养基。加入含有不同药物浓度杂化纳米组装体(tfv/gap/na(zr)或afv/smp/na(fe))的无血清培养基,在细胞培养箱中分别孵育24h和48h,用cck-8检测试剂检测细胞活性。细胞存活率结果如图5所示,不同药物浓度的杂化纳米组装体孵育24h和48h后,细胞活性与空白组相比都没有明显降低现象,说明这些组合药物杂化纳米组装体都是生物安全的。
[0072]
2.组合药物杂化纳米组装体的体外抗炎活性考察
[0073]
将raw264.7细胞按每孔4
×
104个细胞的密度接种于96孔板中,培养24h后,吸出培养基。加入含有杂化纳米组装体(tfv/gap/na(zr)或afv/smp/na(fe),gap或smp为40μm)和lps(1μg/ml)的无血清培养基,在培养箱中孵育24h后,收集细胞上清液,合理稀释后用tnf-α、il-1β、il-6elisa试剂盒测定炎症因子水平,考察gap的体外抗炎活性。体外抗炎结果如图6所示,细胞中加入lps后炎症因子水平明显升高,加入不同的组合药物杂化纳米组装体后,炎症因子水平明显降低,说明这些组合药物杂化纳米组装体有很好的抗炎活性。
[0074]
五、组合药物杂化纳米组装体的体外抗病毒活性测定
[0075]
将hepg2.2.15细胞按每孔4
×
104个细胞的密度接种于96孔板中,培养24h后,吸出培养基。加入含有杂化纳米组装体(tfv/gap/na(zr)或afv/smp/na(fe))的新培养基,在培养箱中孵育每3天换新的含有药物的培养基,分别在3、6、9天时,观察细胞状态后吸取上清液,进行hbv dna测定分析。使用通用基因组dna提取试剂盒提取hbv dna,并在cfx96 real-time pcr检测系统(bio-rad)中用taqman探针进行病毒拷贝数检测。体外抗病毒结果如图7所示,说明这些组合药物杂化纳米组装体对乙肝病毒有很好的持续抑制效果。
[0076]
六、组合药物杂化纳米组装体的体内药动学考察
[0077]
将c57bl/6小鼠按每组10只随机分组,尾静脉注射组合药物杂化纳米组装体制剂(tfv/gap/na(zr)(tfv 6mg/kg,gap 3mg/kg)或afv/smp/na(fe)(afv 6mg/kg,smp3mg/kg))和对应的游离组合药物(tfv+gap或afv+smp),在预定间隔时间点,每组五只小鼠眼眶取血,另五只小鼠在相邻间隔时间点取血,样品处理后用lc-ms/ms系统进行分析测定药物的量。药物动力学参数使用phoenix winnonlin动力学软件的非房室模型计算,结果如表3、4所示,杂化纳米组装体制剂组的药动各项参数比对应游离药物组都明显改善,药物的体内半衰期显著延长。
[0078]
表3 tfv/gap/na(zr)和游离(tfv+gap)的药物代谢动力学参数
[0079][0080]
表4 afv/smp/na(fe)和游离(afv+smp)的药物代谢动力学参数
[0081][0082]
七、组合药物杂化纳米组装体的肝组织药物分布考察
[0083]
将c57bl/6小鼠按每组35只随机分组,尾静脉注射组合药物杂化纳米组装体制剂(tfv/gap/na(zr)(tfv 6mg/kg,gap 3mg/kg)或afv/smp/na(fe)(afv 6mg/kg,smp 3mg/kg))和对应相同浓度的游离组合药物(tfv+gap或afv+smp),在预定时间点,每组取五只小鼠处死后收集肝脏,洗净后称取0.1g肝组织,研磨处理后,用lc-ms/ms测定肝脏中药物浓度。结果如图8所示,杂化纳米组装体制剂组比对应游离药物可以显著促进药物在肝脏积聚。
[0084]
八、组合药物杂化纳米组装体的体内抗病毒活性考察
[0085]
将hbv基因转染的c57bl/6小鼠按每组5只随机分组,尾静脉注射组合药物杂化纳米组装体制剂(tfv/gap/na(zr)(tfv 6mg/kg,gap 3mg/kg)或afv/smp/na(fe)(afv 6mg/kg,smp 3mg/kg)),每三天给药一次,连续给药15天。分别在首次给药后3、6、9、12、15天时,对小鼠眼眶取血并分离血清,进行hbv dna提取,在cfx96 real-time pcr检测系统(bio-rad)中用taqman探针进行病毒拷贝数检测。在第15天时,将小鼠处死收集肝脏,称取0.1g肝组织,匀浆处理后离心取上清,通过pcr方法测定肝脏中hbv拷贝数。结果如图9所示,连续给药杂化纳米组装体制剂可以明显抑制血液和肝脏中hbv水平,说明这些组合药物杂化纳米组装体对乙肝病毒有最优的持续抑制效果。
[0086]
九、组合药物杂化纳米组装体的体内抗炎活性考察
[0087]
将c57bl/6小鼠按每组6只随机分组,尾静脉注射组合药物杂化纳米组装体制剂(tfv/gap/na(zr)(tfv 6mg/kg,gap 3mg/kg)或afv/smp/na(fe)(afv 6mg/kg,smp 3mg/
kg)),每三天给药一次,连续给药15天。最后一次给药2h后,给药组小鼠腹腔注射0.2%的四氯化碳/玉米油溶液,四氯化碳给药剂量为32mg/kg,来诱导急性肝损伤模型。注射四氯化碳20小时后,对所有小鼠眼眶取血,然后小鼠处死并收集肝组织。将收集的血样离心后取上层血清,经过适当稀释后用tnf-α、il-1β、和il-6elisa试剂盒测定炎症因子水平。将称取0.1g肝组织,匀浆处理后,经过适当稀释后用tnf-α、il-1β、和il-6elisa试剂盒测定炎症因子水平。结果如图10所示,四氯化碳诱导肝损伤后,血液和肝脏中炎症因子水平明显升高,预给药杂化纳米组装体制剂显著降低血液和肝脏中的炎症因子水平,说明这些组合药物杂化纳米组装体有最优的抗炎保肝效果。
[0088]
实施例2
[0089]
用于慢性乙肝联合治疗的组合药物杂化纳米组装体
[0090]
一、组合药物杂化纳米组装体的制备
[0091]
将抗病毒药物与抗炎药物在水溶液中共同与金属离子混合组装形成组合药物杂化纳米组装体。
[0092]
将tfv、etvp或磷酸化的拉夫米定(lamp)溶于2%的pvp水溶液配制成21mm的a溶液,将gap或smp溶于四氢呋喃制成18mm的b溶液,将1ml的a溶液和0.2ml的b溶液共同滴加到1ml的18mm四氯化铪2%pvp水溶液中,搅拌15min后,制备得到组合药物杂化纳米组装体tfv/gap/na(hf)、etvp/gap/na(hf)、lamp/gap/na(hf)、tfv/smp/na(hf)、etvp/smp/na(hf)或lamp/smp/na(hf),将组装体溶液置于透析袋中,在去离子水中透析过夜除去残留的小分子药物。将透析袋中的溶液高速离心,白色组装体纳米粒沉积在离心管底部。弃上清液,加入去离子水洗涤沉淀并离心两次。最后,组合药物杂化纳米组装体重悬浮于生理盐水中,用电位粒径分析仪对组装体的粒径进行表征,结果如表5所示。选取lamp/smp/na(hf)通过tem进行形貌表征(图11)。
[0093]
表5组合药物杂化纳米组装体的粒径表征
[0094][0095]
二、组合药物杂化纳米组装体的药物释放
[0096]
将1ml的组合药物杂化纳米组装体(tfv/gap/na(hf)或etvp/smp/na(hf))加入透析袋,同时加入1u/ml的磷酸酶(模拟乙肝高磷酸酶环境),将透析袋密封好后浸润在40ml含有吐温80的pbs释放介质中,固定时间点取样,用lc-ms/ms测定相应药物浓度,并计算药物释放量。药物释放曲线如图12所示。在模拟肝脏高磷酸酶水平条件下,杂化纳米组装体中的抗病毒药物和抗炎保肝药物能够逐渐释放出来。
[0097]
三、组合药物杂化纳米组装体的体外安全性和抗炎活性测定
[0098]
1.组合药物杂化纳米组装体的体外安全性考察
[0099]
分别将raw264.7细胞和l-02细胞按每孔4
×
104个细胞的密度接种于96孔板中,培养24h后,吸出培养基。加入含有不同药物浓度杂化纳米组装体(tfv/gap/na(hf)或etvp/smp/na(hf))的无血清培养基,在细胞培养箱中分别孵育24h和48h,用cck-8检测试剂检测细胞活性。细胞存活率结果如图13所示,不同药物浓度的杂化纳米组装体孵育24h和48h后,细胞活性与空白组相比都没有明显降低现象,说明这些组合药物杂化纳米组装体都是生物安全的。
[0100]
2.组合药物杂化纳米组装体的体外抗炎活性考察
[0101]
将raw264.7细胞按每孔4
×
104个细胞的密度接种于96孔板中,培养24h后,吸出培养基。加入含有杂化纳米组装体(tfv/gap/na(hf)或etvp/smp/na(hf),gap或smp为40μm)和lps(1μg/ml)的无血清培养基,在培养箱中孵育24h后,收集细胞上清液,合理稀释后用tnf-α、il-1β、il-6elisa试剂盒测定炎症因子水平,考察gap的体外抗炎活性。体外抗炎结果如图14所示,细胞中加入lps后炎症因子水平明显升高,加入不同的组合药物杂化纳米组装体后,炎症因子水平明显降低,说明这些组合药物杂化纳米组装体有最优的抗炎活性。
[0102]
四、组合药物杂化纳米组装体的体外抗病毒活性测定
[0103]
将hepg2.2.15细胞按每孔4
×
104个细胞的密度接种于96孔板中,培养24h后,吸出培养基。加入含有杂化纳米组装体(tfv/gap/na(hf)或etvp/smp/na(hf),tfv或etv为154μm)的新培养基,在培养箱中孵育每3天换新的含有药物的培养基,分别在3、6、9天时,观察细胞状态后吸取上清液,进行hbv dna测定分析。使用通用基因组dna提取试剂盒提取hbv dna,并在cfx96 real-time pcr检测系统(bio-rad)中用taqman探针进行病毒拷贝数检测。体外抗病毒结果如图15所示,说明这些组合药物杂化纳米组装体对乙肝病毒有最优的持续抑制效果。
[0104]
五、组合药物杂化纳米组装体的体内药动学考察
[0105]
将c57bl/6小鼠按每组10只随机分组,尾静脉注射组合药物杂化纳米组装体制剂(tfv/gap/na(hf)(tfv 6mg/kg,gap 3mg/kg)或etvp/smp/na(hf)(etvp 6mg/kg,smp 3mg/kg))和对应的游离组合药物(tfv+gap或etv+smp),在预定间隔时间点,每组五只小鼠眼眶取血,另五只小鼠在相邻间隔时间点取血,样品处理后用lc-ms/ms系统进行分析测定药物的量。药物动力学参数使用phoenix winnonlin动力学软件的非房室模型计算,结果如表6、7所示,杂化纳米组装体制剂组的药动各项参数比对应游离药物组都明显改善,药物的体内半衰期显著延长。
[0106]
表6 tfv/gap/na(hf)和游离(tfv+gap)的药物代谢动力学参数
[0107][0108]
表7 etvp/smp/na(hf)和游离(etv+smp)的药物代谢动力学参数
[0109][0110][0111]
六、组合药物杂化纳米组装体的肝组织药物分布考察
[0112]
将c57bl/6小鼠按每组35只随机分组,尾静脉注射组合药物杂化纳米组装体制剂(tfv/gap/na(hf)(tfv 6mg/kg,gap 3mg/kg)或etvp/smp/na(hf)(etvp 6mg/kg,smp 3mg/kg))和对应相同浓度的游离组合药物(tfv+gap或etvp+smp),在预定时间点,每组取五只小鼠处死后收集肝脏,洗净后称取0.1g肝组织,研磨处理后,用lc-ms/ms测定肝脏中药物浓度。结果如图16所示,杂化纳米组装体制剂组比对应游离药物可以显著促进药物在肝脏积聚。
[0113]
七、组合药物杂化纳米组装体的体内抗病毒活性考察
[0114]
将hbv基因转染的c57bl/6小鼠按每组5只随机分组,尾静脉注射组合药物杂化纳米组装体制剂(tfv/gap/na(hf)(tfv 6mg/kg,gap 3mg/kg)或etvp/smp/na(hf)(etvp 6mg/kg,smp 3mg/kg)),每三天给药一次,连续给药15天。分别在首次给药后3、6、9、12、15天时,对小鼠眼眶取血并分离血清,进行hbv dna提取,在cfx96 real-time pcr检测系统(bio-rad)中用taqman探针进行病毒拷贝数检测。在第15天时,将小鼠处死收集肝脏,称取0.1g肝组织,匀浆处理后离心取上清,通过pcr方法测定肝脏中hbv拷贝数。结果如图17所示,连续给药杂化纳米组装体制剂可以明显抑制血液和肝脏中hbv水平,说明这些组合药物杂化纳米组装体对乙肝病毒有最优的持续抑制效果。
[0115]
八、组合药物杂化纳米组装体的体内抗炎活性考察
[0116]
将c57bl/6小鼠按每组6只随机分组,尾静脉注射组合药物杂化纳米组装体制剂
(tfv/gap/na(hf)(tfv 6mg/kg,gap 3mg/kg)或etvp/smp/na(hf)(etvp 6mg/kg,smp 3mg/kg)),每三天给药一次,连续给药15天。最后一次给药2h后,给药组小鼠腹腔注射0.2%的四氯化碳/玉米油溶液,四氯化碳给药剂量为32mg/kg,来诱导急性肝损伤模型。注射四氯化碳20小时后,对所有小鼠眼眶取血,然后小鼠处死并收集肝组织。将收集的血样离心后取上层血清,经过适当稀释后用tnf-α、il-1β、和il-6elisa试剂盒测定炎症因子水平。将称取0.1g肝组织,匀浆处理后,经过适当稀释后用tnf-α、il-1β、和il-6elisa试剂盒测定炎症因子水平。结果如图18所示,四氯化碳诱导肝损伤后,血液和肝脏中炎症因子水平明显升高,预给药杂化纳米组装体制剂显著降低血液和肝脏中的炎症因子水平,说明这些组合药物杂化纳米组装体有最优的抗炎保肝效果。
[0117]
实施例3
[0118]
用于耐药肿瘤联合治疗的组合药物杂化纳米组装体
[0119]
一、化疗药物和化疗增敏剂/分化诱导剂的修饰
[0120]
化疗药物修饰
[0121]
将5-氟-2
’‑
脱氧尿核苷、喜树碱、阿霉素或紫杉醇(1.9mmol)溶于5ml磷酸三甲酯,加入到氮气保护反应管中,三氯氧磷(0.33ml,3.8mmol)逐滴加入上述溶液中,在4℃下反应16h。反应结束后,反应液中加入10ml水猝灭反应,搅拌30min,反应液用乙酸乙酯萃取10次,收集水相并与甲醇混合旋干,得到油状产物。柱层析得到磷酸化产物。
[0122]
磷酸化的低氧响应分化诱导剂合成
[0123]
将全反式维甲酸、1,3-顺式维甲酸或9-顺式维甲酸(10mmol)溶于100ml二氯甲烷和6ml二甲亚砜的混合溶液,加入4-(4-(羟甲基)苯基)二氮烯基)苯酚(3.16g,10mmol),1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(2.4g,12mmol),1-羟基苯并三唑(1.62g,12mmol),n,n-二异丙基乙胺(5ml),室温过夜反应。反应结束后,反应液水洗,饱和食盐水洗,无水硫酸钠干燥,过滤后有机相旋干得到粗产物,柱层析得到偶氮苯修饰产物。
[0124]
将三氯氧磷(0.2ml,2.3mmol)溶于2ml无水thf中,加入到氮气保护反应管并置于0℃冰水混合浴下,将偶氮苯修饰的分化诱导剂(0.67mmol)溶于无水吡啶(0.53ml,6.5mmol)和3ml无水thf的混合溶液逐滴加入到上述反应液中,在0℃下反应3h。反应结束后,反应液旋干,残渣溶于乙酸乙酯,有机相水洗,稀盐酸溶液洗,饱和食盐水洗,无水硫酸钠干燥,过滤后有机相旋干得到粗产物。柱层析得到磷酸化的低氧响应产物。
[0125]
二、组合药物杂化纳米组装体的制备
[0126]
将氟代脱氧尿苷酸(fdump)、活性氧响应性磷酸化的喜树碱(r-cptp)或磷酸化的阿霉素(r-doxp)溶于5ml 2%的tpgs溶液配制成15mm的溶液,用氢氧化钠溶液调ph到弱碱性(ph=8)。将磷酸化的低氧响应的全反式维甲酸(r-atrap)或1,3-顺式维甲酸(r-crap)溶于1ml乙醇配制成76mm的溶液,和2ml的3mm四氯化铪2%tpgs溶液共同滴加到上述溶液中,搅拌15min后,形成组合药物杂化纳米组装体(r-atrap/fdump/na(hf)、r-atrap/r-cptp/na(hf)、r-atrap/r-doxp/na(hf)、r-crap/fdump/na(hf)、r-crap/r-cptp/na(hf)或r-crap/r-doxp/na(hf))。将组装体溶液置于透析袋中,在去离子水中透析过夜除去残留的小分子药物。连续离心冲悬浮洗涤三次后,冲悬浮于生理盐水中,用电位粒径分析仪对组装体的粒径进行表征,结果如表8所示。选取r-atrap/fdump/na(hf)通过tem进行形貌表征和haadf-stem进行元素mapping表征,结果如图19所示。
[0127]
表8组合药物杂化纳米组装体的粒径表征
[0128][0129]
三、组合药物杂化纳米组装体的药物释放
[0130]
将1ml的组合药物杂化纳米组装体(r-atrap/fdump/na(hf)或r-crap/r-cptp/na(hf))加入透析袋,同时加入10mm的连二硫酸钠(模拟低氧环境),将透析袋密封好后浸润在40ml含有吐温80的pbs释放介质中,固定时间点取样,用hplc测定相应药物浓度,并计算药物释放量。药物释放曲线如图20所示。在模拟肿瘤低氧条件下,组装体中低氧响应的药物快速释放出来,化疗药物缓慢释放出来。
[0131]
将1ml的组合药物杂化纳米组装体(r-atrap/fdump/na(hf)或r-crap/r-cptp/na(hf))加入透析袋,同时加入10mm的连二硫酸钠,将透析袋密封好后浸润在40ml含有吐温80的pbs释放介质中,固定时间点取样。释放12h后,透析袋中加入双氧水,放入释放介质中继续释放,在固定时间点取样,用hplc测定相应药物浓度,并计算药物释放量。药物释放曲线如图21所示。在模拟肿瘤低氧条件下,组装体中低氧响应的药物快速释放出来,化疗药物缓慢释放,加入双氧水模拟活性氧条件,化疗药物释放明显加快。
[0132]
四、组合药物杂化纳米组装体对耐药肿瘤细胞的体外细胞毒性测定
[0133]
将4t1 cscs按每孔5
×
103个细胞的密度接种于96孔超低粘附培养板中,加入含有不同药物浓度杂化纳米组装体(r-atrap/fdump/na(hf)或r-crap/r-cptp/na(hf)),放置于低氧培养箱中培养48h,用cck-8检测试剂检测细胞活性。细胞存活率结果如图22所示,经过模拟计算,r-atrap/fdump/na(hf)和r-crap/r-cptp/na(hf)的ic50值分别为0.4274和0.3510μm,说明这些组合药物杂化纳米组装体逆转了肿瘤干样细胞的耐药性,杀伤效果明显。
[0134]
五、组合药物杂化纳米组装体的体内抗肿瘤活性测定
[0135]
收集4t1 cscs并重悬于积比1:1的pbs和matrigel基质胶混合溶液中,以5
×
105个细胞/只的密度接种于腹部脱毛的balb/c小鼠左侧乳房垫下,构建耐药肿瘤小鼠模型。将荷瘤小鼠随机分组,每组六只,尾静脉注射组合药物杂化纳米组装体制剂(r-atrap/fdump/na(hf)(fdump 3.33mg/kg,r-atrap 24mg/kg)或r-crap/r-cptp/na(hf)(r-cptp 3.33mg/kg,r-crap 24mg/kg)),每两天给药一次,连续给药14天。每两天测量肿瘤长径与短径,计算肿瘤体积,检测肿瘤体积变化。结果如图23所示,组合药物杂化纳米组装体制剂组对肿瘤抑制效果最好。
[0136]
实施例4
[0137]
用于耐药肿瘤联合治疗的组合药物杂化纳米组装体
[0138]
一、组合药物杂化纳米组装体的制备
[0139]
将r-cptp、r-doxp或活性氧相应磷酸化的紫杉醇(r-ptxp)溶于5ml 2%的tpgs溶液配制成浓度为15mm的溶液,用氢氧化钠溶液调ph到弱碱性(ph=8)。将磷酸化的低氧响应的维拉帕米(r-verp)或环孢菌素a(r-csap)溶于1ml乙醇配制成76mm的溶液,和2ml的3mm四氯化铪2%tpgs溶液共同滴加到上述溶液中,搅拌15min后,形成组合药物杂化纳米组装体(r-verp/r-cptp/na(hf)、r-verp/r-doxp/na(hf)、r-verp/r-ptxp/na(hf)、r-csap/r-cptp/na(hf)、r-csap/r-doxp/na(hf)或r-csap/r-ptxp/na(hf))。将组装体溶液置于透析袋中,在去离子水中透析过夜除去残留的小分子药物。连续离心冲悬浮洗涤三次后,冲悬浮于生理盐水中,用电位粒径分析仪对组装体的粒径进行表征,结果如表13所示。选取r-verp/r-cptp/na(hf)通过tem进行形貌表征,结果如图24所示。
[0140]
表13组合药物杂化纳米组装体的粒径表征
[0141][0142]
二、组合药物杂化纳米组装体的药物释放
[0143]
将1ml的组合药物杂化纳米组装体(r-verp/r-cptp/na(hf)或r-csap/r-doxp/na(hf))加入透析袋,同时加入10mm的连二硫酸钠(模拟低氧环境),将透析袋密封好后浸润在40ml含有吐温80的pbs释放介质中,固定时间点取样,用hplc测定相应药物浓度,并计算药物释放量。药物释放曲线如图25所示。在模拟肿瘤低氧条件下,组装体中低氧响应的药物快速释放出来,化疗药物缓慢释放出来。
[0144]
将1ml的组合药物杂化纳米组装体(r-verp/r-cptp/na(hf)或r-csap/r-doxp/na(hf))加入透析袋,同时加入10mm的连二硫酸钠(模拟低氧环境),将透析袋密封好后浸润在40ml含有吐温80的pbs释放介质中,固定时间点取样。释放12h后,透析袋中加入双氧水,放入释放介质中继续释放,在固定时间点取样,用hplc测定相应药物浓度,并计算药物释放量。药物释放曲线如图26所示。在模拟肿瘤低氧条件下,组装体中低氧响应的药物快速释放出来,化疗药物缓慢释放,加入双氧水模拟活性氧条件,化疗药物释放明显加快。
[0145]
三、组合药物杂化纳米组装体对耐药肿瘤细胞的体外细胞毒性测定
[0146]
将4t1 cscs按每孔5
×
103个细胞的密度接种于96孔超低粘附培养板中,加入含有不同药物浓度杂化纳米组装体(r-verp/r-cptp/na(hf)或r-csap/r-doxp/na(hf)),放置于低氧培养箱中培养48h,用cck-8检测试剂检测细胞活性。细胞存活率结果如图27所示,经过模拟计算,r-verp/r-cptp/na(hf)和r-csap/r-doxp/na(hf)的ic50值分别为0.5293和0.1731μm,说明这些组合药物杂化纳米组装体逆转了肿瘤干样细胞的耐药性,杀伤效果明显。
[0147]
四、组合药物杂化纳米组装体的体内抗肿瘤活性测定
[0148]
收集4t1 cscs并重悬于积比1:1的pbs和matrigel基质胶混合溶液中,以5
×
105个细胞/只的密度接种于腹部脱毛的balb/c小鼠左侧乳房垫下,构建耐药肿瘤小鼠模型。将荷瘤小鼠随机分组,每组六只,尾静脉注射组合药物杂化纳米组装体制剂(r-verp/r-cptp/na(hf)(r-cptp 4mg/kg,r-verp 24mg/kg)或r-csap/r-doxp/na(hf)(r-doxp 4mg/kg,r-csap 24mg/kg)),每两天给药一次,连续给药14天。每两天测量肿瘤长径与短径,计算肿瘤体积,检测肿瘤体积变化。结果如图28所示,组合药物杂化纳米组装体制剂组具有最优的肿瘤抑制效果。
[0149]
除上述实施外,本发明还可以有其他实施方式。凡采用等同替换或等效变换形成的技术方案,均落在本发明要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1