趋化因子CCL23在制备乳腺癌免疫治疗药物中的应用
趋化因子ccl23在制备乳腺癌免疫治疗药物中的应用
技术领域
1.本技术涉及生物医药技术领域,具体而言,涉及趋化因子ccl23在制备乳腺癌免疫治疗药物中的应用。
背景技术:
2.目前,肿瘤的常规治疗方法主要包括手术切除、放疗和化疗,尽管常规疗法多年来已经取得了广泛的应用,然而其局限性也十分明显。某些器官,如胰腺部位的肿瘤手术难度极大,并且手术过程容易对患者器官造成损伤,另外,手术不能有效清除残留的肿瘤细胞,杜绝肿瘤转移;放疗和化疗则往往伴有较大的副作用,造成患者全身免疫功能下降并引起疼痛、恶心、疲劳等症状。而肿瘤的免疫治疗是通过激活患者自身的抗肿瘤免疫应答,从而达到清除肿瘤细胞的目的,其相比于手术、化疗、放疗等常规疗法,具有识别肿瘤的特异性高、毒副作用小、对患者器官的损伤小等不可替代的优势。随着免疫学理论和技术的发展,肿瘤免疫治疗在临床上取得了一系列突破性进展,然而,肿瘤免疫治疗在显现出强大的应用前景的同时,面临的障碍也日渐突显。尤其在实体瘤治疗的过程中,效应性t细胞不能有效浸润至肿瘤局部,以及肿瘤内部的免疫抑制性微环境等问题成为制约肿瘤免疫治疗疗效的主要因素。
3.正常细胞一旦转变为肿瘤细胞,即成为“非己”成分,本应被宿主的免疫系统所识别并且清除,然而肿瘤能够通过多种机制逃避和抑制抗肿瘤免疫应答,例如肿瘤细胞在快速增殖的同时会促使形成一种支持其生长、侵袭的微环境,称为肿瘤微环境(tumor microenvironment,tme)。肿瘤微环境的塑造类似于组织修复与再生的过程,其特点在于血管新生,基质重塑以及具有免疫抑制性。tme的免疫抑制性会导致抗肿瘤效应t细胞和自然杀伤细胞的浸润与功能受损,极大地限制免疫系统介导的抗肿瘤反应。因此,寻找克服肿瘤局部免疫抑制性微环境的方法对于肿瘤免疫治疗疗效的发挥具有重要意义。
4.在实体肿瘤的发生发展过程中,肿瘤间质中的各类免疫细胞通常会被肿瘤细胞“诱骗”,以促进其生长、侵袭和转移,包括巨噬细胞、髓源抑制性细胞(mdscs)、未成熟树突状细胞(idcs)和调节性t细胞 (tregs)。其中,肿瘤相关巨噬细胞(tam)通常是实体瘤中数量最丰富的免疫细胞,能以多种机制促进肿瘤生长或转移。tam被认为是m2样的巨噬细胞,其最显著的特点和作用方式是能够通过分泌il-10,tgf-β, arginase-1等细胞因子,抑制th1细胞的活化并诱导调节性t细胞 (regulatory cell,treg)的分化,从而阻止cd8
+
t细胞和自然杀伤细胞 (natural killer cell,nk)对肿瘤的裂解作用,抑制抗肿瘤免疫应答。m2 样tam同时还可产生vegf,il-1β等促血管生成因子,以及金属基质蛋白酶(matrix metalloproteinases,mmps)类,直接或间接促进肿瘤组织中的血管生成(angiogenesis)。而m1极化状态的巨噬细胞则可通过产生 il-12、cxcl9、cxcl10等细胞因子/趋化因子,促进th1细胞和cd8
+
t 细胞的分化或者浸润,起到增强抗肿瘤免疫的效应。在实际的生理环境中, tams具有较强的异质性,呈现混合复杂的基因表达谱,既表达m2相关的基因,也表达m1相关的基因。只是在tme中的细胞因子信号或低氧等环境因素,能更强地激活m2相关的转录
因子,例如stat3、stat6、 pparγ等,所以使得tams表现出偏向于m2极化的特征。而诱导tams 由m2表型向m1表型的偏转,可增强tam的抗肿瘤效应功能,同时降低其免疫抑制能力,达到肿瘤免疫治疗的目的。因此,寻找肿瘤微环境中影响tams极化和功能的关键分子,并明确其作用机理对于新的抗肿瘤药物靶点的开发具有重要的意义。
技术实现要素:
5.为了解决上述技术问题,本技术的目的在于提供一种趋化因子ccl23 在制备乳腺癌免疫治疗药物中的应用,本技术的趋化因子ccl23具有增强抗肿瘤免疫的效应,其机制在于促进巨噬细胞的m1表型极化。
6.本技术解决其技术问题是采用以下技术方案来实现的。
7.通过分析癌症基因组图谱(the cancer genome atlas,tcga)数据库,对目前已知的所有趋化因子家族成员进行了筛选,鉴定出ccl23/m9与乳腺癌患者生存期具有显著正相关(即高表达提示良好预后),而其表达在乳腺癌患者中显著下降,提示ccl23/m9的表达降低可能促进了乳腺癌进展。因在小鼠中,ccl23的同源蛋白为ccl9,因此本技术均写作 ccl23/m9。通过进一步分析和实验发现:(1)乳腺癌中ccl23/m9的表达与主要抗肿瘤效应细胞-cd4
+
th1细胞及cd8
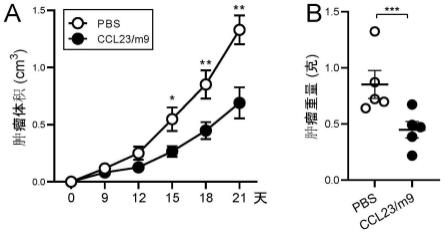
+
t细胞的浸润呈显著正相关,即ccl23/m9高表达的肿瘤体现出免疫活化特征;(2)巨噬细胞是乳腺癌中ccl23/m9的主要作用靶细胞和主要分泌细胞;(3)体内注射ccl23/m9缓解了小鼠乳腺癌的生长,并上调肿瘤组织m1巨噬细胞特征性基因表达(m1巨噬细胞可促进cd4
+
th1细胞和cd8
+
t细胞的浸润和功能);(4)ccl23/m9体外处理能够增强巨噬细胞中m1特征性基因的表达。以上数据表明,ccl23/m9可通过诱导乳腺癌中tam的m1极化,分泌il-12、cxcl9、cxcl10等细胞因子,促进th1细胞及cd8
+
t细胞的趋化和功能,增强抗肿瘤免疫微环境的形成,从而可能作为乳腺癌免疫治疗的新策略。基于此,本技术进一步利用小鼠肿瘤模型,结合体外细胞、分子机制实验,阐明ccl23/m9通过重塑tam功能,促进抗肿瘤免疫微环境形成的功能效应。并通过临床患者样本联合生信分析的方式,为基于 ccl23/m9的免疫治疗策略提供理论基础、实验依据以及临床可行性证据。
8.相对于现有技术,本技术的实施例至少具有如下优点或有益效果:
9.1、本技术提供的趋化因子ccl23在制备乳腺癌免疫治疗药物中的应用,首创性的提出:(1)乳腺癌中ccl23/m9的表达与主要抗肿瘤效应细胞-cd4
+
th1细胞及cd8
+
t细胞的浸润呈显著正相关,即ccl23/m9 高表达的肿瘤体现出免疫活化特征;(2)巨噬细胞是乳腺癌中ccl23/m9 的主要作用靶细胞和主要分泌细胞;(3)体内注射ccl23/m9缓解了小鼠乳腺癌的生长,并上调肿瘤组织m1巨噬细胞特征性基因表达(m1巨噬细胞可促进cd4
+
th1细胞和cd8
+
t细胞的浸润和功能);(4) ccl23/m9体外处理能够增强巨噬细胞中m1特征性基因的表达。
10.2、本技术通过构建小鼠肿瘤模型,结合体外细胞、分子机制实验,阐明ccl23/m9通过重塑tam功能,促进抗肿瘤免疫微环境形成的功能效应。并通过临床患者样本联合生信分析的方式,为基于ccl23/m9的免疫治疗策略提供理论基础、实验依据以及临床可行性证据。
附图说明
11.为了更清楚地说明本技术实施例的技术方案,下面将对实施例中所需要使用的附
图作简单地介绍,应当理解,以下附图仅示出了本技术的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
12.图1为本技术实施例1中tcga数据库分析趋化因子家族的结果图;
13.其中,图1a为趋化因子家族在乳腺癌患者中的表达变化(横坐标),以及与患者os的相关性(纵坐标);图1b为ccl23/m9的泛癌表达变化;
14.图2为本技术实施例1中tcga数据库分析结果和roc分析结果;其中,图2a为tcga数据库分析ccl23/m9水平与乳腺癌患者os、dfs 及pfi的相关性;图2b为geo数据库分析结果;图2c为roc分析乳腺癌患者ccl23/m9表达的曲线下面积
15.图3为本技术实施例1中ccl23/m9
hi
组和ccl23/m9
low
组乳腺癌患者肿瘤组织基因表达谱差异和kegg/go富集分析结果;其中图3a为 ccl23/m9
hi
组和ccl23/m9
low
组乳腺癌患者肿瘤组织基因表达谱差异;图 3b为kegg/go富集分析结果;
16.图4为本技术实施例1中ccl23/m9表达水平与t细胞、nk细胞、巨噬细胞及dc的免疫浸润相关性分析;其中,图4a为乳腺癌中ccl23/m9的表达丰度与th1细胞和th2细胞的免疫浸润相关性分析结果;图4b为乳腺癌中ccl23/m9的表达丰度与th17细胞和treg的免疫浸润相关性分析结果;图4c为乳腺癌中ccl23/m9的表达丰度与cd8
+
t细胞和nk细胞的免疫浸润相关性分析结果;图4d为乳腺癌中ccl23/m9的表达丰度与树突状细胞(dc)和巨噬细胞(macrophages)的免疫浸润相关性分析结果;
17.图5为本技术实施例1中tcga数据库分析ccl23/m9受体ccr1与各免疫细胞亚群signature相关性;
18.图6为本技术实施例1中单细胞测序数据集分析ccr1在乳腺癌患者 (6a)和小鼠(6b)中的表达分布;
19.图7为本技术实施例2中小鼠肿瘤生长情况;其中,图7a为小鼠肿瘤生长曲线;图7b为小鼠肿瘤重量变化情况;
20.图8为本技术实施例2中qpcr检测m1巨噬标志基因表达结果;
21.图9为本技术实施例2中ccl23/m9刺激bmdm以及ifn-γ诱导的 m1 bmdm,qpcr相应基因表达情况。
具体实施方式
22.为使本技术实施例的目的、技术方案和优点更加清楚,下面将对本技术实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
23.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考具体实施例来详细说明本技术。
24.本技术实施例中提供一种趋化因子ccl23在制备乳腺癌免疫治疗药物中的应用。
25.本技术提供的趋化因子ccl23在制备乳腺癌免疫治疗药物中的应用,首创性的提出:(1)乳腺癌中ccl23/m9的表达与主要抗肿瘤效应细胞
‑ꢀ
cd4
+
th1细胞及cd8
+
t细胞的浸润呈显著正相关,即ccl23/m9高表达的肿瘤体现出免疫活化特征;(2)巨噬细胞是乳腺癌中
ccl23/m9的主要作用靶细胞和主要分泌细胞;(3)体内注射ccl23/m9缓解了小鼠乳腺癌的生长,并上调肿瘤组织m1巨噬细胞特征性基因表达(m1巨噬细胞可促进cd4
+
th1细胞和cd8
+
t细胞的浸润和功能);(4)ccl23/m9 体外处理能够增强巨噬细胞中m1特征性基因的表达。
26.本技术通过构建小鼠肿瘤模型,结合体外细胞、分子机制实验,阐明 ccl23/m9通过重塑tam功能,促进抗肿瘤免疫微环境形成的功能效应。并通过临床患者样本联合生信分析的方式,为基于ccl23/m9的免疫治疗策略提供理论基础、实验依据以及临床可行性证据。
27.在本技术的一些实施例中,上述趋化因子ccl23在乳腺癌微环境中的作用靶细胞包括巨噬细胞。
28.在本技术的一些实施例中,上述趋化因子ccl23在乳腺癌微环境中的来源细胞为巨噬细胞。
29.以下结合实施例对本技术的特征和性能作进一步的详细描述。
30.实施例1
31.生信分析趋化因子家族成员在乳腺癌中的表达变化和预后价值
32.趋化因子的筛选:利用tcga数据库对四类趋化因子家族(ccl家族、 cxcl家族、cx3cl家族以及xcl家族)所有成员的表达变化(与癌旁相比),以及与患者预后的相关性进行了分析,其分析结果如图1所示。
33.图1中,ccl家族(橙气泡),cxcl家族(蓝气泡),cx3cl家族 (绿气泡)以及xcl家族(黄气泡)。从图1a中可以看出,共有9个趋化因子(位于横线上方)的表达与患者的总生存期(os)呈显著性相关 (p《0.05,即-log10(p)》1.30)。图1a中,以图1a中的横线为基准,横线上方的为具有显著性差异(p《0.05),横线下方的为无显著性差异 (p》0.05),另外,两根竖线围合成的中间部分为具有一定的差异,但是无2倍差异变化,其余部分的趋化因子均具有2倍或者及其以上的差异变化。由图1a可以看出,位于横线上方的左边部分(下调的趋化因子)有 4个趋化因子,位于横线上方的右边部分(上调的趋化因子)有2个趋化因子,即共有6个趋化因子的表达变化倍数(癌组织vs正常组织)超过2 倍。而ccl23/m9是唯一表达下降超过2倍,且与乳腺癌患者os呈正相关的趋化因子。从图1b中可以看出,除乳腺癌(brca)之外, ccl23/m9在多种类型癌组织中的表达均呈现降低(癌组织vs正常组织),表明肿瘤中ccl23/m9的下调是较为普遍的现象。
34.进一步的,通过tcga数据库分析ccl23/m9水平与乳腺癌患者os, dfs及pfi的相关性,其结果如图2a所示。图2a中ccl23
low
代表 ccl23/m9低表达乳腺癌患者,ccl23
hi
代表ccl23/m9高表达乳腺癌患者。从图2a中可以看出,除os外,ccl23/m9与乳腺癌患者的无病生存期 (dfs)以及无进展间隔(pfi)亦呈显著性正相关(p《0.05)。又通过 geo数据库分析ccl23/m9水平与乳腺癌患者os的相关性,其结果如图 2b所示(p《0.01),图2b中,low代表ccl23/m9低表达乳腺癌患者, high代表ccl23/m9高表达乳腺癌患者。同样发现ccl23/m9高表达乳腺癌患者的os显著优于ccl23/m9低表达患者,以上结果表明,ccl23/m9 可作为乳腺癌预后评估的有效指标。此外,又通过roc曲线下面积 (auc)来评估ccl23/m9的诊断效能,其中,auc值用来表示预测的准确性。当auc>0.5时,auc越接近于1,说明诊断效果越好。auc在 0.7-0.9时有一定准确性,auc在0.9以上时有较高准确性。其结果如图 2c所示,从图2c中可以看出,其auc值为0.858,表明ccl23/m9表达也可作为乳腺癌诊断的优良指标。
35.进一步的,通过研究ccl23/m9高表达组(ccl23/m9
hi
)和 ccl23/m9低表达组
(ccl23/m9
low
)患者之间基因表达谱的差异,进行 kegg/go富集分析,以及ccl23/m9
hi
和ccl23/m9
low
患者之间肿瘤免疫微环境的差异,来进一步分析ccl23/m9表达水平对乳腺癌患者肿瘤组织基因表达谱的影响,其分析结果如图3所示。从图3a中可以看出, ccl23/m9高表达组肿瘤(ccl23/m9
hi
)相比于ccl23/m9低表达组肿瘤 (ccl23/m9
low
),存在1478个显著上调的基因,2659个显著下调的基因 (p《0.05,|log2(fc)|≥1)。对ccl23/m9
hi
组中上调的基因进行 go/kegg可视化网络分析,其结果如图3b所示,可以发现,多种与肿瘤免疫相关的条目存在富集,主要涉及t细胞功能。
36.由于t细胞亚群的分化平衡(主要指cd4
+
t细胞)对肿瘤免疫的结局有着关键性影响,因此进一步通过免疫浸润分析了ccl23/m9与四种主要cd4
+
t细胞亚群特征性转录因子(th1、th2、th17、treg)以及cd8
+ t细胞的相关性,其分析结果如图4所示。以斯皮尔曼等级相关系数 spearman(r)作为评估标准,r=0表示两者之间没有相关性,|r|越接近于 1则相关性越强,r《0表示负相关性,r>0表示正相关性,一般r>0.5,表示强相关,r《-0.5,表示弱相关。由图4可以看出,乳腺癌中ccl23/m9 的表达丰度与th1细胞和cd8
+
t细胞signature具有较强相关性 (p《0.001),而与th17细胞、treg signature的相关性相对较弱(p=0.003, p《0.001),与th2细胞signature无显著性相关(p=0.411);除t细胞亚群之外,ccl23/m9与巨噬细胞(macrophages)和树突状细胞(dc) signature也具有较强相关性(p《0.001),而与nk细胞signature的相关性较弱(p《0.001)。以上结果表明,ccl23/m9可以通过促进促进th1细胞及cd8
+
t细胞的趋化和功能,增强抗肿瘤免疫微环境的形成从而增强抗肿瘤免疫。
37.进一步的,通过研究ccl23/m9及其受体ccr1在乳腺癌中的细胞特异性表达模式,确定其主要产生细胞和作用靶细胞。通过tcga数据库分析ccr1与各免疫细胞亚群signature相关性,其结果如图5所示,tcga 数据库分析结果表明,乳腺癌患者中ccr1的水平与巨噬细胞 (macrophages)signature的关联性在所有涵盖的免疫细胞中居首。此外,通过分析单细胞测序数据发现,乳腺癌患者中ccr1阳性细胞与单核/巨噬细胞(mono/macro)的位置高度重合(图6a)。进一步的对乳腺癌小鼠单细胞进行测序,其结果如图6b所示,可以发现ccr1主要表达于单核/ 巨噬细胞中,而其在t细胞、b细胞、肿瘤细胞、内皮细胞(endothelial) 及成纤维细胞(fibroblast)等中的表达量极低。以上结果表明, ccl23/m9主要作用于巨噬细胞,从而影响乳腺癌抗肿瘤免疫微环境的形成,且这一作用方式在人和小鼠之间相对保守。
38.实施例2
39.实施例1的生信分析结果表明ccl23/m9可能具有增强抗肿瘤免疫的效应,为了验证这一猜想,通过构建e0771乳腺癌小鼠模型,并给予 ccl23/m9腹腔注射治疗。
40.具体操作步骤如下:
41.1、构建小鼠肿瘤模型
42.将e0771小鼠乳腺癌细胞在荷瘤前一天进行传代,使接种当日细胞汇合度达到约80%,胰酶消化细胞,中止消化后将细胞收集至15ml离心管, 500rcf离心5min,弃去上清。加1ml pbs重悬细胞,使用血球计数板进行计数。用pbs将细胞密度稀释调整至3
×
106个/ml混匀细胞悬液,用胰岛素注射器吸取100μl细胞悬液,注射入6-8周c57bl/6小鼠皮下,即每只小鼠注射3
×
105个细胞。皮下注射当天为第0天,此后每隔2天观测肿瘤生长并使用游标卡尺测量荷瘤小鼠的肿瘤大小,记录肿瘤的长径(l) 与短径(w),肿瘤体积(v)计算公式如
下:v肿瘤=(长径l
×
短径 w/2)。3-4周后,取小鼠肺脏、肝脏,观察肿瘤转移情况,统计转移灶数量。
43.2、ccl23/m9治疗
44.将e0771乳腺癌细胞以3
×
105个皮下荷瘤至6-8周c57bl/6小鼠,待肿瘤可触及时(约7天),将小鼠ccl9以200μl pbs稀释,通过腹腔注射至荷瘤小鼠,剂量为2μg/只,每3日注射一次。对照组小鼠给予200μlpbs腹腔注射。
45.监测小鼠肿瘤生长曲线,其结果如图7所示,*p《0.05;**p《0.01; ***p《0.001;对其肿瘤组织使用qpcr检测m1巨噬标志基因表达情况,其结果如图8所示。从图7a和图7b中可以看出,与pbs组相比,接受 ccl23/m9注射小鼠的肿瘤生长受到了显著抑制。而且经qpcr分析发现, ccl23/m9组小鼠肿瘤组织中m1型巨噬特征性细胞因子tnf-α、il-12、 cxcl9以及cxcl10的表达较pbs组小鼠显著上调,如图8所示,** p《0.01;***p《0.001。
46.进一步的,在体外利用ccl23/m9刺激小鼠骨髓来源巨噬细胞 (bmdm),其具体操作步骤如下:
47.颈椎脱臼处死小鼠,取小鼠腿骨四根,注射器吹出骨髓细胞。经离心,裂解红细胞后,铺于6孔板内,加入含10ng/ml巨噬细胞集落刺激因子 (m-csf)的dmem培养基进行培养,第三天补充新鲜培养基2ml,第五天全换液,第七天巨噬细胞成熟。经胰酶(含edta)消化后,计数,重新铺板。过夜后给予不同浓度(10ng/ml、20ng/ml、50ng/ml)ccl23/m9 刺激,检测巨噬细胞m1型基因表达,检测ccl23/m9表达,其结果如图 9所示,*p《0.05;**p《0.01;***p《0.001。
48.由图9可以看出,在体外利用ccl23/m9刺激小鼠bmdm,可以发现 ccl23/m9处理可上调bmdm中tnf-α、il-12、cxcl9以及cxcl10的表达水平;而用ccl23/m9刺激ifn-γ诱导形成m1巨噬细胞后, ccl23/m9促进上述分子表达的效应得到了进一步增强;然而,ccl23/m9 处理则抑制了免疫抑制性细胞因子il-10的表达。以上实验结果表明 ccl23/m9可通过增强巨噬细胞的m1极化促进抗肿瘤免疫应答,延缓肿瘤进展。
49.综上所述,本技术实施例的趋化因子ccl23在制备乳腺癌免疫治疗药物中的应用,通过分析癌症基因组图谱(the cancer genome atlas, tcga)数据库,对目前已知的所有趋化因子家族成员进行了筛选,鉴定出ccl23/m9与乳腺癌患者生存期具有显著正相关(即高表达提示良好预后),而其表达在乳腺癌患者中显著下降,提示ccl23/m9的表达降低可能促进了乳腺癌进展。通过进一步分析和实验发现:(1)乳腺癌中 ccl23/m9的表达与主要抗肿瘤效应细胞-cd4
+
th1细胞及cd8
+
t细胞的浸润呈显著正相关,即ccl23/m9高表达的肿瘤体现出免疫活化特征; (2)巨噬细胞是乳腺癌中ccl23/m9的主要作用靶细胞和主要分泌细胞; (3)体内注射ccl23/m9缓解了小鼠乳腺癌的生长,并上调肿瘤组织m1 巨噬细胞特征性基因表达(m1巨噬细胞可促进cd4
+
th1细胞和cd8
+
t 细胞的浸润和功能);(4)ccl23/m9体外处理能够增强巨噬细胞中m1 特征性基因的表达。以上数据表明,ccl23/m9可通过诱导乳腺癌中tam 的m1极化,分泌il-12、cxcl9、cxcl10等细胞因子,促进th1细胞及cd8
+
t细胞的趋化和功能,增强抗肿瘤免疫微环境的形成,从而可能作为乳腺癌免疫治疗的新策略。而肿瘤微环境中的乳酸则通过抑制巨噬细胞ccl23/m9表达,促进肿瘤免疫逃逸。基于此,本技术进一步利用小鼠肿瘤模型,结合体外细胞、分子机制实验,阐明ccl23/m9通过重塑tam 功能,促进抗肿瘤免疫微环境形成的功能效应。并通过临床患者样本联合生信分析的方式,为基
于ccl23/m9的免疫治疗策略提供理论基础、实验依据以及临床可行性证据。
50.以上所描述的实施例是本技术一部分实施例,而不是全部的实施例。本技术的实施例的详细描述并非旨在限制要求保护的本技术的范围,而是仅仅表示本技术的选定实施例。基于本技术中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1