一种胶质瘤细胞膜包覆的聚合物点探针及其制备方法与应用
1.本发明涉及半导体聚合物纳米材料技术领域,具体涉及一种胶质 瘤细胞膜包覆的聚合物点探针及其制备方法与应用。
背景技术:
2.脑胶质瘤是颅内常见的原发性恶性肿瘤,恶性度最高可达4级, 其平均生存期仅为12-15个月。磁共振成像(mri)是最常见的胶质 瘤的检测手段。然而磁共振成像诊断方法价格昂贵且耗时久。相比之 下,近红外二区(nir-ii,1000-1700nm)荧光成像技术用于癌症诊断 的发展受到越来越多的关注。生物组织在近红外二区窗口中的自发荧 光比可见光区(400-700nm)和近红外一区窗口(nir-i,700-900)中 少,近红外二区荧光探针能够实现对生物组织更高的时空分辨率和更 深的穿透性成像。构建能够穿过血脑屏障(bbb)并能对肿瘤部位靶 向性聚集的纳米探针,用于脑胶质瘤的检测和治疗是非常具有挑战性 的。
3.纳米探针可以通过多种不同的策略进行设计修饰来增强穿过血 脑屏障的可能性,包括直接破坏血脑屏障、吸附介导的胞吞作用、细 胞介导的转运、受体介导的胞吞作用、载体介导的胞吞作用和反向神 经元转运等。最近,细胞膜包覆的纳米颗粒已被应用于多种形式的成 像和治疗,包括药物输送、疫苗开发和中和毒素等。仿生纳米系统是 一种很有临床转化前景的研发方向。细胞可在复杂的环境中执行各种 各样的功能。因此,利用细胞膜包覆技术,将天然的细胞膜包裹在纳 米颗粒表面,可以赋予其天然的细胞功能。通过从母细胞中提取细胞 膜,然后将细胞膜连接到纳米探针的表面,因此所有与生物相关的表 面部分都被转移到纳米颗粒表面,形成一种仿生纳米平台。与传统的 纳米探针不同,细胞膜包覆的纳米探针展现出更好的生物相容性和特 定的生物学功能,如细胞特性的滞留特性和适应性等。涂有红细胞膜 的纳米颗粒可以延长其体内循环时间,降低其在血液中的快速清除性 质。此外,研究发现涂有细胞膜活性成分的纳米探针可以打开血脑屏 障的通道,并且提高胶质瘤的靶向性。因此,由于细胞膜表面保留了 细胞的抗原和细胞膜结构,仿生纳米探针可以获得许多新奇的功能, 例如:配体识别和靶向性特性、长血液循环时间和免疫逃逸等特殊功 能为脑肿瘤诊断提供了一种有潜力的方法。
4.多功能纳米探针可作为高灵敏度脑肿瘤检测的造影剂。共轭聚合 物点(pdots)具有许多优异的生物功能和光学特性,例如生物相容 性好、光稳定性强、光物理性质可调和表面官能团丰富等,因此在生 物医学领域受到广泛关注。近来,近红外发光共轭聚合物荧光特性的 研究受到广泛关注,为实时成像和脑胶质瘤检测提供了新的方法。例 如,wu课题组开发了具有聚集诱导发光(aie)活性的聚合物点, 用于小鼠的脑血管成像。然而,聚合物点作为外源性物质,很容易被 免疫系统识别,因此,在被输送到大脑之前容易被肝脏和肾脏清除。 此外,聚合物点难以穿过血脑屏障。相比之下,表面修饰靶向适配体 或细胞穿透肽的纳米颗粒已证实具有脑肿瘤诊断特性。利用天然细胞 膜作为外衣的新型仿生纳米平台也有望作为一种新的方法,实现荧光 聚合物点的脑胶质瘤检测。因此,将细胞膜有效成分与共轭聚合物点 连接,有可能为改善脑胶质瘤诊断提供一种有效方案。
技术实现要素:
5.针对现有技术中的缺陷,本发明提供了一种胶质瘤细胞膜包覆的 聚合物点探针及其制备方法与应用。c6胶质瘤细胞膜包覆的聚合物 点(pdots-c6)作为仿生生物材料荧光探针,用于脑胶质瘤靶向的近红 外二区荧光成像。通过体内和体外实验,系统性的证明了pdots-c6 的与脑胶质瘤细胞的同源靶向性、生物分布特性和近红外二区荧光成 像特性。
6.本发明提供的一种胶质瘤细胞膜包覆的聚合物点探针,所述探针 包括聚合物点和包覆在聚合物点上的胶质瘤细胞膜,胶质瘤细胞膜的 膜蛋白与聚合物点连接;所述聚合物点至少包括结构如式ⅰ的共轭聚 合物和结构如式ii所示的功能聚合物;
7.需要说明的是,所述探针还可以由聚合物点和包覆在聚合物点上 的胶质瘤细胞膜组成;所述聚合物点由结构如式ⅰ的共轭聚合物和结 构如式ii所示的功能聚合物组成。
8.式ⅰ中,n的取值范围为20-40;式ii中n的范围为20-40,m的 范围为180-400。
[0009][0010]
细胞膜与传统的聚合物点表面均带负电荷。为了克服这种电荷阻 力,这里在制备过程中加入ps-peg-cooh(羧基封端的聚苯乙烯-聚 乙二醇),使得聚合物点表面包覆一层peg(聚乙二醇),降低聚合物 点表面的电荷,使其能更顺利的与细胞膜结合。
[0011]
在较优的技术方案中,所述共轭聚合物由ptztpa-dob(二硼 酸频那醇酯-(二甲基三苯胺-吩噻嗪))和bbt-dbr(二溴-苯并双噻二 唑)通过suzuki聚合反应制得。
[0012]
在较优的技术方案中,所述ptztpa-dob和bbt-dbr的摩尔比 为1∶1。
[0013]
在较优的技术方案中,所述聚合物点中共轭聚合物和功能聚合物 的质量比为10:3。
[0014]
在较优的技术方案中,所述胶质瘤细胞膜的膜蛋白与聚合物点的 质量比为3:2。
[0015]
本发明还提供了上述的胶质瘤细胞膜包覆的聚合物点探针的制 备方法,包括以下步骤:
[0016]
s1、共轭聚合物ptztpa-bbt的合成
[0017]
取50ml圆底烧瓶,分别加入0.5mmol的ptztpa-dob和 bbt-dbr、2m碳酸钾水溶液4ml、0.03mmol的四(三苯基膦)钯和 甲苯20ml,密封;进行3次冻干-抽泵-解冻的循环对烧瓶进行脱气; 将混合物加热至80℃保持48小时并在冷却至室温后用水洗涤;将有 机层浓缩并在搅拌下滴入200ml甲醇中;将溶液过滤,沉淀物以已 丙酮为溶剂,通过索氏萃取进一步纯化,最终得到深绿色固体产物 ptztpa-bbt;
[0018]
s2、c6胶质瘤细胞膜的提取
[0019]
采用试剂盒提取胶质瘤细胞膜;首先,使用175t细胞培养瓶培 养c6胶质瘤细胞约2000-5000万个,用磷酸盐缓冲液冲洗一遍,用 细胞刮子刮下细胞,离心收集细胞,吸除上清液,留下细胞沉淀备用; 用适量冰浴预冷的磷酸盐缓冲液轻轻重悬细胞沉淀,4℃,600g离心 5min沉淀细胞,弃上清液;取2ml膜蛋白抽提试剂a加入苯甲基 磺酰氟,使苯甲基磺酰氟的最终浓度为1mm,把2ml临用前添加 了甲基磺酰氟的膜蛋白抽提试剂a加入至2000-5000万细胞中,轻轻 并充分悬浮细胞,冰浴放置15分钟;把细胞悬液转移到玻璃匀浆器 中,匀浆约50下;4℃,700g离心10分钟,去除细胞核和未破碎的 细胞,收集上清液至一新的离心管中;4℃,14000g离心30分钟, 沉淀即为细胞膜碎片;
[0020]
s3、pdots-c6的制备
[0021]
pdots是通过纳米沉淀法和简单的超声处理合成的。将共轭聚合 物ptztpa-bbt和功能聚合物ps-peg-cooh溶解在3ml四氢呋喃 中得到混合溶液,混合溶液中ptztpa-bbt浓度为100μg
·
ml-1
, ps-peg-cooh的浓度为30μg
·
ml-1
;然后将混合溶液快速倒入 10ml超纯水中,并在剧烈超声作用(40khz,300w)下持续震荡3 分钟;然后将所得悬浮液在氮气保护下加热除去四氢呋喃;浓缩后使 用220nm过滤膜过滤除去尺寸较大的聚集体;从而获得pdots溶液, 然后将s2提取的胶质瘤膜蛋白与pdots溶液混合,其中膜蛋白与pdots 的质量比为3∶2,使用脂质体挤出器挤压通过200nm的滤膜,挤压重 复10次,使得纯化的c6膜蛋白连接到聚合物点的表面,从而获得 pdots-c6纳米探针。
[0022]
在较优的技术方案中,步骤s3中,所述混合溶液中还包括其他 共轭聚合物,如:0-100μg
·
ml-1
的pfbt,即混合溶液中pfbt与 ptztpa-bbt的质量比为0-1∶1。
[0023]
传统的聚合物点难以穿过血脑屏障、主动靶向性较弱,且体内循 环时间较短。脑胶质瘤细胞膜包覆后具有与脑胶质瘤细胞的同源靶向 性、低毒性和体内长循环特性。
[0024]
基于此,本发明还提供了一种胶质瘤细胞膜包覆的聚合物点探针 在荧光成像和/或荧光传感中的应用。
[0025]
本发明进一步提供了一种胶质瘤细胞膜包覆的聚合物点探针在 制备治疗颅内胶质瘤药物中的应用。
[0026]
本发明技术方案具有如下优点:
[0027]
本发明提供的探针pdots-c6不仅在细胞水平上表现出同源靶向 作用,而且在组织水平上表现出高空间分辨率和深层组织穿透性。作 为一种新的近红外二区荧光成像探针,与纯的聚合物点探针相比, pdots-c6具有高特异性、低毒性和长循环特性,在临床胶质瘤检测方 面具有很大的应用前景。
附图说明
[0028]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方 案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简 单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式, 对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可 以根据这些附图获得其他的附图。
[0029]
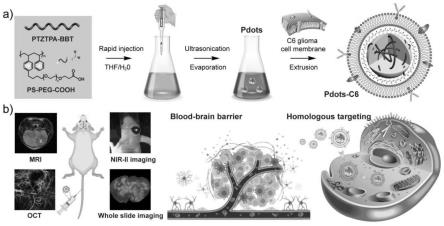
图1是本发明制备的用于脑肿瘤靶向的近红外二区荧光成像的 c6胶质瘤细胞膜包覆的探针pdots-c6。
[0030]
其中,(a)pdots-c6的制备过程;(b)pdots-c6穿越血脑屏障和 同源靶向脑瘤成像的示意图。
[0031]
图2是胶质瘤细胞膜包覆的聚合物点(pdots-c6)的表征;
[0032]
其中,(a)共轭聚合物ptztpa-bbt的结构式及其合成路线;(b) pdots-c6的水合粒径分布和透射电子显微镜图像;(c)聚合物点(pdots) 的水合粒径分布和透射电子显微镜图像;(d)pdots-c6的水合粒径与 室温下储存时间的关系变化曲线;(e)pdots、pdots-c6和c6细胞膜 (c6cms)的zeta电位;(f)pdots和pdots-c6的吸收光谱;(g)pdots 和pdots-c6的发射光谱;(h)c6cms、pdots-c6、pdots和蛋白质标 记物的凝胶电泳蛋白质分析结果。
[0033]
图3是pdots-c6的抗吞噬特性。
[0034]
其中,(a)pdots和pdots-c6之间细胞摄取差异的示意图;(b) pdots和pdots-c6孵育后的c6细胞通过流式细胞术分析细胞内荧光 强度对比;(c)c6细胞的平均荧光强度值对比;(d)c6细胞的荧光 成像图,比例尺=20μm;(e)用荧光成像图分析的c6细胞内荧光强 度分布。
[0035]
图4:(a)ptztpa-bbt:pfbt pdots、ptztpa-bbt:pfbt pdots-c6 以及c6细胞膜(c6cms)的吸收光谱;(b)ptztpa-bbt:pfbt pdots 和ptztpa-bbt:pfbt pdots-c6的发射光谱(激发波长为460nm); (c)ptztpa-bbt:pfbt pdots和ptztpa-bbt:pfbt pdots-c6的发 射光谱(激发波长为808nm)。
[0036]
图5是不同浓度pdots和pdots-c6孵育后的c6细胞的细胞活力 测定。
[0037]
图6:(a)脑胶质瘤小鼠的核磁共振成像图;(b)脑胶质瘤小鼠 的脑部光学相干断层扫描成像图像;(c)脑胶质瘤小鼠的荧光成像图; (d)分别注射pdots和pdots-c6后,在不同时间点对小鼠的脑胶质 瘤进行活体近红外二区荧光成像;(e)注射24小时后小鼠脑组织切 片;比例尺=1mm。
具体实施方式
[0038]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合 实施例,对本发明进行进一步详细说明。
[0039]
应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不 用于限定本发明。
[0040]
实施例中,如无特别说明,所用手段均为本领域常规的手段。
[0041]
本文中所用的术语“包含”、“包括”或其任何其它变形,意在覆 盖非排它性的包括。例如,包含所列要素的组合物、步骤、方法、制 品或装置不必仅限于那些要素,而是可以包括未明确列出的其它要素 或此种组合物、步骤、方法、制品或装置所固有的要素。
[0042]
此外,下面所描述的本发明各个实施方式中所涉及到的技术特征 只要彼此之间未构成冲突就可以相互组合。
[0043]
如没有特殊说明,本发明所用的原料均为市售常规产品。
[0044]
一.实验部分
[0045]
制备过程如图1(a)所示。
[0046]
1.1共轭聚合物ptztpa-bbt的合成
[0047]
取50ml或100ml圆底烧瓶,加入ptztpa-dob(二硼酸频那 醇酯-(二甲基三苯胺-吩噻嗪),361-722mg,0.5-1.0mmol)、bbt-dbr (二溴-苯并双噻二唑),175-350mg,0.5-1.0mmol)、碳酸钾水溶 液(k2co3,2.0m,2-4ml)、四(三苯基膦)钯(pd(pph3)4,34-68 mg,0.03-0.06mmol)和甲苯(20-40ml),然后用封口膜密封。进 行3次冻干-抽泵-解冻的循环对烧瓶进行脱气。将混合物加热至85 ℃保持48小时并在冷却至室温后用水洗涤。将有机层浓缩并在搅拌 下滴入甲醇(100-200ml)中。将溶液过滤,沉淀物已丙酮为溶剂, 通过索氏萃取进一步纯化,最终得到深绿色固体产物。聚合物的分子 量通过凝胶渗透色谱表征,测得数均分子量为4.9kda。
[0048]
1.2 c6胶质瘤细胞膜的提取
[0049]
采用碧云天细胞膜蛋白与细胞浆蛋白提取试剂盒提取胶质瘤细 胞膜。首先,使用175t细胞培养瓶培养c6胶质瘤细胞约2000-5000 万个,用磷酸盐缓冲液(pbs)冲洗一遍,用细胞刮子刮下细胞,离 心收集细胞,吸除上清液,留下细胞沉淀备用。用适量冰浴预冷的磷 酸盐缓冲液轻轻重悬细胞沉淀,离心沉淀细胞(4℃,600g,5分钟)。 弃上清液。取2ml膜蛋白抽提试剂a加入苯甲基磺酰氟(pmsf),使 苯甲基磺酰氟的最终浓度为1mm,把2ml临用前添加了甲基磺酰氟 的膜蛋白抽提试剂a加入至2000-5000万细胞中,轻轻并充分悬浮细 胞,冰浴放置15分钟。把细胞悬液转移到玻璃匀浆器中,匀浆约50 下。4℃,700g离心10分钟,去除细胞核和未破碎的细胞:收集上 清液至一新的离心管中。4℃,14000g离心30分钟,沉淀即为细胞 膜碎片。通过bca(bicinchoninicacid)蛋白测定法测定提取细胞 膜碎片的蛋白质含量。
[0050]
1.3pdots-c6的制备
[0051]
pdots是通过纳米沉淀法和简单的超声处理合成的。将共轭聚合 物ptztpa-bbt(100μg
·
ml-1
)、pfbt(0-100μg
·
ml-1
)和功能聚 合物ps-peg-cooh(30μg
·
ml-1
)溶解在3ml四氢呋喃溶液中。然 后将混合溶液快速倒入10ml超纯水中,并在剧烈超声作用下持续震 荡3分钟。然后将所得悬浮液在氮气保护下加热除去四氢呋喃。浓缩 后使用220nm过滤膜过滤除去尺寸较大的聚集体。从而获得pdots 溶液,然后将提取的胶质瘤膜蛋白(1.5mg/ml)与pdots溶液(1mg/ml) 混合,使用脂质体挤出器挤压通过200nm的滤膜,挤压重复10次, 从而获得pdots-c6纳米探针。
[0052]
2.结果与讨论
[0053]
2.1.pdot-c6的制备和表征。
[0054]
pdots-c6的制备包括以下步骤。首先,利用共轭聚合物 ptztpa-bbt(化学结构式见图2a)和ps-peg-cooh(羧基封端的聚苯 乙烯-聚乙二醇)过纳米沉淀法制备获得聚合物点(pdots)。共轭聚 合物ptztpa-bbt通过铃木(suzuki)聚合反应合成。此外,使用细 胞膜蛋白与细胞浆蛋白提取试剂盒,从收获的c6胶质瘤细胞中提取 细胞膜成分。然后,将聚合
物点和细胞膜成分混合,使用脂质体挤出 器反复10次挤压,从而使得纯化的c6膜蛋白连接到聚合物点的表面, 从而获得pdots-c6。透射电子显微镜(tem)图像和动态光散射(dls) 结果表明,pdots-c6具有球形形貌和典型的核壳结构,平均粒径为 40.8nm(图2b),尺寸略大于纯pdots(35.2nm)(图2c)。我们还 发现获得的pdots和pdots-c6可以保持10天以上的胶体稳定性(图2d),从而为后续实验的开展提供了可行性。研究发现pdots被c6细 胞膜包被后,zeta电位也从原来的-16.3mv增加到-23.5mv(图2e)。 因此,透射电镜、动态光散射以及表面电位分析结果一致表明聚合物 点成功地被c6胶质瘤细胞膜包覆。
[0055]
此外,利用吸收光谱和近红外发射光谱分别测量了pdots和 pdots-c6的光学性质。pdots和pdots-c6显示几乎相同的吸收光谱, 其最高吸收峰在745nm处(图2f)。同时,我们用808nm为激发光, 测得pdots和pdots-c6的荧光光谱,其最高发射峰在1055nm处(图 2g)。使用ir-26染料(近红外荧光染料ir 26,cas:76871-75-5) 作为参考,在808nm激发下,测得pdots的近红外荧光量子效率为 0.6%。此外,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page) 蛋白质分析,同样证明了c6膜蛋白已转移到pdots的表面(图2h)。 c6细胞膜、pdots-c6和蛋白标记的相同蛋白条带表明pdots-c6成功 地保留了原始c6细胞的膜蛋白。
[0056]
2.2.pdots-c6的生物相容性和抗吞噬特性
[0057]
外源性纳米探针进入细胞后会被免疫系统识别并被巨噬细胞清 除,导致纳米探针在生物医学诊断和治疗中的效率受到限制。对比了 pdots和pdots-c6的体外生物相容性和细胞内吞特性。同源胶质瘤 细胞膜(c6cms)表面的膜蛋白可以主动向巨噬细胞发出“不要吃我
”ꢀ
的信号,防止它们被清除(图3a)。
[0058]
本研究中,我们采用混合共轭聚合物pfbt(聚(9,9-二辛基芴
‑ꢀ
共-苯并噻二唑))制备两种纳米探针分别是为ptztpa-bbt:pfbtpdots和ptztpa-bbt:pfbt pdots-c6。因此,它们能够发出pfbt所 具有的绿色荧光信号(图4)。首先,我们使用cck-8测定法评估了 pdots和pdots-c6的体外细胞毒性,验证了不同浓度(0、3、6、12、 25、50和100μg/ml)pdots-c6的细胞毒性(图5)。接下来,我们 将ptztpa-bbt:pfbt pdots和ptztpa-bbt:pfbt pdots-c6分别与c6 细胞共孵育6小时。采用流式细胞术分别量化c6细胞对pdots和 pdots-c6的摄取效率(图3b)。实验结果表明pdots-c6实验组的荧 光强度比纯pdots组高约3.3倍(图3c)。这种细胞摄取差异主要是 源于pdots-c6所具有的同源靶向能力。另外,我们还对细胞的定性 摄取进行了可视化分析,细胞核采用具有蓝色荧光信号的dapi(4
′
,6
‑ꢀ
二脒基-2-苯基吲哚)标记。由于pfbt发射绿色荧光,该实验中混合 了pfbt的pdots和pdots-c6都能够发射绿色荧光。通过将两个发光 通道的合并视图比较pdots和pdots-c6的荧光亮度差异(图3d)。 结果表明,pdots-c6组检测到更强的绿色荧光信号。(图3e)。与传 统的pdots相比,细胞膜包覆的pdots-c6更容易被同源的胶质瘤细 胞摄取,证明了pdots-c6具有更好的同源靶向能力。
[0059]
2.3.近红外二区活体脑肿瘤成像
[0060]
根据体外实验结果中pdots-c6优异的生物相容性和主动靶向能 力结果,进一步使用携带脑肿瘤的balb/c裸鼠模型进行体内成像实验。 将荧光素酶标记的c6胶质瘤细胞(c6-luc)注射到小鼠纹状体中,构 建胶质瘤原位植入肿瘤模型。雌性balb/c裸鼠(5-6周)购自北京维 通利华实验动物技术有限公司。将小鼠麻醉后固定在脑立体定位仪上, 使用
酒精对小鼠头皮层消毒,把小鼠注射位点的头皮剪开,对颅顶钻 孔后,5分钟时间内缓慢进针至-4毫米,等待小鼠适应5分钟后调整z 轴至-3.5毫米,使用微量进样器吸取5ul细胞(5
×
105个细胞/小鼠), 在5分钟内缓慢注射胶质瘤细胞,缓慢将注射器抽出后,用骨蜡将颅 顶的孔封好,最后用缝合液将脑皮黏合。通过使用c6-luc构建肿瘤模 型,使我们能够通过生物发光成像评估胶质瘤细胞的活性。此外,还 进行了核磁共振成像(mri)和光学相干断层扫描(oct)以监测颅内 胶质瘤细胞的生长情况。核磁共振成像结果显示,肿瘤细胞接种8天 后,胶质瘤的深度约为3.55mm(图6a),而oct能够观察到胶质瘤肿 瘤微环境中的血管结构(图6b)。核磁共振成像和光学相干断层扫描 成像结果表明脑肿瘤模型构建成功。
[0061]
此外,我们还进行了体内近红外二区荧光成像,分别获取pdots 和pdots-c6在活体脑肿瘤中的靶向能力。由于胶质瘤细胞含有荧光素 酶标记的报告基因,能够在原位胶质瘤小鼠的肿瘤部位检测到荧光信 号强度(图6c)。取两组小鼠,每组3只,分别通过尾静脉注射pdots 和pdots-c6,在注射后1、6、12、24和48小时监测两组小鼠的荧 光信号(图6d)。在pdots-c6组的小鼠大脑中清楚地检测到大量荧光。 而pdots组中没有发现出明显的荧光信号。此外,对pdots-c6组的小 鼠大脑组织切片进行荧光成像,同样表现出明显的荧光信号(图6e)。 该结果表明,与pdots组相比,pdots-c6组纳米探针在胶质瘤细胞中 表现出明显的富集量增加,这是由于pdots-c6具有更好的血脑屏障穿 越能力和脑瘤靶向性。
[0062]
显然,上述具体实施方式仅仅是为清楚地说明所作的举例,而并 非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说 明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法 对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变 动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1