一种双阴离子多糖稳定化的大豆分离蛋白-姜黄素自组装纳米粒子及其制备方法与流程
1.本发明涉及载药纳米粒子,具体涉及一种双阴离子多糖稳定化的大豆分离蛋白-姜黄素自组装纳米粒子及其制备方法。
背景技术:
2.姜黄素(curcumin, c)是姜黄根茎的主要酚类化合物,由于具有独特的黄色,其传统作用为在食品、烘焙品中作为天然色素使用。随着研究的深入,姜黄素被阐明其“双阿魏酰甲烷”化学结构,即主链是α,β-二酮,两端连接对称的邻-甲基苯酚,该独特结构逐渐被挖掘出广泛的药理活性,例如抗炎、抗氧化、清除自由基等,因此姜黄素作为药物使用极具有开发潜力。但是由于其疏水性较高导致口服利用率较低,以及稳定性差,遇光容易分解、不耐热,使其在食品和制药行业的应用受到限制。
3.为了克服以上两个主要缺陷,利用输送系统的形式对姜黄素进行包埋处理,将有助于姜黄素在食品、药品工业领域得到更广泛的应用。目前对姜黄素运输系统的研究主要包括:脂质体、微乳液、纳米颗粒等。其中纳米颗粒因为具有较小的尺寸,对于生物膜屏障表现出良好的穿透性,且十分适合用于改善疏水化合物的水溶性,因此引起学者们的广泛关注。用于制备姜黄素纳米颗粒的蛋白载体包括β-乳球蛋白、人血清蛋白、大豆分离蛋白(spi)等,特别的,大豆分离蛋白相比与动物蛋白,具有来源广泛、价格低廉且致敏性低等优势,是纳米级蛋白载体的理想原料。大豆分离蛋白作为两性离子聚合物,其结构中具有许多疏水性氨基酸(含量>60%),其大量的极性与带电残基可以通过疏水作用、氢键、静电相互作用与姜黄素结合,这为自组装形成姜黄素-大豆分离蛋白纳米颗粒,提高姜黄素的稳定性提供了可能。
4.但是,作为一种蛋白质,大豆分离蛋白极易被消化液中的胃蛋白或者胰蛋白酶分解,从而过快释放出被包裹的活性物质;除此之外,通过反溶剂法制备的大豆分离蛋白纳米颗粒仍具有强烈疏水性,易导致纳米颗粒在中性甚至低ph环境下发生凝聚,最终产品在水溶液中再分散性差。
技术实现要素:
5.为解决上述现有技术问题,本发明的首要目的在于提供一种双阴离子多糖稳定化的大豆分离蛋白-姜黄素自组装纳米粒子的制备方法,该方法采用卡拉胶与岩藻多糖双重阴离子多糖作为复合涂层,能有效提高载姜黄素的大豆分离蛋白纳米颗粒的水再分散性与稳定性。
6.本发明实现上述目的的技术方案如下:一种双阴离子多糖稳定化的大豆分离蛋白-姜黄素自组装纳米粒子的制备方法,包括如下步骤:
(1)将姜黄素乙醇溶液加入到大豆分离蛋白溶液中,均质,得到混合溶液;(2)将卡拉胶溶液加入到混合溶液中,调节溶液ph至2.5~4.5,均质,使大豆分离蛋白与卡拉胶复合凝聚反应完全,形成卡拉胶-大豆分离蛋白纳米颗粒分散液;(3)将岩藻多糖溶液加入到卡拉胶-大豆分离蛋白纳米颗粒分散液中,均质,去除体系中残留的乙醇,冷冻干燥,最终获得双阴离子多糖稳定化的大豆分离蛋白-姜黄素自组装纳米粒子。
7.多糖和蛋白质之间的静电相互作用可以稳定蛋白质基药物载体。本发明构建了卡拉胶与岩藻多糖作为稳定化双涂层的负载姜黄素的大豆分离蛋白纳米颗粒。卡拉胶(car)作为天然阴离子多糖可以中和低ph下大豆分离蛋白表面的正电荷,制备出稳定的大豆分离蛋白-卡拉胶复合纳米载体;岩藻多糖(fuc)是一种岩藻糖基硫酸多糖,其丰富的羟基与硫酸基团可以对大豆分离蛋白-卡拉胶复合纳米颗粒的整体电荷进行调控,使得纳米颗粒具有更宽广的ph适应性和更高离子强度耐受性,有利于进一步提高复合纳米粒在胃肠液中的稳定性,实现姜黄素的控制释放。此外,岩藻多糖本身也具有抗氧化、降血糖、抗炎等诸多生物学活性,可以协同增强所运载的活性物质的功能发挥。
8.优选地,步骤(1) 中,姜黄素与大豆分离蛋白的质量比为1: 5~50,优选为1:10~25。
9.优选地,步骤(1) 中,均质的时间为4~6 min。
10.优选地,步骤(2) 中,大豆分离蛋白与卡拉胶的质量比为1: 0.25~1.25,优选为1: 0.5~1。优选地,步骤(2)中,均质的时间为8~12 min。
11.优选地,步骤(3)中,大豆分离蛋白与岩藻多糖的质量比为1: 0.1~0.5,优选为1:0.2~0.4。优选地,步骤(3)中,均质的时间为3~7 min。本发明另一方面提供了一种双阴离子多糖稳定化的大豆分离蛋白-姜黄素自组装纳米粒子,由上述的制备方法制备得到。本发明制备得到的双阴离子多糖稳定化的大豆分离蛋白-姜黄素自组装纳米粒子的粒径小于650nm,对姜黄素的包埋率大于91%。
12.本发明与现有技术相比,具有如下有益效果:本发明采用大豆分离蛋白作为姜黄素载体,其具有丰富疏水与亲水基团,易通过疏水作用自组装形成纳米颗粒,原材料廉价易得,安全性高,且制备方法环保简易。
13.本发明采用卡拉胶与岩藻多糖双重阴离子多糖作为复合涂层,有效提高了载姜黄素的大豆分离蛋白纳米颗粒的水再分散性与稳定性。
14.本发明采用岩藻多糖作为复合壁材之一,具有较多生理功能,在提高姜黄素稳定性的同时还可以与姜黄素协同增强其生物活性。
附图说明
15.图1为实施例2与对比例1-3的粒径分布、分散性指数(pdi)与zeta电位的测定结
果;图2为实施例2与对比例1-3的电子显微镜(sem)图;图3为本发明自组装原理图;图4为实施例2与对比例1-3在460~630nm范围内姜黄素的稳态荧光光谱;图5为实施例2与对比例1-3的光稳定性测定结果;图6为实施例2与对比例1-3的热稳定性测定结果。
具体实施方式
16.下面通过具体实施方式来进一步说明本发明,以下实施例为本发明具体的实施方式,但本发明的实施方式并不受下述实施例的限制。
17.实施例1:最佳比例筛选实验将1 ml姜黄素乙醇溶液(1、2、5、10、17 mg/ml)注入到含有5 mlspi溶液(10 mg/ml)的烧杯中,使用高速剪切均质机(10,000 rpm)均质5 min;将5 mlcar溶液(2.5、5、10、12.5、15mg/ml)缓慢注入到上述溶液中,使用ph仪调节溶液ph至2.5、3、3.5、4.0、4.5,继续使用高速剪切均质机(10,000 rpm)均质10 min,使spi与car复合凝聚反应完全,形成 car/spi纳米颗粒分散液;将10 mlfuc溶液(0.5、1、1.5、2、2.5 mg/ml)倒入10 ml car/spi纳米颗粒分散液中,均质(10000 rpm) 5 min,用旋转蒸发仪去除体系中残留的乙醇,最终获得fuc/car/spi/c复合纳米颗粒的水分散液,将复合纳米颗粒水分散液进行冷冻干燥,最终获得fuc/car/spi/c复合纳米颗粒。
18.其中姜黄素与大豆分离蛋白的质量比为1: 3、1:5、1:10、1:25、1:50;大豆分离蛋白与卡拉胶的质量比为1: 0.25、1:0.5、1:1、1:1.25、1:1.5;大豆分离蛋白与岩藻多糖的质量比为1:0.1、1:0.2、1:0.3、1:0.4、1:0.5。分别考察不同制备参数对复合纳米颗粒的粒径、浊度、载药量、包埋率的影响,选择较优制备复合纳米粒的参数。
19.粒径的测定:粒径采用malvern delsa nano(英国malvern instruments ltd.)测量。将仪器设置为25
°
c并预热30分钟。将样品倒入测量池中并以200rpm搅拌5分钟,然后开始测量。着色率设置为 10%
–
20%。计算平均粒径。
20.浊度的测定:使用紫外可见分光光度计(723pc,中国上海恒平科学仪器有限公司)在460nm处测试不同纳米颗粒的吸光度用来表示浊度。
21.载药量与包埋率的测定:将1ml样品加入到3ml二氯甲烷中并通过振荡提取2分钟。解决方案被搁置以方便分层。取下层并用无水乙醇稀释。用紫外可见分光光度计(723pc,中国上海恒平科学仪器有限公司)测量427 nm处的吸光度,根据标准曲线y=0.1575x-0.0155(r2=0.9998)计算纳米颗粒中游离姜黄素含量,其中y表示吸光度值,x表示姜黄素的含量(μg/ml)。将1ml样品加入到3ml无水乙醇中,并在超声下充分混合,然后离心(22331 hamburg,eppendorf ltd.,德国)以8000rpm离心3分钟。转移上清液,通过吸光值确定纳米颗粒中总姜黄素含量。姜黄素的包封效率和负载能力计算如下:;
22.实验结果(见表1-4):表1不同大豆分离蛋白与卡拉胶质量对纳米粒粒径、溶液浊度和形态的影响
spi:car(w/w)粒径(nm)浊度观察1:0.25324.04
±
0.26c1.85
±
0.04d白色絮状1:0.5323.14
±
0.63d2.43
±
0.05b稍粘,有流动性1:1321.82
±
0.58e2.58
±
0.01a稍粘,有流动性1:1.25321.97
±
0.47e2.34
±
0.04c流动性较差1:1.5335.03
±
0.83b2.31
±
0.04c沉淀由表1可知,当加入car时,在spi与car的比例为1:0.25(w/w)时,颗粒大小明显下降(p《0.05),约为324.04 nm。这一结果表明,car能够抑制spi的聚集,并有助于形成car/c复合纳米粒子,其粒径相对较小。在1:0.5(w/w)到1:1(w/w)的比例下,纳米颗粒的粒径继续下降到321.82纳米,而当car持续增加时,粒径逐渐增加,其原因可能当spi和car分子链的电荷密度相等,较强的静电作用力导致颗粒大小变小。同时,复合纳米粒子的数量增加,导致浊度最高,随后颗粒大量聚集而发生沉淀。综合考虑,spi 与car的质量比优选为1: 0.5~1,更优选为 1:1 作为spi 与car最佳质量比。
23.表2 不同复合凝聚ph值对纳米粒粒径、溶液浊度和形态的影响ph粒径(nm)浊度观察2.5356.94
±
1.07a2.45
±
0.02b沉淀3.0334.76
±
2.80b3.11
±
0.03a流动性较好3.5320.15
±
1.53e3.21
±
0.02a流动性较好4.0324.42
±
1.09c3.14
±
0.02a流动性一般4.5334.97
±
3.10b2.46
±
0.01b流动性差由表2可知,当ph值过低(2.5)或过高(4.5)时,体系的浊度显着降低(p《0.05)。这是因为体系的ph值越接近每种聚合物的等电点,spi和car的电离程度就越低,导致分散性差,故优选ph范围为2.5-4.5。ph值为3.0、3.5和4.0时浊度无显著性意义(p》0.05)。当ph为3.5时,复合纳米颗粒的粒径最小,浊度最大。因此,更优选 ph值为3.5。
24.表3不同spi与cur质量比对负载cur的car-spi微胶囊理化性质的影响spi:curcumin(w/w)粒径(nm)浊度包埋率(%)50:1420.41
±
0.04a4.17
±
0.03c96.55
±
0.20a25:1419.23
±
0.85
ab
4.19
±
0.05
bc
95.60
±
0.31b10:1419.11
±
0.33
ab
4.23
±
0.02
bc
95.51
±
0.17b5:1417.88
±
0.52b4.28
±
0.06b94.58
±
0.23c3:1418.10
±
0.61b5.04
±
0.08a87.88
±
0.30d由表3可知,在spi与姜黄素的质量比为50:1至5:1时,粒径从420.41 nm逐渐减小到417.88 nm,具有显著性差异(p《0.05)。在质量比为3:1时,粒径略有增加。在50:1到5:1的范围内,随着姜黄素添加量的增加,包埋率与粒径皆呈下降趋势,尤其是在质量比为5:1和3:1时,包埋率大大降低,表明有相对较多的姜黄素未被car/spi载体包埋。同时,观察到分散体的浊度随着姜黄素的增加而增加,这证实了过量的姜黄素难以被纳米颗粒负载。考虑到25:1和10:1的质量比之间没有统计学上的差异,且后者纳米颗粒具有较高的姜黄素添加量,载药量更高,因此,姜黄素与大豆分离蛋白的质量比优选为1: 10~25 ,更优选 10:1作为spi与姜黄素的最佳比例。
25.表4 不同fuc与cur质量比对负载cur的fuc-car-spi微胶囊理化性质的影响
spi:fuc(w/w)粒径(nm)浊度包埋率(%)载药量(%)1:0.1618.51
±
0.62c4.05
±
0.10c91.21
±
0.85d4.73
±
0.09b1:0.2619.04
±
0.68
c 4.16
±
0.01
bc
92.61
±
1.12c4.56
±
0.06c1:0.3622.16
±
0.70b4.23
±
0.01
b 94.03
±
0.72
bc
4.34
±
0.05d1:0.4624.35
±
0.86
b 4.30
±
0.01
ab
95.28
±
1.23a4.16
±
0.04e1:0.5636.22
±
1.01a4.43
±
0.01a94.25
±
0.16b4.12
±
0.07e由表4可知,随着fuc添加量的增加,虽然复合纳米粒的粒径逐渐增加,但体系的分散性能明显改善,浊度逐渐增加。此外,负载能力下降的原因可能是fuc涂层引起的重量增加,导致整个纳米颗粒中姜黄素的比例较小。因此,大豆分离蛋白与岩藻多糖的质量比优选为1: 0.2~0.4,考虑到1:0.4和1:0.5的质量比在浊度和负载能力方面没有显著差异,并且在质量比为1:0.4时包封效率达到最大值,更优选为 1:0.4作为spi与fuc的最佳质量比。
26.实施例2:岩藻多糖/卡拉胶/大豆分离蛋白/姜黄素复合纳米粒(fuc/car/spi/c)的制备将1 ml姜黄素乙醇溶液(5 mg/ml)注入到含有5 mlspi溶液(10 mg/ml)的烧杯中,使用高速剪切均质机(10,000 rpm)均质5 min;将5 mlcar溶液(10 mg/ml)缓慢注入到上述溶液中,使用ph仪调节溶液ph至3.5,继续使用高速剪切均质机(10,000 rpm)均质10 min,使spi与car复合凝聚反应完全,形成 car/spi纳米颗粒分散液;将10 mlfuc溶液(2 mg/ml)倒入10 ml car/spi纳米颗粒分散液中,均质(10000 rpm) 5 min,用旋转蒸发仪去除体系中残留的乙醇,最终获得fuc/car/spi/c复合纳米颗粒的水分散液,将复合纳米颗粒水分散液进行冷冻干燥,最终获得fuc/car/spi/c复合纳米颗粒。
27.实施例3:岩藻多糖/卡拉胶/大豆分离蛋白/姜黄素复合纳米粒(fuc/car/spi/c)的制备将1 ml姜黄素乙醇溶液(10 mg/ml)注入到含有5 mlspi溶液(10 mg/ml)的烧杯中,使用高速剪切均质机(10,000 rpm)均质6 min;将5 mlcar溶液(12.5 mg/ml)缓慢注入到上述溶液中,使用ph仪调节溶液ph至3,继续使用高速剪切均质机(10,000 rpm)均质12min,使spi与car复合凝聚反应完全,形成 car/spi纳米颗粒分散液;将10 mlfuc溶液(2.5 mg/ml)倒入10 ml car/spi纳米颗粒分散液中,均质(10000 rpm) 7min,用旋转蒸发仪去除体系中残留的乙醇,最终获得fuc/car/spi/c复合纳米颗粒的水分散液,将复合纳米颗粒水分散液进行冷冻干燥,最终获得fuc/car/spi/c复合纳米颗粒。
28.实施例4:岩藻多糖/卡拉胶/大豆分离蛋白/姜黄素复合纳米粒(fuc/car/spi/c)的制备将1 ml姜黄素乙醇溶液(2 mg/ml)注入到含有5 mlspi溶液(10 mg/ml)的烧杯中,使用高速剪切均质机(10,000 rpm)均质4 min;将5 mlcar溶液(5 mg/ml)缓慢注入到上述溶液中,使用ph仪调节溶液ph至4,继续
使用高速剪切均质机(10,000 rpm)均质8min,使spi与car复合凝聚反应完全,形成 car/spi纳米颗粒分散液;将10 mlfuc溶液(1.5 mg/ml)倒入10 ml car/spi纳米颗粒分散液中,均质(10000 rpm) 5min,用旋转蒸发仪去除体系中残留的乙醇,最终获得fuc/car/spi/c复合纳米颗粒的水分散液,将复合纳米颗粒水分散液进行冷冻干燥,最终获得fuc/car/spi/c复合纳米颗粒。
29.对比例1:姜黄素纳米颗粒的制备将1 ml姜黄素乙醇溶液(5 mg/ml)注入到20 ml蒸馏水中,使用高速剪切均质机(10,000 rpm)均质5min,通过反溶剂沉淀法形成姜黄素纳米颗粒水分散液,然后进行冷冻干燥,最终获得姜黄素纳米颗粒。
30.对比例2:大豆分离蛋白/姜黄素纳米粒(spi/c)的制备将1 ml姜黄素乙醇溶液(5 mg/ml)注入到含有5 ml spi溶液(10 mg/ml)的烧杯中,使用高速剪切均质机(10,000 rpm)均质5 min, 形成spi/cur纳米颗粒水分散液,然后进行冷冻干燥,最终获得spi/c复合纳米颗粒。
31.对比例3:卡拉胶/大豆分离蛋白/姜黄素复合纳米粒(car/spi/c)的制备将1 ml姜黄素乙醇溶液(5 mg/ml)注入到含有5 mlspi溶液(10 mg/ml)的烧杯中,使用高速剪切均质机(10,000 rpm)均质5min;将5 mlcar溶液(10 mg/ml)缓慢注入到上述溶液中,使用ph仪调节溶液ph至3.5,继续使用高速剪切均质机(10,000 rpm)均质10 min,使spi与car复合凝聚反应完全,形成 car/spi纳米颗粒分散液,然后进行冷冻干燥,最终获得car/spi/c复合纳米颗粒。
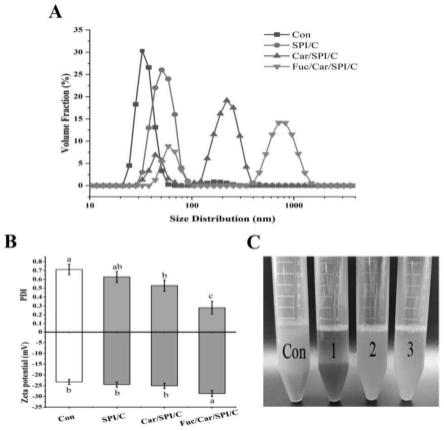
32.将实施例2制备得到的双阴离子多糖稳定化的大豆分离蛋白-姜黄素自组装纳米粒子与对比例1中姜黄素单质、对比例2中载姜黄素的spi纳米粒和对比例3中卡拉胶/大豆分离蛋白复合稳定的姜黄素纳米颗粒进行理化表征、水中再分散性与稳定性对比测试,结果如下:一、粒径分布、分散性指数(pdi)与zeta电位的测定采用malvern delsa仪器测定了纳米颗粒的粒径分布、pdi和zeta电位。仪器设置为25℃,预热30min。将样品倒入测量池中,以200 rpm搅拌5 min后,再开始测量,遮光比设置为10%-20%。利用光散射数据处理软件计算并得到了平均粒径、pdi和zeta电位。以对比例姜黄素为对照组(con), 粒径测定结果如图1a,pdi与zeta电位与测定结果如图1b,各个样品在水溶液中的分散情况见图1c:由图1可知,spi/c粒径要稍大于姜黄素纳米粒,而随着阴离子多糖涂层的添加,纳米颗粒的粒径明显增大,fuc/car/spi/c复合纳米粒的粒径要大于car/spi/c, 说明连续的双阴离子涂层逐渐形成,较好的包裹在载姜黄素的纳米粒表面,导致粒径变大。与对照组相比,三种纳米颗粒的pdi呈逐渐下降趋势,zeta负电位增加,尤其是fuc/car/spi/c的pdi与zeta电位变化显著 (p《0.05),这表明,带负电荷的fuc被完全沉积在car/spi/c表面,以进一步稳定载姜黄素的纳米颗粒。同时地,观察到spi/c和对照样品(姜黄素)在离心管底部有明显的沉淀, car/spi/c在水中重新分散时没有明显的沉淀,但溶液仍浑浊,而fuc/car/spi/c的水分散液呈均匀澄清状,这验证了使用car-fuc双涂层有利于明显提高载姜黄素的spi纳米颗粒在水中的再分散性。
33.二、电子显微镜(sem)的测定通过sem观察了实施例2与对比例2-3所制备的样品样貌,并对比spi观察其聚集问题的改善情况。将spi与实施1、对比例2-3轻轻涂在导电胶带上,在5.0kv的高真空模式下观察样品的形貌,放大倍数为20000。测定结果见图2,其中图2a为spi颗粒,图2b为spi/c纳米颗粒,图2c为car/spi/c复合纳米颗粒,图2d为fuc/car/spi/c复合纳米颗粒。
34.由图2可观察到,大量的spi纳米颗粒相互靠拢形成聚集体,这解释了spi纳米颗粒易出现沉淀的原因,这是因为spi所携带的正电荷容易通过疏水相互作用团聚。加入姜黄素-乙醇溶液后高速均质处理并没有使spi的不稳定问题得到明显的缓解,分散的spi/c纳米颗粒在中性的ph环境中仍然很容易聚集。当添加car后,car通过复合凝聚反应与spi形成膜结构,包裹在spi/c纳米颗粒表面,但由于该复合凝聚过程往往是可逆的,其不连续的膜结构导致部分spi/c纳米颗粒仍然暴露在水中(图中绿色框部分)。相比之下,添加了fuc的纳米颗粒表面明显变得更加粗糙与不规则,spi/c纳米颗粒外部形成连续的fuc/car复合涂层膜结构,从剖面图(黄色实线框部分)可直观观察到复合纳米颗粒中有较多“芯孔”,表明该种自组装的纳米颗粒为多核型复合微胶囊结构,其中spi/c纳米颗粒被较好地包埋在内部。具体的自组装原理图见图3。
35.三、荧光光谱的测定利用岛津rf-5301荧光光谱仪测定了的实施例2与对比例1-3在460~630nm范围内姜黄素的稳态荧光光谱。激发波长设置为427nm,发射缝和激发缝宽度均为2.5nm。其中实施例与对比例的样品皆用纯水制备成纳米颗粒分散液再进行测定。测定结果见图4。
36.由图4可知,姜黄素纳米粒在在约550nm处有一个相对较宽的荧光发射峰,且荧光强度较低。这可能是因为游离姜黄素被极性极强的水环境包围,导致姜黄素的荧光相当不稳定,易被降解。随着壁材的添加,姜黄素的荧光强度显著增加,其发射峰值发生蓝移,这是因为经过亲水聚合物的包埋可以缓解姜黄素被极性极强的水环境荧光猝灭,大大提高了姜黄素的荧光的稳定性。与car/spi/c复合纳米粒相比,fuc/car/spi/c的荧光发射强度进一步增强,表面的fuc/car双阴离子多糖涂层可以为姜黄素提供更疏水的结合环境。
37.四、光稳定性的测定实施例2与对比例1-3在室温(25
±
2℃)下分别暴露于强光(4400lux)和柔光(2200lux)下。在强光照条件下每8小时取样,在柔光照条件下每16小时取样,并计算保留率进行比较。测定结果见图5。姜黄素的保留率公式如下:由图5可知,无论是在强光还是弱光照射下,经过包埋处理的姜黄素保留率皆有提高。spi能够显著增加姜黄素的保留率(p<0.05),说明spi对姜黄素起到明显保护作用。随着阴离子多糖涂层的添加,姜黄素的保留率逐渐提高,其中双层阴离子多糖涂层的纳米粒子(fuc/car/spi/c)稳定性要稍高于单一阴离子多糖涂层的纳米粒子(car/spi/c),这是因为fuc的加入增加了光的散射,故减少了因光照造成的姜黄素损失。
38.五、热稳定性的测定通过鼓风干燥箱,将实施例2与对比例1-3分别在40℃、60℃、80℃加热条件下每隔2天、每隔1天与每隔1天测定姜黄素保留率,比较实施例2与对比例1-3之间姜黄素保留率的变化。
39.由图6可知,随着加热温度的增加,所有样品保留率的下降趋势明显增大。实施例2
及对比例2-3的三个样品保留率皆大于对比例1(姜黄素纳米粒),说明壁材的添加能有效提高姜黄素的热稳定性,其稳定性排序为:fuc/car/spi/c≥car/spi/c>spi/c,这说明双阴离子多糖涂层(fuc/car)与spi结合可提供更为致密的微胶囊结构,从而抑制姜黄素泄露在颗粒表面而发生降解,有效提高其热稳定性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1