长链酰基肉碱类化合物在制备预防和/或治疗肝癌的药物中的应用
1.本发明属于生物医药技术领域,具体涉及一种长链酰基肉碱类化合物在制备预防和或治疗肝癌的药物中的应用。
背景技术:
2.肝细胞癌(hepatocellμlar carcinoma,hcc)占原发性肝癌的70%-90%,是全球第四大肿瘤致死病因。hcc对治疗具有很高的耐受性,经过手术或者射频消融治疗,5年内约70%的患者会发生肿瘤复发。一旦肿瘤进展至晚期,目前的治疗策略只能带来微小的生存获益。此外,尽管近年出现了分子靶向抗癌药,但由于肿瘤异质性,其治疗效果仍然欠佳。总之,hcc是一种侵袭性癌症,预后不良,预防策略至关重要。
3.长链酰基肉碱(long-chain acylcarnitine,lcac)是脂肪酸氧化的中间产物,是由长链脂肪酸和肉碱发生酯化反应形成的两性化合物。近年来,学者们发现包括lcac除了参与长链脂肪酸的β氧化,还参与胰岛素敏感性、蛋白激酶c活性以及离子平衡的调节。既往研究表明十六碳长链酰基肉碱(lcac-16:0)能够抑制神经母细胞瘤以及结肠癌细胞系的增殖,或发下其可以作为检测乳腺癌、膀胱癌等癌症的生物标志物的用途。然而,lcac-16:0等长链酰基肉碱与hcc发生发展的关系暂无文献报道。
4.因此,提供一种有效的药物来预防和/或治疗肝癌,实现降低hcc高危人群的hcc风险的目的具有重要的意义。
技术实现要素:
5.针对现有技术的不足,本发明的目的在于提供一种长链酰基肉碱类化合物在制备预防和/或治疗肝癌的药物中的应用,旨在降低hcc高危人群的hcc风险。
6.为达此目的,本发明采用以下技术方案:
7.第一方面,本发明提供一种长链酰基肉碱类化合物在制备预防和/或治疗肝癌的药物中的应用。
8.在本发明中,通过体外细胞实验证明了长链酰基肉碱类化合物能够显以剂量依赖和时间依赖的方式抑制人肝细胞癌细胞系和人肝细胞系的增殖。通过体内实验证明了腹腔注射长链酰基肉碱类化合物能够显著抑制不同细胞系构建的小鼠皮下荷瘤瘤体的增长。此外,在二乙基亚硝胺联合四氯化碳诱发小鼠原发性肝癌模型中,腹腔注射长链酰基肉碱类化合物能够显著降低小鼠肝脏肿瘤发生。而关于长链酰基肉碱类化合物(lcac)抗肝细胞癌的机制探索,我们发现lcac在线粒体中进行脂肪酸β氧化产生乙酰辅酶a,线粒体乙酰辅酶a通过“柠檬酸穿梭”被转运至细胞质和细胞核中,细胞核中乙酰辅酶a含量的升高促进klf6启动子区域组蛋白发生乙酰化修饰,上调klf6/p21表达,诱导细胞周期阻滞,从而抑制肝细胞癌发生发展。
9.在本发明中,所述长链酰基肉碱类化合物为酰基中碳原子数≥12(例如可以是12、
13、14、15、16、17、18、19、20、21、22、23、24、25、26等)的酰基肉碱,优选为碳原子数≥14的偶数碳(例如可以是14、16、18、20、22等)酰基肉碱,进一步优选为碳原子数为14~18的偶数碳酰基肉碱。
10.在本发明中,所述长链酰基肉碱类化合物选自肉豆蔻酰基肉碱(lcac-14:0)、棕榈酰基肉碱(lcac-16:0)、棕榈烯酰基肉碱(lcac-16:1)、十八烷酰基肉碱(lcac-18:0)、十八烷烯酰基肉碱(lcac-18:1)或十八烷二烯酰基肉碱(lcac-18:2)中的任意一种或至少两种的组合。
11.在本发明中,所述长链酰基肉碱类化合物的使用剂量为2.8~5.6mg/kg/d,例如可以是2.8mg/kg/d、3.0mg/kg/d、3.5mg/kg/d、4.0mg/kg/d、4.5mg/kg/d、5.0mg/kg/d、5.6mg/kg/d等。
12.在本发明中,所述长链酰基肉碱类化合物用于制备抑制人肝细胞癌细胞系和/或人肝细胞系的增殖的药物。
13.在本发明中,所述人肝细胞癌细胞系包括mhcc97h、huh7、smmc-7721、hep g2或hep 3b中的任意一种或至少两种的组合;所述人肝细胞系包括l02和/或miha。
14.第二方面,本发明提供长链酰基肉碱类化合物以非诊断和/或治疗为目的的在制备人肝细胞癌细胞系和/或人肝细胞系的增殖抑制剂中的应用。
15.根据本发明的研究结果,长链酰基肉碱类化合物具有显著地抑制人肝细胞癌细胞系和/或人肝细胞系增殖的作用,因此,该结果表明长链酰基肉碱类化合物可以作为一种制剂,用于科研领域,例如用于肝癌细胞代谢行为的理论研究、用于筛选更多的治疗肝癌的药物等等。
16.第三方面,本发明提供一种预防和/或治疗肝癌的药物,所述药物包括至至少一种所述的长链酰基肉碱类化合物。
17.在本发明中,所述药物的剂型包括混悬剂、颗粒剂、胶囊剂、散剂、片剂、乳剂、溶液剂、滴丸剂、注射剂、栓剂、灌肠剂、气雾剂、贴剂或滴剂中的任意一种或至少两种的组合。
18.在本发明中,所述药物的给药途径包括静脉注射、腹腔注射、肌肉注射、皮下注射、口服给药、舌下给药、鼻腔给药或经皮给药中的任意一种或至少两种的组合。
19.在本发明中,所述药物中还包括药学上可接受的辅料,所述药学上可接受的辅料包括稀释剂、粘合剂、润湿剂、崩解剂、乳化剂、助溶剂、增溶剂、渗透压调节剂、表面活性剂、包衣材料、抗氧剂、抑菌剂或缓冲剂中的任意一种或至少两种的组合。
20.相对于现有技术,本发明具有以下有益效果:
21.本发明通过体外细胞实验证明了长链酰基肉碱类化合物能够显以剂量依赖和时间依赖的方式抑制人肝细胞癌细胞系和人肝细胞系的增殖。通过体内实验证明了腹腔注射长链酰基肉碱类化合物能够显著抑制不同细胞系构建的小鼠皮下荷瘤瘤体的增长。此外,在二乙基亚硝胺联合四氯化碳诱发小鼠原发性肝癌模型中,腹腔注射长链酰基肉碱类化合物能够显著降低小鼠肝脏肿瘤发生。
附图说明
22.图1为不同浓度的lcac-14:0处理人肝细胞系和人hcc细胞系cck8比色法检测细胞增殖情况图。
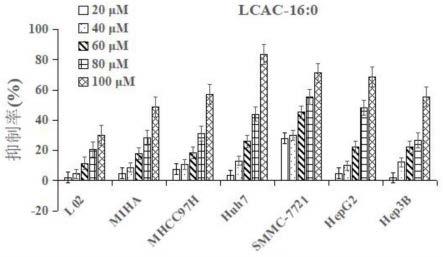
23.图2为不同浓度的lcac-16:0处理人肝细胞系和人hcc细胞系cck8比色法检测细胞增殖情况图。
24.图3为不同浓度的lcac-16:1处理人肝细胞系和人hcc细胞系cck8比色法检测细胞增殖情况图。
25.图4为不同浓度的lcac-18:0处理人肝细胞系和人hcc细胞系cck8比色法检测细胞增殖情况图。
26.图5为不同浓度的lcac-18:1处理人肝细胞系和人hcc细胞系cck8比色法检测细胞增殖情况图。
27.图6为不同浓度的lcac-18:2处理人肝细胞系和人hcc细胞系cck8比色法检测细胞增殖情况图。
28.图7为利用lcac-16:0(60μm)和溶剂对照处理人肝细胞系l02的不同时间下cck8比色法检测细胞增殖情况图。
29.图8为利用lcac-16:0(60μm)和溶剂对照处理人肝细胞系miha的不同时间下cck8比色法检测细胞增殖情况图。
30.图9为利用lcac-16:0(60μm)和溶剂对照处理人hcc细胞系huh7的不同时间下cck8比色法检测细胞增殖情况图。
31.图10为利用lcac-16:0(60μm)和溶剂对照处理人hcc细胞系mhcc97h的不同时间下cck8比色法检测细胞增殖情况图。
32.图11a为裸鼠皮下荷瘤(smmc-7721)中对照组和lcac-16:0干预组大体图片和瘤体体积直观对比图。
33.图11b为裸鼠皮下荷瘤(smmc-7721)中对照组和lcac-16:0干预组大体图片和瘤体体积柱状对比图。
34.图11c为裸鼠皮下荷瘤(mhcc97h)中对照组和lcac-16:0干预组大体图片和瘤体体积直观对比图。
35.图11d为裸鼠皮下荷瘤(mhcc97h)中对照组和lcac-16:0干预组大体图片和瘤体体积柱状对比图。
36.图12a为在den联合ccl4诱导的小鼠原发性肝癌模型中对照组小鼠肝脏大体图。
37.图12b为在den联合ccl4诱导的小鼠原发性肝癌模型中lcac-16:0(25mg/kg)干预组小鼠肝脏大体图。
38.图12c为在den联合ccl4诱导的小鼠原发性肝癌模型中对照组和lcac-16:0(25mg/kg)干预组肝脏表面肿瘤数目的柱状对比图。
39.图12d为在den联合ccl4诱导的小鼠原发性肝癌模型中对照组和lcac-16:0(25mg/kg)干预组肝脏体重比的柱状对比图。
40.图13a为在化学诱导的小鼠原发性hcc模型中对照组小鼠肝脏大体图。
41.图13b为在化学诱导的小鼠原发性hcc模型中lcac-16:0(50mg/kg)干预组小鼠肝脏大体图。
42.图13c为在化学诱导的小鼠原发性hcc模型中对照组和lcac-16:0(50mg/kg)干预组肝脏表面肿瘤数目的柱状对比图。
43.图13d为在化学诱导的小鼠原发性hcc模型中对照组和lcac-16:0(50mg/kg)干预
组肝脏体重比的柱状对比图。
44.图14a为lcac-16:0和溶剂对照处理人肝细胞系miha和人hcc细胞系(mhcc97h、huh7以及hepg2)24小时后,p21 mrna表达情况图。
45.图14b为lcac-16:0和溶剂对照处理人肝细胞系miha24和48小时后,p21蛋白表达情况图。
46.图14c为lcac-16:0和溶剂对照处理hcc细胞系(huh7)24和48小时后,p21蛋白表达情况图。
47.图14d为lcac-16:0和溶剂对照处理hcc细胞系(mhcc97h)24和48小时后,p21蛋白表达情况图。
48.图14e为lcac-16:0和溶剂对照处理hcc细胞系(hepg2)24和48小时后,p21蛋白表达情况图。
49.图14f为lcac-16:0和溶剂对照处理人肝细胞系miha 24小时后,细胞质和细胞核中p21蛋白的含量图。
50.图14g为lcac-16:0和溶剂对照处理人肝细胞系huh724小时后,细胞质和细胞核中p21蛋白的含量图。
51.图14h为lcac-14:0处理对p21和klf6蛋白表达的影响图。
52.图14i为lcac-18:0处理对p21和klf6蛋白表达的影响图。
53.图14j为lcac-18:1处理对p21和klf6蛋白表达的影响图。
54.图14k为lcac-18:2处理对p21和klf6蛋白表达的影响图。
55.图15a为si-p21和si-nc转染人肝细胞系miha和hcc细胞系(mhcc97h和huh7),lcac-16:0和溶剂对照细胞处理48小时cck8比色法检测细胞增殖并计算抑制率图。
56.图15b为si-p21和si-nc转染人肝细胞系miha,lcac-16:0(60μm)和溶剂对照处理24、48、72和96小时cck8比色法检测细胞增殖情况图。
57.图15c为si-p21和si-nc转染人hcc细胞系(mhcc97h),lcac-16:0(60μm)和溶剂对照处理24、48、72和96小时cck8比色法检测细胞增殖情况图。
58.图15d为si-p21和si-nc转染人hcc细胞系(huh7),lcac-16:0(60μm)和溶剂对照处理24、48、72和96小时cck8比色法检测细胞增殖情况图。
59.图16a为在利用mhcc97h细胞构建的裸鼠皮下荷瘤中,sh-nc、sh-nc+lcac-16:0、sh-p21和sh-p21+lcac-16:0组瘤体大体、瘤体生长情况以及干预14天后的瘤体体积的直观对比图。
60.图16b为在利用mhcc97h细胞构建的裸鼠皮下荷瘤中,sh-nc、sh-nc+lcac-16:0、sh-p21和sh-p21+lcac-16:0组瘤体大体、瘤体生长情况以及干预14天后的瘤体体积的曲线对比图。
61.图16c为在利用mhcc97h细胞构建的裸鼠皮下荷瘤中,sh-nc、sh-nc+lcac-16:0、sh-p21和sh-p21+lcac-16:0组瘤体大体、瘤体生长情况以及干预14天后的瘤体体积的柱状对比图。
62.图17a为lcac-16:0(60μm)和溶剂对照处理hcc细胞系48小时蛋白表达情况图。
63.图17b为si-klf6和si-nc转染hcc细胞系klf6和p21蛋白表达情况图。
64.图17c为si-klf6和si-nc转染肝细胞系(miha),lcac-16:0处理48小时,cck8比色
法检测细胞增殖情况图。
65.图17d为si-klf6和si-nc转染hcc(mhcc97h),lcac-16:0处理48小时,cck8比色法检测细胞增殖情况图。
66.图17e为si-klf6和si-nc转染hcc(huh7),lcac-16:0处理48小时,cck8比色法检测细胞增殖情况图。
67.图17f为si-klf6和si-nc转染肝细胞系和hcc,不同组给予相应干预,在24、48、72和96小时cck8比色法检测细胞增殖情况的柱状对比图。
68.图17g为si-klf6和si-nc转染肝细胞系(miha)不同组给予相应干预,在24、48、72和96小时cck8比色法检测细胞增殖情况曲线图。
69.图17h为si-klf6和si-nc转染hcc(mhcc97h)不同组给予相应干预,在24、48、72和96小时cck8比色法检测细胞增殖情况曲线图。
70.图17i为si-klf6和si-nc转染hcc(huh7)不同组给予相应干预,在24、48、72和96小时cck8比色法检测细胞增殖情况曲线图。
具体实施方式
71.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
72.以下实施例中,若无特殊说明,所用实验方法和技术手段均为本领域常规的方法和手段。若无特殊说明,其余所用试剂及耗材均购自本领域常规试剂厂商。
73.实施例1
74.本实施例用于验证长链酰基肉碱类化合物(lcac)抑制人hcc细胞系和人肝细胞系的增殖
75.测试方法
76.实验细胞系:本实验共涉及人hcc细胞系(smmc-7721、hep g2、hep 3b和huh7)和人正常肝上皮细胞系miha共5种细胞系,均从atcc(american type cμlture collection)细胞库购入。
77.主要试剂及公司:
78.[0079][0080]
实验仪器耗材及公司
[0081][0082]
实验方法:
[0083]
1、细胞复苏、培养和传代
[0084]
细胞复苏:提前进行细胞操作超净台紫外线照射消毒30min,准备好细胞培养相关试剂及耗材并预热37℃恒温水浴锅。本研究中人hcc细胞系smmc-7721、hep g2、hep 3b和huh7均使用高糖dmem培养基,人正常肝上皮细胞系miha用rpmi 1640培养基培养。将冻存好的细胞从-80℃超低温冰箱中取出,迅速将细胞置于37℃恒温水浴锅中,连续轻轻晃动解冻。待冻存细胞溶液全部融化后,进入细胞超净台将冻存管内细胞溶液转移至无菌ep管中,室温5min 1000转/min进行离心。弃去上层液体,加入1ml培养基进行重悬细胞,将重悬后的细胞溶液加入培养瓶中,同时加入新鲜含血清培养基进行培养。
[0085]
细胞换液和传代:当培养瓶内细胞长满约90%左右进行细胞传代。将细胞从恒温细胞孵箱中取出,进入细胞超净台进行操作。因为本实验涉及的细胞系均为贴壁细胞,因此直接吸取弃去细胞培养瓶内培养基,用无菌pbs溶液清洗细胞2遍后加入新鲜培养基完成细胞换液,或者加入适量0.25%胰蛋白酶溶液,放入细胞恒温孵箱进行消化。显微镜下观察贴壁细胞变圆脱落,加入相同体积含血清培养基进行终止消化,待细胞全部脱落后将细胞溶液加入ep管中,进行室温5min 1000转/min进行离心。弃去上层液体,加入1ml新鲜培养基进行细胞重悬吸取适量细胞溶液于细胞培养瓶中并加入新鲜培养基,放入细胞孵箱中进行培养,细胞传代完成。整个操作过程遵循无菌原则。
[0086]
2、lcac半数抑制率(ic
50
)测定
[0087]
提前进行细胞操作超净台紫外线照射消毒30min,准备好cck8等相关试剂及耗材。
选择96孔板进行ic50测定,为了防止液体蒸发引起误差,96孔板外侧一圈加150μl无菌pbs溶液。选择处于对数生长期的细胞系(smmc-7721、hep g2、hep 3b、huh7、hep1-6和miha),消化成细胞溶液,显微镜下计数,计算后进行铺板,约每孔3000个细胞每孔,100μl液体每孔;待12小时后,细胞贴壁较为稳定,进行换液。每个细胞系依次换成0μm、20μm、40μm、60μm、80μm、100μm的lcac(lcac-14:0、lcac-16:0、lcac-16:1、lcac-18:0、lcac-18:1、lcac-18:2)溶液,培养48小时。48小时后加入每孔10μl cck8溶液,反应2小时后在酶标仪上测定吸光值(od值),波长设定为450nm,收集处理数据,绘制成图,每组5个复孔,弃去最大最小值,每个实验重复3次。
[0088]
3、细胞增殖实验(cck8法)
[0089]
铺板步骤同ic
50
测定实验。待12小时后,细胞贴壁较为稳定,进行换液。每个细胞系换成0μm和80μm的lcac-16:0溶液。并在第一排加入每孔10μl cck8溶液,反应2小时后在酶标仪(450nm)上测定od值,记录为day 0-0h接下来4天每天同一时间加入cck8溶液并测定od值,分别记录为day 1-24h、day 2-48h、day3-72h、day4-96h。
[0090]
测试结果:
[0091]
如图1-6所示,六种lcac(lcac-14:0、lcac-16:0、lcac-16:1、lcac-18:0、lcac-18:1、lcac-18:2)以剂量依赖方式人hcc细胞系(mhcc97h、huh7、smmc-7721、hep g2和hep 3b)和人肝细胞系(l02和miha)的增殖。如图7-10所示,lcac-16:0对人hcc细胞系(mhcc97h、huh7和hep g2)和人肝细胞系miha的细胞增殖抑制效应存在时间依赖性,作用时间越长,抑制效应越显著。
[0092]
实施例2
[0093]
本实施例用于验证长链酰基肉碱类化合物(lcac-16:0)抑制裸鼠皮下瘤瘤体生长
[0094]
测试方法
[0095]
实验动物:4周龄左右的雄性balb/c裸鼠自广东省医学动物中心购入。所有实验动物均于华南农业大学实验动物中心spf级别环境中饲养,小鼠垫料、饲料和饮水用均经过严格消毒灭菌,平均每天给予小鼠12小时光照(7:00-19:00)12小时黑暗,小鼠自由取饮用水和饲料。
[0096]
裸鼠hcc移植瘤模型建立:
[0097]
1、细胞准备:选择处于对数生长期的mhcc97h和smmc-7721细胞,按细胞培养所述步骤消化离心,用无菌pbs溶液重悬和配置,通过细胞计数,配置成5
×
107/ml的单细胞悬液;
[0098]
2、试剂准备:准确称量0.025g lcac-16:0粉末,加至10ml无菌pbs溶液中,再通过等比稀释法,分别得到2.5g/l和1.25g/l的lcac-16:0混悬液;准确称量0.4g水合氯醛晶体,加至10ml无菌pbs溶液中,得到10ml4%水合氯醛溶液;
[0099]
3、建模和分组给药:肿瘤细胞接种:小鼠按体重0.1ml/10g水合氯醛溶液的剂量进行腹腔注射,麻醉小鼠,麻醉理想效果为小鼠翻正反射消失,呼吸变慢且规则,对脚趾给予的疼痛刺激没有反应。选择小鼠右大腿后外侧进行接种。酒精常规消毒小鼠皮肤,给予100μl单细胞悬液进行皮下注射,形成卵圆形皮丘。5-7天后可见小鼠移植瘤肿块形成,通过随机数字表法将小鼠分为pbs对照组和lcac-16:0实验组,实验组按照小鼠体重给予lcac-16:050mg/kg/d进行腹腔注射,对照组给予小鼠相同体积的pbs,给药12天。隔天观察小鼠左侧
腋下移植瘤体积变化,拍照,利用游标卡尺进行测量肿块的长径和短径,肿瘤体积计算公式为:体积=(长径
×
短径^2)/2。
[0100]
测试结果:
[0101]
如图11a-11d所示,在利用smmc-7721和mhcc97h细胞构建了裸鼠皮下荷瘤模型中,每天给予小鼠lcac-16:0(50mg/kg)腹腔注射显著抑制皮下瘤瘤体生长,在给药12天后,smmc-7721皮下瘤体积相比对照组减少了83.3%,mhcc97h皮下瘤体积减少了43.2%。
[0102]
实施例3
[0103]
本实施例用于验证长链酰基肉碱类化合物(lcac-16:0)抑制诱导的hcc发生
[0104]
实验动物:从湖南斯莱克景达实验动物有限公司购入12天龄雄性c57bl/6j乳鼠及相应母鼠(spf级),休息2天适应环境。所有实验动物均于华南农业大学实验动物中心spf级别环境中饲养,小鼠垫料、饲料和饮水用均经过严格消毒灭菌,平均每天给予小鼠12小时光照(7:00-19:00)12小时黑暗,小鼠自由取饮用水和饲料。
[0105]
den联合ccl4小鼠hcc诱发癌模型:
[0106]
1、试剂准备:准确取25μl二乙基亚硝胺(diethyl nitrosamine,den)原液(sigma-aldrich)加至15mlpbs溶液中,配置成约0.16%的den溶液;ccl4溶液配置:准确吸取上1ml ccl4(ar,海易恩化学试剂有限公司)溶解至30ml橄榄油中,配置成3.4%的ccl4,一周一次,直至实验结束。
[0107]
2、造模及分组:在乳鼠14天龄时按照25mg/kg剂量腹腔注射一次,从小鼠4周龄开始,每周按照小鼠体重给予0.5ml/kg ccl4溶液腹腔注射,一周一次,直到18周实验结束。通过随机数字表法将小鼠分为pbs对照组、lcac-16:0低剂量组(25mg/kg/d)和lcac-16:0低剂量组(50mg/kg/d),在小鼠18周龄通过颈椎脱臼法处死小鼠,解剖分离肝脏,进行大体拍照,统计小鼠肝脏表面肿瘤数目,肝脏体重比,肝脏表面肿瘤最大直径,进行数据分析。
[0108]
测试结果:
[0109]
如图12a-12d所示,在den联合ccl4诱导的小鼠原发性肝癌模型中,每天给予小鼠lcac-16:0(25mg/kg)腹腔注射显著抑制肝癌发生,相比对照组,连续腹腔注射lcac-16:06周后,小鼠肝癌的发生数目减少了38.8%。如图13a-13d所示,在化学诱导的小鼠原发性hcc模型中,每天给予小鼠lcac-16:0(50mg/kg)腹腔注射显著抑制肝癌发生,相比对照组,连续腹腔注射lcac-16:06周后,小鼠肝癌的发生数目减少了100%。
[0110]
实施例4
[0111]
本实施案例用于研究长链酰基肉碱类化合物抗肝细胞癌的机制
[0112]
(1)lcac-16:0上调p21表达
[0113]
测试方法
[0114]
主要实验试剂及公司:
[0115][0116]
实验仪器耗材及公司
[0117][0118]
实验方法:
[0119]
逆转录实时荧光定量pcr(rt-qpcr)
[0120]
1、逆转录反应:使用试剂盒进行rna逆转录,采用nanodrop2000系统检测总rna的浓度和纯度。根据浓度用超纯水将rna样品稀释至500ng/μl,取2μlrna加入含有1μl oligo(dt)的无rna酶的pcr管中,加入rnase-free water 5μl;65℃5min后冰浴2min;加入10μl2
×
ts reaction、1μl e-mix、1μl gdnaremover;42℃30min,85℃5s。
[0121]
2、实时荧光定量pcr:使用超纯水将逆转录cdna稀释20倍;pcr管中加入稀释后的cdna9.4μl,上下游引物分别0.3μl,sybr green 10μl;放入roche 480pcr仪中进行实时荧光定量pcr,反应体系为:95℃10s,60℃30s,95℃1min,40个循环。本研究中使用的p21引物序列为:p21-f:aaactaggcggttgaatgag;p21-r:aaaggagaacacgggatgag;
[0122]
western blot实验体系
[0123]
1、细胞蛋白的提取:配制提取蛋白的裂解液:6孔板每个孔对应100μl高强度的ripa蛋白裂解液,再分别加入1μl磷酸酶抑制剂和蛋白酶抑制剂。取出hcc细胞,吸去培养基,使用pbs缓冲液清洗hcc细胞3次,然后吸去pbs。将配制好的裂解液加入到6孔板中,把6孔板放入4℃摇床中15分钟,然后使用细胞刮轻刮6孔板,再放入4℃摇床15分钟,再把裂解液从6孔板转移至1.5ml的ep管中,将ep管置于离心机离心,参数为12000g,4℃离心30min。
[0124]
2、细胞蛋白浓度的测定以及蛋白变性:计算总共所需的bca工作液体积,然后将a
液与b液按照50:1的比例配制成工作液。将bsa蛋白标准品稀释到合适浓度。取出96孔板,每个孔都加入1μl的样品和19μl的pbs缓冲液;将bsa蛋白标准品按照0、3、6、9、12、20μl体积加入孔中,再使用pbs补足至20μl。然后再往每个孔加入混合后的100μl的bca工作液,在37℃孵箱孵育30分钟。然后测量在波长562nm时的吸光度,计算出蛋白样品的浓度,然后计算总体积,加入五分之一总体积的5x的loading buffer,剩下由ripa裂解液补足。充分混匀后把蛋白放到100℃中孵育7分钟变性,随后上样;
[0125]
3、sds-page凝胶电泳:配置好电泳液、转膜液、分离胶以及压缩胶。蛋白电泳:将配制好的电泳液倒入电泳槽中,在每块胶板的两侧加入4μl蛋白marker,将蛋白样品按蛋白总量30μg/孔的量,按顺序加入到胶孔中,然后电泳参数设置为150v恒压,时间为50分钟。转膜:将凝胶自胶板中轻轻取出,按照“三明治”结构,将转膜夹拼装好(注意胶和pvdf膜之间不要有气泡),放置在转膜槽中,加满转膜液,于冰上转膜。转膜的参数设置为200ma恒流,60分钟。封闭:转膜结束后,取出膜放到5%牛奶中,常温摇床上封闭1小时孵育一抗:将pvdf膜按照需要的蛋白分子量裁剪,然后把膜转移到特定一抗中进行孵育4℃过夜。漂洗一抗:在一抗中取出所有的条带,然后使用tbst在摇床上洗10分钟
×
3次(摇床频率为70次/分)。孵育二抗:将条带放到抗兔的二抗中,在摇床上缓慢摇晃,常温下孵育1小时,孵育结束后在摇床上高速tbst洗涤10分钟
×
3次。洗膜结束后将pvdf膜放在发光仪中,滴加适量的ecl化学发光液,将发出的条带拍照、保存和统计分析。
[0126]
测试结果:
[0127]
如图14a所示,lcac-16:0以剂量依赖方式上调人hcc细胞系(mhcc97h、huh7和hep g2)和人正常肝细胞系mihap21 mrna的表达。如图14b-14k所示,lcac(lcac-14:0,lcac-18:0,lcac-18:1和lcac-18:2)能够上调人hcc细胞系(mhcc97h、huh7和hep g2)和人正常肝细胞系(miha)p21和klf-6蛋白的表达。
[0128]
(2)lcac通过上调p21表达抑制细胞增殖
[0129]
主要实验试剂及公司
[0130][0131]
细胞复苏、培养和传代;细胞增殖实验(如上文所述);
[0132]
si-rna转染:提前将97h、huh7和miha细胞铺入六孔板中,待细胞融合度达到70%左右的时候,可以做转染。配制p21-sirna的转染体系:a液opti 125μl,si序列6μl;b液opti 125μl,lipofectamine 30005μl。a、b液各自配置完成后静置5min。将静置后的a液和b液轻轻混合一起,之后静置15min。将配好的转染体系逐滴慢慢滴入到6孔板中。24h后,把转染后的细胞消化,进行细胞增殖实验。
[0133]
测试结果:
[0134]
如图15a所示,利用p21的si-rna敲低人hcc细胞系(mhcc97h和huh7)和人肝细胞系mihap21表达,可以部分逆转不同浓度的lcac-16:0的细胞增殖抑制作用。
[0135]
(3)lcac通过上调p21表达抑制裸鼠皮下瘤瘤体生长
[0136]
测试方法
[0137]
主要实验试剂及公司
[0138][0139]
细胞复苏、培养和传代(如上文所述);
[0140]
p21的shrna感染:提前将mhcc97h细胞铺入六孔板中,待细胞融合度达到30%左右的时候,可以做感染。取1ug(50pmol)的shrna,加入一定量无血清稀释液,充分混匀,制成rna稀释液。将rna稀释液滴加到有全培养基的细胞上,前后移动培养皿,混合均匀。继续培养24-96小时,将感染lv-p21 shrna的97h细胞置于含嘌呤霉素(5μg/ml)的培养基中进行筛选,以获得稳定敲低的细胞株,进行裸鼠hcc移植瘤实验。
[0141]
裸鼠hcc移植瘤模型建立方法(如上文所述);实验分组:通过随机数字表法将小鼠分为四组:pbs对照组、sirna-nc+lcac-16:0组、sirna-p21组和sirna-p21+lcac-16:0组,irna-nc+lcac-16:0组sirna-p21+lcac-16:0组按照小鼠体重给予lcac-16:050mg/kg/d进行腹腔注射,对照组给予小鼠相同体积的pbs,给药12天。隔天观察小鼠左侧腋下移植瘤体积变化,拍照,利用游标卡尺进行测量肿块的长径和短径,肿瘤体积计算公式为:体积=(长径
×
短径^2)/2。
[0142]
测试结果:
[0143]
如图16a-16c所示,在利用mhcc97h细胞构建裸鼠皮下荷瘤模型中,p21敲低可以部分抑制lcac-16:0的肿瘤生长抑制作用。
[0144]
(4)lcac-16:0通过klf6上调p21表达
[0145]
测试方法
[0146]
主要实验试剂及公司
[0147][0148]
细胞复苏、培养和传代;细胞增殖实验;western blot实验体系;si-rna转染;逆转录实时荧光定量pcr(如上文所述);
[0149]
测试结果:
[0150]
如图17a-17b所示,lcac-16:0干预hcc细胞系(smmc-7721、mhcc97h和huh7)后,klf6蛋白表达上调。如图17c-17e所示,利用klf6的si-rna敲低hcc细胞系(mhcc97h和huh7)和人肝细胞系miha,可以部分逆转lcac-16:0对p21表达的上调作用。如图17f-17i所示,si-klf6可以部分逆转lcac-16:0的细胞增殖抑制作用。
[0151]
申请人声明,本发明通过上述实施例来说明本发明的长链酰基肉碱类化合物在制备预防和或治疗肝癌的药物中的应用,但本发明并不局限于上述工实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1