多靶点阻断肽在制备预防和治疗新冠病毒感染药物中的应用的制作方法
1.本发明涉及多肽药物合成技术领域,尤其涉及一种多靶点阻断肽在制备预防和治疗新冠病毒感染药物中的应用。
背景技术:
2.现有抗病毒药物对新冠病毒的杀灭作用有限且毒副作用难以避免,已投入使用的部分mrna疫苗不良反应明显。因此,进一步揭示新冠病毒感染宿主细胞的全过程,发现新的药物作用靶点,开发新型治疗药物对新冠病毒入侵宿主细胞进行干预,是当前新冠病毒研究的重点。
3.新冠病毒属于单链rna病毒,主要通过其s蛋白的rbd结构域与宿主细胞膜上的受体结合后进入细胞,目前新冠抗体疫苗的研发主要是集中在病毒蛋白的rbd 上,但目前已知的抗体对病毒的中和效应仅能维持半年左右,随着抗体作用的减弱和病毒的快速突变,传统疫苗已经无法满足病毒的防治需求,在继续研发安全有效的新型病毒中和药物的同时,可以考虑从病毒感染细胞的受体入手,寻找安全有效的药物,为新冠病毒的防治带来了全新的理念和新的希望。
技术实现要素:
4.为了克服背景技术中的不足,本发明提供了一种多靶点阻断肽在制备预防和治疗新冠病毒感染药物中的应用,为新冠病毒的防治带来了全新的理念和新的希望。
5.具体技术方案如下:
6.本发明提供了一种多靶点阻断肽在制备预防和治疗新冠病毒感染药物中的应用,所述多靶点阻断肽的氨基酸序列为seq id no.1:kkkkkklkvrlashlrk[glu][c
ꢀ‑
16]lrkrllrda,或者seq id no.2:kkkkkklkvalaghlrk[glu][c-16]lrkrllrda;所述新冠病毒为sars-cov-2。
[0007]
本发明在上述序列第17位的k侧链上以谷氨酸(glu)为连接物链接了十六烷酸 (c16,棕榈酸),以提高肽的稳定性。上述多靶点阻断肽即为ay51,本发明分别通过分子试验和细胞试验,发现ay51能够高效阻断sars-cov-2-s蛋白rbd与靶细胞膜上受体的相互作用。
[0008]
进一步地,所述多靶点阻断肽通过阻断sars-cov-2-s蛋白rbd与靶细胞膜上受体的相互作用,来抑制新冠病毒对靶细胞的感染。
[0009]
更进一步地,所述受体为app、ldlr和lrp;其中,app为aβ前体蛋白(amyloid precursor protein);ldlr为低密度脂蛋白受体(low-density lipoproteinreceptor);lrp为低密度脂蛋白受体相关蛋白(ldlr-related protein)。
[0010]
多靶点阻断肽预防和治疗新冠病毒感染的应用,包括靶向app、ldlr和lrp的多靶点阻断肽即:ay51,多靶点阻断肽的氨基酸顺序及其赖氨酸和c-16脂肪酸修饰后在预防和治疗新型冠状病毒sars-cov-2感染的应用。
[0011]
所述多靶点阻断肽的序列为:
[0012]
ay51-1:kkkkkklkvrlashlrk[glu][c-16]lrkrllrda和
[0013]
ay51-2:kkkkkklkvalaghlrk[glu][c-16]lrkrllrda。
[0014]
所述的多靶点阻断肽能阻断sars-cov-2-s蛋白rbd与其受体相互作用,最终阻止了新冠病毒侵入靶细胞。
[0015]
与现有技术相比,本发明具有以下有益效果:
[0016]
本发明从分子和细胞水平检测了多靶点阻断肽能够高效阻断sars-cov-2-s蛋白 rbd与靶细胞膜上受体的相互作用,最终达到多靶点阻断肽阻止病毒侵入靶细胞,实现预防和治疗新冠病毒感染目的。
[0017]
apoe ldlr结合域的氨基酸顺序及其赖氨酸和c-16脂肪酸修饰后在预防和治疗新型冠状病毒sars-cov-2感染的应用,同时,从分子和细胞水平检测了修饰的多肽能高效靶向阻断sars-cov-2-s蛋白rbd与其细胞膜上多种受体相互作用,最终多靶点阻断了病毒侵入靶细胞以达到预防和治疗新冠病毒感染目的。
附图说明
[0018]
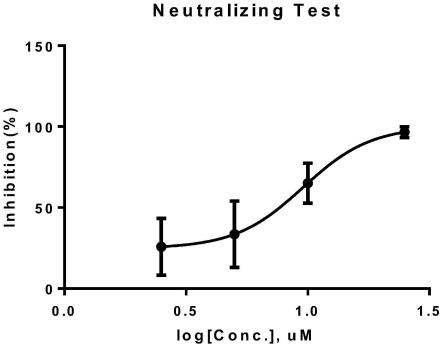
图1为实施例1中多靶点阻断肽ay51的中和试验结果图。
[0019]
图2为实施例1中多肽ay28的中和试验结果图。
[0020]
图3为实施例3中多靶点阻断肽ay51在4μm-500μm浓度梯度下od值的变化情况。
[0021]
图4为实施例3中多靶点阻断肽ay51在10μm和5μm的浓度下处理sh-sy5y 细胞0h~24h的od值变化情况。
[0022]
图5为实施例4中s-protein rbd与app的浓度梯度结合曲线。
[0023]
图6为实施例4中app与ay51的浓度梯度结合曲线。
[0024]
图7为修饰后的ay51氨基酸序列的化学结构式。
具体实施方式
[0025]
下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施例,但本发明的保护范围不仅限于此。
[0026]
下列实施例涉及的实验材料中ay51的氨基酸序列如seq id no.1所示(kkkkkklkvrlashlrk[glu][c-16]lrkrllrda),结构式如图7所示,ay28 的氨基酸序列如seq id no.3所示;vero e6细胞来自中国科学院微生物研究所,sars-cov-2来自中国科学院微生物研究所,dmem培养基(gibco),fbs(gibco),双抗(gibco),胰酶(tpck处理)为普通市售产品;配体app为干粉,分子量为60 kd;分析物ay51为干粉,分子量为3805.92。
[0027]
实施例1多靶点阻断肽ay51对假病毒(灭活病毒)的中和抑制实验
[0028]
一、实验方法
[0029]
293t-ace2细胞以dmem+10%fbs培养,30000cells/孔铺96孔板,铺板后细胞放入37℃,5%co2培养箱中继续培养。
[0030]
将样品ay28和ay51与293t-ace2细胞孵育2小时;添加假病毒孵育;阳性对照:dmem培养基母液加入到提前铺板的293t-ace2细胞上37℃孵育2小时,加入等体积假病毒;阴性对照:dmem培养基母液加入到提前铺板的293t-ace2细胞上 37℃孵育2小时,加入等体积dmem培养基母液。
[0031]
样品、阴阳性对照放入37℃,5%co2培养箱中继续培养48-72小时。
[0032]
用化学发光仪对96孔板中的样品进行luciferase发光值检测。
[0033]
二、实验结果
[0034]
多肽样本中和检测的结果如下表1~表2和图1~图2所示。
[0035]
ay51中和检测的ic50为样品浓度6.728μm,即该样品浓度为6.728μm时可以使该批次假病毒中和抑制率达到50%。
[0036]
表1多肽ay51假病毒中和抑制率
[0037][0038]
注:rlu1-5:5复孔的luceferase发光值;ave:5复孔发光值的平均值;抑制率=(rlu
阳性对照-rlu
ay51
) /rlu
阳性对照
[0039]
ay28中和检测的ic50为样品浓度14.575μm,即该样品浓度为14.575μm时可以使该批次假病毒中和抑制率达到50%。
[0040]
表2多肽ay28假病毒中和抑制率
[0041][0042]
注:rlu1-5:5复孔的luceferase发光值;ave:5复孔发光值的平均值;抑制率=(rlu
阳性对照-rlu
ay28
)/rlu
阳性对照
[0043]
实施例2多靶点阻断肽ay51对活病毒sars-cov-2复制的抑制实验
[0044]
一、实验方法
[0045]
本实验设置四组,分别为:ay51抑制组,ay28抑制组,病毒对照组,空白对照组;具体为:
[0046]
第一组,ay51抑制组:
[0047]
(1)将ay51用含双抗的无血清dmem培养基稀释为终浓度为80μm的母液,并用0.22μm的滤膜进行过滤备用,然后再将过滤后的ay51母液进行2倍梯度稀释,每个梯度的体积为3ml,备用;
[0048]
(2)将步骤(1)所得ay51稀释液加至生长状态良好的veroe6细胞24孔细胞培养板中,0.5ml/孔,然后补加fbs,10μl/孔,每个梯度2个重复孔,于37℃,5%co2培养箱中孵育4h;
[0049]
(3)将sars-cov-2用含双抗无血清的dmem培养基调至105tcid
50
/ml备用;
[0050]
(4)分别取10μl的105tcid
50
/ml的病毒加至1ml的步骤(1)所得的ay51 稀释液中;
[0051]
(5)待步骤(2)孵育结束后,弃去24孔板中的液体,然后加入步骤(4)所得的混合物,0.5ml/孔,于37℃,5%co2培养箱中孵育1~2h;
[0052]
(6)吸弃24孔板中的液体,并用无菌pbs洗涤一遍,加入步骤(1)所得的ay51 稀释液,0.5ml/孔,然后补加fbs,10μl/孔,于37℃,5%co2培养箱中培养3d,观察细胞病变情况。
[0053]
第二组,ay28抑制组:
[0054]
除将ay51替换成ay28外,其余步骤与ay51抑制组相同。
[0055]
第三组,病毒对照组:
[0056]
(1)将含双抗和2%fbs的dmem加至生长状态良好的veroe6细胞24孔细胞培养板中,0.5ml/孔,2个重复孔,于37℃,5%co2培养箱中孵育4h;
[0057]
(2)取10μl的105tcid
50
/ml的病毒加至1ml的含双抗无fbs的dmem中;
[0058]
(3)待步骤(1)孵育结束后,弃去24孔板中的液体,然后加入步骤(2)所得的混合物,0.5ml/孔,于37℃,5%co2培养箱中孵育1~2h;
[0059]
(4)吸弃24孔板中的液体,并用无菌pbs洗涤一遍,加入含双抗和2%fbs的 dmem,0.5ml/孔,于37℃,5%co2培养箱中培养3d,观察细胞病变情况;
[0060]
第四组,空白对照组:
[0061]
(1)将含双抗和2%fbs的dmem加至生长状态良好的veroe6细胞24孔细胞培养板中,0.5ml/孔,2个重复孔,于37℃,5%co2培养箱中孵育4h;
[0062]
(2)取10μl的pbs加至1ml的含双抗无fbs的dmem中;
[0063]
(3)待步骤(1)孵育结束后,弃去24孔板中的液体,然后加入步骤(2)所得的混合物,0.5ml/孔,于37℃,5%co2培养箱中孵育1~2h;
[0064]
(4)吸弃24孔板中的液体,并用无菌pbs洗涤一遍,加入含双抗和2%fbs的 dmem,0.5ml/孔,于37℃,5%co2培养箱中培养3d,观察细胞病变情况;
[0065]
为了对肉眼观察到的细胞病变进行复核,对同一梯度的重复孔上清进行合并;并取140μl上清,按照病毒rna提取试剂盒(qiagen)说明书进行病毒rna提取(140μ上清+560μl avl+5.6μl carrier rna,混合均匀,室温作用10min,然后加入560μl 的无水乙醇混合均匀,用75%的酒精管子表面完全消毒后带出p3实验室进行后续的操作)。将上述步骤所提取的rna采用taqman探针法进行荧光定量qpcr扩增orflab 基因,检测病毒orflab基因的ct值,客观判断细胞是否被感染。同时,测定不同处理组的不同处理浓度下受感染细胞浓度与半数组织培养感染剂量。
[0066]
二、实验结果
[0067]
实验结果如表3和表4所示,从表中可以看出,2.5μm~80μm浓度的ay51处理的细胞孔均出现了细胞病变,但20μm~80μm等浓度处理孔的orflab基因的ct值与病毒对照孔相比高于病毒对照组,且存在显著差异(p<0.05),说明20μm~80μm浓度的ay51对细胞水平上的100tcid
50
/100μl浓度的病毒复制有一定的抑制作用。
[0068]
而2.5μm~80μm浓度的ay28处理的细胞孔均出现了细胞病变,且其orflab基因的ct值与病毒对照孔相比更低或无显著差异(p>0.05),说明了2.5μm~80μm浓度的ay28不能抑制100tcid
50
/100μl的病毒复制。
[0069]
表3不同处理组的不同处理浓度下orflab的ct值
[0070][0071][0072]
表4不同处理组的不同处理浓度下受感染细胞浓度与半数组织培养感染剂量
[0073]
处理浓度ay51抑制组ay28抑制组0μm12.3263312.755092.5μm13.2601712.087845μm12.6584513.1856910μm13.6580913.2045220μm13.761612.8284540μm15.6848912.4513380μm26.3404811.79037tcid
50
10.00010.000
[0074]
实施例3多靶点阻断肽ay51的mtt细胞毒力实验
[0075]
一、实验方法
[0076]
采用人神经母细胞瘤细胞株sh-sy5y进行毒力实验。实验步骤为:
[0077]
1、复苏细胞sh-sy5y,复苏53h后进行细胞计数,计数密度为4.88
×
105个/ml;
[0078]
2、采用无菌水溶解多肽ay51,分别配置5ml 1mm的储存液,稀释成10个梯度,分别为:500μm,250μm,125μm,63μm,32μm,16μm,10μm,8μm,4μm,0μm。
[0079]
3、分装96孔板,每孔200μl,3.0
×
103个/孔,培养24h;
[0080]
处理步骤:
[0081]
(1)取90μl步骤2中配制的0~500μm不同浓度多肽加入110μl培养基,与细胞在培养箱共孵育12h;另取90μl 10μm和5μm浓度多肽加入110μl培养基,与细胞在培养箱共孵育0h、2h、4h、6h、8h、24h;
[0082]
加入含mtt的10μl+90μl培养基,处理4h;
[0083]
(2)结晶可充分形成;去掉上清,每孔加入100μl甲瓒溶解液;
[0084]
(3)放入培养箱中继续孵育10min,镜下观察,待结晶全部溶解后490nm测吸光度。
[0085]
二、实验结果
[0086]
选取多肽ay51在(4-500μm)浓度梯度下分别处理sh-sy5y细胞,处理12h后,检测样品间吸光值的变化,如图3所示;并且利用不同浓度的多靶点阻断肽ay51对 sh-sy5y细胞处理不同时间,即:10μm和5μm的浓度下分别处理sh-sy5y细胞0h、 2h、4h、6h、8h、24h,检测样品间od值的变化,如图4所示。
[0087]
结果表明,通过mtt检测结果差异不显著(p>0.05),说明不同浓度多靶点阻断肽ay51对sh-sy5y细胞的毒力没有差异,即多靶点阻断肽ay51对sh-sy5y细胞的生长没有产生影响。
[0088]
实施例4多靶点阻断肽ay51的内在机理研究
[0089]
一、实验方法
[0090]
采用表面等离子共振(surface plasmon resonance,spr)分析多靶点阻断肽ay51 与细胞膜表面受体app以及sars-cov-2-s蛋白rbd与app的亲和力。
[0091]
具体试验流程为:
[0092]
1、按照opensprtm仪器标准操作程序安装cooh芯片;
[0093]
2、开始以最大流速(150μl/min)运行,运行缓冲液pbs(ph7.4);
[0094]
3、达到信号基线后,上样200μl的ipa(异丙醇),运行10s排气泡,达到基线后,缓冲液冲洗样本环,并用空气排空;
[0095]
4、在信号达到基线后,调整缓冲液流速到20μl/min。
[0096]
5、上样200μl edc/nhs溶液(20μl/min,4min)。
[0097]
6、上样200μl激活缓冲液稀释的配体s-protein rbd/app运行4min(20 μl/min).缓冲液冲洗样本环,并用空气排空。
[0098]
7、上样200μl blocking(20μl/min,4min)溶液,缓冲液冲洗样本环,并用空气排空。
[0099]
8、观察基线5min,以确保稳定。
[0100]
9、分析物用缓冲液稀释,浓度详见实验结果,并以20μl/min上样分析物与配体结合时间均为240;自然解离480s。
[0101]
10、本次实验结果所使用分析软件为:tracedrawer(ridgeview instruments ab, sweden),分析方法是one to one分析模型。
[0102]
二、实验结果
[0103]
结果:表5为s-protein rbd与app的动力学及亲和力参数,图5为s-protein rbd 与app的浓度梯度结合曲线;由表5和图5可知,cooh芯片上捕获的app与 sars-cov-2-s蛋白rbd有较强结合力。表6为app与ay51的动力学及亲和力参数,图6为app与ay51的浓度梯度结合曲线;由表6和图6可知,cooh芯片上捕获的 app与ay51结合有较强结合力。
[0104]
表5.app与s-protein rbd的浓度梯度结合亲和力参数
[0105][0106]
表6.app与ay51的浓度梯度结合亲和力参数
[0107]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1