一种组织工程表皮的制备方法与流程
1.本发明属于细胞与组织体外培养领域,尤其涉及一种组织工程表皮的制备方法。
背景技术:
2.白癜风是一种发病机制不明的皮肤病,全球每200人中就有1人受到白癜风的影响。目前已经提出了几种潜在的白癜风发病机制,包括自身免疫、神经体液因素和自身细胞毒性等,不过白癜风可能是由多种因素引起的,发病部位覆盖全身,常见于面部、躯干、四肢。白癜风是局部黑色素细胞破坏引起的色素脱失的皮肤病,发病区域为边界清晰的皮肤白斑,临床上较常见的以皮肤颜色减退、变白,境界鲜明,无自觉症状为特征。目前白癜风治疗方案主要为药物、紫外照射及表皮移植等。传统的表皮移植方案是从健康皮肤上取下一部分正常肤色的皮肤,然后移植到患病的白斑区,移植比例一般都小于1:1。大面积的白斑患者需要多次重复进行移植手术,过程比较痛苦。
3.组织工程表皮的培养可实现皮肤面积由小变大的扩增,很好地解决了移植时需大面积取皮的问题。组织工程表皮主要由角质细胞和黑色素细胞组成。现阶段,将组织工程表皮应用于临床主要面临两个问题:1.使用无血清培养基让角质细胞和黑色素细胞共同有效扩增,2.扩增过程中保持黑色素细胞的功能。首先,组织工程表皮培养过程中容易受到成纤维细胞污染,所以现阶段都是采用rmd9小鼠胚胎细胞作为滋养层细胞来抑制成纤维细胞的生长。但是rmd9小鼠胚胎细胞是异种细胞,虽然经过灭活处理,但是分泌的外囊泡依然会被角质细胞和黑色素细胞所吸收,因此应用于临床是有极大潜在风险的。其次,由于黑色素细胞在普通培养基中很难生长,所以目前商业化的黑色素培养基中会添加十四烷酞佛波醇乙酯(tpa)、霍乱毒素 (ct)、牛垂体提取物(bpe)、胎牛血清(fbs)等其中一种或多种物质。但是tpa是公认的致癌物,ct对人体是有毒性的,bpe和fbs来源于异种,使用含有这些物质培养出来的组织工程表皮应用于临床是有极大潜在风险的。因此,现在亟需开发一种采用无滋养层细胞无血清培养基的组织工程表皮的制备方法。
技术实现要素:
4.本发明的目的在于提供一种无滋养层细胞、无血清制备组织工程表皮的方法。
5.为实现上述目的,本发明采用如下技术方案:一种组织工程表皮的制备方法,具体步骤如下:1、人组织工程表皮细胞的分离取人大腿内侧正常皮肤3cm
×
3cm,用75%酒精消毒1min,然后用剪刀和镊子将结缔组织和脂肪组织剔除。接着用生理盐水清洗7遍,用手术刀将皮肤组织切成0.5cm
×
0.5cm大小,加入6ml 0.2wt% i型胶原酶(215u/mg)酶液,4℃冰箱消化过夜。第二天用镊子将表皮从真皮上剥离下来,用生理盐水漂洗3次。将表皮剪碎,加入4ml 0.2wt% i型胶原酶(215u/mg)酶液,37℃摇床消化2h。随后加入1ml 0.25wt%的胰蛋白酶(gibco),37℃摇床消化30min。最终加入等体积的胰酶抑制剂(gibco,r002100)终止消化,吹打,将细胞悬液过70μm细胞筛,
500g离心5min,弃上清,加入生理盐水重悬细胞,得到人组织工程表皮细胞悬液,取样计数。
6.2、组织工程表皮细胞的培养及观察将细胞悬液500g离心5min,弃上清,加入自主研发的含终浓度为0.1mm 5-brdu(sigma,b5002)的无血清培养基,按照2
×
10
5 cells/孔的量接种到六孔板里,置于37℃条件下培养。5-brdu能有效地抑制成纤维细胞的污染。每隔两天镜下观察一次,培养四天后更换成新鲜的无血清培养基,随后每两天换液一次。当镜下观察到角质细胞克隆每个克隆含有100-150个细胞时即可执行传代步骤。
7.所述无血清培养基为在dmem/f12培养基中加入10g/l人血白蛋白,10mg/l人胰岛素,6.5mg/l人转铁蛋白,7.5μg/l亚硒酸钠,3mg/l氨基乙醇,4mm谷氨酰胺,0.5mg/ml环磷酸腺苷,30ng/ml人骨形态发生蛋白4,1nm α-黑色素细胞刺激素,10ng/ml肝细胞生长因子,1μg/ml粒细胞巨噬细胞集落刺激因子,0.6μg/ml碱性成纤维细胞生长因子,50μm干细胞生长因子,2mg/l三碘甲状腺原氨酸,10ng/ml表皮生长因子,0.5μg/ml异丙肾上腺素,10nm内皮素-1,10nm内皮素-3,0.4μg/ml氢化可的松和10μm rock抑制剂y-27632;其中,所述dmem/f12培养基为dmem和f12按照3:1体积比例的混合液。
8.3、组织工程表皮细胞的传代去除培养基,加入0.02wt%的edta清洗细胞两次,然后再加入0.02wt%的edta于37℃孵育20min。接着加入0.05wt%的胰蛋白酶消化1-3min,再加入等体积的胰酶抑制剂终止消化。500g离心5min,弃上清,加入无血清培养基,接种到60mm培养皿中。按照1个孔传1个60mm培养皿的比例传代。
9.4、组织工程表皮细胞的融合传代后每两天换一次无血清培养基,直至表皮细胞完全融合,接着改为每天换液,表皮细胞开始重叠生长,并分化增厚成多层的层状表皮。
10.5、组织工程表皮的剥离往培养液里加入终浓度为0.1mg/ml的分散酶,37℃孵育15-20min,用镊子从边缘开始往中间方向将组织工程表皮从培养皿上剥离下来,用1
×ꢀ
pbs缓冲液(ph 7.2)清洗两遍后,将表皮转移到新的60mm培养皿中,4℃冷藏,待质检合格后即可用于临床移植。
11.6、dopa染色切取部分组织工程表皮成品,用1
×ꢀ
pbs缓冲液(ph 7.2)清洗2遍,加入4%多聚甲醛固定10min,然后再用1
×ꢀ
pbs缓冲液(ph 7.2)液清洗2次,自然干燥2h,加入1mg/ml的左旋多巴,37℃孵育4-5h。镜下观察计数。
12.7、he染色切取部分组织工程表皮成品,经过脱蜡至水、组织包埋、组织切片、组织切片脱蜡至水、he染色及脱蜡至二甲苯等步骤,最终镜下观察并拍照。
13.8、内毒素检测取组织工程表皮成品的上清液,按照药典2020版规定的内毒素凝胶限度试验进行检测。
14.9、无菌性检测取组织工程表皮成品一周前的上清液,按照药典2020版规定的无菌检查法进行检测。
15.10、支原体检测取组织工程表皮成品的上清液,按照一步法支原体检测试剂盒(购自上海易色医疗科技有限公司 ,货号:md001)的说明书进行操作。
16.本发明的优点在于:使用自主研发的无血清培养基,无需胎牛血清、tpa等物质,又能保证黑色素细胞和角质细胞得到高效扩增;采用多种酶多步骤的消化方法,将表皮和真皮完美分离开后再将角质细胞和黑色素细胞消化下来,从根源上就有效杜绝了成纤维细胞的污染,从而无需滋养层细胞。
附图说明
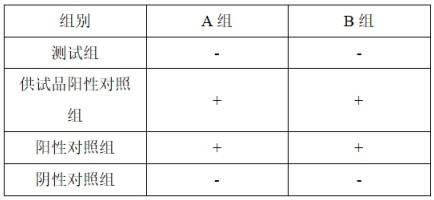
17.图1为组织工程表皮细胞传代前的细胞形态示意图。
18.图2为组织工程表皮细胞融合过程的示意图。
19.图3为组织工程表皮细胞完全融合的示意图。
20.图4为组织工程表皮剥离的示意图。
21.图5为组织工程表皮dopa染色的示意图。
22.图6为组织工程表皮he染色的示意图。
具体实施方式
23.下面通过具体实施例对本发明的技术方案进行详细的介绍和说明,但是应当理解的是,下述实施例并不限制本发明范围。
24.实施例1 人组织工程表皮的培养及形态学观察本实施例之中,采用的自主研发的组织工程表皮培养基为:在dmem/f12培养基中加入10g/l人血白蛋白,10mg/l人胰岛素,6.5mg/l人转铁蛋白,7.5μg/l亚硒酸钠,3mg/l氨基乙醇,4mm谷氨酰胺,0.5mg/ml环磷酸腺苷(camp),30ng/ml人骨形态发生蛋白4(bmp-4),1nm α-黑色素细胞刺激素(α-msh),10ng/ml肝细胞生长因子(hgf),1μg/ml粒细胞巨噬细胞集落刺激因子(gm-csf),0.6μg/ml碱性成纤维细胞生长因子(bfgf),50μm干细胞生长因子(scf),2mg/l三碘甲状腺原氨酸(t3),10ng/ml表皮生长因子(egf),0.5μg/ml异丙肾上腺素,10nm内皮素-1(et-1),10nm内皮素-3(et-3),0.4μg/ml氢化可的松和10μm rock抑制剂y-27632;其中,所述dmem/f12培养基为dmem和f12按照3:1体积比例的混合液。
25.具体培养方法为:1、人组织工程表皮细胞的分离取人大腿内侧正常皮肤3cm
×
3cm,用75%酒精消毒1min,然后用剪刀和镊子将结缔组织和脂肪组织剔除。接着用生理盐水清洗7遍,用手术刀将皮肤组织切成0.5cm
×
0.5cm大小,加入6ml 0.2wt% i型胶原酶(215u/mg)酶液,4℃冰箱消化过夜。第二天用镊子将表皮从真皮上剥离下来,用生理盐水漂洗3次。将表皮剪碎,加入4ml 0.2wt% i型胶原酶(215u/mg)酶液,37℃摇床消化2h。随后加入1ml 0.25wt%的胰蛋白酶(gibco),37℃摇床消化30min。最终加入等体积的胰酶抑制剂(gibco,r002100)终止消化,吹打,将细胞悬液过70μm细胞筛,500g离心5min,弃上清,加入生理盐水重悬细胞,得到人组织工程表皮细胞悬液,取样计数。
26.2、组织工程表皮细胞的培养及观察
将细胞悬液均分成a、b两组,500g离心5min,弃上清。a组加入自主研发的含终浓度为0.1mm5-brdu(sigma,b5002)的无血清培养基,按照2
×
105cells/孔的量接种到六孔板里,置于37℃条件下培养。b组加入自主研发的无血清培养基,按照2
×
105cells/孔的量接种到含mmc处理过的滋养层的六孔板里,置于37℃条件下培养。每隔两天镜下观察一次,培养四天后更换成新鲜的无血清培养基,随后每两天换液一次。当镜下观察到角质细胞形成克隆时即可执行传代步骤。此时组织工程表皮细胞的形态如图1所示。
27.mmc处理滋养层步骤如下:从液氮罐中取出冻存的rmd9细胞,立即投入37℃水浴中加热融化,然后转移到dmem基础培养基中,500g离心5min,去上清,加入适量的rmd9完全培养基:dmem+10%fbs,调整密度为5
×
104cells/ml,接种至六孔板或60mm培养皿里,六孔板每孔接种2ml,60mm培养皿每皿接种4ml。三天后,镜下观察细胞融合度达到90%,即可将浓度为0.1mg/ml的mmc直接加入到成纤维细胞培养基中,然后置于37℃孵育90min。mmc和rmd9完全培养基的比例为1:24。孵育完成后,吸走上清,加入α-mem培养基清洗两遍。清洗完成后加入rmd9完全培养基,放回培养箱中备用。
28.3、组织工程表皮细胞的传代去除培养基,加入0.02wt%的edta清洗细胞两次,然后再加入0.02wt%的edta于37℃孵育20min。接着加入0.05wt%的胰蛋白酶消化1-3min,再加入等体积的胰酶抑制剂终止消化。500g离心5min,弃上清,加入无血清培养基,a组接种到60mm培养皿中,b组接种到含mmc处理过的滋养层的60mm培养皿中。按照1个孔传1个60mm培养皿的比例传代。
29.4、组织工程表皮细胞的融合传代后每两天换一次无血清培养基,直至表皮细胞完全融合。接着改为每天换液,表皮细胞开始重叠生长,并分化增厚成多层的层状表皮,如图2、图3所示。
30.5、组织工程表皮的剥离往培养液里加入终浓度为0.1mg/ml的分散酶,37℃孵育15-20min,用镊子从边缘开始往中间方向将组织工程表皮从培养皿上剥离下来,用1
×
pbs缓冲液(ph7.2)清洗两遍后,将表皮转移到新的60mm培养皿中,4℃冷藏,待质检合格后即可用于临床移植。
31.6、结果及分析a、b两组人组织工程表皮细胞生长状态均良好。如图2、3所示,角质细胞分裂生长形成克隆,并逐渐完全融合。在这个过程中伴随着黑色素细胞的生长。角质细胞融合成片后开始分化增厚成多层的层状表皮。如图4所示,皮片具有一定的厚度,易于剥离,且剥离后皮片完整无破损。
32.实施例2dopa染色切取实施例1获得的部分组织工程表皮,用1
×
pbs缓冲液(ph7.2)清洗2遍,加入4%多聚甲醛固定10min,然后再用1
×
pbs缓冲液(ph7.2)液清洗2次,自然干燥2h,加入1mg/ml的左旋多巴,37℃孵育4-5h。镜下观察计数,结果如图5所示:a组黑色素细胞分布均匀,细胞数大于140个/mm2,黑色素细胞得到有效扩增;b组黑色素细胞分布均匀,细胞数大于120个/mm2,黑色素细胞得到有效扩增。由上述结果可见,黑色素细胞扩增效力a组比b组强。
33.实施例3he染色切取实施例1获得的部分组织工程表皮,经过脱蜡至水、组织包埋、组织切片、组织
切片脱蜡至水、he染色及脱蜡至二甲苯等步骤,最终镜下观察并拍照,结果如图6所示:a、b两个处理组组织工程表皮都具有人正常表皮的分层结构,且分层厚度相差无几。
34.实施例4 内毒素检测取实施例1获得的组织工程表皮成品的上清液,按照药典2020版规定的内毒素凝胶限度试验进行检测,结果如表3所示:组织工程表皮内毒素检测结果为阴性。
35.表3 内毒素检测结果注:“+”表示“阳性”,
“‑”
表示“阴性”。
36.实施例5 无菌性检测取实施例1获得的组织工程表皮成品一周前的上清液,按照药典2020版规定的无菌检查法进行检测,结果如表4所示:组织工程表皮无菌性检测结果为阴性。
37.表4 无菌性检测结果注:“+”表示“阳性”,
“‑”
表示“阴性”。
38.实施例6 支原体检测取实施例1获得的组织工程表皮成品的上清液,按照一步法支原体检测试剂盒(购自上海易色医疗科技有限公司 ,货号:md001)的说明书进行操作,检测结果如表5所示:组织工程表皮支原体检测结果为阴性。
39.表5 支原体检测结果注:“+”表示“阳性”,
“‑”
表示“阴性”。
40.结论:采用本发明方法制备出来的组织工程表皮具有人正常表皮完整的分层结构,且含有大量形态完整的黑色素细胞,有利于白癜风白斑均匀复色,更美观,并且表皮通过内毒素检测、无菌性检测、支原体检测等安全性检测。
41.以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1