一种坎地沙坦酯药物组合物及其制备方法与流程
1.本发明属于医药技术领域,具体涉及一种坎地沙坦酯片剂及其制备方法。
背景技术:
2.坎地沙坦酯适应症为原发性高血压,其在体内迅速被水解成活性代谢物坎地沙坦。坎地沙坦为选择性血管紧张素ⅱ受体(at1)拮抗剂,通过与血管平滑肌at1受体结合而拮抗血管紧张素ⅱ的血管收缩作用,从而降低末梢血管阻力。
3.坎地沙坦酯存在多种晶型,其中晶型i(又称type c)具有生物利用度高、不良反应少等优点,为市售制剂所普遍采用,但该晶型对外力挤压敏感不稳定,容易发生结晶结构转变进而导致有关物质升高。
4.为减轻坎地沙坦酯晶型i在制剂制备过程中受到破坏,原研开发商武田药品工业株式会社通过加入低熔点油性化合物与坎地沙坦酯混合(中国发明专利zl93100008.4),以抑制活性组分的分解。国内众多仿制药厂家在实践过程中发现,规避原研专利保护并获得一种质量稳定的坎地沙坦酯组合物及制备方法并不容易。中国专利cn103127010b公开了一种坎地沙坦酯不参与制粒和干燥、无油性化合物的组合物及制备方法,但该方法制得的片剂硬度需严格控制在2.20-2.60kg范围内,这种低硬度片剂无法应用于大生产高速压片机,也不利于药品后续贮存及运输。
技术实现要素:
5.本发明的目的是提供一种质量稳定性优于原研制剂且适合工业化生产的坎地沙坦酯药物组合物。
6.根据坎地沙坦酯晶型i在外力挤压下易发生结晶结构转变进而有关物质升高的特点,在为突破原研专利进行处方工艺筛选过程中,意外的发现了本发明技术方案。
7.本发明技术方案通过坎地沙坦酯、琼脂、瓜耳胶、乳糖、微晶纤维素、交联聚维酮的合理配伍,获得了对外力挤压不敏感、质量稳定性优于原研制剂且适合工业化生产的坎地沙坦酯药物组合物。
8.本发明的技术方案是:一种坎地沙坦酯药物组合物,其特征是单位剂量的片中含有坎地沙坦酯(晶型i)8mg,琼脂0.8-1.8mg,瓜耳胶2-6mg,乳糖83-91mg,微晶纤维素17-28mg,交联聚维酮5-7mg,硬脂酸镁1.2mg。
9.优选的,本发明所述的坎地沙坦酯药物组合物,其特征是单位剂量的片中含有坎地沙坦酯(晶型i)8mg,琼脂1.2-1.4mg,瓜耳胶3-5mg,乳糖85-89mg,微晶纤维素21-24mg,交联聚维酮6mg,硬脂酸镁1.2mg。
10.更优选的,本发明所述的坎地沙坦酯药物组合物,其特征是单位剂量的片中含有坎地沙坦酯(晶型i)8mg,琼脂1.3mg,瓜耳胶4mg,乳糖87mg,微晶纤维素22.5mg,交联聚维酮6mg,硬脂酸镁1.2mg。
11.本发明所述组合物的制备方法,包括以下步骤:
第一步:将处方量琼脂加入到纯化水中,加热至90℃溶解,形成质量百分比为2%的琼脂水溶液,再将瓜耳胶加入,搅拌溶解后放凉至室温形成凝胶溶液;第二步:将坎地沙坦酯加入到第一步制得的凝胶溶液中,使用均质机高速搅拌5min,转速12000r/min,使坎地沙坦酯均匀分散于凝胶溶液中,得乳浊液;第三步:将乳糖、微晶纤维素加入到流化床中,用高压喷枪将第二步制得的坎地沙坦酯乳浊液喷入制粒,干燥后用0.5mm孔径筛网整粒;第四步:将交联聚维酮和硬脂酸镁加入到整粒后的颗粒中,使用总混机混合均匀;第五步:对总混后的颗粒用φ7mm浅凹冲模压片。
12.本发明的有益效果是:(1)通过本发明合理配方及制备方法,有效抑制了坎地沙坦酯晶型i在制剂制备及贮存过程中的分解,突破了原研严苛且宽泛的专利技术壁垒,获得了质量稳定性优于原研制剂的片剂组合物。
13.(2)本发明所得组合物的可压性优良,采用高速压片机所得片剂最大平均硬度可达90n,有利于工业化生产和贮存运输。
14.具体实施方式:实施例1配方:坎地沙坦酯(晶型i)8g,琼脂1.3g,瓜耳胶4g,乳糖87g,微晶纤维素22.5g,交联聚维酮6g,硬脂酸镁1.2g。
15.制备方法:按下述制备方法制备1000片。
16.第一步:将处方量琼脂加入到纯化水中,加热至90℃溶解,形成质量百分比为2%的琼脂水溶液,再将瓜耳胶加入,搅拌溶解后放凉至室温形成凝胶溶液;第二步:将坎地沙坦酯加入到第一步制得的凝胶溶液中,使用均质机高速搅拌5min,转速12000r/min,使坎地沙坦酯均匀分散于凝胶溶液中,得乳浊液;第三步:将乳糖、微晶纤维素加入到流化床中,用高压喷枪将第二步制得的坎地沙坦酯乳浊液喷入制粒,干燥后用0.5mm孔径筛网整粒;第四步:将交联聚维酮和硬脂酸镁加入到整粒后的颗粒中,使用总混机混合均匀;第五步:对总混后的颗粒用φ7mm浅凹冲模压片。
17.实施例2配方:坎地沙坦酯(晶型i)8g,琼脂0.8g,瓜耳胶2g,乳糖83g,微晶纤维素28g,交联聚维酮7g,硬脂酸镁1.2g。
18.制备方法:参照实施例1制备方法制备1000片。
19.实施例3配方:坎地沙坦酯(晶型i)8g,琼脂1.8g,瓜耳胶6g,乳糖91g,微晶纤维素17g,交联聚维酮5g,硬脂酸镁1.2g。
20.制备方法:参照实施例1制备方法制备1000片。
21.对照例1配方:坎地沙坦酯(晶型i)8g,琼脂1.3g,瓜耳胶4g,乳糖87g,微晶纤维素22.5g,交联聚维酮6g,硬脂酸镁1.2g。
22.制备方法:按下述制备方法制备1000片。
23.第一步:将处方量坎地沙坦酯、琼脂、瓜耳胶、乳糖、微晶纤维素一起加入到流化床中,用喷枪喷入与实施例1等量的纯化水进行制粒,干燥后用0.5mm孔径筛网整粒;第二步:将交联聚维酮和硬脂酸镁加入到整粒后的颗粒中,使用总混机混合均匀;第三步:对总混后的颗粒用φ7mm浅凹冲模压片。
24.对照例2配方:坎地沙坦酯(晶型i)8g,琼脂0.7g,瓜耳胶1.9g,乳糖89g,微晶纤维素24.2g,交联聚维酮5g,硬脂酸镁1.2g。
25.制备方法:参照实施例1制备方法制备1000片。
26.对照例3配方:坎地沙坦酯(晶型i)8g,琼脂1.9g,瓜耳胶6.1g,乳糖85g,微晶纤维素20.8g,交联聚维酮7g,硬脂酸镁1.2g。
27.制备方法:参照实施例1制备方法制备1000片。
28.对照例4配方:坎地沙坦酯(晶型i)8g,琼脂0.8g,瓜耳胶2g,乳糖90g,微晶纤维素24g,交联聚维酮4g,硬脂酸镁1.2g。
29.制备方法:参照实施例1制备方法制备1000片。
30.对照例5配方:坎地沙坦酯(晶型i)8g,琼脂1.8g,瓜耳胶6g,乳糖85g,微晶纤维素20g,交联聚维酮8g,硬脂酸镁1.2g。
31.制备方法:参照实施例1制备方法制备1000片。
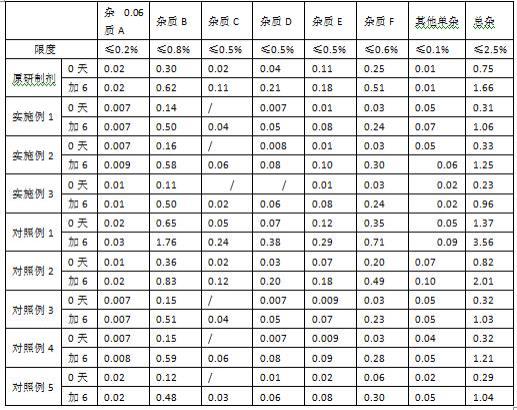
32.试验例1 最大平均硬度考察将实施例1-3及对照例1-5总混工序后的物料分别加入北京国药龙立科技有限公司生产的实验型zp-10a高速旋转式压片机的料斗中,选用φ7mm浅凹圆形冲模,调节压片机速至1万片/小时,以物料和设备所能承受的最大压力(压片机会有轻微异响,注意不要损坏压片机)进行试机考察,待装量差异等相关指标确认合格后,收集药片并记录最大平均硬度,数据记录于下表1。
33.表1 实施例1-3及对照例1-5的最大平均硬度考察(n=10)取市售坎地沙坦酯片原研制剂(天津武田药品有限公司生产)10片,测得其平均硬度约为60n;考虑到生产过程对压片机的保护,实际制片压力要小于最大制片压力,因此推测原研制剂的最大平均硬度高于60n。实施例1-3和对照例2-5均采用琼脂、瓜耳胶和坎地沙坦酯提前分散的制备方式,所得片剂的最大平均硬度在82-95n之间;然而对照例1采用将原辅料一起投至流化床中制粒的制备方式,所得片剂的最大平均硬度为60n,低于原研制剂。通过本试验例的数据可以发现,应用该发明的组合物及制备方式所得片剂硬度较高,适合工业化生产和贮存运输。
34.试验例2 有关物质稳定性考察
因该产品有关物质与制片压力密切相关,故取试验例1所得最大平均硬度的片剂进行有关物质考察。照高效液相色谱法(中国药典2020年版四部通则0512)测定原研制剂、实施例1-3及对照例1-5产品在0天和加速6月有关物质,数据记录于表2。
35.检测方法:依据美国药典2021版检测。
36.杂质限度:杂质a不得过坎地沙坦酯标示量的0.2%,杂质b不得过坎地沙坦酯标示量的0.8%,杂质c、杂质d、杂质e均不得过坎地沙坦酯标示量的0.5%,杂质f不得过坎地沙坦酯标示量的0.6%,其他单个杂质不得过坎地沙坦酯标示量的0.1%,各杂质的和不得过坎地沙坦酯标示量的2.5%。
37.表2 实施例1-3及对照例1-5有关物质稳定性考察(0天及加速6月)备注:表中“/”为未检出。
38.从有关物质考察结果来看:实施例1-3及对照例3-5的0天及加速6月的有关物质均符合质量标准且优于原研制剂;对照例1采用流化床一锅制粒,该样品在0天的有关物质符合质量标准,但差于原研制剂,加速6月的杂质b、杂质f及总杂超标,不符合质量标准,说明琼脂、瓜耳胶及坎地沙坦酯的加入方式对制剂有关物质具有显著影响;对照例2处方中琼脂和瓜耳胶的用量低于专利保护范围,其在加速6月的杂质b超标,不符合质量标准。综上,琼脂、瓜耳胶的用量及坎地沙坦酯三者加入方式对产品有关物质具有重要影响。
39.试验例3 体外释放度介质的溶出曲线研究以含0.05%聚山梨酯20的ph6.5磷酸盐缓冲液900ml为溶出介质,转速为每分钟50转,分别测定实施例1-3及对照例1-5产品在20min、30min及90min的溶出量,计算与原研制剂的溶出相似因子f2,数据记录于表3。
40.表3 实施例1-3及对照例1-5的溶出曲线考察
时间原研实施例1实施例2实施例3对照例1对照例2对照例3对照例4对照例5
20min50.0449.6357.8341.2665.2762.8236.8535.4763.7530min63.3563.8173.0958.7881.3178.3954.7357.8576.3890min87.0187.3294.6481.0395.14951478.1980.3394.62f2\9355574347484948
注:当f2≥50时,可判定溶出曲线相似。
41.从溶出曲线考察结果来看:实施例1与原研制剂具有较高的溶出相似度;实施例2处方中琼脂、瓜耳胶的用量在专利保护范围的下限,崩解剂交联聚维酮在专利保护范围的上限,制剂的溶出较快,但仍与原研制剂溶出相似;实施例3处方中琼脂、瓜耳胶的用量在专利保护范围的上限,崩解剂交联聚维酮在专利保护范围的下限,制剂溶出较慢,但仍与原研制剂溶出相似;对照例1与实施例1的处方相同,但琼脂、瓜耳胶及坎地沙坦酯的加入方式不同,制剂溶出明显快于原研制剂且不相似;对照例2-3处方中琼脂、瓜耳胶的用量均超出了专利保护范围,制剂溶出明显快或慢于原研制剂且不相似;对照例4-5处方中崩解剂交联聚维酮的用量均超出了专利保护范围,制剂溶出明显慢或快于原研制剂且不相似。综上,琼脂、瓜耳胶、交联聚维酮的用量及制备方法对产品溶出具有重要影响。
42.结合试验例1-3的考察结果,专利保护范围之内的实施例1-3均表现出了优良的可压性及优于原研制剂的质量稳定性,适合工业化大生产。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1