帕唑帕尼在制备神经炎症抑制剂中的应用
1.本发明涉及生物医药领域,主要涉及帕唑帕尼(pazopanib)在神经炎症中的应用。
背景技术:
2.帕唑帕尼,商品名为维全特,是一种酪氨酸激酶抑制剂,作用靶点包含血管内皮细胞生长因子受体1/2/3(vegfr1/2/3)、血小板衍生生长因子受体β(pdgfrβ),c-kit以及成纤维生长因子受体1(fgfr1)。帕唑帕尼是诺华公司研发的小分子抗血管生成靶向药物,于2009年获fda批准上市,用于治疗晚期肾癌、软组织肉瘤、晚期卵巢癌。近期的研究表明,帕唑帕尼能够透过血脑屏障,在中枢神经系统发挥药效,能有效地缓解复发性胶质母细胞瘤的发展。然而,有关帕唑帕尼对于lps诱导的小胶质细胞的炎症反应的作用没有相关的报道。
技术实现要素:
3.本发明提供的是帕唑帕尼可作为一种神经炎症的抑制剂的新应用,本发明首次公开了帕唑帕尼对小胶质细胞的炎症抑制作用,说明其对多巴胺能神经元在体内与体外的保护作用。
4.本发明采用如下技术方案:帕唑帕尼作为神经炎症抑制剂的应用。
5.帕唑帕尼在制备神经炎症抑制剂中的应用。
6.帕唑帕尼作在制备帕金森病治疗药物中的应用。
7.本发明还公开了一种神经炎症抑制药物,包括帕唑帕尼与药物载体。
8.上述一种神经炎症抑制药物的制备方法为,将药物活性成分帕唑帕尼与药物载体混合,得到神经炎症抑制药物。
9.上述技术方案中,药物载体为常规药物载体,比如缓冲液、生理盐水、赋形剂等,具体载体选择以及活性药物帕唑帕尼与药物载体的混合方法为常规技术。
10.进一步的,神经炎症为小胶质细胞神经炎症。
11.上述技术方案中,所述小胶质细胞为小胶质细胞系 bv2或原代小胶质细胞。
12.进一步的,神经炎症为 lps诱导的小胶质细胞神经炎症。
13.帕唑帕尼在制备小胶质细胞过度激活抑制剂中的应用。
14.帕唑帕尼在制备炎症介质抑制剂中的应用。
15.进一步的,所述炎症介质包括 inos、cox-2、il-6、tnf-α。
16.本发明的优点是:本发明首次证明了帕唑帕尼在治疗神经炎症的新用途,该用途显示抑制神经炎症的效应优于其他现有药物。细胞实验证明:帕唑帕尼可以下调lps诱导的小胶质细胞系bv2的炎症因子inos、cox-2的mrna和蛋白水平以及炎症介质il-6和tnf-α的释放量。在原代小胶质细胞中,帕唑帕尼同样能够抑制lps诱导的inos和cox-2蛋白水平的上调。动物实验证
0.0001。
实施例
28.1、细胞实验:根据不同处理方式将bv2细胞或者原代小胶质细胞分为:
①
dmso+pbs组;
ꢀ②
帕唑帕尼(1,5,10 μm)+pbs组;
③
dmso+lps(100 ng/ml)组;
④
帕唑帕尼(1,5,10 μm)+ lps(100 ng/ml)。在细胞模型中,dmso和pbs分别为帕唑帕尼和lps的溶剂。在处理bv2细胞时,先用帕唑帕尼预处理细胞 4 h,然后再用lps处理20 h,再进行相关的实验。
29.2、小胶质细胞bv2的培养:将细胞从培养箱取出,在显微镜下观察细胞形态和密度,密度达到80%~90%左右时,需要进行传代,传代前应在37℃水浴锅中预热pbs缓冲液、0.05%胰蛋白酶和细胞培养基(含有10%灭活血清和1%双抗的dmem培养基)30 min;吸弃原有的培养基,加入1 ml温热的pbs,洗去残存培养基;吸弃pbs,加入1 ml 0.05%胰酶,将培养皿放回培养箱中消化1 min,直至皿边缘的细胞脱落,再加入1 ml新鲜培养基终止消化;吹打细胞直至皿底部的细胞全部脱落,将细胞悬液转移至干净5 ml 离心管中,1000 rpm离心5 min,离心间隙向新培养皿中加入3.5 ml的新鲜培养基;小心吸弃离心后的上清,加入1 ml新鲜培养基重悬沉淀,取250 μl重悬细胞加至新培养皿中,十字摇匀,放于37℃,5 % co2的恒温培养箱培养。
30.3、原代小胶质细胞的培养:小鼠在新生的3-5天内,脑内的胶质细胞正值增殖高峰,为原代小胶质细胞取材的最佳时期。将新生鼠放入75%乙醇中消毒麻醉,再转移到pbs中洗去乙醇,取出脑组织放入有预冷pbs的皿中,在显微镜下剥离脑膜和血管,放入新的含pbs培养皿中;将脑组织剪碎后用0.25%胰酶消化15 min,消化后用无血清的df-12培养基洗3次。最后一次将粘稠的组织转移干净的50 ml离心管中,加入脱氧核糖核酸酶i(dnase i)(使用浓度0.3 mg/ml),放入37℃水浴锅中酶解体系中的dna;此时组织团块被消化为细胞悬液,小心吹散细胞团块,用0.45μm的滤膜过滤悬液至新的50ml离心管中,1000 rpm离心5 min;小心吸弃上清,将细胞沉淀用新鲜的原代小胶质细胞培养基重悬,平均分到多聚赖氨酸包被过的培养瓶中(培养体系为75 cm2中瓶应放20 ml培养基),将培养瓶置于co2培养箱中培养;次日换液,去除未贴壁或死亡细胞,继续培养7天,每三天换液,而后置于37
ꢀ°
c,5% co2摇床以230rpm摇2 h,收集培养基上清,离心,重悬细胞铺板即得原代小胶质细胞。
31.4、western blot免疫印迹(1)细胞蛋白样本的制备:将不同方式处理的细胞处理结束之后,吸弃细胞上清;加入500 μl pbs洗去残留培养基,吸弃pbs,加入500 μl 0.05%胰酶,放回培养箱消化1 min,直至边缘的细胞轻微脱落,加入500 μl培养基终止消化;轻轻吹打细胞,使贴壁细胞脱落下来,将细胞转移至1.5 ml离心管,1000 rpm离心5 min;吸弃上清,根据细胞量加入适量的细胞裂解液重悬沉淀,于冰上裂解10 min,200 w超声5次,加入与细胞裂解液等量的2
×
上样缓冲液(sample buffer),煮样10 min,使蛋白变性,获得细胞蛋白样本。
32.(2)sds-page凝胶电泳:将配胶的薄厚两块玻璃板、梳子经自来水、双蒸水清洗干净,喷洒75%乙醇,在烘箱中烘干,取出放至室温;按照目的蛋白分子量大小配制合适浓度和体积的聚丙烯酰胺分离胶,倒入玻璃板间隙中,并加入1 ml异丙醇压胶,静置50 min使其凝固;将异丙醇移除,用双蒸水小心冲洗残留的异丙醇,用滤纸小心擦除残留水分,倒入6 ml体系的浓缩胶,插入梳子,静置30 min使其凝固;拔掉梳子,将玻璃板装载于蛋白质电泳装
置上,倒入电泳缓冲液1
×
eb作为电泳池内外液,将煮好的样品小心地打入凝胶的样品孔中,在样品的两遍加上蛋白marker作为标度;120 v电泳1 h 左右,待上样缓冲液的前沿跑至凝胶底部,电泳结束。
33.(3)转膜:跑胶开始时即预冷转膜液1
×
tb;将转印蛋白的pvdf膜裁至与上述分离胶大小相同,用镊子将之放入无水甲醇中激活;在搪瓷盘中准备好“三明治”转膜装置,即夹子打开,白色面在下,倒入预冷的转膜液,放入海绵,用切胶板排出气泡,放入两层滤纸,排出气泡,将激活好的pvdf膜放于滤纸中央;将凝胶从电泳装置中取出,洗去玻璃板上残存的电泳液,用切胶板将两块;玻璃板分开,切除上层浓缩胶,在分离胶左上角切角标记,将凝胶从玻璃板上完全取下,洗去残存的电泳液;将凝胶放在pvdf膜上,使凝胶切角在右上,确保没有气泡,再放上两层滤纸,排气泡,最后再放上一块海绵,排气泡,夹好转膜夹;将夹子放入转膜槽中(黑色对黑色,白色对红色),再放入冰盒,倒上转膜液,盖好盖子,由于转膜时的温度较高,故将转膜装置整体放入盆中周围加好冰水混合物以降温,240 ma转膜2 h。
34.(4)封闭与抗体孵育:转膜结束后,关闭电源,取出pvdf膜,浸泡至含5 %脱脂牛奶的1
×
tbst中,室温摇床上封闭30 min;用1
×
tbst配制一抗至1.5 ml 离心管,混匀,用枪吸取抗体稀释液滴至提前铺好的parafilm封口膜上;将裁好的膜从1
×
tbst取出,用纸巾吸干缓冲液,正面朝向抗体孵育,膜与抗体对应;孵育好的膜放在湿盒中,4℃冰箱孵育过夜;一抗孵育结束后用1
×
tbst清洗,放于摇床摇10 min,重复洗两次;配制二抗,igg兔抗与igg鼠抗稀释度均为1:5000,将膜转移至相应的二抗中,室温孵育2 h。
35.(5)显影成像:二抗孵育结束后,加入1
×
tbst,放于摇床摇5 min,重复洗两次;继续用1
×
tbs重复洗两次;将ecl显影液1:1混合,将洗完的膜浸泡与ecl显影液中3 min;打开clinx chemicapture软件,将膜放入化学发光成像仪中,进行显影成像。
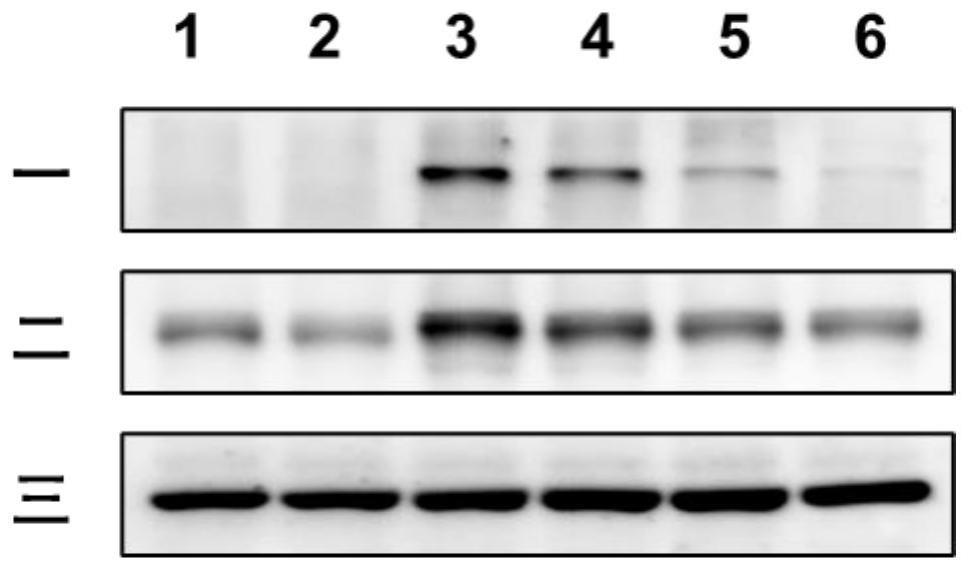
36.图1为帕唑帕尼抑制lps刺激后的小胶质细胞系bv2炎症蛋白表达情况结果,其中,一条带示炎症蛋白inos的表达量,二条带示炎症蛋白cox-2的表达量,三条带示内参蛋白β-actin的表达量。1组示正常小胶质细胞系bv2中三种蛋白的表达量,2组示单独用10 μm的帕唑帕尼的处理的小胶质细胞系bv2中三种蛋白的表达量,3组示单独用lps处理的小胶质细胞系bv2中三种蛋白的表达量,4组中示用lps刺激并用1 μm帕唑帕尼预处理的小胶质细胞系bv2中三种蛋白的表达量,5组中示用lps刺激并用5 μm帕唑帕尼预处理的小胶质细胞系bv2中三种蛋白的表达量,6组中示用lps刺激并用10 μm帕唑帕尼预处理的小胶质细胞系bv2中三种蛋白的表达量。
37.图2为帕唑帕尼抑制lps刺激后的原代小胶质细胞中炎症蛋白表达情况结果,其中,一条带示炎症蛋白inos的表达量,二条带示炎症蛋白cox-2的表达量,三条带示内参蛋白β-actin的表达量。1组示正常原代小胶质细胞中三种蛋白的表达量,2组示单独用帕唑帕尼(5 μm)的处理的原代小胶质细胞中三种蛋白的表达量,3组示单独用lps(100 ng/ml)处理的原代小胶质细胞中三种蛋白的表达量,4组中示用lps(100 ng/ml)刺激并用帕唑帕尼(5 μm)预处理的原代小胶质细胞中三种蛋白的表达量,条带淡,具有作用。
38.图3为帕唑帕尼与其他同类药物对lps刺激后的小胶质细胞系bv2炎症蛋白表达的抑制情况,其中,一条带示炎症蛋白inos的表达量,二条带示炎症蛋白cox-2的表达量,三条带示内参蛋白β-actin的表达量。1组示正常小胶质细胞系bv2中三种蛋白的表达量;2组示单独用lps处理的小胶质细胞系bv2中三种蛋白的表达量;3组示用lps刺激并用阿帕替尼
(apatinib)预处理的小胶质细胞系bv2中三种蛋白的表达量;4组中示用lps刺激并用巴拉塞西(barasertib)预处理的小胶质细胞系bv2中三种蛋白的表达量;5组中示用lps刺激并用雷格非尼(regorafenib)处理的小胶质细胞系bv2中三种蛋白的表达量;6组中示用lps刺激并用帕唑帕尼(pazopanib)预处理的小胶质细胞系bv2中三种蛋白的表达量,对于inos的表达完全未见条带,其他组都可见条带,只是清晰度有差异。以上都用lps(100 ng/ml)刺激,药物用量为10 μm。
39.5、酶联免疫吸附实验:药物处理后,收取细胞上清,离心去除不溶沉淀,将上清转移至新离心管中,混匀;将样品或标准品加入包被好的酶标板中,100 μl/孔,封板膜封板后于37℃孵育,90 min后弃液体,拍尽水分,不洗板;加入稀释好的生物素抗体,100 μl/孔,封板膜封板室温孵育,60 min后弃去抗体,稀释好的洗涤液400 μl/孔,洗板3次,拍尽水分;加入亲和素-过氧化物酶复合物工作液,100 μl/孔,封板膜封板后于37℃避光孵育30 min,弃去工作液,洗涤液400 μl/孔,洗板5次,拍尽水分;加入90 μl/孔显色液,37℃避光孵育15 min,直至标准品的前三到四个孔颜色差异明显,后三到四个孔差异不明显时,加入100 μl/孔终止液,停止反应;在酶标仪中测定450 nm的od吸光度值。根据标准品浓度与读数作标准曲线,根据标准曲线计算样品中炎症因子的含量。
40.图4为帕唑帕尼抑制lps刺激后的小胶质细胞系bv2炎症因子tnf-α的释放量,其中,柱1表示正常小胶质细胞系bv2中炎症因子tnf-α的释放量,柱2示单独用10 μm帕唑帕尼处理的小胶质细胞系bv2中炎症因子tnf-α的释放量,柱3示单独用lps处理的小胶质细胞系bv2中炎症因子tnf-α的释放量,柱4用lps刺激并用1 μm的帕唑帕尼预处理的小胶质细胞系bv2中炎症因子tnf-α的释放量,柱5用lps刺激并用5 μm的帕唑帕尼预处理的小胶质细胞系bv2中炎症因子tnf-α的释放量,柱6用lps刺激并用10 μm的帕唑帕尼预处理的小胶质细胞系bv2中炎症因子tnf-α的释放量。
41.图5为帕唑帕尼抑制lps刺激后的小胶质细胞系bv2炎症因子il-6的释放量,其中,柱1表示正常小胶质细胞系bv2中炎症因子il-6的释放量,柱2示单独用用10 μm帕唑帕尼的处理的小胶质细胞系bv2中炎症因子il-6的释放量,柱3示单独用lps处理的小胶质细胞系bv2中炎症因子il-6的释放量,柱4示用lps刺激并用1 μm的帕唑帕尼预处理的小胶质细胞系bv2中炎症因子il-6的释放量,柱5示用lps刺激并用5 μm的帕唑帕尼预处理的小胶质细胞系bv2中炎症因子il-6的释放量,柱6示用lps刺激并用10 μm的帕唑帕尼预处理的小胶质细胞系bv2中炎症因子il-6的释放量。
42.图6为帕唑帕尼与其他同类药物对lps刺激后的小胶质细胞系bv2炎症因子tnf-α的释放的抑制情况,1组示正常小胶质细胞系bv2中炎症因子tnf-α的释放量,2组示单独用lps处理的小胶质细胞系bv2中炎症因子tnf-α的释放量,3组示用lps刺激并用阿帕替尼(apatinib)预处理的小胶质细胞系bv2中炎症因子tnf-α的释放量,4组中示用lps刺激并用巴拉塞西(barasertib)预处理的小胶质细胞系bv2中炎症因子tnf-α的释放量,5组中示用lps刺激并用雷格非尼(regorafenib)处理的小胶质细胞系bv2中炎症因子tnf-α的释放量;6组中示用lps刺激并用帕唑帕尼(pazopanib)预处理的小胶质细胞系bv2中炎症因子tnf-α的释放量。以上都用lps(100 ng/ml)刺激,药物用量为10 μm。
43.6、细胞和组织rna提取:细胞处理结束之后,移除样品孔中的培养基,用pbs清洗,加入500 μl trizol,摇床上摇5 min提取样品中的mrna;将孔中的trizol转移至新离心管
中,编号,加入100 μl氯仿,上下颠倒离心管,充分混合,静置10 min,萃取mrna;在冷冻离心机中4℃,12000 rpm离心15 min,体系分为三层,最上层包含萃取的mrna,中间层包含dna,最下层包含蛋白,小心吸取上层,转移到新的离心管中,约200 μl,不得吸到白色沉淀;加入与上清等量的异丙醇,上下颠倒离心管混合均匀,在-20℃静置30 min,在冷冻离心机中4℃,12000 rpm离心10 min,可观察到羽状沉淀;小心吸弃上清,加500 μl 75%乙醇,轻弹洗涤沉淀;在冷冻离心机中4℃,12000 rpm离心5 min,观察沉淀位置,吸弃上清,在通风橱中风干15 min,根据沉淀量加入适量depc水重悬;在nanodrop仪器上测的mrna浓度,标记在管壁上。
44.7、逆转录pcr和qrt-pcr(1)逆转录pcr体系(10 μl):5
×
primescript rt master mix逆转录酶2 μlmrna
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
500 ngdepc水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
定容至10 μl(2)逆转录程序:37
ꢀ°
c,15 min,85
ꢀ°
c,5 s得到cdna;(3)逆转录pcr结束之后,将得到的cdna稀释50倍;qrt-pcr体系(20 μl):cdna
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
20 ng正向引物(50mm)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.1 μl反向引物(50mm)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.1 μlsybr green qpcr mix
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10 μlddh2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
定容至20 μlinos正反向引物序列分别为forward:5
′‑
tcccagcctgccccttcaat-3
′
reverse:5
′‑
cggatctctctcctcctggg-3
′
cox-2正反向引物序列分别为forward:5
′‑
caggctgaacttcgaaaca-3
′
reverse:5
′‑
gctcacgaggccactgataccta-3
′
β-actin正反向引物序列分别为forward:5
′‑
gacctgactgactacctc-3
′
reverse:5
′‑
gacagcgaggccaggatg-3
′
(4)qrt-pcr程序:95
°
c预变性30秒,95
°
c变性5秒,60
°
c退火和延伸30秒,共40个循环。7500 system software分析数据,通过2^(-δδct)值定量样本中的相关基因表达。
45.图7为帕唑帕尼抑制lps刺激后的小胶质细胞系bv2炎症因子inos的mrna表达量测定结果,其中,柱1表示正常小胶质细胞系bv2中炎症因子inos的mrna的相对表达量,柱2示单独用5 μm帕唑帕尼的处理的小胶质细胞系bv2中炎症因子inos的mrna的相对表达量,柱3示单独用lps处理的小胶质细胞系bv2中炎症因子inos的mrna的相对表达量,柱4示用lps刺激并用5 μm帕唑帕尼预处理的小胶质细胞系bv2中炎症因子inos的mrna的相对表达量。
46.图8为帕唑帕尼抑制lps刺激后的小胶质细胞系bv2炎症因子cox2的mrna表达量测定结果,其中,柱1表示正常小胶质细胞系bv2中炎症因子cox2的mrna的相对表达量,柱2示
单独用5 μm帕唑帕尼的处理的小胶质细胞系bv2中炎症因子cox2的mrna的相对表达量,柱3示单独用lps处理的小胶质细胞系bv2中炎症因子cox2的mrna的相对表达量,柱4示用lps刺激并用5 μm帕唑帕尼预处理的小胶质细胞系bv2中炎症因子cox2的mrna的相对表达量。
47.8、动物实验:将8周的c57bl/6j雄性小鼠随机分为4组:
①
solvent+pbs组;
②
帕唑帕尼+pbs组;
③
solvent +lps组;
④
帕唑帕尼+lps组。其中pbs和solvent分别为lps和帕唑帕尼的溶剂。小鼠预先用帕唑帕尼或其溶剂solvent以10 mg/kg/d的剂量腹腔注射给药10天。 随即以立体定位注射的方式,给予小鼠双侧中脑黑质区单次注射lps 2 μg或等体积的pbs。继续饲养七天后牺牲动物,获取组织样本,进行后续实验。
48.9、免疫组织化学实验:小鼠给药结束24 h后,用0.3%戊巴比妥钠麻醉,之后用4%多聚甲醛对小鼠进行灌流;灌流结束后,立即用镊子取下小鼠全脑,浸泡在4%多聚甲醛中,4 ℃保存,作为后固定,后固定三天;再将脑组织用30%的蔗糖溶液脱水,4
°
c保存,脱水三天;用包埋剂对全脑进行包埋,冻切片机上进行切片,切片厚度为20 μm,收集于抗冻液中;用pbs清洗脑片,每孔加入500 μl漂洗液(含0.4% triton-x100,1% fbs 的 pbs)室温孵育打孔10min;脑片再用pbs清洗3遍,每孔加入500 μl封闭液(含0.4% triton-x100,5% fbs的 pbs)室温孵育60 min;用漂洗液稀释一抗抗体(th,1: 1000;iba1,1: 1000;gfap,1: 1000),每孔加入300 μl一抗稀释液,4 ℃过夜孵育;吸去一抗,用pbs洗三次;用漂洗液稀释二抗(alexa fluor
®ꢀ
594 donkey anti-mouse igg(h+l)红色荧光二抗,1: 300;alexa fluor
®ꢀ
488 donkey anti-rabbit igg(h+l)绿色荧光二抗,1: 300),用锡箔纸避光,室温摇床孵育2 h;吸去二抗,用pbs洗三遍;用pbs稀释细胞核染料dapi(1:10000),每孔加300 μl dapi,孵育10 min后用pbs洗两遍;然后加入抗淬灭剂封片;将切片放于olympusix71型倒置荧光显微镜上,观察中脑黑质区的th、iba1的染色情况,拍照。
49.图9为在体水平上,帕唑帕尼抑制lps刺激引起的小鼠多巴胺能神经元细胞标志物th的情况测定,其中,组1表示正常对照小鼠得中脑黑质区多巴胺能神经元细胞标志物th的强度,组2表示单独用帕唑帕尼处理的小鼠的中脑黑质区多巴胺能神经元细胞标志物th的强度,组3表示单独用lps刺激的小鼠的多巴胺能神经元细胞标志物th的强度,组4表示用lps刺激并用帕唑帕尼预给药的小鼠中脑黑质区多巴胺能神经元细胞标志物th的强度。
50.图10为在体水平上,帕唑帕尼抑制lps刺激引起的小鼠中脑黑质区小胶质细胞标志物iba1的活化情况测定,其中,组1表示正常对照小鼠得中脑黑质区小胶质细胞标志物iba1的强度,组2表示单独用帕唑帕尼处理的小鼠的中脑黑质区小胶质细胞标志物iba1的强度,组3表示单独用lps刺激的小鼠的中脑黑质区小胶质细胞标志物iba1的强度,组4表示用lps刺激并用帕唑帕尼预给药的小鼠中脑黑质区小胶质细胞标志物iba1的强度。
51.以脑内胶质细胞过度激活为特征的神经炎症,出现在疾病早期,且贯穿整个疾病过程,不仅是pd(帕金森病)进展的病理标志,更是加剧疾病发展的重要因素,有效地控制神经炎症很可能减缓疾病的发展,改善患者的生存状态。因此,以抗神经炎症为靶标的药物研发对于治疗帕金森病至关重要。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1