一种基于合成生物学自组装的新冠病毒S蛋白疫苗产生系统和方法
一种基于合成生物学自组装的新冠病毒s蛋白疫苗产生系统和方法
技术领域
1.本发明涉及生物医药技术领域,具体涉及一种基于合成生物学自组装的新冠病毒s蛋白疫苗产生系统和方法,用于新型的新冠疫苗的开发。
背景技术:
2.新型冠状病毒是以前从未在人体中发现的冠状病毒新毒株,新型冠状病毒s蛋白(sars-cov-2 spike蛋白)是ⅰ型跨膜糖蛋白,也是病毒最大的结构蛋白,能够刺激机体产生中和抗体和介导免疫反应。现有研究证明,s蛋白与病毒侵入细胞的过程密切相关,因此,针对s蛋白研发疫苗具有重要的意义。
3.疫苗是防控新冠疫情的最重要手段之一。在本次全球疫情中,以mrna疫苗为代表的核酸疫苗成为了领跑的疫苗技术路线。mrna疫苗具有安全、有效、生产速度快、能够快速应对病毒变异等优点。但是目前仍然存在技术流程复杂、短时间难以成功仿制开发、副作用大、成本昂贵、储存和运输条件苛刻等缺点。因此,如果能够开发一种新型的、并解决上述技术问题的疫苗类型,则可能对于本领域而言是一个重大变革,其将带来很多新的优势和新的希望。
4.在前期研究中南京大学张辰宇团队以哺乳动物自身的组织器官(主要是肝脏,因为能自发内吞裸露的质粒dna并表达外源基因;当然其他的组织器官也可以)作为天然生物基盘(cell chassis),直接利用人工设计的合成生物学元件(part)组成的基因环路(circuit)在体内建立了一个基于外泌体自组装、内分泌的基因治疗系统,同时,可以通过操作基因环路使得特定蛋白装载到外泌体的表面并递送到全身各处组织。基于该研究成果,针对现有mrna疫苗的问题,张辰宇团队开发了“基于合成生物学的自组装核酸疫苗”创新技术。
5.以上所说的外泌体是一类直径50-200nm的双层膜结构囊泡,几乎所有的细胞都可以分泌外泌体,多项研究表明外泌体在细胞间通讯中发挥了重要作用。本技术人和发明人团队在对于外泌体的研究中一直处于领先地位,也有不少研究成果。
技术实现要素:
6.本发明针对现有技术的缺陷提供了一种基于合成生物学自组装的新冠病毒s蛋白疫苗产生系统和方法,旨在克服现有技术中的不足。
7.本发明的目的是通过以下技术方案来实现:
8.本发明的一个发明点为提供一种基于合成生物学自组装的新冠病毒s蛋白疫苗产生系统,所述系统包括新冠病毒s蛋白的碱基序列组件和跨膜蛋白碱基序列片段,所述碱基序列组件能够表达可产生免疫应答反应的s蛋白,所述跨膜蛋白碱基序列片段能够使所述s蛋白锚定在囊泡表面并自组装形成囊泡复合体;该系统为能够在生物体组织器官中富集且将s蛋白表达于囊泡表面并自组装成囊泡复合体的碱基序列,所述囊泡复合体能够引发免
疫应答反应。
9.进一步地,所述跨膜蛋白为cd63。
10.进一步地,所述碱基序列组件插入所述cd63的碱基序列片段中。
11.进一步地,所述碱基序列组件插入至cd63氮端第20~第60个中的任意两个碱基之间。
12.进一步地,所述碱基序列组件插入至cd63氮端第20~第60个中的gg之间。
13.进一步地,所述碱基序列组件将所述cd63分割成两部分,分别为含有cd63氮端的氮端序列和含有cd63碳端的碳端序列,所述碱基序列组件位于所述氮端序列和碳端序列之间。优选地,所述碱基序列组件插入至cd63氮端第30~第45个中的任意两个碱基之间,如gg之间。
14.进一步地,所述氮端序列包括seq1或与该seq1序列70%以上同源的序列;所述碳端序列包括seq2或与该seq2序列70%以上同源的序列;
15.上述的同源的序列均包括在原序列基础上增加一个或几个碱基、减少一个或几个碱基、替换其中任意一个或几个碱基后得到的序列;
16.进一步地,所述氮端序列与所述碱基序列组件之间通过第一连接序列连接。
17.进一步地,所述第一连接序列为agatctctagccacc或在该序列基础上增加、减少或替换其中任意1~4个碱基后得到的序列。
18.进一步地,所述碱基序列组件与所述碳端序列之间通过第二连接序列连接。
19.进一步地,所述第二连接序列为accggtggagctcgaatcagatct或在该序列基础上增加、减少或替换其中任意1~6个碱基后得到的序列。
20.进一步地,所述s蛋白的碱基序列组件包括该碱基序列组件本身或与该序列70%以上同源的序列,该同源的序列包括在碱基序列组件本身的基础上增加一个或几个碱基、减少一个或几个碱基、替换其中任意一个或几个碱基后得到的序列:s蛋白的基因序列为现有技术,在众多网站和文献中都有记载,如wu,f.et al.a new coronavirus associated with human respiratory disease in china.nature 579,265
–
269(2020),因此,本技术不再列举。
21.对应地,所述新冠病毒s蛋白包括s蛋白以及s蛋白序列中的任意一个或几个氨基酸突变以后的序列。
22.进一步地,在所述囊泡复合体中,所述s蛋白通过所述cd63连接于所述囊泡的外表面,所述cd63通过两个跨膜域与所述囊泡的表面连接。
23.进一步地,所述s蛋白疫苗产生系统还包括位于上游的启动子;优选地,所述启动子设置于所述氮端序列的上游。
24.进一步地,所述s蛋白疫苗产生系统还包括位于下游的终止信号;优选地,所述终止信号位于所述碳端序列的下游,所述终止信号优选为hsv终止信号。
25.进一步地,所述碱基序列组件为可编辑或可合成的基因组件。
26.进一步地,所述系统还包括能够装载或携带本技术中基因线路的载体。所述载体包括但不限于质粒和病毒。
27.进一步地,所述系统中的任意一个或几个碱基均独立地为修饰过的碱基或未经过修饰的碱基;其中,所述修饰包括硫代修饰、氟代修饰、氨代修饰、甲氧基修饰。
28.进一步地,所述组织器官包括生物体的所有细胞、组织和器官,所述囊泡为外泌体,所述囊泡复合体为外泌体复合体。
29.本发明另一个发明点为提供一种基于合成生物学自组装的病毒疫苗产生方法,所述方法包括构建以上任意一段所述的系统,该系统为能够在生物体细胞、组织和/或器官中富集且将s蛋白表达于囊泡表面并自组装成囊泡复合体的序列,所述囊泡复合体为能够引发免疫应答反应的疫苗。具体地,合成碱基序列组件以及其他序列,按照本技术记载的任意一种排列方式合成。
30.本发明还有一个发明点为提供一种疫苗,其包括以上任意一段所述的系统。
31.进一步地,所述疫苗的给药方式包括但不限于口服、吸入、皮下注射、肌肉注射、静脉注射。
32.本发明的主要具有的有益效果为:
33.本技术中,针对新冠病毒s蛋白,研究了一种含有s蛋白基因和跨膜蛋白基因作为基因线路的疫苗,该疫苗的基因线路可编辑与合成,研究时合成方便,技术成熟,周期短;且成品化时,同样具有生产成本低廉,周期短,且理化性质稳定,且理化性质稳定,且便于储存、运输等优势。
34.对于本技术所保护的基因线路或基因环路,使用时,将其导入人体或其他细胞中以后,其可以正确高效的表达对应基因组件的s蛋白,并且可以锚定或富集到囊泡(即外泌体)的表面,且外泌体表面s蛋白含量高。并在血液或血清中能够检测到高滴度的抗体。且以极少的囊泡复合体就可以产生相当滴度的抗体,即表达少量的s蛋白便可激发产生较多的s蛋白抗体;本技术引发的副作用更小,且所诱导出的抗体可以长期存在,稳定性高,甚至高于目前一些商品化的疫苗的稳定性。
35.由于本发明的系统可自组装成囊泡复合体,该复合体非人为合成,且囊泡复合体能够通过循环系统运输至全身的主要组织、脏器等中,再在碱基序列组件的原始作用下,实现对新冠病毒s蛋白的免疫,故其s蛋白组装、分泌过程高效,引发的免疫反应强,且安全性、保护性高等。且避免了现有技术中的一些毒副作用。
36.因此,本技术的疫苗技术流程简单,可在极短的时间内成功仿制开发,毒副作用极小甚至没有什么毒副作用,合成基因线路技术成熟,成本低,理化性质稳定,保藏条件温和,保藏方便,保藏成本低,且便于储存、运输等。
37.而且,本发明惊喜的开发出了以cd63作为跨膜蛋白,并应用于本技术的疫苗产生系统中,在该系统中,cd63能够极好的辅助s蛋白锚定在囊泡表面并自组装形成囊泡复合体,该复合体携带其表面的s蛋白进行全身递送,从而引起特异性免疫反应,产生抗体。该cd63的惊喜使用,具有极佳的效果,并且可使得本系统的跨膜蛋白具有更多元化的选择,有利于后续的产品化,对于本团队后期的进一步的研究或突破具有极其重要的意义。更重要的是,cd63与外泌体有两个跨膜域,结合更牢固,可以兼容大体积s蛋白在表面展示,效果佳。
38.本发明中的系统和方法的整体效果佳,其为一种全新的新冠s蛋白疫苗类型以及疫苗合成方法,其在生物和医药领域中均是巨大的突破,具有里程碑式的重要意义。
附图说明
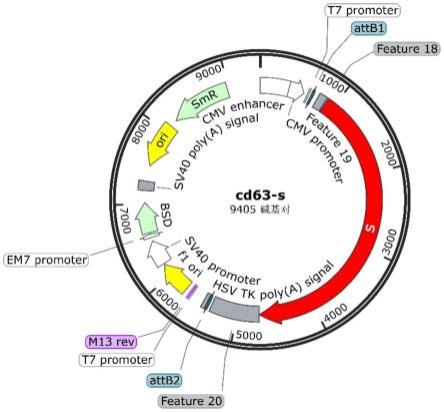
39.图1为本发明实施例所述的质粒体内递送及作用原理示意图。
40.图2为本发明实施例所述的外泌体跨膜蛋白与s蛋白结合的结构示意图。
41.图3为本发明实施例所述的以质粒为载体的新冠病毒s蛋白疫苗产生系统示意图。
42.图4为本发明实施例所述的cd63促进新冠s蛋白引发免疫反应的检测结果示意图。
43.图5为本发明实施例所述的碱基序列组件插入位置对于抗原表达的影响检测结果示意图。
44.图6为本发明实施例所述的linker序列改变对于抗原表达的影响检测结果示意图。
45.图7为本发明实施例所述的cd63促进抗原的膜定位的观测图。
46.图8为本发明实施例所述的包含有启动子和终止信号的质粒图谱。
47.图9为本发明实施例所述的不同载体对于抗原表达的影响检测结果示意图,其中,图9a为体外的细胞检测结果,图9b为小鼠的体内检测结果。
具体实施方式
48.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明具体实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
49.本发明中所述上游指5’端,下游指3’端。
50.实施例1
51.一种基于合成生物学自组装的新冠病毒s蛋白疫苗产生系统,所述系统包括能够表达s蛋白的基因组件和跨膜蛋白碱基序列片段,该基因组件由于是碱基序列,其可编辑或可合成。所述基因组件能够表达可产生免疫应答反应的s蛋白,所述跨膜蛋白碱基序列片段能够使所述s蛋白锚定在外泌体表面并自组装形成外泌体复合体。含有这些基因组件的所述系统能够在生物体体内组织器官中富集且将s蛋白表达于外泌体表面并自组装成外泌体复合体,所述外泌体复合体能够引发免疫应答反应,则所述系统或所述外泌体复合体可称为疫苗。
52.作为进一步优选的实施方式,cd63为跨膜蛋白,cd63促进新冠s蛋白引发免疫反应的检测结果如图4所示。所述基因组件插入所述cd63的碱基序列片段中,其能够更好的实现表达以及表达以后,s蛋白能够更好的通过cd63连接于外泌体表面。优选地,所述cd63与所述外泌体之间存在2个两个跨膜域,因此其结合更牢固,能够将大体积s蛋白展示于外泌体表面。
53.cd63促进抗原的膜定位的观测图如图7所示。
54.作为进一步优选的实施方式,所述基因组件插入至cd63氮端第20~第60个中的任意两个碱基之间。优选所述基因组件插入至cd63氮端第20~第60个中的gg之间。
55.作为进一步优选的实施方式,所述基因组件将所述cd63分割成两部分,分别为含有cd63氮端(即5’端)的氮端序列和含有cd63碳端(即3’端)的碳端序列,所述基因组件位于所述氮端序列和碳端序列之间,优选地,所述基因组件插入至cd63氮端第30~第45个中的
任意两个碱基之间。
56.碱基序列组件插入位置对于抗原表达的影响检测结果如图5所示。通过图5结果可以看出,在本实施例限定范围内,碱基序列组件的插入位置在cd63氮端第30~第45个中时(选择了32aa、34aa、36aa以及40aa进行检测)都能够有效产生抗原的表达,且效果相差不大,其中,新冠rbd抗原表达水平最优的为36aa。
57.作为进一步优选的实施方式,所述基因组件插入至cd63氮端第36~第37个碱基之间,则所述氮端序列为含有seq1的序列或与该seq1序列70%以上同源的序列;所述碳端序列为含有seq2的序列或与该seq2序列70%以上同源的序列;
58.上述的70%以上同源的序列,如70%、75%、80%、85%、90%、95%、98%、99%等等;这些同源的序列均包括在原序列(seq1或seq2)基础上增加一个或几个碱基、减少一个或几个碱基、替换其中任意一个或几个碱基后得到的序列;几个包括2及2以上的数量,如2、3、4、5、6、7等。通过试验发现,采用seq1或seq2或其同源序列与本技术其他的基因片段配合,其效率更高、s蛋白浓度和抗体滴度均较好,抗体能够与现有技术中成熟的疫苗相当,且所诱导出的疫苗稳定性更好,能够长期存在,因此,优选该序列。
59.seq1序列为:atggcggtggaaggaggaatgaagtgtgtcaagtttttgctctacgttctcctgctggccttctgcgcctgtgcagtgggattgatcgccattggtgtagcggttcag。
60.seq2序列为:gttgtcttgaagcaggccattacccatgagactactgctggctcgctgttgcctgtggtcatcattgcagtgggtgccttcctcttcctggtggcctttgtgggctgctgtggggcctgcaaggagaactactgtctcatgattacatttgccatcttcctgtctcttatcatgcttgtggaggtggctgtggccattgctggctatgtgtttagagaccaggtgaagtcagagtttaataaaagcttccagcagcagatgcagaattaccttaaagacaacaaaacagccactattttggacaaattgcagaaagaaaataactgctgtggagcttctaactacacagactgggaaaacatccccggcatggccaaggacagagtccccgattcttgctgcatcaacataactgtgggctgtgggaatgatttcaaggaatccactatccatacccagggctgcgtggagactatagcaatatggctaaggaagaacatactgctggtggctgcagcggccctgggcattgcttttgtggaggtcttgggaattatcttctcctgctgtctggtgaagagtattcgaagtggctatgaagtaatgtag。
61.作为进一步优选的实施方式,所述氮端序列与所述基因组件之间通过第一连接序列连接,该第一连接序列为一个linker。
62.优选地,所述第一连接序列为agatctctagccacc或在该序列基础上增加、减少或替换其中任意1~4个碱基后得到的序列,如增加、减少或替换1个、2个、3个或4个等。通过该第一连接序列或在该序列基础上增加、减少或替换其中任意1~4个碱基后得到的序列连接,基因结构稳定,不会影响后续在体内的表达和组装,若换成其他连接子,则不一定能够实现本技术中的正确、高效的组装以及高滴度的产生抗体,该连接子及其同源序列为本技术人通过具体的研发试验获得。
63.作为进一步优选的实施方式,所述基因组件与所述碳端序列之间通过第二连接序列连接,该第二连接序列也为一个linker。
64.优选地,所述第二连接序列为accggtggagctcgaatcagatct或在该序列基础上增加、减少或替换其中任意1~6个碱基后得到的序列,如增加、减少或替换1个、2个、3个、4个、5个或6个等。通过该第二连接序列或在该序列基础上增加、减少或替换其中任意1~6个碱基后得到的序列连接,基因结构稳定,不会影响后续在体内的表达和组装,若换成其他连接
子,则不一定能够实现本技术中的正确、高效的组装以及高滴度的产生抗体,该连接子及其同源序列为本技术人通过具体的研发试验获得。
65.linker序列改变对于抗原表达的影响检测结果如图6所示。
66.作为进一步优选的实施方式,所述s蛋白的基因组件包括该基因本身或与该基因70%以上相同的序列,该70%以上相同的序列包括在基因组件本身的基础上增加一个或几个碱基、减少一个或几个碱基、替换其中任意一个或几个碱基后得到的序列,s蛋白以及其基因组件为现有技术,这里不再赘述。
67.对应地,所述s蛋白包括其本身以及s蛋白序列中的任意一个或几个氨基酸突变以后的序列,此处的几个指2~5个。
68.作为进一步优选的实施方式,所述新冠病毒s蛋白疫苗产生系统还包括位于上游的启动子;优选地,所述启动子设置于所述氮端序列的上游,优选cmv启动子。
69.启动子的序列包括含有seq3的序列或与该seq3序列70%以上同源的序列,如70%、75%、80%、85%、90%、95%等等;该同源的序列包括在seq3基础上增加一个或几个碱基、减少一个或几个碱基、替换其中任意一个或几个碱基后得到的序列;几个包括2及2以上的数量。虽然可选用其他类型的启动子,但通过试验发现,采用seq3或其同源序列与本技术其他的基因片段配合,其效率更高、s蛋白浓度和抗体滴度均较好,抗体能够与现有技术中成熟的疫苗相当,因此,优选该序列。
70.seq3:gacattgattattgactagttattaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgccaatagggactttccattgacgtcaatgggtggagtatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatggtgatgcggttttggcagtacatcaatgggcgtggatagcggtttgactcacggggatttccaagtctccaccccattgacgtcaatgggagtttgttttggcaccaaaatcaacgggactttccaaaatgtcgtaacaactccgccccattgacgcaaatgggcggtaggcgtgtacggtgggaggtctatataagcagagct。
71.作为进一步优选的实施方式,所述新冠病毒s蛋白疫苗产生系统还包括位于下游的终止信号;优选地,所述终止信号位于所述碳端序列的下游,所述终止信号优选为hsv终止信号。
72.所述终止信号的序列为含有终止序列或与该终止序列70%以上同源的序列;如70%、75%、80%、85%、90%、95%等等,该同源的序列包括在终止序列基础上增加一个或几个碱基、减少一个或几个碱基、替换其中任意一个或几个碱基后得到的序列;几个包括2及2以上的数量。虽然可选用其他类型的终止信号,但通过试验发现,采用终止序列或其同源序列与本技术其他的基因片段配合,其效率更高、s蛋白浓度和抗体滴度均较好,抗体能够与现有技术中成熟的疫苗相当,因此,优选该序列。
73.终止序列:cggcaataaaaagacagaataaaacgcacgggtgttggg tcgtttgttc。
74.包含有启动子和终止信号的质粒图谱如图8所示。
75.作为进一步优选的实施方式,所述系统中的任意一个或几个碱基均独立地为修饰过的碱基或未经过修饰的碱基;其中,所述修饰包括硫代修饰、氟代修饰、氨代修饰、甲氧基修饰。通过合适的修饰可增加碱基序列的稳定性。
76.在本实施例中,所述组织器官包括生物体的所有细胞、组织和器官,包括不限于血液、肌肉、肝脏、脾、肺、胃、肠、胆、胰腺、脑、心、肾等等,所述外泌体为外泌体,所述外泌体复合体为外泌体复合体。
77.上述系统或上述疫苗的给药方式包括但不限于口服、吸入、皮下注射、肌肉注射、静脉注射等。
78.作为进一步优选的实施方式,所述系统还包括能够装载或携带以上的基因序列的载体,所述载体包括但不限于质粒和病毒。
79.不同载体对于抗原表达的影响检测结果示意图,其中,图9a为体外的细胞检测结果,图9b为小鼠的体内检测结果。
80.实施例2
81.在实施例1的基础上,一种基于合成生物学自组装的病毒s蛋白疫苗产生方法,所述方法包括构建以上任意一段所述的系统,该系统为能够在生物体细胞、组织和/或器官中富集且将s蛋白表达于外泌体表面并自组装成外泌体复合体的序列,所述外泌体复合体为能够引发免疫应答反应的疫苗。具体地,合成基因组件以及其他序列,按照本技术记载的任意一种排列方式合成。
82.本实施例中的方法简单、快速,能够短期内合成大量不同的序列,因此,本发明的疫苗产生系统能够快速、高效的生产。
83.实施例3
84.在实施例1或2的基础上,一种载体体系,该体系包含实施例1或实施例2中所述的疫苗产生系统以及装载或携带该系统的载体。该载体可以为质粒或病毒,当然,也可以是其他类型的载体。
85.实施例4
86.对于以上任一本实施例中所述的疫苗产生系统,该系统中的基因路线可装载在质粒中,形成基因环路,如图3所示,该基因环路通过体外编辑合成便可。然后将基因环路通过静脉或肌肉注射等方式递送到体内后,以哺乳动物自身的组织器官作为天然生物基盘,如图1所示,图1为质粒体内递送及作用的原理示意图;表达新冠病毒s蛋白,同时表达外泌体表面蛋白cd63作为骨架,cd63帮助s蛋白组装并展示在外泌体表面,如图2所示,图2为外泌体跨膜蛋白lamp2b(左)/cd63(右)与s蛋白结合的结构示意图,cd63与外泌体的结合更牢固,利用外泌体的体内循环特点,将s蛋白运输到全身主要组织器官,进而引发免疫应答反应,如图1所示。
87.上述实施例所用的载体是质粒,即将相关的基因序列插入了质粒结构中。当然,本技术的系统插入至其他类型的质粒或病毒等中均可以,均能达到较佳效果。
88.本发明对于相关联的结构均给出明确的序列。但是本领域人员应当理解,在上述序列基础上进行微小的变动是不影响本发明所述序列的保护,均在本发明的保护范围内。即本技术中所有的序列均包括在其基础上增加、缺少或替换一个或多个碱基或氨基酸,此处的多个指2个或多于2个。
89.在本发明中,本发明人团队的在先研究中,如针对普通新冠疫苗,跨膜蛋白主要使用的是lamp2b,然而,lamp2b由于其结构限制,无法高效的将大体积的s蛋白展示在其n端,故需要寻求其他的跨膜蛋白。而且,仅仅使用lamp2b,可能会在某些时候存在来源不畅、成
本高等问题,而且也为了寻找对于本技术而言更优的跨膜蛋白,因此,本发明人尝试了多种跨膜蛋白以及有类似功能的产品,最后惊喜的发现将cd63应用在s蛋白疫苗系统中,该cd63通过两个跨膜域可以兼容大体积s蛋白的展示,效果好,因此,对于本团队而言,该发现对于后期的进一步研究具有极其重要的意义,也是一个非常惊喜的成果,且还能增加跨膜蛋白的多样性,同于有利于后续研发和产品化。
90.cd63做为跨膜蛋白应用的新冠病毒s蛋白疫苗系统的实验验证效果如图4所示。
91.最后应说明的是:以上所述的各实施例仅用于说明本实用新型的技术方案,而非对其限制;尽管参照前述实施例对本实用新型进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分或全部技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本实用新型各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1