一种NO供体型胶束组合物及其制备方法与应用与流程
一种no供体型胶束组合物及其制备方法与应用
技术领域
1.本发明属于生物医药领域,具体涉及一种no供体型胶束组合物及其制备方法与应用。
背景技术:
2.目前,药物治疗是脑部缺血再灌注损伤保护的主要手段。姜黄素通过抗氧化、抗炎等作用治疗脑卒中。但姜黄素水溶性较差,生物利用度低,且由于血脑屏障的存在,难以转运到脑损伤部位,限制了其在脑卒中疾病上的应用。如何攻克包括姜黄素在内的难溶性化合物溶解度差的问题,突破血脑屏障成为药物制剂研究在脑部应用的首要瓶颈问题。随着纳米技术的发展,纳米递药系统已成为优化药物治疗效果的潜在靶向给药系统,通过生物、物理或化学修饰策略进行形状、大小和表面设计,成为解决提高脑部给药效率的有效方法和研究热点。
3.将药物包封入嵌段共聚物形成的聚合胶束核内,能改善难溶性药物的溶解度和生物利用度,改变其体内分布行为及延长在体循环时间,同时达到增效减毒的作用,充分发挥药物的抗脑缺血再灌注神经保护作用。
4.除了较高的发病率,脑卒中复发亦是导致患者致死致残的主要原因,脑血管狭窄是影响急性缺血性卒中复发的主要因素之一。因此,脑梗死首次发病术后,除了神经保护外,扩张血管、改善血管内皮功能,预防脑卒中再次发生亦显得尤为重要。临床常用预防脑卒中手段包括脑血管支架和血管扩张剂的应用。脑血管支架手术易造成支架贴壁不良、扩张不全,导致血管再次堵塞,促进血栓再形成,且术后需长期服用抗凝血药物治疗。硝普钠等临床血管扩张剂,存在消化系统、心脏功能及肝肾功能严重不良反应,而姜黄素虽然抗氧化神经保护作用药效明显,但其扩张血管能力较差。为了治疗ciri神经损伤与扩张血管预防脑梗死复发,需同时服用神经保护药物、扩张血管药物及抗凝血药物,不仅增加患者用药负担,而且增大药物不良反应。若将扩张血管与姜黄素类神经保护药物共同包裹于胶束递药系统内,又存在载药量低、载药比例不确定及配伍变化等问题。
5.研究表明:以血管壁细胞为靶点的作用机制,通过对血管内皮的氧化损伤、通透性、细胞因子、凝血和纤溶系统等方面的调节,能进一步起到保护内皮防止血栓形成的作用。no作为内皮舒张因子,是迄今发现的分子最小的生物活性物质之一,通过进入细胞与鸟苷酸环化酶中的fe
2+
结合并提高鸟苷酸环化酶活性,增加细胞cgmp含量,cgmp作为第二信使,激活细胞蛋白激酶pkg,调控离子通道,降低细胞内ca
2+
浓度,使肌凝蛋白轻链磷酸化,引起血管平滑肌舒张效应,参与血压的即刻调节和局部血流调节。正常条件下,脑部血管内皮细胞持续不断地释放no以保持血管恒定的舒张状态,同时抑制白细胞浸润和血小板在其表面聚集并粘附。当血管内皮细胞受氧自由基等损伤时,no释放减少,易致血栓形成。
6.合成no供体材料型聚合物辅料,构建具有产业化和临床应用前景的创新药物分子与聚合物辅料协同作用的递送系统。针对ciri术后微环境及脑卒中复发的病因,从神经保护和扩张血管两个角度提高药物递药系统的治疗效果。在脑卒中缺血期,利用no供体型胶
束组合物在受损实质释放no,改善微循环,增加局部血流量,改善血管内皮功能,抑制缺氧-复氧对内皮细胞的损伤而起到保护组织作用;再灌注期依靠姜黄素发挥神经保护的作用。这种利用药物分子和辅料供体上的no双通道协同的药物组合物,能够同时治疗脑缺血再灌注神经保护和预防缺血性卒中。
技术实现要素:
7.本发明旨在解决临床迫切需要解决的问题和疾病的发病机理,根据动物实验结果创造性地提出利用药物活性成分干预及胶束聚合物上的no内皮舒张的双通道协同作用,治疗脑缺血再灌注损伤和预防脑卒中复发。
8.为了达到上述目的,本发明提供的技术方案为:本发明提供了一种no供体型胶束组合物,所述no供体型胶束组合物包含no供体型胶束材料和抗脑缺血再灌注损伤神经保护作用的难溶性药物。所述难溶性药物为姜黄素。
9.优选地,所述no供体型胶束组合物具体由以下重量份数的原料组成:1~10份姜黄素、1~30份no供体型胶束材料、1~30份表面活性剂及1~60份冻干保护剂。
10.优选地,所述no供体型胶束组合物由以下重量份数的原料组成:6份姜黄素、15份no供体型胶束材料、15份表面活性剂及30份冻干保护剂。
11.优选地,所述no供体型胶束材料由一种或者多种两亲性嵌段聚合物no供体组成,所述两亲性嵌段聚合物no供体为两亲性二嵌段聚合物no供体、两亲性三嵌段聚合物no供体或者两亲性多嵌段聚合物no供体。如plga-no、pla-no、mpeg-pla-no、mpeg-plga-no、mpeg-pga-no、pga-no中的一种或多种。
12.其中,plga为聚乳酸-羟基乙酸,l/g=50/50或者75/25,分子量为5000~20000;pla为聚乳酸,分子量为500~5000;pga为聚谷氨酸,分子量为5000~30000;mpeg为聚乙二醇单甲醚,其分子量为500~5000。
13.优选地,所述no供体型胶束材料为mpeg-pla-no,所述mpeg-pla-no的结构式为:;其中,n1=6~100,n2=6~100。
14.优选地,所述表面活性剂选自吐温类、聚氧乙烯脂肪醇醚类、聚氧乙烯烷基酚醚类、聚氧乙烯脂肪酸酯类、聚氧乙烯聚氧丙烯共聚物类、脂肪酸山梨坦类及聚氧乙烯失水山梨醇脂肪酸酯类中的一种或多种。
15.优选地,所述冻干保护剂选自海藻糖、甘露醇、蔗糖、葡萄糖、氯化钠、乳糖、山梨醇、右旋糖苷、甘油、甘氨酸中的一种或多种。
16.本发明还提供了一种no供体型胶束组合物的制备方法,具体制备步骤为:按照重量份数,将姜黄素、no供体型胶束材料和表面活性剂混合后,置于有机溶剂中溶解充分,加
入纯化水,搅拌均匀后加入冻干保护剂,经灭菌后冷冻干燥,即得no供体型胶束组合物成品。
17.所述灭菌方法为过滤除菌法及湿热灭菌法中的一种或多种。
18.所述有机溶剂具体为乙醇、甲醇、乙醚、三氯甲烷、二氯甲烷、异丙醇、叔丁醇、正丁醇、乙酸乙酯中的一种或多种的组合。
19.优选地,本发明的no供体型胶束组合物的制备方法具体为:将6份姜黄素、15份mpeg-pla-no以及15份吐温类表面活性剂混合后,置于20 ml乙醇中充分溶解,加入纯化水,搅拌均匀后加入30份甘露醇,经灭菌后冷冻干燥,即得no供体型胶束组合物成品。
20.本发明还提供了所述的no供体型胶束组合物在制备抗脑缺血再灌注损伤中神经保护及预防复发的药物上的应用。优选的,其给药方式为静脉注射。
21.与现有技术相比,本发明的有益效果为:1)协同性治疗脑缺血再灌注损伤及预防脑卒中复发,提高长期生存率和降低致残率;2)起到增效减毒的作用,降低了神经保护药物给药剂量从而减少不良反应;3)避免脑血管支架手术中造成的支架贴壁不良、扩张不全等副作用,减少扩张血管及抗凝药所致的不良反应。
22.本发明证实no供体型胶束与药物结合的协同作用,能够在药物干预的前提下,利用no改善微循环,增加局部血流量,改善血管内皮功能,抑制缺氧-复氧对内皮细胞的损伤,从而降低小鼠脑梗死体积,改善神经学功能,起到协同增效的作用。其抗脑缺血再灌注损伤作用远远优于无no供体的药物胶束。
23.总之,本发明的no供体型胶束组合物能同时利用药物干预及no内皮靶点作用的双通路,协同性治疗和预防缺血性脑卒中,能显著减轻脑缺血再灌注损伤。
附图说明
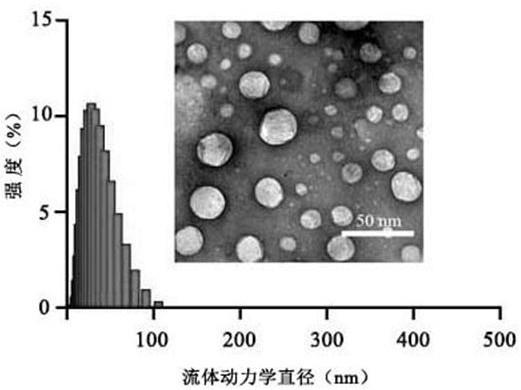
24.图1为本发明制备的no供体型胶束组合物cur-pla-no的粒径图;图2为本发明制备的no供体型胶束组合物cur-pla-no的dsc测定图;图3为本发明制备的no供体型胶束组合物cur-pla-no的xrd测定图;图4为本发明制备的no供体型胶束组合物cur-pla-no中姜黄素和no的体外释放行为图;图5为本发明试验研究中不同制剂组的体外血脑屏障渗透率对比图;图6为本发明试验研究中不同制剂组的体内神经功能评分图;图7为本发明试验研究中不同制剂组的ttc梗死体积图;图8为本发明试验研究中不同制剂组的脑梗死体积计算对比图;图9为本发明试验研究中不同制剂组的水迷宫热区图;图10为本发明试验研究中不同制剂组的水迷宫目标象限停留时间对比图;图11为本发明试验研究中不同制剂组对大脑中动脉闭塞(middle cerebral artery occlusion, mcao) 小鼠6h、24h脑组织enos、inos、nnos表达的影响 [(a)注射药物后6 h mcao小鼠脑内nnos浓度;(b)注射药物后24 h mcao小鼠脑内nnos浓度变化;(c)注射药物后6 h mcao小鼠脑内inos浓度变化;(d)注射药物后24 h mcao小鼠脑内inos浓度变
化;(e)注射药物后6 h mcao小鼠脑内enos浓度变化;(f)注射药物后24 h mcao小鼠脑内enos浓度变化] 。
具体实施方式
[0025]
为了进一步理解本发明,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0026]
实施例1本实施例提供了一种no供体型胶束组合物的制备方法,按照重量份数,将6份姜黄素、15份mpeg-pla-no以及15份表面活性剂(吐温类)混合后,置于20 ml乙醇中充分溶解,加入纯化水,搅拌均匀后加入30份冻干保护剂(甘露醇),经灭菌后冷冻干燥,即得no供体型姜黄素胶束成品(cur-pla-no)。
[0027]
对比例1本对比例提供了一种非no供体型胶束组合物的制备方法,按照重量份数,将6份姜黄素、15份mpeg-pla以及15份表面活性剂(吐温类)混合后,置于20 ml乙醇中充分溶解,加入纯化水,搅拌均匀后加入及30份冻干保护剂(甘露醇),经灭菌后冷冻干燥,即得非no供体型姜黄素胶束成品(cur-pla)。
[0028]
一、no供体型胶束组合物的特性1、cur-pla-no体外形貌的评价对实施例1制备的no供体型姜黄素胶束(cur-pla-no)以及对比例1制备的非no供体型姜黄素胶束(cur-pla)的体外性质进行测定,结果见下表1和图1、图2、图3。
[0029]
表1 cur-pla-no及cur-pla的体外性质。
[0030]
由表1可知,cur-pla-no及cur-pla粒径可控(《50 nm)、质量稳定,可用于后期实验对比研究。
[0031]
图1中透射电子显微镜观察cur-pla-no的表观形貌,呈球形或类球形;图2及图3采用差示扫描量热法(differential scanning calorimetry,dsc)和x射线衍射法(x-ray diffraction,xrd)测定不同制剂组(cur-pla-no、姜黄素、mpeg-pla-no胶束、姜黄素和mpeg-pla-no胶束的物理混合物)的熔点及晶型,结果表明,cur-pla-no中姜黄素完全负载在胶束内核中,呈无定形态。
[0032]
cur-pla-no:实施例1制备的cur-pla-no胶束;mpeg-pla-no胶束:空白mpeg-pla-no胶束,即未加入姜黄素的胶束;姜黄素与mpeg-pla-no胶束物理混合物:姜黄素原料药和空白mpeg-pla-no胶束的
物理混合物。
[0033]
2、cur-pla-no体外释放行为的评价为了评价cur-pla-no在体内循环过程中的释放行为,采用含吐温80表面活性剂和l-半胱氨酸的pbs溶液为溶出介质,流池法溶出仪进行溶出度实验,hplc测定姜黄素含量,紫外分光光度法测定no含量,评价cur-pla-no中姜黄素和no的释放行为。origin pro 2018c软件对姜黄素和no的释放速率进行拟合(见表2),结果表明姜黄素和no的释放过程符合一级动力学方程,不存在突发性释放。no在前3h的累积释放量为32.67
±
1.73%,释放呈现先快后慢、缓释先多后少的趋势(见图4)。与no相比,姜黄素在前3h的累积释放量仅为4.65
±
0.19%,直到60h呈现缓释趋势,释放量达到55.43
±
0.006%。姜黄素和no的不同释放趋势与ciri梗死期no缺乏的微环境和灌注期的抗氧化神经保护需求相吻合。
[0034]
表2 cur-pla-no中姜黄素与no体外释放模型的拟合方程。
[0035]
3、cur-pla-no体外血脑屏障通透性评价bend.3 细胞(1
×
105细胞/孔)接种于transwell膜(1.0μm孔径,预涂2% w/v的明胶)上,在含胎牛血清(10% v/v)的培养基中培养,建立体外血脑屏障模型,比较透过transwell膜溶液中姜黄素的含量,评价不同制剂(姜黄素溶液、cur-pla和cur-pla-no)的血脑屏障通透性。实验结果见图5(*指p<0.05,**指p<0.01,当p<0.05时差异显著)。结果表明,姜黄素溶液、cur-pla和cur-pla-no在体外可不同程度穿透血脑屏障,这与姜黄素本身是一个脂溶性强的小分子有关。且与姜黄素溶液和cur-pla相比,cur-pla-no具有更高的渗透性,这是由于在mpeg-pla嵌段中加入了呋喃环化合物,改变了共聚物嵌段的化学组成、长度和亲脂性,并对小鼠大脑内皮细胞表现出更积极的亲和力。是否能增加体内进入大脑的药物量,还与血脑屏障的通透性及其与血液中血清蛋白的结合能力有关。而在小鼠mcao模型中,血脑屏障通透性增加,cur-pla-no表面的负电荷会排斥血清蛋白。这些都有利于cur-pla-no通过血脑屏障进入大脑,发挥治疗作用。
[0036]
二、本发明的no供体型胶束组合物的抗缺血再灌注损伤神经保护作用研究将实施例1制备的no供体型姜黄素胶束(cur-pla-no)以及对比例1制备的非no供体型姜黄素胶束(cur-pla),进行c57bl/6小鼠的抗脑缺血再灌注损伤研究,具体如下:(一)cur-pla-no抗脑缺血再灌注损伤神经保护研究1、动物模型建立采用线栓阻断法建立c57bl/6小鼠mcao模型,具体如下:体式显微镜下制备小鼠mcao模型,3%戊巴比妥钠作为小鼠注射镇静剂,暴露颈总动脉、颈内动脉和颈外动脉。用手术用4-0尼龙丝结扎颈外动脉至颈内动脉,硅胶包衣单丝闭塞右侧大脑中动脉30分钟后取出线栓,结扎颈内动脉并缝合伤口,恢复血流灌注。造模至小鼠复苏期间,保持小鼠体温恒定。
[0037]
2、给药方案取23~25 g雄性 c57bl/6小鼠126只,mcao术前随机分为6组,分别为生理盐水组、正常对照组、假手术组、cur-pla-no组、对比cur-pla组及阳性对照依达拉奉组,每组21只小鼠,其中3只小鼠用于神经功能评分研究,15只小鼠用于脑梗死体积研究,3只小鼠用于水迷宫行为学研究,各组在不同时间点给药,取零时间点表示mcao造模前给药,其余时间点为造模后给药,各组单次给药剂量为 0.72 mg/kg。
[0038]
正常对照组:不作任何处理的健康小鼠,尾静脉注射生理盐水。
[0039]
假手术组:将线栓插到脑中动脉分叉处即停,其他后续工作与mcao模型一致,尾静脉注射生理盐水。
[0040]
生理盐水组:mcao模型小鼠,尾静脉注射生理盐水。
[0041]
cur-pla-no组:mcao模型小鼠,尾静脉注射no供体型姜黄素胶束溶液。
[0042]
对比cur-pla组:mcao模型小鼠,尾静脉注射非no供体型姜黄素胶束溶液。
[0043]
阳性对照依达拉奉组:mcao模型小鼠,尾静脉注射依达拉奉溶液(dmso溶解依达拉奉粉末,无菌注射用水稀释至dmso浓度为0.1%以下制成)。
[0044]
3、测试项目与结果(1)神经功能评分研究各组小鼠在造模前给药,动物复苏24小时后评估行为,根据zea longa标准对小鼠进行了评分。
[0045]
评分标准为:0分,无神经损伤症状;1分,对侧前爪不能完全伸出;2分,后部转向对侧;3分,向对侧无精打采;4分,不能独立行走;5分,失去意识。结果表明生理盐水组小鼠出现明显的神经运动功能障碍,而给药组均明显改善神经功能缺损症状,且cur-pla-no组神经功能评分低于对比cur-pla组,与阳性对照依达拉奉组效果相当(见图6)。
[0046]
(2)脑梗死体积研究(ttc染色)分别在0h、3h、6h、12h和24 h对各组小鼠单次给药,再灌注48h后,取小鼠脑组织进行ttc染色,测量各组脑梗死体积。
[0047]
脱颈椎处死小鼠,取大脑取出嗅球后,冷冻30min,连续采集2mm脑组织冠状切片,1% ttc溶液37℃染色30min,梗死区呈白色,非梗死区呈红色。采用imagej软件1.51j8对切片进行拍照和分析(见图7),所有数据采用spss 20.0软件进行统计学分析(见图8,*指p<0.05,**指p<0.01,***指p<0.001,当p<0.05时差异显著,ns表示无显著性差异)。
[0048]
图7、图8结果表明与生理盐水组相比,cur-pla-no组能显著降低小鼠脑梗死体积。在0h、3h、6 h,cur-pla-no减少脑梗死体积的作用与阳性对照依达拉奉组相当,且明显优于对比cur-pla组。在0h(造模前)给药条件下,药效作用最佳,故在后期内皮细胞保护作用试验中,采取造模前单次给药方式进行进一步研究。
[0049]
(3)水迷宫行为学研究morris水迷宫(morris water maze, mwm)主要用于测试实验动物对空间位置和方位的学习记忆能力。
[0050]
6组小鼠依次在第0天、第3天、第6天、第9天、第12天和第15天尾静脉给药一次,每组共计给药6次。各组小鼠从第15天给药后开始进行定向导航训练。每天同一时间观察小鼠在水迷宫第一象限内找到平台的时间和轨迹。连续训练5天后,采用水迷宫轨迹跟踪系统监
测不同组小鼠在目标象限停留时间和轨迹。
[0051]
结果见图9、图10(*指p<0.05,**指p<0.01,当p<0.05时差异显著,ns表示无显著性差异),表明cur-pla-no组小鼠在目标象限停留时间明显长于对比cur-pla组,与阳性对照依达拉奉组基本相同,提示持续静脉给药cur-pla-no组对小鼠脑缺血再灌注后神经记忆功能的恢复有一定的协同作用。
[0052]
(二)cur-pla-no内皮舒张作用研究no能明显改善缺血性脑卒中的神经预后,其主要由内皮no (enos)、诱导no (inos)和神经no (nnos)三种一氧化氮合酶产生,在缺血性脑卒中中发挥不同作用。通过测定给药前后三种一氧化氮合酶的产生,研究本制剂内皮舒张、改善血液循环的作用。
[0053]
1、给药方案取23~25 g雄性 c57bl/6小鼠30只,按“(一)cur-pla-no抗脑缺血再灌注损伤神经保护研究”项下动物模型建立所示方法制备mcao模型,造模前随机分为5组,分别为生理盐水组、正常对照组、cur-pla-no组、对比cur-pla组及阳性对照依达拉奉组,每组6只小鼠。优选造模前单次给药方式,给药剂量为 0.72 mg/kg。
[0054]
2、测试项目与结果各组在给药并造模后再随机均分为2组,每组3只小鼠,分别在规定时间点(6h、12h)脱颈椎处死小鼠并取脑组织,去除嗅球和小脑,左脑和右脑各自称重,按1g组织加入9ml pbs溶液,全自动样品快速研磨仪将样本充分匀浆(30hz,90s),离心20min(4℃,3000 r/min),仔细收集上清液,测定enos、inos和nnos三种一氧化氮合酶。
[0055]
结果见图11(*指p<0.05,**指p<0.01,***指p<0.001,当p<0.05时差异显著,ns表示无显著性差异),相对生理盐水组,给药组(cur-pla-no、cur-pla、依达拉奉)在注射后6h和24h均能一定程度降低nnos表达[见图11中的(a)和图11中的(b)],这与早期炎症药物的应用有关。与正常对照组的健康小鼠相比,生理盐水组小鼠在两个时期inos水平均呈显著上升趋势,且在受损右脑中这一现象尤为明显,这与炎症刺激后中枢神经系统inos水平逐渐升高有关。而注射药物后各组小鼠右脑inos表达明显减少,能够减轻inos损伤[见图11中的(c)和图11中的(d)]。对于enos的表达,除cur-pla-no组外,其他药物均未增加有利于内皮舒张作用的enos表达[见图11中的(e)和图11中的(f)],这是由于cur-pla-no释放的no刺激了大脑内皮细胞,进一步调控了大脑微血管血流所致。该结果表明,cur-pla-no通过no供体材料能够上调enos,抑制inos和nnos,扩张微血管,改善脑微循环,促进小鼠缺血再灌注损伤的恢复和血管扩张。
[0056]
最后应说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1