卡巴匹林钙固体制剂及其制备方法与流程
1.本发明涉及卡巴匹林钙固体制剂技术领域,尤其涉及一种卡巴匹林钙固体制剂及其制备方法。
背景技术:
2.卡巴匹林钙又称(阿司匹林钙脲),是一种阿司匹林衍生物,为乙酰水杨酸钙(阿司匹林的钙盐)与尿素的螯合物,为白色无定形粉末,易吸潮结块,味微苦,极易溶于水。为乙酰水杨酸钙与脲的络合物,代谢特点和药理作用与阿司匹林(乙酰水杨酸)相同,具有解热、镇痛、抗炎以及抑制血小板聚集作用,预防各种原因引起的血栓。
3.其作用机理大致为口服卡巴匹林钙后吸收快,水解为阿司匹林(乙酰水杨酸),阿司匹林能被快速吸收,经肝脏代谢并在体内迅速水解为水杨酸,最终达到解热、镇痛、消炎的目的。
4.猪或鸡大群发病的时候,比如口蹄疫、猪瘟、流感、蓝耳病等,不能一个个打针,而口蹄疫打针有可能心肌炎伤猪,所以饮水给药方式是非常方便的,但阿司匹林难溶于水,且口服后易刺激胃肠道,导致胃肠溃疡、出血,而卡巴匹林钙易溶于水,口服吸收快,口服后消化道耐受性好,副作用少,对猪身体无害,没有药物残留,对人类的身体健康无害,而且卡巴匹林钙还具有阿司匹林所缺乏的抗炎作用,因此卡巴匹林钙非常适合做成可溶性粉剂型,作为畜禽的口服解热镇痛药临床应用。
5.但是,卡巴匹林钙稳定性差,易水解。卡巴匹林钙本身就是无定形粉末,晶型不稳定,在日常贮存中就容易受温度或空气中的湿度影响,从而发生自身水解,同理,在可溶性粉制剂中也易受配方辅料的ph、水活度影响,而且在饲喂过程中也容易吸潮、水解、产生水杨酸,刺激动物黏膜,引起动物的不适,严重时可能会造成内出血症状。卡巴匹林钙粉贮存稳定性(水杨酸问题)是行业内的共同难点。
6.中国专利cn106491538a提出一种卡巴匹林钙可溶性粉及其制备方法,该方法需要先制备微囊化卡巴匹林钙,在这过程,需要在30℃~40℃温度调节处理一段时间,而卡巴匹林钙本身对高温敏感,高温易催化水解反应,增加水杨酸的生成。而且,这样做成的微囊化卡巴匹林钙是颗粒形式,与水溶性载体混合难保证混合均匀度,可能对工艺要有更细节的要求,工艺把控难度较大。再者,《中国兽药典》对于“粉”、“可溶性粉”、“细粉”有粒径要求,“细粉”为能全部通过五号筛/80目筛,并含能通过六号筛/100目筛不少于95%的粉末,而由卡巴匹林钙、水解阻滞剂、ph调节剂造粒制成的微囊化卡巴匹林钙是颗粒,不能符合卡巴匹林钙粉或卡巴匹林钙可溶性粉粒径要求。总而言之,该专利提出的工艺关键控制点多、把控难度大,对生产设备要求高,且存在可能会催化水解反应的工艺步骤。
7.中国专利cn111557915a公开了一种兽用高水溶性卡巴匹林钙可溶性粉,其与cn106491538a提出的制备方法相似,区别在于:卡巴匹林钙要先跟抗氧化剂混合、配方中引入了抗结块剂。具体而言,cn106491538a是将“卡巴匹林钙、水解阻滞剂、ph调节剂”造粒,再跟水溶性载体混合,得到卡巴匹林钙可溶性粉;而cn111557915a是将“卡巴匹林钙与抗氧化
剂混合物、水解阻滞剂、ph缓冲剂、抗结块剂和水溶性载体”制粒,得到卡巴匹林钙可溶性粉,从而没有了混合均匀度这个难点。但是两个专利提供的制备方法并没有本质上的区别,cn111557915a除了减少了混合均匀度这个工艺难点,卡巴匹林钙可溶性粉在制备过程中,有效成分卡巴匹林钙依然会受到较高温度的工艺处理,可能会催化水解反应,而且工艺难度、生产设备都有较高要求,制剂粒度问题未能解决。
技术实现要素:
8.本发明所要解决的技术问题在于,提供一种卡巴匹林钙固体制剂,其水溶性和稳定性好,对动物胃肠道刺激性小,适口性好。
9.本发明所要解决的技术问题还在于,提供一种卡巴匹林钙固体制剂的制备方法,其工艺简单,所需生产设备简单,生产周期短,适合大规模商业化生产。
10.为了解决上述技术问题,本发明提供了一种卡巴匹林钙固体制剂,按照重量份计包括第一组分89份~99份和第二组分1份~11份;
11.所述第一组分按照重量份计包括:卡巴匹林钙45份~55份、第一填充剂0.1份~54份和第二填充剂0份~53.9份;
12.所述第二组分为增稠剂。
13.在一种实施方式中,所述第一填充剂选用乳糖和/或无水乳糖;
14.所述第二填充剂选用抗性糊精、聚葡萄糖、预糊化淀粉和麦芽糊精中的一种或组合。
15.在一种实施方式中,所述无水乳糖的干燥失重值≤0.5%;
16.所述第一填充剂选用无水乳糖。
17.在一种实施方式中,所述抗性糊精的干燥失重值≤3.5%;
18.所述聚葡萄糖的干燥失重值≤3.5%;
19.所述预糊化淀粉的干燥失重值≤3.5%;
20.所述麦芽糊精的干燥失重值≤3.5%;
21.所述预糊化淀粉的溶解度≥1g/100ml。
22.优选地,所述第二填充剂选用预糊化淀粉。
23.在一种实施方式中,所述增稠剂选用黄原胶、羧甲基纤维素钠和果胶中的一种或组合。
24.在一种实施方式中,所述果胶选用柑橘果胶和/或苹果果胶。
25.优选地,所述增稠剂选用柑橘果胶。
26.为解决上述问题,本发明还提供了上述的卡巴匹林钙固体制剂的制备方法,包括以下步骤:
27.称取卡巴匹林钙、第一填充剂和第二填充剂,分别确认卡巴匹林钙、第一填充剂和第二填充剂的干燥失重值符合预设标准;
28.将所述卡巴匹林钙、第一填充剂和第二填充剂过筛后混合,得到第一组分;
29.称取增稠剂,得到第二组分;
30.将所述第一组分和第二组分单独包装,制得成品。
31.在一种实施方式中,将所述卡巴匹林钙、第一填充剂和第二填充剂过20目~60目
筛后混合,混合转速为5转/分钟~10转/分钟,混合时间为20min~40min;
32.所述卡巴匹林钙、第一填充剂、第二填充剂和增稠剂的存放条件为温度≤35℃,湿度≤65%。
33.实施本发明,具有如下有益效果:
34.本发明提供的一种卡巴匹林钙固体制剂,其包括第一组分和第二组分;所述第一组分按照重量份计包括:卡巴匹林钙、第一填充剂和第二填充剂;所述第二组分为增稠剂。该产品水溶性好、卡巴匹林钙粉有关物质稳定性好,水解产物水杨酸产生少,从而降低对靶动物胃肠道的刺激,减少动物的使用不适。同时配方中含有增稠剂,使卡巴匹林钙粉溶解于水中形成胶浆剂,减少水杨酸对靶动物黏膜的刺激,并能干扰味觉对卡巴匹林钙微苦味的敏感性而起到矫味作用。水杨酸生成减少和增稠剂协同作用,能减少制剂的刺激性。并且提供的制备方法工艺简单,只使用最简单的生产设备,生产周期短,适合大规模商业化生产。
具体实施方式
35.为使本发明的目的、技术方案和优点更加清楚,下面对本发明作进一步地详细描述。
36.为了解决上述技术问题,本发明提供了一种卡巴匹林钙固体制剂,按照重量份计包括第一组分89份~99份和第二组分1份~11份;
37.所述第一组分按照重量份计包括:卡巴匹林钙45份~55份、第一填充剂0.1份~54份和第二填充剂0份~53.9份;
38.所述第二组分为增稠剂。
39.所述卡巴匹林钙固体制剂水溶性好、卡巴匹林钙粉有关物质稳定性好,水解产物水杨酸产生少,从而降低对靶动物胃肠道的刺激,减少动物的使用不适。同时配方中含有增稠剂,使卡巴匹林钙粉溶解于水中形成胶浆剂,减少水杨酸对靶动物黏膜的刺激,并能干扰味觉对卡巴匹林钙微苦味的敏感性而起到矫味作用。水杨酸生成减少和增稠剂协同作用,能减少制剂的刺激性。
40.其中,所述第一组分包括卡巴匹林钙、第一填充剂和第二填充剂。优选地,所述第一组分的重量份为90份~98份,包括但不限于91份、92份、93份、94份、95份、96份、97份。
41.具体地,卡巴匹林钙受热、水活度影响会产生水杨酸,而卡巴匹林钙粉制剂中的原辅料本身含有一定的水活度,在贮存过程中不可避免地会发生一定程度的水解反应,而且卡巴匹林钙粉产品也会受储存温度、包材透湿性影响而产生水解产物,因此水杨酸的产生不可避免,只能尽量减少产品有效期内的水解产物含量和增加速度。在一种实施方式中,所述卡巴匹林钙的水分值≤0.2%;这样可最大程度上减少水杨酸的产生。优选地,所述卡巴匹林钙的重量份为46份~54份,包括但不限于47份、48份、49份、50份、51份、52份、53份。
42.根据国家标准规定,卡巴匹林钙制剂中须含有乳糖类物质,在一种实施方式中,所述第一填充剂选用乳糖和/或无水乳糖;优选地,所述第一填充剂选用无水乳糖。优选地,所述第一填充剂选用无水乳糖。无水乳糖相对于乳糖而言,对生产操作更方便,乳糖需要干燥处理后使干燥失重达标后方能使用,无水乳糖可直接使用,有利于减少生产能耗。优选地,所述第一填充剂的重量份为1份~50份,包括但不限于10份、15份、20份、25份、30份、35份、40份。在一种实施方式中,所述乳糖的干燥失重值≤0.5%;所述无水乳糖的干燥失重值≤
0.5%;这样可最大程度上减少水杨酸的产生。得到乳糖和无水乳糖不仅与有效成分卡巴匹林钙具有良好相容性,而且能够用来解决制剂流动性问题,从而避免加入助流剂,因为助流剂的加入会加速有效成分卡巴匹林钙水解速度,甚至会在水溶过程中出现漂浮物。
43.在一种实施方式中,所述第二填充剂选用抗性糊精、聚葡萄糖、预糊化淀粉和麦芽糊精中的一种或组合。优选地,所述预糊化淀粉的溶解度≥1g/100ml。更佳地,所述第二填充剂选用预糊化淀粉。可选地,所述预糊化淀粉选用预糊化淀粉5型、预糊化淀粉9型、预糊化淀粉pm和预糊化淀粉gnhm中的一种或组合。所述预糊化淀粉5型、预糊化淀粉9型、预糊化淀粉pm和预糊化淀粉gnhm的溶解度均≥1g/100ml。需要说明的是,如果所述预糊化淀粉的溶解度过低,将影响本发明的实现。优选地,所述第二填充剂的重量份为1份~50份,包括但不限于10份、15份、20份、25份、30份、35份、40份。在一种实施方式中,所述抗性糊精的干燥失重值≤3.5%;所述聚葡萄糖的干燥失重值≤3.5%;所述预糊化淀粉的干燥失重值≤3.5%;所述麦芽糊精的干燥失重值≤3.5%;这样可最大程度上减少水杨酸的产生。所述第二填充剂与有效成分卡巴匹林钙相容性良好,且具有高溶解度、低粘度、热稳定、酸稳定、口感温和、流动性好等特点,符合粉剂/可溶性粉剂的填充剂要求。
44.在一种实施方式中,所述增稠剂选用黄原胶、羧甲基纤维素钠和果胶中的一种或组合。优选地,所述果胶选用柑橘果胶和/或苹果果胶。更佳地,所述增稠剂选用柑橘果胶。柑橘果胶是一种可溶性膳食纤维,有抗氧化、抗炎、降血脂、运输药物等生物功能,在卡巴匹林钙粉溶解在水中饮水给药时起稳定、增稠作用,可延长水溶液的保存期,具有天然水果风味,口感佳,动物服药依从性强。优选地,所述第二组分的重量份为1.25份~10份,包括但不限于2份、3份、4份、5份、6份、7份、8份、9份。更佳地,所述增稠剂选用黄原胶时,所述黄原胶的重量份为5份~6.25份;所述增稠剂选用羧甲基纤维素钠时,所述羧甲基纤维素钠的重量份为5份~10份;所述增稠剂选用果胶时,所述果胶的重量份为1.25份~7.5份。
45.相应地,本发明还提供了上述的卡巴匹林钙固体制剂的制备方法,包括以下步骤:
46.s1、称取卡巴匹林钙、第一填充剂和第二填充剂,分别确认卡巴匹林钙、第一填充剂和第二填充剂的干燥失重值符合预设标准;
47.优选地,所述预设标准中,所述卡巴匹林钙的水分值≤0.2%;所述乳糖的干燥失重值≤0.5%;所述无水乳糖的干燥失重值≤0.5%;所述抗性糊精的干燥失重值≤3.5%;所述聚葡萄糖的干燥失重值≤3.5%;所述预糊化淀粉的干燥失重值≤3.5%;所述麦芽糊精的干燥失重值≤3.5%。如所述卡巴匹林钙、第一填充剂和第二填充剂的干燥失重值不符合预设标准,将其置于50℃~80℃烘箱中烘至符合要求后,密封存放、备用。生产配制前储存温湿度要求为:温度≤35℃,湿度≤65%。优选地,温度为15℃~25℃,湿度为40%~60%。存放条件会影响卡巴匹林钙的水解反应,环境湿度过大,空气中水活度高,会促进卡巴匹林钙水解。
48.s2、将所述卡巴匹林钙、第一填充剂和第二填充剂过筛后混合,得到第一组分;
49.在一种实施方式中,将所述卡巴匹林钙、第一填充剂和第二填充剂过20目~60目筛后混合,混合转速为5转/分钟~10转/分钟,混合时间为20min~40min。优选地,将卡巴匹林钙、第一填充剂和第二填充剂等比交叉投料至摇摆筛中,过20目~60目筛进行分散;投入方锥混合机中,转速5转/分钟~10转/分钟,混合20min~40min。更佳地,将卡巴匹林钙、第一填充剂和第二填充剂等比交叉投料至摇摆筛中,过30目筛进行分散;投入方锥混合机中,
转速9转/分钟,混合25min。
50.s3、称取增稠剂,得到第二组分;
51.s4、将所述第一组分和第二组分单独包装,制得成品。
52.需要说明的是,所述第二组分,即增稠剂需要与所述第一组分分开包装。发明人发现若增稠剂不单独分装,会明显影响卡巴匹林钙粉整个制剂的稳定性,增稠剂的存在会加速卡巴匹林钙的水解速度。因此本发明将第一组分与第二组分单独包装,这样既能延缓有效成分卡巴匹林在产品贮存过程中的水解速度,减少水杨酸的产生,又能兼顾产品的适口性,并且降低产品对靶动物胃肠道的刺激性。
53.进一步地,在一种实施方式中,所述卡巴匹林钙、第一填充剂、第二填充剂和增稠剂的存放条件为温度≤35℃,湿度≤65%。优选地,所述卡巴匹林钙、第一填充剂、第二填充剂和增稠剂的存放条件为温度为15℃~25℃,湿度为40%~60%。生产环境条件会影响卡巴匹林钙的水解反应,环境湿度过大,空气中水活度高,会促进卡巴匹林钙水解。
54.下面以具体实施例进一步说明本发明:
55.实施例1
56.本实施例提供一种卡巴匹林钙固体制剂,按照重量份计包括第一组分93.75份和第二组分6.25份;
57.所述第一组分按照重量份计包括:卡巴匹林钙50份、无水乳糖1份和预糊化淀粉gnhm 42.75份;
58.所述第二组分为柑橘果胶。
59.所述无水乳糖的干燥失重值≤0.5%;所述预糊化淀粉gnhm的干燥失重值≤3.5%。
60.上述卡巴匹林钙固体制剂的制备方法如下:
61.s1、称取卡巴匹林钙50份、无水乳糖1份和预糊化淀粉gnhm 42.75份,分别确认卡巴匹林钙、无水乳糖和预糊化淀粉gnhm的干燥失重值符合预设标准;
62.s2、将所述卡巴匹林钙、无水乳糖和预糊化淀粉过30目筛进行分散;投入方锥混合机中,转速9转/分钟,混合25min,得到第一组分;
63.s3、称取柑橘果胶6.25份,得到第二组分;
64.s4、将所述第一组分和第二组分单独包装,制得成品。
65.所述卡巴匹林钙、无水乳糖、预糊化淀粉gnhm和柑橘果胶的存放条件为温度为20℃,湿度为50%。
66.实施例2
67.本实施例提供一种卡巴匹林钙固体制剂,按照重量份计包括第一组分89份和第二组分11份;
68.所述第一组分按照重量份计包括:卡巴匹林钙55份、无水乳糖30份和预糊化淀粉gnhm 4份;
69.所述第二组分为羧甲基纤维素钠。
70.所述无水乳糖的干燥失重值≤0.5%;所述预糊化淀粉gnhm的干燥失重值≤3.5%。
71.上述卡巴匹林钙固体制剂的制备方法参照实施例1。
72.实施例3
73.本实施例提供一种卡巴匹林钙固体制剂,按照重量份计包括第一组分95份和第二组分5份;
74.所述第一组分按照重量份计包括:卡巴匹林钙45份、无水乳糖34份和预糊化淀粉gnhm 16份;
75.所述第二组分为黄原胶。
76.所述无水乳糖的干燥失重值≤0.5%;所述预糊化淀粉gnhm的干燥失重值≤3.5%。
77.上述卡巴匹林钙固体制剂的制备方法参照实施例1。
78.实施例4
79.本实施例提供一种卡巴匹林钙固体制剂,按照重量份计包括第一组分93.75份和第二组分6.25份;
80.所述第一组分按照重量份计包括:卡巴匹林钙50份、无水乳糖43.75份;
81.所述第二组分为柑橘果胶。
82.所述无水乳糖的干燥失重值≤0.5%。
83.上述卡巴匹林钙固体制剂的制备方法参照实施例1。
84.实施例5
85.本实施例提供一种卡巴匹林钙固体制剂,其与实施例1不同之处在于以抗性糊精替代预糊化淀粉gnhm,其余与实施例1相同。
86.实施例6
87.本实施例提供一种卡巴匹林钙固体制剂,其与实施例1不同之处在于以聚葡萄糖替代预糊化淀粉gnhm,其余与实施例1相同。
88.实施例7
89.本实施例提供一种卡巴匹林钙固体制剂,其与实施例1不同之处在于以麦芽糊精替代预糊化淀粉gnhm,其余与实施例1相同。
90.实施例8
91.本实施例提供一种卡巴匹林钙固体制剂,其与实施例1不同之处在于以乳糖替代无水乳糖,其余与实施例1相同。
92.实施例9
93.本实施例提供一种卡巴匹林钙固体制剂,其与实施例1不同之处在于以无水硫酸钠替代预糊化淀粉gnhm,其余与实施例1相同。
94.实施例10
95.本实施例提供一种卡巴匹林钙固体制剂,其与实施例1不同之处在于以无水葡萄糖替代预糊化淀粉gnhm,其余与实施例1相同。
96.实施例11
97.本实施例提供一种卡巴匹林钙固体制剂,其与实施例1不同之处在于以甘露醇替代预糊化淀粉gnhm,其余与实施例1相同。
98.对比例1
99.提供一种卡巴匹林钙固体制剂,按照重量份计包括:卡巴匹林钙50份、柠檬酸0.5
份和无水乳糖49.5份;
100.上述卡巴匹林钙固体制剂的制备方法如下:
101.s1、称取卡巴匹林钙50份、柠檬酸0.5份和无水乳糖49.5份,并过30目筛进行分散,投入方锥混合机中,转速9转/分钟,混合25min,得到成品。
102.所述卡巴匹林钙、柠檬酸和无水乳糖的存放条件为温度为20℃,湿度为50%。
103.对比例2
104.提供一种卡巴匹林钙固体制剂,按照重量份计包括:卡巴匹林钙50份、磷酸二氢钾8.3份、磷酸氢二钾0.9份和无水乳糖40.8份;
105.上述卡巴匹林钙固体制剂的制备方法参照对比例1。
106.对比例3
107.提供一种卡巴匹林钙固体制剂,按照重量份计包括:卡巴匹林钙50份、二氧化硅1份和无水乳糖49份;
108.上述卡巴匹林钙固体制剂的制备方法参照对比例1。
109.对比例4
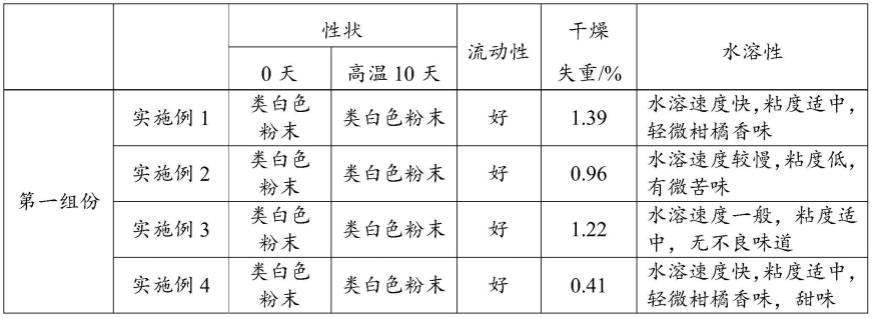
110.提供一种卡巴匹林钙固体制剂,与实施例1不同之处在于不含有第二组分,即柑橘果胶。其余与实施例1相同。
111.对比例5
112.提供一种卡巴匹林钙固体制剂,与实施例1相同;
113.上述卡巴匹林钙固体制剂的制备方法,与实施例1不同之处在于步骤s4、将所述第一组分和第二组分包装在同一包装袋中,制得成品。其余与实施例1相同。
114.对比例6
115.提供一种卡巴匹林钙固体制剂,与实施例1不同之处在于第二组分,即柑橘果胶的加入量为0.5份,其余与实施例1相同。
116.对比例7
117.提供一种卡巴匹林钙固体制剂,与实施例1不同之处在于第二组分,即柑橘果胶的加入量为11.5份,其余与实施例1相同。
118.(一)性状、流动性、干燥失重、水溶性测试
119.实施例1-11和对比例1~4、对比例6~7制得的卡巴匹林钙固体制剂中的第一组分和对比例5中制得的卡巴匹林钙固体制剂进行制剂性状、流动性、干燥失重、水溶性测试,测试结果如表1所示。
120.其中,高温10天的试验条件为:装入规定的内包材中密封,置于60
±
2℃条件下考察,10天后取样观察。
121.干燥失重的试验条件为:取约1g样品,平铺在快速水分测定仪的样品碟上,105℃烘15min,测得干燥失重。
122.干燥失重合格标准:制剂应≤2.0%;
123.表1为实施例1-11和对比例1~7制得的卡巴匹林钙固体制剂的测试结果
[0124][0125][0126]
(二)有关物质含量测试
[0127]
对实施例1-11和对比例1~4、6~7制得的卡巴匹林钙固体制剂中的第一组分和对比例5中制得的卡巴匹林钙固体制剂的有关物质含量进行测定,测试结果如表2所示,有关物质种类及其合格标准如下:
[0128]
1)水杨酸≤1.5%;
[0129]
2)最大单杂≤0.05%;
[0130]
3)乙酰水杨酰基水杨酸≤0.15%;
[0131]
4)总杂≤1.7%。
[0132]
表2实施例1-11和对比例1~5制得的卡巴匹林钙固体制剂的有关物质测试结果
[0133][0134]
比较实施例1~3可知,实施例1中第二组分为柑橘果胶,实施例2中第二组分为羧甲基纤维素钠,实施例3中第二组分为黄原胶,从水溶速度、溶液外观、口感可知,所述第二组分优选为柑橘果胶。
[0135]
比较实施例1和实施例5~10和实施例12~14,实施例1中第二填充剂为预糊化淀粉gnhm,实施例5中第二填充剂为抗性糊精,实施例6中第二填充剂为聚葡萄糖,实施例7中第二填充剂为麦芽糊精,实施例9中第二填充剂为无水硫酸钠,实施例10中第二填充剂为无水葡萄糖,实施例11中第二填充剂为甘露醇。对比性状、流动性、干燥失重、水溶性及有关物质结果可知,抗性糊精、聚葡萄糖、麦芽糊精、预糊化淀粉与有效成分卡巴匹林钙具有良好相容性,并且所述第二填充剂优选为预糊化淀粉。
[0136]
比较实施例1和对比例1,对比例1中添加柠檬酸作为水解阻滞剂,由性状、流动性、干燥失重、水溶性测试结果可知,对比例1高温处理10天后,出现小黑点,且干燥失重不合格。由有关物质测试结果可知,对比例1高温处理10天后水杨酸、乙酰水杨酰基水杨酸、总杂含量均不合格,说明通过加入水解阻滞剂调节卡巴匹林钙粉制剂体系的酸碱度来延缓有效成分的水解是不可行的。
[0137]
比较实施例1和对比例2,对比例2添加磷酸二氢钾和磷酸氢二钾作为ph调节剂,由性状、流动性、干燥失重、水溶性测试结果可知,对比例2高温处理10天后,出现小黑点,且干燥失重不合格。由有关物质测试结果可知,对比例2高温处理10天后水杨酸、乙酰水杨酰基水杨酸、最大单杂、总杂含量均不合格,说明通过加入ph调节剂调节卡巴匹林钙粉制剂体系的酸碱度来延缓有效成分的水解是不可行的。
[0138]
比较实施例1和对比例3,对比例3添加二氧化硅作为助流剂,其水溶过程出现漂浮物,对使用体验有所影响,而且对比例3高温处理10天后,有关物质不合格,说明制剂中加入助流剂是不可行的,会影响制剂有关物质稳定性,本发明添加流动性较好的填充剂,不仅能够解决制剂流动性问题,而且有利于制剂稳定性和制剂性状。
[0139]
比较实施例1和对比例5,实施例1中第一组分和第二组分单独包装,对比例5第一组分和第二组分包装在同一袋中,由表1和表2测试结果可知,若所述第二组分不单独分装,会明显影响卡巴匹林钙粉整个制剂的稳定性,第二组分的存在会加速卡巴匹林钙的水解速度,因此本发明将第一组分和第二组分装,这样既能延缓有效成分卡巴匹林在产品贮存过程中的水解速度,减少水杨酸的产生,又能兼顾产品的适口性,并且降低产品对靶动物胃肠道的刺激性。
[0140]
(三)适口性、肠胃刺激性测试
[0141]
对实施例1~3和对比例4、对比例6~7制得的卡巴匹林钙固体制剂进行适口性、肠胃刺激性测试,测试结果和测试方法如下:
[0142]
3.1适口性
[0143]
选取某大型猪场60头有发热、发炎症状并确诊需要使用卡巴匹林钙粉解热镇痛消炎治疗的猪,随机分成6组,各10头。用实施例1~3和对比例4、对比例6~7制得的卡巴匹林钙固体制剂进行测试,以正常剂量的卡巴匹林钙粉(每1kg体重猪40mg一次量内服)用水稀释500倍给药。
[0144]
表3适口性测试结果
[0145]
[0146]
实施例1~3、对比例6~7含有第二组分,对比例4不含有第二组分,由适口性测试结果可知,制剂中含有第二组份时对给药水溶液适口性有明显改善作用,但当第二组份加入量过少、给药水溶液粘度过低时,无法有效掩盖药物苦味,说明制剂中添加合适分量的第二组份(增稠剂)能起到掩味作用,改善制剂适口性。
[0147]
比较实施例1和对比例7的制剂水溶性结果可知,当第二组份加入量超过11份时,制剂水溶速度慢,影响产品使用体验,说明第二组份的优选分量为1~11份。
[0148]
比较实施例1~3适口性结果可知,第二组份优选柑橘果胶。
[0149]
3.2胃肠刺激性
[0150]
选取体质量相近(220
±
20g)的清洁级雄性sd大鼠60只,随机分成6组,每组各10只。实验前大鼠禁食12h,用实施例1~3和对比例4、对比例6~7制得的卡巴匹林钙固体制剂进行测试,以靶动物鸡最高给药剂量(每1kg体重80mg一次量内服)的卡巴匹林钙粉水溶液(用水稀释500倍)灌胃给药。然后处死动物并解剖取胃,生理盐水清洗后,所有胃组织以10%甲醛固定液固定24h,制作病理组织切片,照相,观察胃部溃疡的发生情况。
[0151]
根据胃粘膜的完整性及炎症细胞的浸润情况分为以下4种情况:
[0152][0153]
表4各组胃损伤发生率
[0154]
组别动物数量/只胃损伤动物数/只溃疡率/%实施例11000实施例21000实施例310110对比例410550对比例610550对比例71000
[0155]
表5各组胃损伤情况评分
[0156][0157]
正常;1-轻度;2-中度;3-重度
[0158]
由胃肠道刺激性测试结果可知,含有合适份量第二组份的卡巴匹林钙粉制剂(实施例1~3、对比例6)与不含第二组份或第二组份份量过少的卡巴匹林钙粉制剂(对比例4、对比例6)相比,在正常且等量的给药剂量下,对比例4、对比例6对胃肠道刺激性明显更大。
[0159]
综合(一)至(三)各项试验结果可知,本发明提供的一种卡巴匹林钙固体制剂,其产品水溶性好、卡巴匹林钙粉有关物质稳定性好,水解产物水杨酸产生少,从而降低对靶动物胃肠道的刺激,减少动物的使用不适。
[0160]
以上所述是发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1