磺酰脲类衍生物治疗疾病的用途的制作方法
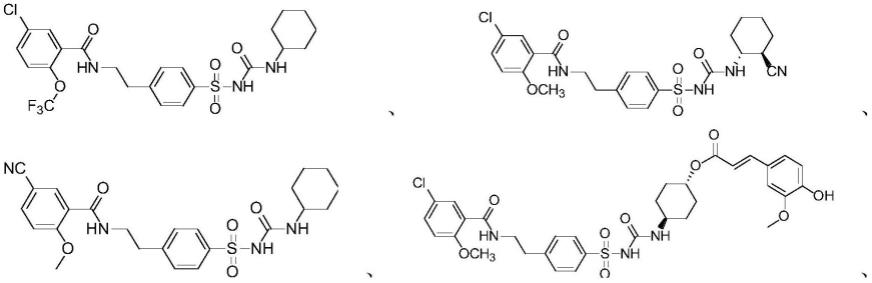
1.本公开属于医药领域,具体涉及一类磺酰脲类衍生物治疗疾病的用途。
背景技术:
2.流入大脑而引起脑组织损伤的一组疾病,包括缺血性和出血性卒中。缺血性卒中的发病率高于出血性卒中,占脑卒中总数的60%~70%。颈内动脉和椎动脉闭塞和狭窄可引起缺血性脑卒中,年龄多在40岁以上,男性较女性多,严重者可引起死亡。出血性卒中的死亡率较高。调查显示,城乡合计脑卒中已成为我国第一位死亡原因,也是中国成年人残疾的首要原因,脑卒中具有发病率高、死亡率高和致残率高的特点。
3.脑卒中发生的最常见原因是脑部供血血管内壁上有小栓子,脱落后导致动脉栓塞,即缺血性卒中。也可能由于脑血管或血栓出血造成,为出血性卒中。冠心病伴有房颤患者的心脏瓣膜容易发生附壁血栓,栓子脱落后可以堵塞脑血管,也可导致缺血性卒中,其他因素有高血压、糖尿病、高血脂等。
4.2018年,生物制药公司百健(biogen)评估了biib093(静脉注射格列本脲)用于大面积脑梗死(lhi)患者预防和治疗重度脑水肿的iii期临床研究(cn103108637b)。lhi是最严重的脑卒中类型之一,在美国、欧盟、日本三大主要医药市场,估计每年发生大约170万例缺血性卒中,其中大约15%被归类为lhi。格列本脲是一种磺脲类降糖药,作用于β细胞的atp敏感性钾通道,直接刺激胰岛β细胞分泌胰岛素,降糖作用强,是目前临床应用最广泛的口服降糖药类别之一。biib093是sur1-trpm4(磺酰脲类受体1-瞬时受体电位离子通道蛋白4)通道的高亲和抑制剂,该通道在缺血和创伤后上调,这些通道的开放可导致脑水肿、中线偏移、颅内压增加和脑疝,导致永久性残疾或死亡。biib093是一种实验性药物,目前正开发用于预防和治疗由lhi引起的重症脑水肿。
5.e.hill等报道抗糖尿病药物格列本脲(glibenclamide)能够大大减少α突触核蛋白聚集物所产生的影响效应。他们发现,接受治疗的2型糖尿病患者往往帕金森疾病的发生率较低,而理解单一大脑神经元细胞中α突触核蛋白病理学发生背后的分子机制或有望帮助开发出治疗帕金森疾病的新型靶向性疗法。
6.本公开的目的在于提供一类磺酰脲类衍生物在制备治疗或预防疾病的用途。
技术实现要素:
7.本公开提供通式(i)所示的化合物或其可药用盐在制备用于治疗或预防神经退行性疾病的药物中的用途,
[0008][0009]
其中,
[0010]
每一个r1各自独立地选自氘、任选被卤素取代的烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、任选被卤素取代的烷氧基、烷硫基;
[0011]
r2选自烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基,所述烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基任选进一步被选自氘、烷基、卤代烷基、卤素、羟基、氧代、巯基、-nr
irj
、-c(o)rk、-c(o)ork、-sri、-s(o)ri、-so2ri、硝基、氰基、任选被羟基或烷氧基取代的芳基、任选被氧代或烷基取代的杂芳基、任选被氧代或烷基取代的杂环基、任选被氧代或烷基取代的环烷基、任选被取代的烯基、任选被取代的炔基、烷氧基、烷硫基的一个或多个基团所取代;
[0012]
r3各自独立地选自氘、任选被卤素取代的烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、烷氧基、烷硫基;
[0013]ri
和rj各自独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0014]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基任选进一步被选自芳基、杂芳基、杂环基、环烷基、烷基、烷氧基的一个或多个基团所取代;
[0015]
m选自0-5的整数;
[0016]
n选自0-10的整数;
[0017]
并且r2不是
[0018]
在一些实施方案中,式(i)化合物中,
[0019]
每个r1各自独立地选自氘、任选被卤素取代的c
1-6
烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、c
1-6
烷氧基、c
1-6
烷硫基;
[0020]
r2选自c
1-20
烷基、c
1-20
烷氧基、c
2-12
烯基、c
2-12
炔基、6-14元芳基、5-14元杂芳基、3-15元环烷基、3-20元杂环基:
[0021]
所述c
1-20
烷基优选c
1-12
烷基,更优选c
1-6
烷基,
[0022]
所述c
1-20
烷氧基优选c
1-12
烷氧基,更优选c
1-6
烷氧基,
[0023]
所述c
2-12
烯基优选c
2-6
烯基,
[0024]
所述6-14元芳基优选6-12元芳基,更优选苯基或萘基,
[0025]
所述5-14元杂芳基优选6-12元杂芳基,更优选5元或6元杂芳基,
[0026]
所述3-15元环烷基优选3-10元环烷基,更优选5-7元环烷基,
[0027]
所述3-20元杂环基优选3-12元杂环基,更优选3-8元杂环基,
[0028]
所述的c
1-20
烷基、c
1-20
烷氧基、c
2-12
烯基、c
2-12
炔基、6-14元芳基、5-14元杂芳基、3-15元环烷基、3-20元杂环基任选进一步被选自氘、烷基、卤代烷基、卤素、羟基、氧代、巯基、-nr
irj
、-c(o)rk、-c(o)ork、-sri、-s(o)ri、-so2ri、硝基、氰基、任选被羟基或烷氧基取代的芳
基、任选被氧代或烷基取代的杂芳基、任选被氧代或烷基取代的杂环基、任选被氧代或烷基取代的环烷基、任选被取代的烯基、任选被取代的炔基、烷氧基、烷硫基的一个或多个基团所取代;
[0029]
r3各自独立地选自氘、任选被卤素取代的c
1-6
烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、c
1-6
烷氧基、c
1-6
烷硫基;
[0030]ri
和rj各自独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0031]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基任选进一步被选自芳基、杂芳基、杂环基、环烷基、烷基、烷氧基的一个或多个基团所取代;
[0032]
m选自0-5的整数;
[0033]
n选自0-10的整数;
[0034]
并且r2不是
[0035]
在一些实施方案中,式(i)化合物中r1选自卤素、c
1-6
烷氧基、任选被卤素取代的c
1-6
烷基或氰基,r2、r3、m、n的定义如上所述。
[0036]
在一些实施方案中,式(i)化合物中r1选自cl、och3、ocd3、cn、oh、ocf3,r2、r3、m、n的定义如上所述。
[0037]
在一些实施方案中,式(i)化合物中,
[0038]
每个r1各自独立地选自氘、任选被卤素取代的c
1-6
烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、c
1-6
烷氧基、c
1-6
烷硫基;
[0039]
r2选自c
1-c6烷基、c
2-c6烯基、c
6-c
10
芳基:
[0040]
所述烷基任选被c
6-c
10
芳基或-nr
irj
取代,ri和rj可独立地选自氢或-c(=nh)-nh2,
[0041]
所述c
6-c
10
芳基任选被羟基和/或c
1-c6烷氧基取代,或者所述芳基任选被5-7元杂环基取代,所述5-7元杂环基任选被氧代和/或c
1-c6烷基取代;
[0042]
所述c
2-c6烯基任选被c
6-c
10
芳基取代,所述c
6-c
10
芳基任选被羟基和/或c
1-c6烷氧基取代;
[0043]
r3各自独立地选自氘、任选被卤素取代的c
1-6
烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、c
1-6
烷氧基、烷硫基;
[0044]ri
和rj可独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0045]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基可进一步被芳基、杂芳基、杂环基、环烷基、烷基、烷氧基所取代;
[0046]
m选自0-5的整数;
[0047]
n选自0-10的整数。
[0048]
在一些实施方案中,式(i)化合物中,
[0049]
r1选自卤素、c
1-6
烷氧基、任选被卤素取代的c
1-6
烷基或氰基,
[0050]
r2选自c
1-6
烷基、c
2-c6烯基、c
6-c
10
芳基:
[0051]
所述烷基任选被芳基或-nr
irj
取代,ri和rj可独立地选自氢或-c(=nh)-nh2,所述芳基任选的被羟基和/或烷氧基取代,
[0052]
所述烯基任选被芳基取代,所述芳基任选被羟基和/或烷氧基取代,
[0053]
所述芳基任选被杂环基取代,所述杂环基任选被氧代和/或烷基取代;
[0054]
n为0;
[0055]
m选自0-5的整数。
[0056]
在一些实施方案中,式(i)化合物中,
[0057]
每个r1各自独立地选自氘、任选被卤素取代的烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、烷氧基、烷硫基;
[0058]
r3各自独立地选自氘、任选被卤素取代的烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、烷氧基、烷硫基;
[0059]ri
和rj可独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0060]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基可进一步被芳基、杂芳基、杂环基、环烷基、烷基、烷氧基所取代;
[0061]
m选自0-5的整数;
[0062]
n选自0-10的整数;
[0063]
r2选自
[0064]
在一些实施方案中,式(i)化合物中,n为0,
[0065]
r1各自独立地选自氘、任选被卤素取代的烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、烷氧基、烷硫基;
[0066]
r2选自烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基,所述烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基任选进一步被选自氘、烷基、卤代烷基、卤素、羟基、氧代、巯基、-nr
irj
、-c(o)rk、-c(o)ork、-sri、-s(o)ri、-so2ri、硝基、氰基、任选被羟基或烷氧基取代的芳基、任选被氧代或烷基取代的杂芳基、任选被氧代或烷基取代的杂环基、任选被氧代或烷基取代的环烷基、任选被取代的烯基、任选被取代的炔基、烷氧基、烷硫基的一个或多个基团所取代;
[0067]ri
和rj可独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0068]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基可进一步被选自芳基、杂芳基、杂环基、环烷基、烷基、烷氧基的一个或多个基团所取代;
[0069]
m选自0-5的整数;
[0070]
并且r2不是
[0071]
在一些实施方案中,式(i)化合物中,
[0072]
n为0,
[0073]
r1选自卤素、烷氧基、任选被卤素取代的烷基、或氰基,
[0074]
r2选自烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基,所述烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基任选进一步被选自氘、烷基、卤代烷基、卤素、羟基、氧代、巯基、-nr
irj
、-c(o)rk、-c(o)ork、-sri、-s(o)ri、-so2ri、硝基、氰基、任选被羟基或烷氧基取代的芳基、任选被氧代或烷基取代的杂芳基、任选被氧代或烷基取代的杂环基、任选被氧代或烷基取代的环烷基、任选被取代的亚烯基、任选被取代的亚炔基、烷氧基、烷
硫基的一个或多个基团所取代;
[0075]ri
和rj可独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0076]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基可进一步被选自芳基、杂芳基、杂环基、环烷基、烷基、烷氧基的一个或多个基团所取代;
[0077]
m选自0-5的整数;
[0078]
并且r2不是
[0079]
在一些实施方案中,式(i)化合物中,
[0080]
n为0,
[0081]
r1选自cl、och3、cn、oh、ocf3,
[0082]
r2选自烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基,所述烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基任选进一步被选自氘、烷基、卤代烷基、卤素、羟基、氧代、巯基、-nr
irj
、-c(o)rk、-c(o)ork、-sri、-s(o)ri、-so2ri、硝基、氰基、任选被羟基或烷氧基取代的芳基、任选被氧代或烷基取代的杂芳基、任选被氧代或烷基取代的杂环基、任选被氧代或烷基取代的环烷基、任选被取代的亚烯基、任选被取代的亚炔基、烷氧基、烷硫基的一个或多个基团所取代;
[0083]ri
和rj可独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0084]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基可进一步被芳基、杂芳基、杂环基、环烷基、烷基、烷氧基所取代;
[0085]
m选自0-5的整数;
[0086]
并且r2不是
[0087]
在一些实施方案中,式(i)化合物中,
[0088]
n为0,
[0089]
每一个r1各自独立地选自氘、任选被卤素取代的烷基、卤素、羟基、巯基、-nr
irj
、-c(o)rk、-c(o)ork、硝基、氰基、烷氧基、烷硫基;
[0090]
r2选自
[0091]ri
和rj可独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0092]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基可进一步被选自芳基、杂芳基、杂环基、环烷基、烷基、烷氧基的一个或多个基团所取代;
[0093]
m选自0-5的整数。
[0094]
在一些实施方案中,式(i)化合物中,
[0095]
r1选自卤素、烷氧基、任选被卤素取代的烷基或氰基,
[0096]
r2选自
[0097]
n为0;
[0098]
m选自0-5的整数。
[0099]
在一些实施方案中,式(i)化合物中,
[0100]
r1选自cl、och3、cn、oh、ocf3,
[0101]
r2选自
[0102]
n为0,
[0103]
m选自0-5的整数。
[0104]
式(i-1)化合物、或其可药用盐,
[0105][0106]
其中,
[0107]
r2选自烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基,所述烷基、烷氧基、烯基、炔基、芳基、杂芳基、环烷基、杂环基任选进一步被选自氘、烷基、卤代烷基、卤素、羟基、氧代、巯基、-nr
irj
、-c(o)rk、-c(o)ork、-sri、-s(o)ri、-so2ri、硝基、氰基、任选被羟基和/或烷氧基取代的芳基、任选被氧代和/或烷基取代的杂芳基、任选被氧代和/或烷基取代的杂环基、任选被氧代和/或烷基取代的环烷基、任选被取代的亚烯基、任选被取代的亚炔基、烷氧基、烷硫基的一个或多个基团所取代;
[0108]ri
和rj可独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0109]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基可进一步被选自芳基、杂芳基、杂环基、环烷基、烷基、烷氧基的一个或多个基团所取代;
[0110]
并且r2不是
[0111]
在一些实施方案中,式(i-1)化合物中,r2选自烷基、烯基、芳基,
[0112]
所述烷基任选被芳基或-nr
irj
取代,ri和rj可独立地选自氢或-c(=nh)-nh2,
[0113]
所述芳基任选被羟基和/或烷氧基取代;或者所述芳基任选被杂环基取代,所述杂环基任选被氧代和/或烷基取代,
[0114]
所述烯基任选被芳基取代,所述芳基任选被羟基和/或烷氧基取代。
[0115]
在一些实施方案中,式(i-1)化合物中,r2选自c
1-20
烷基、c
1-20
烷氧基、c
2-12
烯基、c2-12
炔基、6-14元芳基、5-14元杂芳基、3-15元环烷基、3-20元杂环基,
[0116]
所述c
1-20
烷基优选c
1-12
烷基,更优选c
1-6
烷基,
[0117]
所述c
1-20
烷氧基优选c
1-12
烷氧基,更优选c
1-6
烷氧基,
[0118]
所述c
2-12
烯基优选c
2-6
烯基,
[0119]
所述6-14元芳基优选6-12元芳基,更优选苯基或萘基,
[0120]
所述5-14元杂芳基优选6-12元杂芳基,更优选5元或6元杂芳基,
[0121]
所述3-15元环烷基优选3-10元环烷基,更优选5-7元环烷基,
[0122]
所述3-20元杂环基优选3-12元杂环基,更优选3-8元杂环基,
[0123]
所述的c
1-20
烷基、c
1-20
烷氧基、c
2-12
烯基、c
2-12
炔基、6-14元芳基、5-14元杂芳基、3-15元环烷基、3-20元杂环基任选进一步被选自氘、烷基、卤代烷基、卤素、羟基、氧代、巯基、-nr
irj
、-c(o)rk、-c(o)ork、-sri、-s(o)ri、-so2ri、硝基、氰基、任选被羟基或烷氧基取代的芳基、任选被氧代或烷基取代的杂芳基、任选被氧代或烷基取代的杂环基、任选被氧代或烷基取代的环烷基、任选被取代的亚烯基、任选被取代的亚炔基、烷氧基、烷硫基的一个或多个基团所取代;
[0124]ri
和rj可独立地选自氢、羟基、烷基、环烷基、烷氧基、-c(=nh)-nh2;
[0125]rk
选自烷基、烷氧基、芳基、烯基、炔基,所述烷基、烷氧基、芳基、烯基、炔基可进一步被选自芳基、杂芳基、杂环基、环烷基、烷基、烷氧基的一个或多个基团所取代;
[0126]
并且r2不是
[0127]
本公开还提供如下化合物、或其可药用盐在制备用于治疗或预防神经退行性疾病的药物中的用途,
[0128][0129]
在一些实施方案中,所述神经退行性疾病选自多发性硬化(ms),帕金森病,阿尔茨海默病,肌萎缩侧面硬化(als),优选帕金森病。
[0130]
本公开还涉及一种治疗神经退行性疾病的方法,包括向患者给予本公开所述的化合物或其可药用盐。
[0131]
本公开还涉及一种用于治疗神经退行性疾病的化合物,所述化合物为本公开所述化合物。
[0132]
本公开还涉及一种药物组合物在制备用于治疗或预防神经退行性疾病的药物中的用途,所述药物组合物包含本公开所述的化合物或其可药用盐。一般来说,所述组合物还包含至少一种药学上可接受的载体、稀释剂或者赋形剂。
[0133]
在某些实施方式中,所述的药物组合物的单位剂量为0.001mg-1000mg。
[0134]
在某些实施方式中,基于组合物的总重量,所述的药物组合物含有0.01%-99.99%的前述化合物。在某些实施方式中,所述的药物组合物含有0.1%-99.9%的前述化合物。在某些实施方式中,所述的药物组合物含有0.5%-99.5%的前述化合物。在某些实施方式中,所述的药物组合物含有1%-99%的前述化合物。在某些实施方式中,所述的药物组合物含有2%-98%的前述化合物。
[0135]
在某些实施方式中,基于组合物的总重量,所述的药物组合物含有0.01%-99.99%的药学上可接受的载体、稀释剂或赋形剂。在某些实施方式中,所述的药物组合物含有0.1%-99.9%的药学上可接受的载体、稀释剂或赋形剂。在某些实施方式中,所述的药物组合物含有0.5%-99.5%的药学上可接受的载体、稀释剂或赋形剂。在某些实施方式中,所述的药物组合物含有1%-99%的药学上可接受的载体、稀释剂或赋形剂。在某些实施方式中,所述的药物组合物含有2%-98%的药学上可接受的载体、稀释剂或赋形剂。
[0136]
以治疗有效的量给予本文公开的磺酰脲类衍生物或其药物可接受的盐,其根据包括所使用的具体化合物的活性,化合物的代谢稳定性和作用长短、患者的年龄、体重、健康状况、性别和饮食,排泄速度,药物组合,特殊的病症或疾病状态的严重程度以及受治疗的个体的多种因素而变化。
[0137]
本公开的化合物或其可药用盐可制成适合口服、颊面、阴道、直肠、经由吸入、经由吹入、鼻内、舌下、局部或肠胃外(例如肌内、皮下、腹膜内、胸内、静脉内、硬膜外、鞘内、侧脑室内或通过注射到关节内)施用的剂型。
[0138]
术语“治疗”指为预防和/或治疗目的而给予药物组合物。对于“预防疾病”指预防性治疗尚未得病,但对特定疾病易感,或者面临特定疾病风险的受试者。对于“治疗疾病”指对已经罹患疾病的患者进行治疗以改善或稳定患者的病症。
[0139]
本公开所述化合物或其可药用盐的任何同位素标记的(或“放射性标记的”)衍生物都被本公开所覆盖。这种衍生物是其中一个或多个原子被原子质量或质量数不同于通常在自然界中所发现的原子质量或质量数的原子置换。可以被掺入的放射性核素的实例包括2h(也被写成“d”,即氘)、3h(也被写成“t”,即氚)、
11
c、
13
c、
14
c、
13
n、
15
n、
15
o、
17
o、
18
o、
18
f、
36
cl、
82
br、
75
br、
76
br、
77
br、
123
i、
124
i、
125
i、
31
p、
32
p、
35
s、以及
131
i。所使用的放射性核素将取决于该放射性标记的衍生物的具体应用。举例来说,对于体外受体标记和竞争测定,3h或
14
c常常是有用的。对于放射成像应用,
11
c或
18
f常常是有用的。在一些实施方案中,放射性核素是3h。在一些实施方案中,放射性核素是
14
c。在一些实施方案中,放射性核素是
11
c。并且在一些实施方案中,放射性核素是
18
f。
[0140]
除非有相反陈述,否则下列用在说明书和权利要求书中的术语具有下述含义。
[0141]“可接受的载体、稀释剂或赋形剂”包括但不限于任何已经被美国食品和药物管理局批准对于人类或家畜动物使用可接受的任何助剂、载体、赋形剂、助流剂、甜味剂、稀释
剂、防腐剂、染料/着色剂、增香剂、表面活性剂、润湿剂、分散剂、助悬剂、稳定剂、等渗剂、溶剂或乳化剂。
[0142]
术语“烷基”指饱和的脂族烃基团,包括1至20个碳原子的直链和支链基团。优选含有1至12个碳原子的烷基,更优选含有1至6个碳原子的烷基。非限制性实施例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,1-二甲基丙基、1,2-二甲基丙基、2,2-二甲基丙基、1-乙基丙基、2-甲基丁基、3-甲基丁基,及其各种支链异构体等。烷基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,优选为一个或多个以下基团,独立地选自芳基、杂芳基、卤素所取代。
[0143]
术语“烯基”包括具有2至12个碳原子的支链和直链烯烃或含有脂族烃基团的烯烃。例如“c
2-6
烯基”表示具有2、3、4、5或6个碳原子的烯基。烯基的实例包括但不限于,乙烯基、烯丙基、1-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、2-甲基丁-2-烯基、3-甲基丁-1-烯基、1-戊烯基、3-戊烯基及4-己烯基。
[0144]
术语“炔基”包括具有2至12个碳原子的支链和直链炔基或含有脂族烃基的烯烃,或若规定指定碳原子数,则意指该特定数目。例如乙炔基、丙炔基(例如1-丙炔基、2-丙炔基)、3-丁炔基、戊炔基、己炔基及1-甲基戊-2-炔基。
[0145]
术语“环烷基”指饱和或部分不饱和单环或多环环状烃取代基,环烷基环包含3至20个碳原子,优选包含3至12个碳原子,更优选包含3至6个碳原子。单环环烷基的非限制性实例包括环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环己二烯基、环庚基、环庚三烯基、环辛基等;多环环烷基包括螺环、稠环和桥环的环烷基。所述环烷基环可以稠合于芳基、杂芳基或杂环烷基环上,其中与母体结构连接在一起的环为环烷基,非限制性实例包括茚满基、四氢萘基、苯并环庚烷基等。环烷基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代基、羧基或羧酸酯基。
[0146]
术语“杂环基”指饱和或部分不饱和单环或多环环状烃取代基,其包含3至20个环原子,其中一个或多个环原子为选自氮、氧或s(o)m(其中m是整数0至2)的杂原子,但不包括―o―o―、―o―s―或―s―s―的环部分,其余环原子为碳。优选包含3至12个环原子,其中1~4个是杂原子;更优选包含3至8个环原子。单环杂环基的非限制性实例包括吡咯烷基、咪唑烷基、四氢呋喃基、四氢噻吩基、二氢咪唑基、二氢呋喃基、二氢吡唑基、二氢吡咯基、哌啶基、哌嗪基、吗啉基、硫代吗啉基、高哌嗪基等。多环杂环基包括螺环、稠环和桥环的杂环基。“杂环基”非限制性实例包括:
[0147]
[0148]
等。
[0149]
所述杂环基环可以稠合于芳基、杂芳基或环烷基环上,其中与母体结构连接在一起的环为杂环基,其非限制性实例包括:
[0150]
等。
[0151]
杂环烷基的环碳原子可以被氧代(官能化为羰基)。这种杂环烷基的示例性实例是:
[0152]
杂环基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、氧代基、羧基或羧酸酯基。
[0153]
术语“芳基”指具有共轭的π电子体系的6至14元全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,优选为6至12元,例如苯基和萘基。所述芳基环可以稠合于杂芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为芳基环,其非限制性实例包括:
[0154][0155]
芳基可以是取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基,优选苯基。
[0156]
术语“杂芳基”指包含1至4个杂原子、5至14个环原子的杂芳族体系,其中杂原子选自氧、硫和氮。杂芳基优选为6至12元,更优选为5元或6元。例如。其非限制性实例包括:咪唑基、呋喃基、噻吩基、噻唑基、吡唑基、噁唑基、吡咯基、四唑基、吡啶基、嘧啶基、吡嗪,噻二唑等等。
[0157]
所述杂芳基环可以稠合于芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为杂芳基环,其非限制性实例包括:
[0158][0159]
杂芳基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、氧代、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0160]
术语“烷氧基”指―o―(烷基)和―o―(非取代的环烷基),其中烷基的定义如上所述。烷氧基的非限制性实例包括:甲氧基、乙氧基、丙氧基、丁氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基。烷氧基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基、羧基或羧酸酯基。
[0161]
术语“羟烷基”指被羟基取代的烷基,其中烷基如上所定义。
[0162]
术语“卤代烷基”指被卤素取代的烷基,其中烷基如上所定义。
[0163]
术语“卤代芳基”指被卤素取代的芳基,其中芳基如上所定义。
[0164]
术语“卤代杂芳基”指被卤素取代的杂芳基,其中杂芳基如上所定义。
[0165]
术语“卤代杂环基”指被卤素取代的杂环基,其中杂环基如上所定义。
[0166]
术语“卤代环烷基”指被卤素取代的环基,其中环烷基如上所定义。
[0167]
术语“羟基”指-oh基团。
[0168]
术语“巯基”指-sh基团。
[0169]
术语“烷硫基”是指-s-烷基,例如-s-ch3、-s-ch
2-ch3等。
[0170]
术语“卤素”指氟、氯、溴或碘。
[0171]
术语“氨基”指-nh2。
[0172]
术语“氰基”指-cn。
[0173]
术语“硝基”指-no2。
[0174]
术语“氧代”指=o取代基。
[0175]“任选的”或“任选”是指意味着随后所描述的事件或环境可以但不必发生,该说明包括该事件或环境发生或不发生的场合。例如“任选的被卤素或者氰基取代的c
1-c6烷基”是指卤素或者氰基可以但不必须存在,该说明包括烷基被卤素或者氰基取代的情形和烷基不被卤素和氰基取代的情形。
[0176]“取代的”指基团中的一个或多个氢原子,优选为最多5个,更优选为1~3个氢原子彼此独立地被相应数目的取代基取代。不言而喻,取代基仅处在它们的可能的化学位置,本领域技术人员能够在不付出过多努力的情况下确定(通过实验或理论)可能或不可能的取代。
[0177]
本公开所述化合物的化学结构中,键并未指定构型,即键可以为
或或者同时包含和两种构型。本公开所述化合物的化学结构中,键并未指定构型,即可以为z构型或e构型,或者同时包含两种构型。
[0178]
虽然为简便起见将全部上述结构式画成某些异构体形式,但是本公开可以包括所有的异构体,如互变异构体、旋转异构体、几何异构体、非对映异构体、外消旋体和对映异构体。
[0179]
互变异构体是有机化合物的结构异构体,通过被称为互变异构化的化学反应容易相互转化。这种反应常导致氢原子或质子的形式迁移,伴随着单键和邻近的双键的转换。一些常见的互变异构对为:酮-烯醇、内酰胺-内酰亚胺。内酰胺-内酰亚胺平衡实例是在如下所示的a和b之间。
[0180][0181]
本公开中的所有化合物可以被画成a型或b型。所有的互变异构形式在本公开的范围内。化合物的命名不排除任何互变异构体。
[0182]
本公开所述化合物或其可药用盐的任何同位素标记的衍生物都被本公开所覆盖。能够被同位素标记的原子包括但不限于氢、碳、氮、氧、磷、氟、氯、碘等。它们可分别被同位素同位素2h(d)、3h、
11
c、
13
c、
14
c、
15
n、
18
f、
31
p、
32
p、
35
s、
36
cl和
125
i等代替。除另有说明,当一个位置被特别地指定为氘(d)时,该位置应理解为具有大于氘的天然丰度(其为0.015%)至少3000倍的丰度的氘(即,至少45%的氘掺入)。
[0183]“治疗有效量”指产生它为了其施用的所需效应的治疗剂的量。在一些实施方式中,该术语指当根据方案施用于患有或易患疾病、病症和/或状况的群体时,足以治疗所述疾病、病症和/或状况的量。在一些实施方式中,治疗有效量是降低疾病、病症和/或状况的一种或多种症状的发生率和/或严重性,和/或延迟其发作的量。本领域普通技术人员将了解,术语“治疗有效量”实际上不需要实现在特定个体中的成功治疗。相反,治疗有效量可以是当施用于需要此类治疗的患者时,在大量受试者中提供特定的所需药理学应答的量。在一些实施方式中,提及治疗有效量可以指如在一种或多种特定组织(例如,受疾病、病症或状况影响的组织)或流体(例如,血液、唾液、血清、汗液、泪、尿等)中测量的量。本领域普通技术人员将了解,在一些实施方式中,治疗有效量的特定试剂或疗法可以以单一剂量配制和/或施用。在一些实施方式中,治疗有效试剂可以以多个剂量配制和/或施用,例如,作为方案的部分。
附图说明
[0184]
图1为化合物7可逆转体外a-syn oligomer引起的大鼠脑片黑质区神经元动作电位频率降低;
[0185]
图2为化合物7对体外大鼠脑片黑质区多巴胺神经元动作电位的其他参数无影响。
具体实施方式
[0186]
以下结合实施例进一步描述本公开,但这些实施例并非限制本公开的范围。
[0187]
本公开实施例中未注明具体条件的实验方法,通常按照常规条件,或按照原料或商品制造厂商所建议的条件。未注明具体来源的试剂,为市场购买的常规试剂。
[0188]
nmr位移(δ)以10-6
(ppm)的单位给出。nmr的测定是用bruker avance-400核磁仪,测定溶剂为氘代二甲基亚砜(dmso-d6),氘代氯仿(cdcl3),氘代甲醇(cd3od),内标为四甲基硅烷(tms)。
[0189]
ms的测定用shimadzu 2010mass spectrometer或agilent 6110a msd质谱仪。
[0190]
高效液相色谱法(hplc)的测定使用shimadzu lc-20a systems、shimadzu lc-2010ht series或安捷伦agilent 1200lc高压液相色谱仪(ultimate xb-c18 3.0*150mm色谱柱或xtimate c18 2.1*30mm色谱柱)。
[0191]
手性hplc分析测定使用的色谱柱:chiralpak ic-3 100
×
4.6mm i.d.,3um,chiralpak ad-3 150
×
4.6mm i.d.,3um,chiralpak ad-3 50
×
4.6mm i.d.,3um,chiralpak as-3150
×
4.6mm i.d.,3um,chiralpak as-3 100
×
4.6mm i.d.,3μm,chiralcel od-3 150
×
4.6mm i.d.,3um,chiralcel od-3 100
×
4.6mm i.d.,3μm,chiralcel oj-h 150
×
4.6mm i.d.,5um,chiralcel oj-3 150
×
4.6mm i.d.,3um。
[0192]
薄层层析硅胶板使用烟台黄海hsgf254或青岛gf254硅胶板,薄层色谱法(tlc)使用的硅胶板采用的规格是0.15mm~0.2mm,薄层层析分离纯化产品采用的规格是0.4mm~0.5mm。
[0193]
柱层析一般使用烟台黄海硅胶100~200目、200~300目或300~400目硅胶为载体。
[0194]
手性制备柱使用daicel chiralpak ic(250mm*30mm,10um)或phenomenex-amylose-1(250mm*30mm,5um)。
[0195]
combiflash快速制备仪使用combiflash rf150(teledyne isco)。
[0196]
激酶平均抑制率及ic
50
值的测定用novostar酶标仪(德国bmg公司)。
[0197]
本公开的已知的起始原料可以采用或按照本领域已知的方法来合成,或可购买自abcr gmbh&co.kg、acros organics、aldrich chemical company、韶远化学科技(accela chembio inc)、达瑞化学品等公司。
[0198]
实施例中无特殊说明,反应能够均在氩气氛或氮气氛下进行。
[0199]
氩气氛或氮气氛是指反应瓶连接一个约1l容积的氩气或氮气气球。
[0200]
氢气氛是指反应瓶连接一个约1l容积的氢气气球。
[0201]
加压氢化反应使用parr 3916ekx型氢化仪和清蓝ql-500型氢气发生器或hc2-ss型氢化仪。
[0202]
氢化反应通常抽真空,充入氢气,反复操作3次。
[0203]
微波反应使用cem discover-s 908860型微波反应器。
[0204]
实施例中无特殊说明,溶液是指水溶液。
[0205]
实施例中无特殊说明,反应的温度为室温,为20℃~30℃。
[0206]
实施例中的反应进程的监测采用薄层色谱法(tlc),反应所使用的展开剂,纯化化合物采用的柱层析的洗脱剂的体系和薄层色谱法的展开剂体系包括:a:二氯甲烷/甲醇体
系,b:正己烷/乙酸乙酯体系,c:石油醚/乙酸乙酯体系,d:石油醚/乙酸乙酯/甲醇,溶剂的体积比根据化合物的极性不同而进行调节,也可以加入少量的三乙胺和醋酸等碱性或酸性试剂进行调节。
[0207]
下述实验中所用缩写代表的含义如下:
[0208]
etoac:乙酸乙酯;dcm:二氯甲烷;dipea:n,n-二异丙基乙胺;ppts:对甲基苯磺酸吡啶盐;boc:叔丁氧羰基,meoh:甲醇。
[0209]
实施例1:5-氯-n-(4-(n-(环己基氨甲酰基)氨磺酰基)苯乙基)-2-羟基苯甲酰胺的制备
[0210][0211]
在50ml反应瓶中,氮气氛下加入化合物1-1(986mg,2mmol,购自cadila pharmaceuticals limited)和dcm(10ml)。将混合物搅拌并冰浴冷却至0℃,缓慢滴加bbr3的dcm(3ml,3mmol)溶液,滴加时间约10分钟。保持冰浴下搅拌30分钟。撤去冰浴,自然升至室温,搅拌过夜。冰浴下滴加入甲醇(2ml)淬灭反应。减压浓缩溶剂。残余物经柱层析色谱法纯化,得到化合物1(560mg,纯度99.08%),收率为58.4%。
[0212]1hnmr(d
6-dmso,400mhz)δ1.06~1.30(m,5h),1.47~1.65(m,5h),2.96(t,j=6.4hz,2h),3.32(bs,1h),3.55~3.58(m,2h),6.33(d,j=7.6hz,1h),6.93(d,j=8.8hz,1h),7.42~7.49(m,3h),7.81~7.89(m,3h),8.96(s,1h),10.31(bs,1h),12.46(bs,1h)。
[0213]
实施例2:5-氯-n-(4-(n-(环己基氨甲酰基)氨磺酰基)苯乙基)-2-(甲氧基-d3)苯甲酰胺(2)的制备
[0214][0215]
步骤1:甲基-d3 5-氯-2-(甲氧基-d3)苯甲酸酯(2-2)的制备
[0216]
室温,氮气氛下,在100ml反应瓶中,加入5-氯-2-羟基苯甲酸(2-1)(5.18g,30.0mmol)、碘甲烷(7.5ml,75.0mmol)、碳酸钾(8.4g,61.0mmol)、dmf(15ml)。升至60℃,搅拌约20小时。lcms监控显示反应完全。向反应液中加入水(50ml)和甲基叔丁基醚(100ml),水相用甲基叔丁基醚萃取(2
×
100ml),合并有机相,无水硫酸钠干燥,过滤,减压浓缩。残余物溶于甲苯(50ml)中,用5%的氢氧化钠溶液洗涤(30ml),有机相用无水硫酸钠干燥,过滤,减压浓缩,得6.20g粗品2-2,直接用于下一步反应。
[0217]
步骤2:5-氯-2-(甲氧基-d3)苯甲酸(2-3)的制备
[0218]
于室温,在100ml烧瓶中,加入化合物2-2(6.20g,30mmol)、乙醇(30ml)和30ml的10%的氢氧化钠溶液。将混合物升温至回流并搅拌2小时。监控到反应基本完全,冷却至室温。减压浓缩除去乙醇。向所得水溶液中加入5%的稀盐酸(60ml)形成悬浊液,搅拌1小时,过滤,固体真空干燥得5.5g类白色固体粗产品2-3,两步收率为96.7%,纯度:97%。
[0219]
步骤3:5-氯-2-(甲氧基-d3)-n-(4-氨磺酰基苯乙基)苯甲酰胺(2-5)的制备
[0220]
在50ml反应瓶中,氮气氛下,加入化合物2-3(3.79g,20.0mmol)、4-(2-氨基乙基)苯磺酰胺(2-4)(4.01g,20.0mmol)、mecn(15ml)。将混合物搅拌并用冰浴冷却。加入吡啶(2.5ml,40.0mmol)、edci(3.84g,20.0mmol),保持冰浴下搅拌30分钟,撤去冰浴,自然升至室温,搅拌过夜。反应液减压浓缩,室温加入水(400ml),搅拌15分钟。过滤,收集固体,干燥得到类白色固体2-5(6.2g),不用纯化直接用于下一步反应,收率为83%,纯度:99%。
[0221]
步骤4:5-氯-n-(4-(n-(环己基氨甲酰基)氨磺酰基)苯乙基)-2-(甲氧基-d3)苯甲酰胺(2)的制备
[0222]
将化合物2-5(2.23g,6.0mmol)和环己基异氰酸酯(2-6)(1.28g,10.2mmol)加入到16ml的dmf中溶解。然后将该混合物冰水浴冷却,缓慢滴加叔丁醇钾溶液(7.8ml,7.8mmol,1m在thf中)约5分钟。滴加完毕后升至室温,搅拌过夜。加入水(50ml),悬浊液继续搅拌约10分钟。收集所得物质,经hplc制备得1.9g化合物2,收率为63.8%,纯度:99.6%。
[0223]1hnmr(d
6-dmso,400mhz)δ1.07~1.23(m,5h),1.46~1.65(m,5h),2.93(t,j=
6.4hz,2h),3.28(bs,1h),3.54~3.57(m,2h),6.33(d,j=7.6hz,1h),7.14(d,j=8.8hz,1h),7.45~7.64(m,4h),7.84(d,j=8.0hz,2h),8.27(s,1h),10.31(bs,1h)。
[0224]
实施例3:5-氯-n-(4-(n-(环己基氨甲酰基)氨磺酰基)苯乙基)-2-(三氟甲氧基)苯甲酰胺(3)的制备
[0225][0226]
步骤1:5-氯-n-(4-氨磺酰基苯乙基)-2-(三氟甲氧基)苯甲酰胺(3-2)的制备
[0227]
在50ml反应瓶中,氮气氛下,加入5-氯-2-(三氟甲氧基)苯甲酸(3-1)(288.7mg,1.2mmol)、4-(2-氨基乙基)苯磺酰胺(2-4)(240.3mg,1.2mmol)、mecn(2ml)。将混合物搅拌并用冰浴冷却;加入吡啶(0.2ml,2.4mmol)和edci(230mg,1.2mmol),保持冰浴下搅拌30分钟,撤去冰浴,自然升至室温,搅拌过夜。反应液减压浓缩,残余物经过柱层析色谱法纯化得到类白色固体化合物3-2(280mg),收率55%,纯度98.8%。
[0228]
步骤2:5-氯-n-(4-(n-(环己基氨甲酰基)氨磺酰基)苯乙基)-2-(三氟甲氧基)苯甲酰胺(3)的制备
[0229]
将化合物3-2(280mg,6.0mmol)和环己基异氰酸酯(2-6)(140mg,1.12mmol)加入到2.5ml的dmf中溶解。然后将该混合物冰水浴冷却,缓慢滴加叔丁醇钾溶液(0.86ml,0.86mmol,1m在thf中)约5分钟。滴加完毕后升至室温,搅拌过夜。加入水(5ml),无固体析出,用乙酸乙酯萃取(3
×
10ml),合并有机相,无水硫酸钠干燥,过滤,滤液减压浓缩。残余物经hplc制备得240mg化合物3,收率66.4%,纯度:99.69%。
[0230]1hnmr(d
6-dmso,400mhz)δ1.05~1.25(m,5h),1.46~1.66(m,5h),2.91(t,j=6.4hz,2h),3.32(bs,1h),3.48~3.52(m,2h),6.33(d,j=7.6hz,1h),7.46~7.55(m,4h),7.64(d,j=8.8hz,1h),7.82(d,j=8.0hz,2h),8.67(s,1h),10.31(bs,1h)。
[0231]
实施例4:5-氯-n-(4-(n-(((1r,4r)-4-羟基环己基)氨甲酰基)氨磺酰基)苯乙基)-2-甲氧基苯甲酰胺(4)的制备
[0232][0233]
将(1r,4r)-4-氨基环己-1-醇(4-2)(250mg,2.2mmol)和((4-(2-(5-氯-2-甲氧基苯甲酰胺基)乙基)苯基)磺酰基)氨基甲酸乙酯(4-1)(880mg,2.0mmol,根据文献方法(bioorganic&medicinal chemistry,2003,11,2099
–
2113)合成得到)加入到30ml甲苯中,然后该混合物升高温度至回流,搅拌约3小时。冷却至室温,减压浓缩。残余物经hplc制备得420mg化合物4,收率为41.2%,纯度:98.85%。
[0234]1hnmr(d
6-dmso,400mhz)δ1.02~1.24(m,4h),1.66~1.76(m,4h),2.08(s,1h),2.94(t,j=6.4hz,2h),3.22(bs,1h),3.54~3.57(m,2h),3.80(s,3h),4.52(bs,1h),6.30(d,j=6.0hz,1h),7.15(d,j=8.4hz,1h),7.47~7.51(m,3h),7.65(s,1h),7.85(d,j=7.2hz,2h),8.28(s,1h),10.35(bs,1h)。
[0235]
实施例5:5-氯-n-(4-(n-((环己基-4,4-d2)氨甲酰基)氨磺酰基)苯乙基)-2-甲氧基苯甲酰胺(5)的制备
[0236][0237]
将((4-(2-(5-氯-2-甲氧基苯甲酰胺基)乙基)苯基)磺酰基)氨基甲酸乙酯(4-1)(137mg,1.36mmol)和环己-4,4-d2-1-胺(5-1)(500mg,1.13mmol)加入到30ml甲苯中,然后该混合物升高温度至回流,搅拌约6小时。将反应液冷却至室温,减压浓缩。残余物经hplc制备得380mg化合物5,收率为67.9%,hplc纯度:100%。
[0238]1hnmr(d
6-dmso,400mhz)δ1.04~1.23(m,4h),1.54~1.66(m,4h),2.93(t,j=6.4hz,2h),3.28(bs,1h),3.53~3.56(m,2h),3.79(s,3h),6.33(d,j=6.4hz,1h),7.15(d,j=8.8hz,1h),7.46~7.50(m,3h),7.63(s,1h),7.84(d,j=7.6hz,2h),8.27(bs,1h),10.31(bs,1h)。
[0239]
实施例6:5-氯-n-(4-(n-(((1r,2r)-2-氰基环己基)氨甲酰基)氨磺酰基)苯乙
基)-2-甲氧基苯甲酰胺(6)的制备
[0240][0241]
将(1r,2r)-2-氨基环己-1-甲腈(6-1)(0.1g,0.80mmol)溶于干燥的甲苯(4ml)中,加入((4-(2-(5-氯-2-甲氧基苯甲酰胺基)乙基)苯基)磺酰基)氨基甲酸乙酯(4-1)(0.44g,0.96mmol),在120℃回流反应4小时。反应液冷却至室温,减压除去溶剂,残余物经过pre-hplc制备得到43mg化合物6,hplc纯度:96.6%,收率10%。
[0242]1hnmr(d6-dmso,400mhz)δ1.03~1.24(m,3h),1.45~1.58(m,4h),1.95~1.99(m,1h),2.80(t,j=6.4hz,1h),2.92(t,j=6.4hz,2h),3.52~3.56(m,3h),3.79(s,3h),6.79(d,j=7.6hz,1h),7.15(d,j=8.8hz,1h),7.44~7.51(m,3h),7.64(s,1h),7.84(d,j=7.2hz,2h),8.26(bs,1h),10.93(bs,1h)。
[0243]
实施例7:5-氰基-n-(4-(n-(环己基氨甲酰基)氨磺酰基)苯乙基)-2-甲氧基苯甲酰胺(7)的制备
[0244][0245]
步骤1:5-氰基-2-甲氧基-n-(4-氨磺酰基苯乙基)苯甲酰胺(7-2)的制备
[0246]
在25ml反应瓶中,氮气氛下,加入5-氰基-2-甲氧基苯甲酸(7-1)(500mg,2.82mmol)、4-(2-氨基乙基)苯磺酰胺(2-4)(565.8mg,2.82mmol)、mecn(2.8ml)。将混合物搅拌并用冰浴冷却,加入吡啶(697mg,8.81mmol)、edci(541mg,2.82mmol),保持冰浴下搅拌30分钟。撤去冰浴,自然升至室温,搅拌过夜。反应液减压浓缩,加入水(2.5ml),搅拌30分
钟,过滤,收集固体,干燥,得到类白色固体化合物7-2(934mg),不用纯化直接用于下一步反应,反应收率为92%。
[0247]
步骤2:5-氰基-n-(4-(n-(环己基氨甲酰基)氨磺酰基)苯乙基)-2-甲氧基苯甲酰胺(7)的制备
[0248]
于室温,在25ml烧瓶中,氮气氛下,加入化合物7-2(567mg,1.578mmol)、环己基异氰酸酯(2-6)(316mg,2.525mmol)、dmf(5ml)。将混合物搅拌溶解并用冰浴冷却,滴加kotbu的thf(2.4ml,2.4mmol)溶液,保持冰浴下搅拌10分钟,撤去冰浴,自然升至室温,搅拌过夜。向反应体系中加入水(15ml)稀释,搅拌5分钟,过滤,残余物加入乙酸乙酯稀释,搅拌30分钟,过滤,固体用少量乙酸乙酯洗一次,收集固体,室温下用dcm:meoh=10:1(4ml)打浆搅拌30分钟,过滤,收集固体,得到化合物7(220mg,纯度95.9%),收率为28.8%。
[0249]1hnmr(d
6-dmso,400mhz)δ1.05~1.23(m,5h),1.46~1.65(m,5h),2.93(t,j=6.4hz,2h),3.28(bs,1h),3.52~3.56(m,2h),3.87(s,3h),6.34(d,j=7.6hz,1h),7.30(d,j=8.0hz,1h),7.49(d,j=7.6hz,2h),7.84(d,j=8.0hz,2h),7.92~7.97(m,2h),8.32(bs,1h),10.32(bs,1h)。
[0250]
生物学测试
[0251]
测试例1:本公开化合物的sur1受体结合活性
[0252]
实验仪器提供商型号涡旋混合器ikams3 basic电热恒温培养箱上海一恒dhp-9032微板振动筛vwr12620-928
topcountperkin elmerntxuniversal harvesterperkin elmerunifilter-96
[0253]
反应缓冲液
[0254][0255]
洗液
[0256][0257]
操作步骤:
[0258]
a)向96深孔板每个孔中加入100μl的反应缓冲液。
[0259]
b)每个孔加入5μl稀释后的待测化合物(1%dmso)到96深孔板中。
[0260]
c)每个孔中加入30μl sur1膜蛋白和270μl反应混合液,600rpm震荡5分钟。
[0261]
d)加入100μl反应缓冲液和[3h]-glibenclamide(终浓度为2nm)的混合液到反应体系中,600rpm震荡5分钟,37℃孵育1小时。
[0262]
e)0.5%pei预处理unifilter-96gf/b板,每孔加入150μl的0.5%pei,4℃孵育1小时。
[0263]
f)用universal harvester洗unifilter-96gf/c和unifilter-96gf/b板2次,每次50ml洗液。
[0264]
g)用universal harvester将sur1受体反应体系转移到unifilter-96gf/b板上,每孔加入900μl洗液洗gf/b板4次,洗后的unifilter-96gf/b板放55℃烘箱10min烘干。
[0265]
h)每孔加入40μl ultima gold闪烁液,使用microbeta读数。
[0266]
结果:本公开化合物的sur1受体结合活性如下表1所示。
[0267]
表1本公开化合物的sur1受体结合活性
[0268][0269]
测试例2:sd大鼠静脉注射给予不同化合物的体内药代动力学及脑组织分布研究
[0270]
供试品配制
[0271]
1、准确称取适宜量的化合物1、化合物4、化合物7或格列本脲,加入适宜体积5%dmso+10%solutol+85%生理盐水,搅拌或超声至完全溶解,得到浓度为1mg/ml的澄清溶液,用于静脉注射给药。
[0272]
2、准确称取适宜量的化合物3或化合物6,加入适宜体积5%dmso+20%pg+20%peg400+55%pbs(ph8.0),搅拌或超声至完全溶解,得到浓度为1mg/ml的澄清溶液,用于静脉注射给药。
[0273]
试验动物
[0274]
spf级sd大鼠,来源:动物转移自实验机构动物储备库(999m-017),上海西普尔-必凯实验动物有限公司。
[0275]
试验设计
[0276][0277]
采集时间点
[0278]
3只/时间点,每组前3只采集血液样本,每组后3只采集脑脊液和脑组织。血液样本:给药前及给药后5min、0.25h、0.5h、1h、1.5h、2h、4h、6h、8h、12h、24h。组织:给药后10min采集脑脊液和脑组织。
[0279]
样品采集和处置
[0280]
血液样本:经颈静脉或其它合适方式采血,每个样品采集约0.20ml,edta-k2抗凝,
采集后放置冰上,并于2小时内离心分离血浆(离心条件:离心力6800g,6分钟,2-8℃)。采集的血浆样本在分析前存放于-70℃冰箱内,分析后剩余血浆样本继续存放于-70℃冰箱,将根据委托方要求进行后续处理。
[0281]
组织样本:用于采集组织的动物给药后10min采集脑脊液和脑组织,脑组织用生理盐水分别冲洗,避免交叉污染,滤纸吸干,称重。然后放入标记好的管子中(一个组织一个管子),样品在存放入-70℃冰箱之前临时放置在冰上。
[0282]
采集的血浆样本及组织样本在分析前存放于-70℃冰箱内,分析后剩余血浆样本及组织样本继续存放于-70℃冰箱,将根据委托方要求进行后续处理。
[0283]
生物分析和数据处理
[0284]
检测血浆及组织样本中各受试物的浓度,分析样品的同时进行质控样品准确度评价,并要求超过66%的质控样品的准确度在80-120%之间。
[0285]
通过不同时间点的血药浓度数据,运用winnonlin计算药代动力学参数,如auc(0-t),t1/2,cmax,tmax和mrt等。
[0286]
进行血浆药物浓度-时间曲线绘制时,blq均记为0。进行药代参数计算时,给药前的浓度按照0计算;cmax之前的blq(包括“no peak”)按照0计算;cmax之后出现的blq(包括“no peak”)一律不参与计算。
[0287]
表2单次静脉注射后化合物在血浆中的浓度变化
[0288][0289][0290]
注:剂量均为5mg/kg;
[0291]
检测下限为5-30ng/ml不等
[0292]
测试例3:膜片钳技术检测sd大鼠黑质区多巴胺神经元动作电位
[0293]
一、试剂及仪器
[0294]
化学试剂:
[0295][0296]
仪器:
[0297][0298][0299]
二、试验动物:
[0300]
sd大鼠,2-3周,雄性,购于北京维通利华实验动物技术有限公司,生产许可证号scxk(京)2016-0011,合格证号110011210103637715,110011210103928635,110011210104041641。
[0301]
三、供试品配制:
[0302]
1、人工脑脊液acsf:234mm sucrose,2.5mm kcl,1.25mm nah2po4·
2h2o,25mm nahco3,25mm d-glucose,0.5mm cacl2·
2h2o,10mm mgso4(通95%o2和5%co2混合气饱和)。
[0303]
孵育液/记录液acsf:125mm nacl,2.5mm kcl,1.25mm nah2po4·
2h2o,25mm nahco3,10mm d-glucose,2mm cacl2·
2h2o,1.5mm mgso4(通95%o2和5%co2混合气饱和)。化合物7组脑片需在化合物7 1μμ孵育液中孵育30min后移至化合物7 1μμ记录槽中进行试验。
[0304]
记录内液:140mm k-gluconate,2mm mgcl2,10mm hepes,8mm kcl,2mm na
2-atp,0.2mm na
2-gtp,koh调ph为7.2。空白组内液中加入5μl pbs至500μl细胞内液中;α-syn组加5μl的α-syn至500μl细胞内液中。化合物7组加5μl的α-syn至500μl细胞内液中。
[0305]
格列本脲或化合物7以2mm的母液浓度保存在0.05m naoh中。
[0306]
2、α-syn oligomer制备
[0307]
重组人α-synuclein蛋白聚合体购自abcam(ab218819),为pre-formed fibrils(pffs),将pffs颠倒混匀后进行分装。由于pff为聚合体,包含一系列长度的单体,分子量不定,购买的母液浓度预计为包含100μm浓度的α-syn单体(α-syn单体14kda),共50μl,分装成可配置500μl的细胞内液的小管,每管预计为5μl,于-80℃保存。使用时吸取500μl细胞内液(细胞内液经0.22μm滤膜过滤)加入管中,配制成终浓度为1μm的α-syn。涡旋震荡后室温50-60hz超声15min得到α-syn oligomer,放置冰盒上保存备用,有效期为3h。每次注入电极前需涡旋震荡,内液注入量为电极的1/3。
[0308]
3、脑片制备
[0309]
将实验动物保定后,腹腔注射乌拉坦深度麻醉并断头(25%,1ml/100g),迅速从颅腔取出大脑。该过程中尽可能减小对脑的损坏和挤压。大脑被移至0-4℃的人工脑脊液(acsf)通95%o2与5%co2混合气饱和。
[0310]
用药匙将大脑移入盛有冰冷切片人工脑脊液(acsf)的培养皿内,培养皿底部预先铺有滤纸。使大脑腹侧与滤纸接触。去除小脑。用502胶将剩余组织粘在琼脂块上,并将琼脂块粘于标本底座,使其直立。
[0311]
将标本底座固定于盛有冰冷切片人工脑脊液(acsf)的标本槽内。调整刀片高度,用震动切片机(leica,vt 1000s,germany)将脑组织冠状切片,厚度300μm。切片速度2.0mm/s,振幅0.8mm,频率90hz。在切片过程中,培养皿和标本槽内持续通混合气。制备的脑片转移至饱和32℃恒温水浴记录液acsf中孵育30min,之后脑片逐个移至记录槽中,通入饱和的孵育液(acsf)。
[0312]
将孵育30min脑片移至室温孵育30min备用
[0313]
记录槽中(acsf)为31
±
1℃,灌流速度为6ml/min。
[0314]
四、试验设计
[0315]
电生理检测
[0316]
用微电极拉制仪将毛细玻璃管拉制成记录电极,在显微镜下操纵微电极操纵仪,将记录电极入液后给予正压,一边吹散组织,一边向下进电极,直至电极接触到细胞膜,给予一定负压进行抽吸,形成gω封接。形成gω封接后进行快速电容补偿,然后继续给予负压,吸破细胞膜。负压破膜后等待细胞稳定3-5min后记录一个5mv的电压刺激(测试串联电阻)。
[0317]
记录ap的电流刺激方案如下:电压钳模式下钳制电压-70mv封接、破膜、补偿后改为电流钳ic模式,开始记录,从-300pa到+50pa结束,δ=50pa阶跃至诱导出动作电位,记录3s间隔5s。记录前后串联电阻的变化,超过20%弃用。
[0318]
五、数据分析
[0319]
分析动作电位的rmp,threshold,peak,amplitude,rin,voltagesag,cm,frequency current of ap。所有数据以mean+sem表示。t-test用于数据的统计学评估,p《0.05具有统计学差异。数据用clampfit 10.6,graphpad 8进行分析。
[0320]
六、试验结果
[0321]
本研究利用膜片钳技术检测了本公开化合物对sd大鼠黑质区多巴胺神经元动作电位的影响。(t-test,p《0.05*,p《0.01**,p《0.001***,p《0.0001****)。若p《0.05,即认为
差异显著。
[0322]
结果显示:ap记录24分钟时三组频率变化最为明显,其余指标均无明显变化。
[0323]
静息电位:对照组与a-syn oligomer组相比(p=0.9175),a-syn oligomer与化合物7组相比(p=0.4864)。
[0324]
阈值:对照组与a-syn oligomer组相比(p=0.4808),a-syn oligomer与化合物7组相比(p=0.7503)。
[0325]
幅度值:对照组与a-syn oligomer组相比(p=0.9886),a-syn oligomer与化合物7组相比(p=0.3564)。
[0326]
输入电阻:对照组与a-syn oligomer组相比(p=0.6322),a-syn oligomer与化合物7组相比(p=0.4638)。
[0327]
电压降:对照组与a-syn oligomer组相比(p=0.8947),a-syn oligomer与化合物7组相比(p=0.9391)。
[0328]
膜电容:对照组与a-syn oligomer组相比(p=0.1343),a-syn oligomer与化合物7组相比(p=0.7269)。均没有显著性差异。
[0329]
50pa对应的动作电位发放频率:对照组与a-syn oligomer组相比(p=0.0027**),a-syn oligomer与化合物7组相比(p=0.0107*)。有显著性差异。
[0330]
具体数据如下:所有数据以均值mean+sem表示。
[0331][0332]
从图1看出,a.从0min开始记录到32min结束,对照l组动作电位频率没有随时间增加而变化。b.从0min开始记录到32min结束,a-syn oligomer组动作电位频率随时间增加而降低。c.从0min开始记录到32min结束,化合物7组动作电位频率没有随时间增加而变化,同时与图1-b相比,化合物7逆转了a-syn oligomer引起动作电位频率降低的作用。d.钳制电流定为+50pa,记录时间为24min,与对照组相比,a-syn oligomer组动作电位频率显著降低(p=0.0027**),与a-syn oligomer组相比,化合物7组动作电位频率显著增加(p=0.0107*),化合物7逆转了a-syn oligomer引起动作电位频率降低的作用。
[0333]
从图2看出,从0min开始到32min结束记录,对照组,a-syn oligomer,化合物7三组静息电位没有显著变化,组间没有差异;f.从0min开始到32min结束记录,对照组,a-syn oligomer,化合物7三组阈值电位没有显著变化,组间没有差异;g.从0min开始到32min结束记录,对照组,a-syn oligomer,化合物7三组幅度值没有显著变化,组间没有差异;h.从0min开始到32min结束记录,在0min时a-syn oligomer,化合物7两组输入电阻值相对对照组有降低趋势但没有显著性差异,其余时间点没有显著变化,组间没有差异;i.从0min开始到32min结束记录,在8min时a-syn oligomer,化合物7两组电压值相对对照组有降低趋势
但没有显著性差异;j.与对照组相比,a-syn oligomer,化合物7两组膜电容有降低趋势但没有显著性差异。
[0334]
体外大鼠脑片电生理试验结果表明,化合物7能够逆转a-syn oligomer引起的大鼠脑黑质区神经元动作电位发放频率降低的作用,可用于体内治疗帕金森氏病。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1