包含可辅助化疗药物高效激活免疫原性细胞死亡的大环化合物的药物组合物
1.本发明属于生物医药领域,涉及一种可辅助化疗药物高效激活免疫原性细胞死亡的大环化合物药物组合。
背景技术:
2.免疫原性细胞死亡(immunogenic cell death,icd)可原位产生癌症疫苗并引发保护性同源抗癌免疫,为癌症免疫治疗带来了光明。然而,icd在临床上的效果却比较受限,通常具有较差的免疫原性和低反应率。这种无效的临床转化主要是由icd诱导剂的固有局限性引起的。首先,大多数常规策略只能通过触发抗癌药物的继发性或附带作用来产生icd相关免疫原性,从而导致引发的抗肿瘤免疫反应有限。此外,细胞毒性和免疫刺激作用是icd诱导剂的两个固有属性,因此,单纯增加icd诱导剂的剂量可能无法提高icd诱导剂的免疫刺激作用,且伴随有严重的副作用。因此,能够有效增强icd相关抗肿瘤免疫反应的创新策略或新型的icd诱导剂对于开发安全有效的基于icd的免疫疗法至关重要。
3.在过去的几十年中,包括环糊精,杯芳烃,葫芦脲和柱芳烃在内的一系列大环分子在生物医学应用中受到越来越多的关注。这些大环分子通常用作药物输送中的分子容器,以提高药物溶解度,增强药物稳定性并减少副作用。然而,可作为icd诱导剂辅助化疗药物高效激活免疫原性细胞死亡的大环化合物至今尚未发现。
技术实现要素:
4.本发明目的是解决传统化疗药物icd免疫激活能力差的问题,提供一种可辅助化疗药物高效激活免疫原性细胞死亡的大环化合物药物组合的制备方法和应用。
5.本发明首次发现了一类新型杯芳烃化合物,它们可以以极高的效率驱动真正的icd。此外,这些分子独特的大环结构还赋予了它们通过主客体相互作用与抗癌药物结合的巨大潜力。两个功能兼具一身,使得这些大环分子成为一个相当简单的“即插即用”平台,可与各种化疗药物配合,并通过激活icd相关的抗肿瘤免疫活性来大幅度提高传统化疗药物的抗癌性能。
6.本发明的技术方案
7.一种包含可辅助化疗药物高效激活免疫原性细胞死亡的大环化合物的药物组合物,包括至少式(i)的一种大环化合物和至少一种药物活性物质:
[0008][0009]
其中,n为4;
[0010]
r1选自h;
[0011]
r2选自-n(ch3)3x,其x是独立地选自bf4的抗衡离子。
[0012]
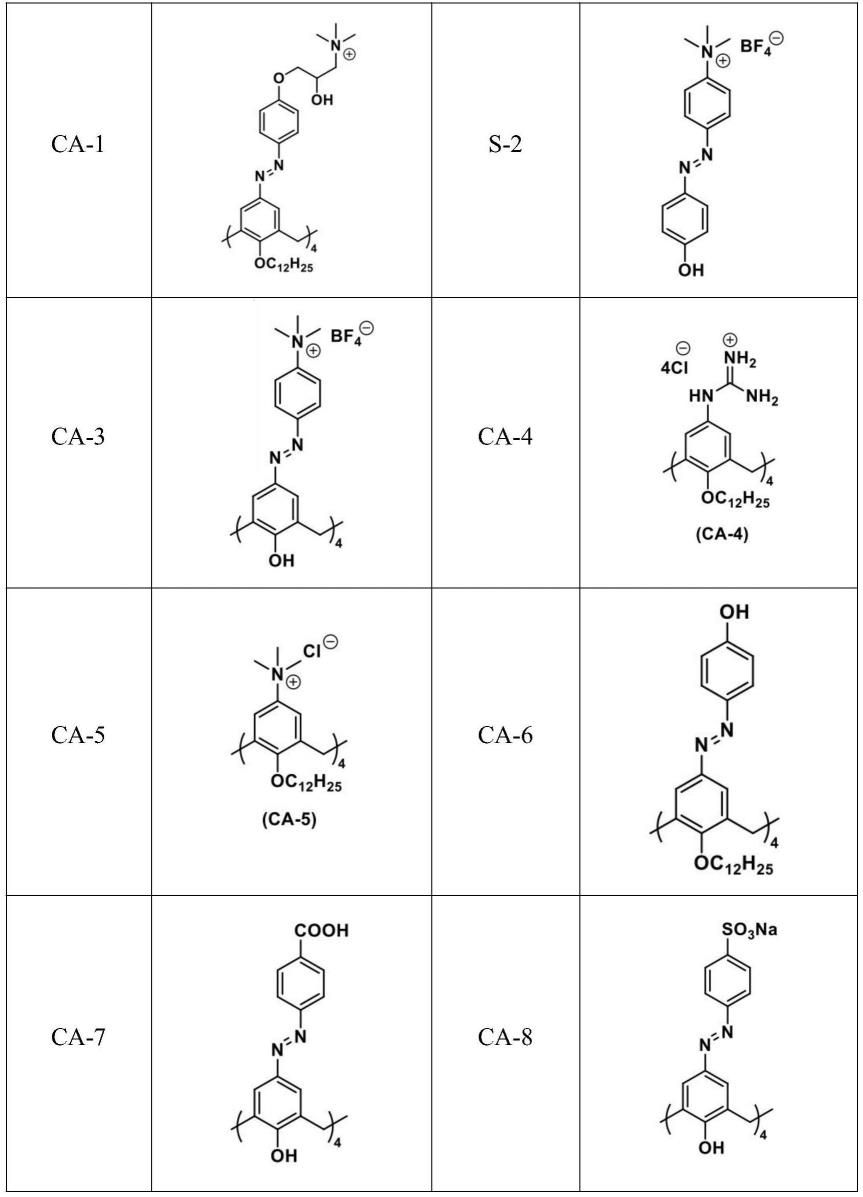
所述式(i)的偶氮杯芳烃化合物选自:
[0013][0014]
所述药物活性物质选自以下一种或多种治疗癌症的药物:阿霉素、紫杉醇、喜树碱、羟基喜树碱、伊立替康、拓扑替康、奥沙利铂、贝洛替康或替拉替尼。
[0015]
本发明同时提供了式(i)中所述的大环化合物ca-3的制备方法,包括:
[0016]
在0度条件下,向1,4-氯苯氨中逐滴滴加nano2的水溶液,其中1,4-氯苯氨和nano2的摩尔比为1:1,室温搅拌至产生大量固体;抽滤固体沉淀,依次用稀hbf4水溶液、乙醇和乙醚洗涤,真空干燥,得到化合物2;
[0017]
随后将化合物2溶解在乙腈溶液中,并在-10度逐渐加入三甲胺,其中三甲胺与化合物2的摩尔比为1.5:1;随着反应的进行,形成乳白色沉淀,上层溶液变为黄色,再次加入三甲胺,搅拌至产生大量固体;将固体沉淀抽滤,依次用乙腈和二氯甲烷洗涤,真空干燥,得到化合物3;
[0018]
接下来将c4a在冰盐浴条件下逐渐滴加到化合物3的溶液中,dmf/吡啶/水=1.6/1/1,v/v/v,其中苯酚和c4a与化合物3的摩尔比分别为1:1和1:4;室温搅拌4小时后,将溶液混合物蒸发至干,残余物用水与丙酮混合溶液重结晶,得到定量收率的橙红色固体ca-3。
[0019]
本发明还提供了所述的大环化合物药物组合物的制备方法。
[0020]
将化合物ca-3溶解在dmso中配备3mm母液,随后,在25度超声下,将1ml预制备母液逐滴加入9mlhepes缓冲液中;超声30分钟后,得到ca-3在hepes缓冲液的纳米组装体;随后用hepes透析除去dmso,储存于4度以供进一步使用。
[0021]
将治疗癌症的药物阿霉素、紫杉醇、喜树碱、羟基喜树碱、伊立替康、拓扑替康、奥沙利铂、贝洛替康或替拉替尼溶分别解于pbs、dmso、甲醇或hepes溶液中,配置1mm药物母液
备用,然后将所述药物母液与大环化合物溶液按摩尔比1:1加入到大环化合物溶液中,震荡15分钟后,制备药物组合物,放置于4度储存备用。
[0022]
本发明首先对构效关系进行了研究,以探索这些大环分子诱导icd的基本结构元素,以及大环分子诱导icd的潜在机制。此外,双侧肿瘤复发实验进一步证实大环分子诱导icd以及引发保护性同源抗癌免疫的能力。最后,通过选择ca-3以及甲氨蝶呤(mtx)作为药物组合,成功触发icd相关的免疫反应,并显著提高了mtx的抗肿瘤作用。这些研究共同证明我们发现了一类新型的icd诱导剂(其中最有效的为ca-3),该化合物表现出多种优势:1、可以高效诱导癌细胞icd;2、可在体内驱动真正的icd并引发保护性同源免疫;3、可以与多种化疗药物协同作用并通过激活icd相关的免疫反应来提高其抗癌作用。此外,本发明中建立的构效关系为设计和合成更有效的可辅助化疗药物高效激活免疫原性细胞死亡的大环化合物药物组合
附图说明
[0023]
图1为s-2和ca-3的合成示意图。
[0024]
图2显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后,细胞的表面crt暴露情况,比例尺为25μm。
[0025]
图3显示乏氧条件下不同样品处理12h后细胞的表面crt暴露,表明ca-3与药物之间具有很强的协同作用,可促进crt在细胞表面的凋亡前暴露,比例尺为25μm。
[0026]
图4中a显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后,细胞内hmgb-1的分布,b显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后细胞外hmgb-1的浓度。
[0027]
图5显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后,细胞外atp的浓度。
[0028]
图6中a显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后,eif2a磷酸化水平的流式结果;b显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后,eif2a磷酸化水平的共聚焦结果。
[0029]
图7中a显示细胞对ca-1,s-2,ca-3,ca-5和ca-7的摄取情况;b显示ca-1,ca-3,ca-5的水动力学直径。
[0030]
图8显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后,bmdcs对4t1的摄取情况。
[0031]
图9显示mtx,chl,eto,pem,ca-1-mtx,ca-1-chl,ca-1-eto,ca-1-pem,ca-3-mtx,ca-3-chl,ca-3-eto,ca-3-pem,ca-7-mtx,ca-7-chl,ca-7-eto和ca-7-pem处理后,bmdcs对4t1的摄取情况。
[0032]
图10显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后,bmdcs对肿瘤抗原的抗原呈递情况。
[0033]
图11显示mtx,chl,eto,pem,ca-3-mtx,ca-3-chl,ca-3-eto,ca-3-pem处理后,bmdcs对肿瘤抗原的抗原呈递情况。
[0034]
图12显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后,bmdcs的成熟情况。
[0035]
图13显示mtx,chl,eto,pem,ca-1-mtx,ca-1-chl,ca-1-eto,ca-1-pem,ca-3-mtx,ca-3-chl,ca-3-eto,ca-3-pem,ca-7-mtx,ca-7-chl,ca-7-eto和ca-7-pem处理后,bmdcs的成熟情况。
[0036]
图14中a显示pbs,f-t,ptx,ca-1,ca-3,ca-5和ca-7处理后,肿瘤的复发情况;b显示pbs,f-t,ptx,ca-1,ca-3,ca-5和ca-7处理后,dcs细胞的成熟情况;c显示pbs,f-t,ptx,
ca-1,ca-3,ca-5和ca-7处理后,cd8
+
效应记忆t细胞的表达情况。
[0037]
图15显示pbs,ptx,ca-1,ca-3,ca-5和ca-7处理后,11种肿瘤细胞表面crt外翻情况。
[0038]
图16显示25℃下,铝酞菁与ca-3的荧光回复;插图显示alpcs4,ca-3-alpcs4在pbs中及ca-3-alpcs4在小鼠血清中的荧光图片。
[0039]
图17中a显示pbs、mtx、ca-3、ca-3-mtx给药后各组小鼠肿瘤生长曲线;b显示pbs、mtx、ca-3、ca-3-mtx给药后各组小鼠生存曲线;c显示pbs、mtx、ca-3、ca-3-mtx给药后各组小鼠体重变化;d显示pbs、mtx、ca-3、ca-3-mtx给药后各组小鼠肿瘤中cd8
+
cd3
+
cd45
+
的比例;e显示pbs、mtx、ca-3、ca-3-mtx给药后各组小鼠肿瘤中cd86
+
cd80
+
cd3
+
的比例;f显示pbs、mtx、ca-3、ca-3-mtx给药后各组小鼠肿瘤中cd8
+
t
em
的比例。
具体实施方式
[0040]
实施例1
[0041]
包含可辅助化疗药物高效激活免疫原性细胞死亡的大环化合物的药物组合物的制备方法,包括如下步骤:
[0042]
1)大环化合物的合成,
[0043]
在0℃条件下,向1,4-氯苯氨(化合物1,9.7g,76mmol,hbf4/h2o,20ml,48%wt)中逐滴滴加nano2的水溶液(5.35g,76mmol),室温搅拌1小时。抽滤固体沉淀,依次用稀hbf4水溶液、乙醇和乙醚洗涤,真空干燥,得到化合物2。
[0044]
随后将化合物2(4.5g,20mmol)溶解在乙腈溶液中(25ml),并在-10度逐渐加入三甲胺(1.77g,30mmol,20ml),其中三甲胺与化合物2的摩尔比为1.5:1。随着反应的进行,形成乳白色沉淀,上层溶液变为黄色,然后加入5ml三甲胺,再搅拌1h。将固体沉淀抽滤,依次用乙腈和二氯甲烷洗涤,真空干燥,得到化合物3。
[0045]
接下来将苯酚(0.89g,9.44mmol)或c4a(1.0g,2.36mmol)在冰盐浴条件下逐渐滴加到化合物3的溶液中(dmf/吡啶/水,1.6/1/1,v/v/v)。室温搅拌4小时后,将溶液混合物蒸发至干,残余物用水/丙酮重结晶,得到定量收率的橙红色固体s-2或ca-3。
[0046]
除s-2或ca-3外,本发明中采用ca-1,ca-4,ca-5,ca-6,ca-7,ca-8作为对照。其中ca-1,ca-6的合成参照发表文章macrocyclic-amphiphile-based self-assembled nanoparticles for ratiometric delivery of therapeutic combinations to tumors;ca-4的合成参照发表文章biomarker displacementactivation:a general host-guest strategy for targeted phototheranostics in vivo;ca-5的合成参照发表文章a facile way to construct sensor array library via supramolecular chemistry for discriminating complex systems;ca-7的合成参照发表文章a general hypoxia-responsive molecular container for tumor-targeted therapy;ca-8的合成参照发表文章promoting tumor accumulation of anticancer drugs by hierarchical carrying of exogenous and endogenous vehicles。各大环化合物结构如下表:
[0047][0048]
2)大环化合物溶液的制备,
[0049]
首先将化合物7.12mg ca-1,4.05mg ca-3,5.19mg ca-4,6.13mg ca-5,5.26mg ca-6,3.55mg ca-7以及3.86mg ca-8分别溶解在1mldmso中配备各自的3mm母液。随后,在25度超声下,将1ml预制备母液逐滴加入9mlhepes缓冲液(10mm,ph 7.4)中。超声30分钟后,hepes透析除去dmso,储存于4度以供进一步使用。
[0050]
s-2则是直接溶解在hepes缓冲液(10mm,ph 7.4)中。
[0051]
3)药物组合物的制备
[0052]
首先将治疗癌症的药物如阿霉素、紫杉醇、喜树碱、羟基喜树碱、伊立替康、拓扑替康、奥沙利铂、贝洛替康或替拉替尼溶解于pbs、dmso、甲醇、hepes等溶液中,配置1mm母液备用,然后将上述药物母液按摩尔比(与大环化合物溶液)1:1加入到步骤2)得到的大环化合物溶液中,震荡15分钟后,制得药物组合物,放置于4度储存备用。
[0053]
测试实施例
[0054]
实施例1:大环化合物的毒性实验
[0055]
测试方法:cck-8法进行细胞毒性实验。
[0056]
实验步骤:
[0057]
1、培养基使用dmem,加有10%fbs和1%青霉素链霉素。将癌细胞置于37℃、5%co2细胞培养箱中孵育,每次在实验之前,将细胞预培养直至达到汇合。收集4t1对数期细胞,调整细胞悬液浓度,每孔加入100μl,铺板使待测细胞调密度至10000每孔,边缘孔用无菌pbs填充。
[0058]
2、在5%co2,37℃下孵育,至细胞单层铺满孔底(96孔平底板),加入浓度梯度的大环化合物(4μm、8μm、16μm、32μm)。
[0059]
3、常氧条件:将96孔板置于5%co2,37℃培养箱中培养24小时。乏氧条件:将96孔板置于乏氧小室,通入5%co2,94%n2,1%o2混合气体,随后关闭进气口和出气口,将其置于37℃培养箱中培养24小时。
[0060]
4、小心吸去孔内培养液,每孔加入100ul新鲜配置的cck-8工作液(1/9,v/v),继续培养1.5小时。
[0061]
5、终止培养。在酶联免疫检测仪od 450nm处测量各孔的吸光值。细胞存活率可以通过下面的公式计算得到:细胞存活率=(od
450
(samples)/(od
450
(control)
×
100%。
[0062]
根据表1的cck-8法细胞毒性结果,我们选择16μm作为后续测试浓度。
[0063]
表1.大环化合物的细胞毒性
[0064][0065][0066]
实施例2:大环化合物及药物组合处理细胞后凋亡前crt的表面检测
[0067]
测试方法:流式细胞术、免疫荧光成像。
[0068]
流式细胞术:首先将细胞(4t1)以1
×
105的密度接种在12孔板中。预孵育12小时
后,将细胞与紫杉醇ptx、甲氨蝶呤mtx、苯丁酸氮芥chl、依托泊苷eto、培美曲塞pem、大环化合物(ca-1至ca-8)、药物组合ca-1-mtx、ca-1-chl、ca-1-eto、ca-1-pem、ca-3-mtx、ca-3-chl、ca-3-eto、ca-3-pem、ca-7-mtx、ca-7-chl、ca-7-eto或ca-7-pem以相同浓度(16μm)分别孵育4小时、12小时或24小时。胰蛋白酶消化和离心后,收集细胞并重新悬浮在冷pbs中,然后与atto488-anti-crt孵育。在进行流式细胞仪分析前,用5μl碘化丙啶(pi)对细胞进行染色。细胞表面的凋亡前crt暴露以pi-crt
+
为标准。结果参见表2和表3。
[0069]
表2.ptx和杯芳烃处理后细胞(4t1)表面的凋亡前crt暴露情况
[0070][0071]
表3.不同化疗药物以及超分子药物组合处理后细胞(4t1)表面的凋亡前crt暴露情况
[0072][0073]
免疫荧光成像:首先将4t1细胞以2
×
104个细胞/孔的密度接种在35mm共聚焦培养皿(ф=15mm)中过夜培养,然后用化疗药物ptx、mtx、eto、pem,大环化合物ca-1、ca-3、ca-5、ca-7,以及药物组合ca-1-mtx,ca-1-eto,ca-1-pem,ca-3-mtx,ca-3-eto,ca-3-pem,ca-7-mtx,ca-7-eto或ca-7-pem以相同浓度16μm与细胞作用12小时。孵育后,将细胞用冷pbs冲洗并在室温下用4%多聚甲醛固定15分钟。5%fbs封闭30分钟后与一抗孵育1小时,洗涤3次后与alexa488偶联的单克隆二抗结合。最后,将细胞用4,6-二脒基-2-苯基吲哚二盐酸盐(dapi)染色并通过clsm检查。
[0074]
上述流式细胞术以及共聚焦结果(见图2、图3)表明,本发明中合成的一系列大环化合物可有效促进细胞的凋亡前crt暴露,其中ca-3最有效。此外,ca-3还可以辅助化疗药物mtx、chl、eto和pem诱导crt外翻。
[0075]
实施例3:大环化合物处理细胞后高迁移率组蛋白-1外流监测
[0076]
测试方法:免疫荧光成像、elisa试剂盒。
[0077]
本实施例中,采用免疫荧光成像和elisa试剂盒分别对细胞内hmgb-1的分布以及细胞外hmgb-1的浓度进行检测。具体来说,首先将4t1细胞以2
×
104个细胞/孔的密度接种在35mm共聚焦培养皿(ф=15mm)中过夜,然后用16μm的ptx、ca-1、ca-3、ca-5和ca-7分别处理细胞4h、12h和24h。最后用hmgb-1的elisa试剂盒检测上清液中hmgb-1的细胞外浓度。接下来,将细胞在4%多聚甲醛中固定15分钟,并用0.1%triton x-100破膜10分钟,然后用hmgb-1抗体对细胞内hmgb-1的分布进行检测。具体步骤与实施例2类似。如图4所示,大环化合物和ptx处理后,细胞内的hmgb-1有效外流,且细胞外的hmgb-1浓度有效提高。其中ca-3效果最好,表明ca-3可以有效诱导hmgb-1的外流。
[0078]
实施例4:大环化合物处理细胞后atp释放监测
[0079]
测试方法:生物发光检测。
[0080]
本实施例中,选用市售atp检测试剂盒对材料处理后细胞外atp水平进行测定。具体来说,首先将4t1细胞以2
×
104个细胞/孔的密度接种在24孔板中过夜,然后用浓度为16μm的ptx、ca-1、ca-3、ca-5和ca-7对细胞进行处理。24小时后,收集细胞培养物的上清液,并根据说明书使用atp检测试剂盒测试atp含量。测试结果如图5所示,ca-3处理后细胞外atp浓度最高。
[0081]
实施例3-4的结果包括crt外翻,hmgb-1外流以及atp释放共同说明本发明中合成制备的大环化合物是有效的icd诱导剂,其中ca-3最有效。
[0082]
实施例5:ca-1、ca-3、ca-5、ca-7诱导icd信号通路的研究
[0083]
测试方法:流式细胞术、免疫荧光成像。
[0084]
流式细胞术:首先将细胞(4t1)以1
×
105的密度接种在12孔板中。预孵育12小时后,将细胞与ptx、ca-1、ca-3、ca-5、ca-7以相同浓度(16μm)分别孵育24小时。胰蛋白酶消化和离心后,收集细胞并重新悬浮在冷pbs中,然后在4%多聚甲醛中固定15分钟,并用0.1%triton x-100通透化10分钟。5%fbs封闭30分钟,然后与一抗孵育(anti-peif2a)1小时,洗涤3次后与alexa488偶联的单克隆二抗孵育30分钟来封闭。最后,将细胞重新悬浮在冷pbs中进行流式细胞术分析。
[0085]
免疫荧光成像:将4t1细胞以2
×
104个细胞/孔的密度接种在35mm共聚焦培养皿(ф=15mm)中过夜,然后用pbs、ptx和大环化合物(ca-1、ca-3,ca-5和ca-7)以相同浓度16μm作用24h。随后对细胞进行免疫荧光成像,具体步骤参照实施例3。
[0086]
结果如图6a所示,ptx、ca-1、ca-3以及ca-5处理细胞后,细胞内peif2a的表达水平明显上调,此外免疫荧光成像(图6b)进一步证明了该结果,表明ca-1、ca-3、ca-5与ptx一样,同样产生了内质网压力,诱导了关键蛋白的磷酸化。
[0087]
实施例6:ca-1、s-2、ca-3、ca-5、ca-7细胞摄取效率研究
[0088]
测试方法:紫外分光光度计比色法。
[0089]
在本实施例中,首先将4t1细胞以1
×
105细胞/孔的密度接种在12孔板中。预孵育12小时后,将细胞与浓度为16μm的ca-1、s-2、ca-3、ca-5和ca-7孵育一段时间(15分钟、30分钟、45分钟、60分钟、90分钟、120分钟、180分钟、240分钟),收集细胞并将其重悬在pbs(1ml)中用于紫外检测。ca-1、s-2、ca-3和ca-7在360nm外有一个较长的吸收峰,因此本实施例中采用420nm处的吸光度来确定它们的细胞摄取效率。特殊的,ca-5的细胞摄取效率利用光谱
减法方法进行研究。由于ca-5在220至280nm的紫外吸收峰逐渐下降,并在280nm几乎降低至零。因此对于正常细胞,220nm处的吸光度(ac220)与其在280nm处的吸光度(ac280)呈正相关,因此ac220可表示为:ac220=k*ac280+b。对于ca-5处理的细胞,a220来源于ac220和内化的ca-5(a-ca220)。因此,a-ca220可通过如下公式得到:a-ca220=a220
–
(k*ac280+b)。因此分别根据标准曲线确定各组ca-1、s-2、ca-3、ca-5和ca-7细胞摄取效率的相应浓度。测试结果如图7所示,细胞对s-2和ca-7的摄取效率较低,低细胞摄取效率可能是这些材料无法高效产生icd的主要原因。ca-5的细胞摄取效率略微提高,与其产生的crt外翻结果一致。ca-1和ca-3的细胞摄取效率最高,但ca-1并没有有效产生crt外翻,表明不仅与细胞内化效率有关,可能还与材料的刚性结构有关。
[0090]
实施例7:大环化合物ca-1、ca-3和ca-5的粒径以及zeta电位监测
[0091]
ca-1、ca-3和ca-5的平均尺寸和zeta电位用动态光散射进行测量。测试设备为配备数字相关器(bi-9000at)的激光散射光谱仪(bi-200sm),波长为636nm,温度为37度。测试结果如图8所示,ca-1和ca-3以及ca-5均可在水溶液中形成粒径均一的纳米颗粒,其中ca-1和ca-3的粒径较小,而ca-5的粒径较大,较小的粒径有利于细胞摄取,而较大粒径的纳米颗粒细胞摄取效率则相对低下。上述结果表明,偶氮结构在形成较小纳米颗粒以及促进细胞内化过程中至关重要。
[0092]
综上,我们认为本发明中的大环化合物产生icd与其结构之间的构效关系如下:1、杯芳烃骨架和上缘带正电荷的基团都是类似物诱导icd活性的基本结构元素;2、icd诱导活性与类似物的细胞摄取效率正相关;3、高结构刚性可能有利于类似物的icd诱导活性。
[0093]
实施例8:ca-1、ca-3、ca-5、ca-7促进树突状细胞摄取肿瘤细胞的研究
[0094]
测试方法:流式细胞术。
[0095]
对于典型的icd,表面暴露的crt可充当促吞噬信号,促进抗原呈递细胞对癌抗原的识别和吞噬。我们采用8周大的balb/c小鼠作为骨髓源dcs细胞来源。4t1细胞首先用钙黄绿素am进行染色,然后以1
×
105个细胞/孔的密度接种在12孔板中。12h后,向细胞中分别加入16μm ptx、mtx、chl、eto、pem、ca-1、ca-3、ca-5、ca-7、ca-1-mtx、ca-1-chl、ca-1-eto、ca-1-pem、ca-3-mtx、ca-3-chl、ca-3-eto、ca-3-pem、ca-7-mtx、ca-7-chl、ca-7-eto或ca-7-pem。孵育12小时后,将细胞收集随后与1
×
106bmdcs(用dil预染色)共培养。4小时后使用流式细胞术检查bmdc介导的癌细胞吞噬作用,门控为fitc
+
apc
+
。结果如图8、图9所示,ca-3可有效促进bmdcs对肿瘤细胞的摄取,并协助非icd化疗药物如mtx、chl、eto、pem促进bmdcs对肿瘤细胞的摄取。
[0096]
实施例9:ca-1、ca-3、ca-5、ca-7促进树突状细胞对肿瘤抗原呈递的研究
[0097]
测试方法:流式细胞术。
[0098]
在本实施例中,采用卵白蛋白(ova)转染的b16f10细胞(b16f10-ova)作为癌细胞模型。具体来说,b16f10-ova细胞首先以1
×
105个细胞/孔的密度接种在12孔板中。12小时后,向细胞中分别加入16μm ptx、mtx、chl、eto、pem、ca-1、ca-3、ca-5、ca-7、ca-3-mtx、ca-3-chl、ca-3-eto、ca-3-pem。孵育12小时后,收集预处理的b16f10-ova细胞并与1
×
106bmdc共培养。48小时后,用siinfekl-mhci和cd11c的抗体进行染色,并用流式细胞术对抗原交叉呈递进行检测。结果如图10、图11所示,ca-3可有效促进bmdcs对肿瘤抗原的提呈,并协助非icd化疗药物如mtx、chl、eto、pem促进bmdcs对肿瘤抗原的提呈。
[0099]
实施例10:ca-1、ca-3、ca-5、ca-7促进树突状细胞成熟的研究
[0100]
测试方法:流式细胞术。
[0101]
在本实施例中,采用卵白蛋白(ova)转染的b16f10细胞(b16f10-ova)作为癌细胞模型。具体来说,b16f10-ova细胞首先以1
×
105个细胞/孔的密度接种在12孔板中。12h后,向细胞中分别加入16μm ptx、mtx、chl、eto、pem、ca-1、ca-3、ca-5、ca-7、ca-1-mtx、ca-1-chl、ca-1-eto、ca-1-pem、ca-3-mtx、ca-3-chl、ca-3-eto、ca-3-pem、ca-7-mtx、ca-7-chl、ca-7-eto或ca-7-pem。孵育12小时后,收集预处理的b16f10-ova细胞并与1
×
106bmdc共培养。48小时后,用cd11c,cd80,cd86的抗体进行染色,并用流式细胞术对抗原交叉呈递进行检测。结果如图12、图13所示,ca-3可有效促进bmdcs成熟,并协助非icd化疗药物如mtx、chl、eto、pem促进bmdcs成熟。
[0102]
实施例9-10共同表明,本发明中合成制备的大环化合物可在体外有效激活icd相关抗肿瘤免疫活性,其中ca-3激活效率最高。
[0103]
实施例11:ca-1、ca-3、ca-5、ca-7抑制肿瘤复发的研究
[0104]
在本实施例中,首先对4t1细胞进行预处理,具体步骤如下:将1
×
1064t1细胞暴露于16μm的ca-1、ca-3、ca-5、ca-7、ptx中24h,然后洗涤并重悬于pbs中。将相同数量的4t1细胞反复冻融并用作隐性对照组。随后将细胞接种到6周龄雌性balb/c小鼠左侧脂肪垫,以相同体积的pbs作为对照。一周后,在小鼠脂肪垫右侧接种1
×
105个未经处理的4t1细胞,也即肿瘤复发实验。在之后的60天内,对肿瘤的发生率和生长进行监测,并在肿瘤大小超过伦理限制或小鼠体重显着减轻的观察期间实施安乐死。在第20天,收集肿瘤引流淋巴结(tdln)和脾脏进行流式细胞术分析包括促进dcs成熟,产生记忆效应(具体步骤参照实施例10),以研究ca-3驱动真正icd的能力。结果如图14所示,ca-3可有效促进dcs成熟并产生记忆效应,最后极大幅度的抑制了肿瘤复发。
[0105]
实施例12:ca-1、ca-3、ca-5、ca-7在多种细胞内引发crt外翻的研究
[0106]
测试方法:流式细胞术。
[0107]
将细胞(4t1、b16f10、mda-mb-231、ct26、mcf-7、hela、inca-1、hct116、hepg2、mia或n2a)以1
×
105个细胞/孔的密度接种在12孔板中。12h后,向细胞中加入16μm ptx、ca-1、ca-3、ca-5、ca-7,24h后,对其进行crt和pi染色并进行流式细胞术检测。具体步骤参照实施例3。结构如图15所示,表明ca-3可在9/11种肿瘤细胞中高效引起crt外翻。
[0108]
实施例13:ca3-alpcs4非特异性竞争测定
[0109]
测试方法:荧光滴定法。
[0110]
ca-3和光致发光分子的荧光非特异性竞争实验均在室温(25℃)进行。首先配置ca-3和alpcs4的母液,将其分别溶于磷酸盐酸缓冲溶液(pbs,10mm,ph=7.4)中,配置浓度均为100μm。测试时先将ca-3-alpcs4(2/2μm)荧光传感对配置于荧光池内,pbs定容到体积2.5ml。将血液中存在的各种竞争物溶于pbs缓冲液中(10mm,ph=7.4)并向加入至荧光池子中,并搅拌30分钟以监测alpcs4的荧光强度。血液中竞争物及其浓度为:三磷酸腺苷(atp)10nm或100μm,二磷酸腺苷(adp)0.1μm,一磷酸腺苷(amp)10nm,烟酰胺腺嘌呤二核苷酸(nad)24μm,谷氨酰胺0.5mm,丙氨酸0.4mm,缬氨酸0.2mm,甘氨酸0.3mm和赖氨酸0.2mm;磷酸盐0.8mm,氯化物95mm,牛血清白蛋白(bsa)10μg/ml,谷胱甘肽8.0μm,肌酐80μm和葡萄糖5.0mm。
[0111]
测试结果如图16所示,添加血液中存在的这些物质后,从ca-3-alpcs4中没有检测到明显的荧光,这表明ca-3-alpcs4在生理环境中具有很高的稳定性。此外,还通过在小鼠血清(ms)中孵育masn-alpcs4来评估血清蛋白中ca-3-alpcs4的完整性。结果显示(图16,插图),用ms处理的ca-3-alpcs4的荧光恢复也可忽略不计。由于ca-3与本研究中使用的药物之间的结合亲和力与alpcs4相似,我们认为ca-3-alpcs4不受血液中竞争物的干扰,因此可以有效避免这些药物在血液循环过程中从ca-3中泄漏,这为ca-3辅助药物激活icd相关抗肿瘤免疫提供了前提。
[0112]
实施例14:ca-3协助化疗药物引发icd相关抗肿瘤免疫活性的体内研究
[0113]
为了研究ca-3与抗癌药物的协同作用,在雌性balb/c小鼠的左侧乳腺脂肪垫处皮下注射1
×
106个4t1癌细胞。1周后,将肿瘤体积约为50mm3的小鼠随机分为四组(n=6),并静脉注射200μlmtx、ca-3和ca-3-mtx。其中给药频率为每三天一次,小鼠肿瘤体积持续监测19天。计算公式为v=l
×
w2/2,其中l为最长尺寸,w为最短尺寸。为了评估潜在的毒性,小鼠的体重也进行了持续的监测,并在表现出健康受损迹象时实施安乐死。结果如图17a-c所示,ca-3和mtx治疗后,小鼠肿瘤生长速度略微下降,而ca-3-mtx组肿瘤生长得到大幅度抑制,表明ca-3可有效协同mtx,并在体内激活icd相关抗肿瘤免疫活性。此外,ca-3-mtx治疗组同样大幅度延长了荷瘤小鼠的生存周期并降低了mtx造成的毒副作用,表明ca-3作为药物辅料协助降低药物毒副作用以及提高抑瘤效果的潜力。
[0114]
在3次给药后,取出荷瘤小鼠的肿瘤,并通过研磨,离心,重悬等系列步骤对肿瘤组织内效应t细胞的浸润情况以及icd的激活情况包括dcs的成熟,效应记忆t细胞的变化等进行流式细胞术表征,具体步骤参照实施例10。结果如图17d-e所示,ca-3-mtx组有效增强了cd8
+
效应t细胞的浸润,并引发了强烈的记忆效应,表明ca-3作为药物辅料协助化疗药物激活icd介导的抗肿瘤免疫的能力。
[0115]
工业应用性
[0116]
本发明提供一种可辅助化疗药物高效激活免疫原性细胞死亡的大环化合物的制备方法和应用。本发明的化合物可以与适当的活性药物分子一起制成相应的药物组合物,适于工业应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1