伤害性感觉神经细胞调控药物的用途
1.本发明涉及医药领域,特别是涉及伤害性感觉神经细胞调控药物在制备增强肿瘤饥饿治疗疗效产品中的用途。
背景技术:
2.肿瘤的生长、转移等恶性进展依赖于肿瘤微环境(tumor microenvironment,tme)中各组分为肿瘤细胞提供必需的营养物质及生长信号。因此,阻断肿瘤细胞与tme间的交互作用以切断tme对肿瘤细胞的营养供给,即肿瘤饥饿治疗是极具潜力的抗肿瘤治疗方式之一。广义的肿瘤饥饿治疗包含切断肿瘤微环境中的营养供给(主要包含抗肿瘤血管生成治疗)和阻断肿瘤细胞的营养代谢通路两种主要方式。其中抗肿瘤血管生成治疗(贝伐珠单抗、阿帕替尼和安罗替尼等)作为化疗、放疗、免疫治疗的协同治疗方式已在临床肿瘤综合治疗中广泛应用。另一方面,对肿瘤代谢异质性的深入研究发现:阻断肿瘤营养代谢关键通路如有氧糖酵解、谷氨酰胺分解代谢、脂肪酸氧化等可通过抑制肿瘤细胞对营养物质的利用从而抑制肿瘤生长。因此,多种特异靶向有氧糖酵解(2-dg、氯尼达明、fasentin等)或谷氨酰胺代谢关键酶(cd839等)的药物也显示出了极佳的临床应用前景。
3.尽管肿瘤饥饿治疗在多种肿瘤中取得了良好的临床疗效,但部分具有活跃肿瘤相关血管生成及高代谢水平的肿瘤如头颈鳞状细胞癌等,对肿瘤饥饿治疗却并不敏感,且对治疗敏感的患者仍会逐渐出现治疗抵抗。进一步研究发现肿瘤细胞会利用tme中各类细胞如免疫细胞、成纤维细胞、内皮细胞等以克服营养物质匮乏环境,从而实现药物治疗抵抗。例如使用cd839这一抗谷氨酰胺分解药物治疗非小细胞肺癌会引起tme中cd8+t细胞功能受损从而引起治疗抵抗。因此,目前仍亟需揭示肿瘤细胞与tme间的交互作用及其对肿瘤饥饿治疗的影响。
4.近期研究显示,多种类型的神经纤维广泛参与的肿瘤微环境的构建与重塑,并参与调控肿瘤的发生、发展、疼痛等病理过程。本发明人的研究结果发现,一类感知、传导、调控癌痛的特化的感觉神经(伤害性感觉神经)与肿瘤细胞间存在直接交互调控,且伤害性感觉神经可通过分泌降钙素基因相关肽(cgrp)增强肿瘤细胞在营养匮乏环境下的生长能力。cgrp是伤害性感觉神经中含量最丰富的神经肽。cgrp及其受体降钙素受体样受体(clr)已被证实在偏头痛的病理过程中发挥重要作用。近年fda已陆续批准多个cgrp及clr的拮抗剂以治疗、预防偏头痛。迄今为止,对伤害性感觉神经是否参与肿瘤饥饿治疗尚未见报导;而使用cgrp受体拮抗剂及cgrp抗体以阻断伤害性感觉神经-肿瘤细胞交互作用以增强肿瘤饥饿治疗疗效同样未见报导。
技术实现要素:
5.鉴于以上所述现有技术的缺点,本发明的目的在于提供伤害性感觉神经细胞调控药物的用途,用于解决现有技术中部分具有活跃肿瘤相关血管生成及高代谢水平的肿瘤如头颈鳞状细胞癌等,对肿瘤饥饿治疗却并不敏感,且对治疗敏感的患者仍会逐渐出现治疗
抵抗。其中产生治疗抵抗的原因之一为肿瘤饥饿治疗会促进tme中伤害性感觉神经-肿瘤细胞间交互作用,尤其是本发明人发现是神经源性cgrp通过促进肿瘤细胞在营养物质匮乏环境下的生长从而介导了这种治疗抵抗。
6.为实现上述目的及其他相关目的,本发明提供伤害性感觉神经细胞调控药物在制备增强肿瘤饥饿治疗疗效产品中的用途,所述伤害性感觉神经细胞调控药物至少包含降钙素基因相关肽(clr)受体抑制剂或降钙素基因相关肽(cgrp)抑制剂的一种或多种。
7.优选地,所述clr抑制剂选自药物瑞美吉泮(rimegepant)、乌布吉泮(ubrogepant)、扎维吉泮(zavegepant)、阿托吉泮(atogepant)和厄瑞努单抗(erenumab);所述cgrp抑制剂选自瑞玛奈珠单抗(fremanezumab)、伽奈珠单抗(galcanezumab)和依普奈珠单抗(eptinezumab)。优选地,所述伤害性感觉神经细胞调控药物为rimegepant。
8.所述伤害性感觉神经细胞调控药物通过肿瘤微环境治疗肿瘤增强肿瘤饥饿治疗疗效:
9.所述肿瘤的类型选自肿瘤微环境中具有伤害性感觉神经支配的瘤种。
10.在一些具体实施方案中,所述肿瘤微环境中具有伤害性感觉神经支配的瘤种选自头颈部恶性肿瘤(鳞状细胞癌、黏膜恶性黑色素瘤、软组织肉瘤、骨肉瘤、唾液腺恶性肿瘤)、皮肤黑色素瘤、胰腺癌、肺癌、胃癌和结直肠癌。优选地,所述肿瘤饥饿治疗药物应用于头颈鳞状细胞癌效果尤佳。
11.本发明还提供伤害性感觉神经细胞调控药物和肿瘤饥饿治疗药物的药物组合物在制备肿瘤饥饿治疗产品中的用途。
12.本发明还提供一种有效成分包含肿瘤饥饿治疗药物和伤害性感觉神经细胞调控药物的肿瘤饥饿治疗产品。
13.如上所述,本发明的伤害性感觉神经细胞调控药在制备增强肿瘤饥饿治疗疗效产品中的用途,具有以下有益效果:
14.cgrp受体拮抗剂及cgrp抗体为fda批准用于临床偏头痛治疗的药物,具有较高人体应用安全性。在单独使用肿瘤饥饿治疗药物无明显抗肿瘤作用的剂量下,联合使用cgrp受体拮抗剂及cgrp抗体后可显著增强肿瘤饥饿治疗的疗效。
附图说明
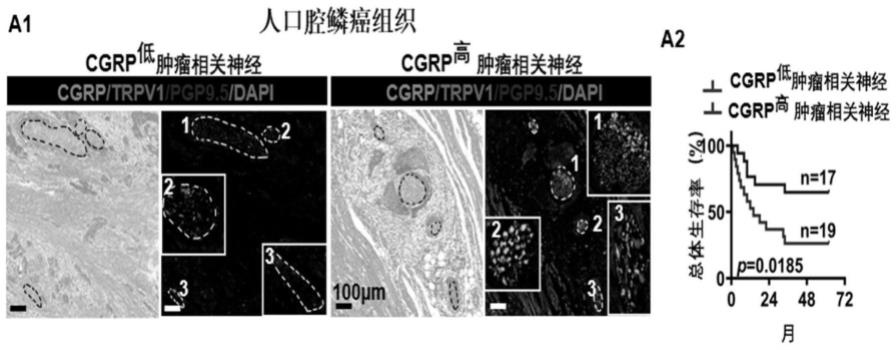
15.图1为及神经源性cgrp在肿瘤微环境中的表达及与头颈鳞状细胞癌患者预后的相关性;图a1为人头颈鳞状细胞癌组织中,伤害性感觉神经与神经源性cgrp的表达实例;图a2为肿瘤微环境中神经源性cgrp表达较高的患者,其总体生存率较差且有统计学差异。
16.图2为肿瘤饥饿治疗具有促进伤害性感觉神经-肿瘤细胞交互作用的体外验证;图a1为肿瘤细胞经肿瘤饥饿治疗处理后,显著上调了神经生长因子ngf的合成;图a2为将经过饥饿治疗预处理的肿瘤细胞与大鼠三叉神经节共培养,可以显著上调三叉神经节中cgrp的合成。
17.图3为肿瘤饥饿治疗具有促进伤害性感觉神经-肿瘤细胞交互作用的体内验证;图a1为经过肿瘤饥饿治疗的舌移植瘤小鼠,其舌移植瘤中ngf表达显著上调,其三叉神经节中磷酸化trka的表达显著上调;图a2为经过肿瘤饥饿治疗的舌移植瘤小鼠,其三叉神经节中cgrp的含量显著上调;图a3为对图a1中westernblot结果的定量分析。
18.图4为小鼠口腔鳞癌原位移植瘤模型中cgrp受体抑制剂(rimegepant)增强多种肿瘤饥饿治疗药物(2-dg、氯尼达明、贝伐珠单抗及安罗替尼)抗肿瘤疗效的验证。
19.图5为小鼠口腔黏膜恶性黑色素瘤原位移植瘤模型中cgrp受体抑制剂(rimegepant)增强2-dg抗肿瘤疗效的验证。
具体实施方式
20.本发明提供伤害性感觉神经细胞调控药物在制备增强肿瘤饥饿治疗疗效产品中的用途。
21.所述“增强肿瘤饥饿治疗疗效产品”为本身无肿瘤饥饿治疗作用,与肿瘤饥饿治疗产品配合使用能实现以下效果中的一种或多种的产品:减小肿瘤体积、降低肿瘤中神经生长因子(ngf)的表达或者降低肿瘤中磷酸化神经生长因子受体(trka)的表达。
22.所述伤害性感觉神经细胞调控药物至少包含降钙素基因相关肽受体(clr)抑制剂或降钙素基因相关肽(cgrp)抑制剂的一种或多种。
23.进一步地,所述clr抑制剂为抑制clr表达的物质、能特异性与clr结合并限制clr结合其配体的物质。所述clr抑制剂选自核酸分子、抗体、多肽或小分子化合物中的一种或多种。在一些具体实施方案中,所述clr抑制剂为小分子化合物或抗体。优选地,所述小分子化合物为瑞美吉泮(rimegepant)、乌布吉泮(ubrogepant)、扎维吉泮(zavegepant)或阿托吉泮(atogepant)中的一种或几种。所述抗体为厄瑞努单抗(erenumab)。更优选地,所述小分子化合物为rimegepant。
24.进一步地,所述cgrp抑制剂为抑制cgrp表达的物质、能特异性与cgrp结合的物质、或特异性与cgrp的靶标结合的物质。所述cgrp抑制剂选自核酸分子、抗体、多肽或小分子化合物中的一种或多种。在一些具体实施方案中,所述cgrp抑制剂为抗体。优选地,所述抗体为单克隆抗体。优选地,所述单克隆抗体为瑞玛奈珠单抗(fremanezumab)、伽奈珠单抗(galcanezumab)或依普奈珠单抗(eptinezumab)的一种或几种。
25.在一些具体实施方案中,所述伤害性感觉神经细胞调控药物的剂型选自注射剂、片剂、胶囊剂、气雾剂、滴眼剂或滴鼻剂中的一种或多种。
26.进一步地,所述伤害性感觉神经细胞调控药物通过肿瘤微环境增强肿瘤饥饿治疗疗效。
27.进一步地,所述肿瘤微环境包含成纤维细胞、巨噬细胞、t细胞或伤害性感觉神经细胞中的一种或几种。优选地,所述肿瘤微环境至少包含伤害性感觉神经细胞。
28.进一步地,所述伤害性感觉神经细胞调控药物通过阻断肿瘤微环境中伤害性感觉神经细胞与肿瘤细胞间的交互调控增强肿瘤饥饿治疗疗效。
29.在一些具体实施方案中,所述肿瘤的类型选自肾上腺皮质癌、膀胱尿路上皮癌、乳腺癌、宫颈鳞状细胞癌、宫颈内腺癌、胆管癌、结肠腺癌、淋巴样肿瘤、弥散性大b细胞淋巴瘤、食管癌、多形性成胶质细胞瘤、肾嫌色细胞癌、肾透明细胞癌、肾乳头状细胞癌、急性髓性白血病、脑低度胶质瘤、肝细胞癌、肺鳞状细胞癌、间皮细胞癌、卵巢癌、胰腺癌、嗜铬细胞瘤、副神经节瘤、前列腺癌、肉瘤、胃癌、睾丸生殖细胞肿瘤、甲状腺癌、胸腺癌、子宫内膜癌、子宫肉瘤、葡萄膜黑色素瘤、多发性骨髓瘤、急性淋系白血病、慢性淋系白血病、慢性髓性白血病、t细胞淋巴瘤、b细胞淋巴瘤、头颈部恶性肿瘤、胰腺癌、皮肤黑色素瘤、肺癌、胃癌或结
直肠癌中的一种或多种。
30.进一步地,所述头颈部恶性肿瘤包括黏膜鳞状细胞癌、黏膜恶性黑色素瘤、软组织/骨肉瘤或唾液腺恶性肿瘤中的一种或多种。优选地,所述头颈部恶性肿瘤至少为黏膜鳞状细胞癌。更优选地,所述黏膜鳞状细胞癌为口腔粘膜鳞状细胞癌。
31.本发明还提供伤害性感觉神经细胞调控药物和肿瘤饥饿治疗药物的药物组合物在制备肿瘤饥饿治疗产品中的用途。
32.所述肿瘤饥饿治疗产品还包含抗肿瘤代谢的药物或抗肿瘤血管生成的药物。所述抗肿瘤代谢的药物用于阻断肿瘤营养代谢关键通路,所述抗肿瘤血管生成的药物用于抑制肿瘤血管生成。
33.进一步地,所述抗肿瘤代谢的药物选自抗糖酵解的药物、抗谷氨酰胺代谢通路的药物、抗脯氨酸代谢环路的药物、抗精氨酸代谢环路的药物、抗天冬酰胺代谢环路的药物或抗精氨酸代谢环路的药物中的一种或多种。优选地,所述抗肿瘤代谢的药物为抗糖酵解的药物。在一些具体实施方案中,所述抗糖酵解的药物包括2-脱氧-d-葡萄糖(2-dg)、3-羟基苯甲酸-3-(氟-1,2-亚苯基)酯(wzb117)、氯尼达明或死亡受体刺激(fas)敏化剂(fasentin)中的一种或多种。
34.进一步地,所述抗肿瘤血管生成的药物选自抗促血管生成因子的药物、促进凝血反应发生的药物或阻断肿瘤血管的药物中的一种或多种。所述抗促血管生成因子的药物选自抗血管内皮生长因子(vegf)的药物、抗血管内皮生长因子受体(vegfr)的药物、抗纤维细胞生长因子(fgf2)的药物或抗纤维细胞生长因子受体(fgfr)的药物的一种或多种。优选地,所述抗抗肿瘤血管生成的药物选自抗促血管生成因子的药物。更优选地,抗促血管生成因子的药物为抗血管内皮生长因子(vegf)的药物或抗血管内皮生长因子受体(vegfr)的药物。
35.在一些具体实施方案中,所述抗肿瘤血管生成的药物为vegf或vegfr抑制剂。
36.vegf或vegfr抑制剂指对于vegf或vegf具有抑制效果的分子。对于vegf或vegf具有抑制效果包括:抑制vegf或vegf的表达或活性。
37.抑制vegf或vegf活性是指使vegf或vegf活力下降。优选地,相比抑制前,vegf或vegf活力下降至少10%,较佳的降低至少30%,再佳的降低至少50%,更佳的降低至少70%,最佳的降低至少90%。
38.抑制vegf或vegf表达具体的可以是抑制vegf或vegf基因的转录或翻译,具体的,可以是指:使vegf或vegf的基因不转录,或降低vegf或vegf的基因的转录活性,或者使vegf或vegf的基因不翻译,或降低vegf或vegf的基因的翻译水平。
39.所述vegf或vegf抑制剂选自vegf/vegfr通路抑制剂类药物或小分子多靶点酪氨酸激酶抑制剂类药物。
40.在一些具体实施方案中,所述vegf/vegfr通路抑制剂类药物选自贝伐珠单抗、雷珠单抗、雷莫芦单抗、阿柏西普或康柏西普中的一种或多种;
41.在一些具体实施方案中,小分子多靶点酪氨酸激酶抑制剂类药物选自索拉非尼、舒尼替尼、卡博替尼、凡德替尼、阿帕替尼、索凡替尼、仑伐替尼、瑞戈非尼、呋喹替尼、帕唑帕尼、阿昔替尼、尼拉尼布、西地尼布或安罗替尼中的一种或多种。
42.优选地,所述抗肿瘤血管生成的药物为贝伐珠单抗、安罗替尼和阿帕替尼中的一
种或多种。
43.进一步地,所述肿瘤饥饿治疗产品还包含药学上可接受的载体或辅料。
44.所述药学上可接受的载体或辅料应当与所述肿瘤饥饿治疗药物的有效成分相容,即能与其共混而不会在通常情况下大幅度降低药物的效果。可作为药学上可接受的载体或辅料的一些物质的具体例子选自透明质酸钠凝胶,糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如甲基纤维素钠、乙基纤维素或甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸或硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油或可可油;多元醇,如丙二醇、甘油、山梨糖醇、甘露糖醇或聚乙二醇;海藻酸;乳化剂,如tween;润湿剂,如月桂基硫酸钠;着色剂;调味剂;压片剂、稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐溶液;磷酸盐缓冲液中的一种或多种。这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味。
45.本发明还提供一种肿瘤饥饿治疗产品,所述产品的有效成分包含肿瘤饥饿治疗药物和伤害性感觉神经细胞调控药物。所述伤害性感觉神经细胞调控药物至少包含clr抑制剂或cgrp抑制剂的一种或多种;优选的,所述clr抑制剂选自以下任一种或多种药物或其有效成分:瑞美吉泮、乌布吉泮、扎维吉泮、阿托吉泮或厄瑞努单抗;和/或,所述肿瘤饥饿治疗药物选自以下任一种或多种药物或其有效成分:氯尼达明、安罗替尼、贝伐珠单抗和2-脱氧-d-葡萄糖。
46.进一步地,所述肿瘤饥饿治疗产品选自以下任一项或其有效成分:
47.1)氯尼达明和瑞美吉泮;
48.2)安罗替尼和瑞美吉泮;
49.3)贝伐珠单抗和瑞美吉泮;
50.4)2-脱氧-d-葡萄糖和瑞美吉泮。
51.本发明还提供一种肿瘤饥饿治疗方法,所述肿瘤饥饿治疗方法包括向有需要的受试者施用治疗安全有效量的所述肿瘤饥饿治疗产品。所述安全有效量对于本领域技术人员来说应该是可以调整的。在一些具体实施方案中,所述肿瘤饥饿治疗产品的施用量依赖于患者的体重、应用的类型、疾病的病情和严重程度,例如,作为活性成分的所述双功能化合物的施用量为1~1000mg/kg/day、1~3mg/kg/day、3~5mg/kg/day、5~10mg/kg/day、10~20mg/kg/day、20~30mg/kg/day、30~40mg/kg/day、40~60mg/kg/day、60~80mg/kg/day、80~100mg/kg/day、100~200mg/kg/day、200~500mg/kg/day、或大于500mg/kg/day。
52.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
53.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实
现本发明。
54.实施例1人头颈鳞状细胞癌组织中伤害性感觉神经及神经源性cgrp染色及神经源性cgrp与患者总体生存率关系
55.本实施例通过对临床人头颈鳞状细胞癌组织中伤害性感觉神经及神经源性cgrp进行染色,并分析神经源性cgrp与患者总体生存率关系。分析结果如图1所示:肿瘤微环境中存在伤害性感觉神经与神经源性cgrp(图1a1),且肿瘤微环境中神经源性cgrp表达较高的患者其总体生存率较表达较低患者的差(图1a2),提示神经源性cgrp可能参与肿瘤的恶性进展。
56.实施例2抗肿瘤药物在体外促进伤害性感觉神经-肿瘤细胞的交互作用
57.本实施例验证了在体外模拟条件下,肿瘤饥饿治疗(抗糖酵解治疗:2-dg、wzb117、氯尼达明和fsentin;抗肿瘤血管生成治疗:安罗替尼)可以促进伤害性感觉神经-肿瘤细胞间交互作用。
58.具体的实验步骤如下:
59.步骤1:用5mm 2-dg、200μm wzb117、100μm氯尼达明、200μm fasentin或5μm安罗替尼分别处理头颈鳞癌细胞cal27 24小时;
60.步骤2:如图2a1所示,通过qpcr检测发现经肿瘤饥饿治疗处理的肿瘤细胞显著上调了神经生长因子ngf的合成,其中**为p《0.01,***为p《0.001;
61.步骤3:使用boyden chamber共培养模型,将经过肿瘤饥饿治疗预处理的肿瘤细胞与大鼠三叉神经节共培养;
62.步骤4:如图2a2所示,经过肿瘤饥饿治疗预处理的肿瘤细胞可以显著上调三叉神经节中cgrp的合成,其中*为p《0.05,**为p《0.01。
63.通过本实例证明,包含抗糖酵解治疗和抗肿瘤血管生成治疗的多种抗肿瘤药物可以在体外促进伤害性感觉神经-肿瘤细胞的交互作用。
64.实施例3肿瘤饥饿治疗促进伤害性感觉神经-肿瘤细胞间交互作用
65.本实施例验证了在体内小鼠舌原位移植瘤模型中,肿瘤饥饿治疗(抗糖酵解治疗:氯尼达明和fasentin;抗肿瘤血管生成治疗:安罗替尼和贝伐珠单抗)可以促进伤害性感觉神经-肿瘤细胞间交互作用。
66.具体步骤如下:
67.步骤1:构建balb/c-nu免疫缺陷小鼠舌原位移植瘤模型;
68.步骤2:采用从生物公司购置的六周大小的balb/c-nu免疫缺陷小鼠用于构建舌原位移植瘤;
69.具体地:将50000个人头颈鳞癌细胞cal27重悬于25μl pbs中(含有10%体积分数的matrigel matrix基质胶);将小鼠全身麻醉后接种肿瘤细胞悬液至小鼠舌体上;
70.步骤3:肿瘤接种后第三天对小鼠进行肿瘤饥饿治疗,具体药物剂量为:fasentin(50mg/kg,每天一次,腹腔注射)、氯尼达明(50mg/kg,每天一次,腹腔注射)、安罗替尼(1.5mg/kg,一周5次,腹腔注射)或贝伐珠单抗(2mg/kg,一周两次,皮下注射);
71.步骤4:根据对照组肿瘤生长速度及动物福利相关规定,在肿瘤接种后18天对所有动物实施安乐死,取出小鼠舌移植瘤与小鼠三叉神经节;
72.步骤5:对小鼠舌移植瘤进行免疫印迹实验,如图3a1所示,经肿瘤饥饿治疗的舌移
植瘤中ngf的表达明显上调;
73.步骤6:对部分小鼠三叉神经节进行免疫印迹实验,如图3a1所示,经肿瘤饥饿治疗的小鼠,其三叉神经节中磷酸化的trka明显上调;
74.步骤7:对部分小鼠三叉神经节进行cgrp含量的elisa检测,如图3a2所示,经肿瘤饥饿治疗的小鼠,其三叉神经节中cgrp的含量明显上调。
75.本实例表明:在体内小鼠口腔原位移植瘤模型中,肿瘤饥饿治疗可以促进伤害性感觉神经-肿瘤细胞间交互作用。
76.实施例4cgrp受体抑制剂增强肿瘤饥饿治疗在口腔鳞癌原位移植瘤中的疗效
77.本实施例验证了在体内小鼠口腔鳞癌原位移植瘤模型中,使用cgrp受体抑制剂(rimegepant)可以显著增强肿瘤饥饿治疗(抗糖酵解治疗:氯尼达明和2-dg;抗肿瘤血管生成治疗:安罗替尼和贝伐珠单抗)的疗效。
78.具体步骤如下:
79.步骤1:构建balb/c-nu免疫缺陷小鼠口腔原位移植瘤模型;
80.步骤2:采用从生物公司购置的六周大小的balb/c-nu免疫缺陷小鼠用于构建口腔原位移植瘤。具体地:将50000个人头颈鳞癌细胞cal27重悬于25μl pbs中(含有10%体积分数的matrigel matrix基质胶);将小鼠全身麻醉后接种肿瘤细胞悬液至小鼠舌体上;
81.步骤3:肿瘤接种后第三天对小鼠进行对照、单药或联合药物治疗,具体药物剂量为:rimegepant(20mg/kg,每天一次,腹腔注射)、2-dg(300mg/kg,每天一次,腹腔注射)、氯尼达明(50mg/kg,每天一次,腹腔注射)、安罗替尼(1.5mg/kg,一周5次,腹腔注射)或贝伐珠单抗(2mg/kg,一周两次,皮下注射)。
82.步骤4:根据对照组肿瘤生长速度及动物福利相关规定,在肿瘤接种后18天对所有动物实施安乐死,取出小鼠舌移植瘤计算体积,分析每种药物单独治疗及与rimegepant联合治疗后小鼠舌移植瘤的体积差异
83.步骤5:如图4所示,使用以上剂量的单药对舌移植瘤的生长无明显抑制作用,但联合使用rimegepant后可以显著增强肿瘤饥饿治疗的疗效。
84.本实例表明:使用cgrp受体抑制剂rimegepant可以有效增强肿瘤饥饿治疗的疗效。实施例5cgrp受体抑制剂增强肿瘤饥饿治疗在口腔黑色素原位移植瘤中的疗效
85.本实施例验证了在体内小鼠口腔黑色素瘤原位移植瘤模型中,使用cgrp受体抑制剂(rimegepant)可以显著增强肿瘤饥饿治疗(2-dg)的疗效。
86.具体步骤如下:
87.步骤1:构建balb/c-nu免疫缺陷小鼠口腔原位移植瘤模型;
88.步骤2:采用从生物公司购置的六周大小的balb/c-nu免疫缺陷小鼠用于构建口腔黑色素瘤原位移植瘤。具体地:将50000个黑色素瘤细胞b16f10重悬于25μl pbs中(含有10%体积分数的matrigel matrix基质胶);将小鼠全身麻醉后接种肿瘤细胞悬液至小鼠舌体上;
89.步骤3:肿瘤接种后第三天对小鼠进行对照、单药或联合药物治疗,具体药物剂量为:rimegepant(20mg/kg,每天一次,腹腔注射)、2-dg(300mg/kg,每天一次,腹腔注射)。
90.步骤4:根据对照组肿瘤生长速度及动物福利相关规定,在肿瘤接种后18天对所有动物实施安乐死,取出小鼠舌移植瘤计算体积,分析每种药物单独治疗及与rimegepant联
合治疗后小鼠舌移植瘤的体积差异
91.步骤5:如图5所示,使用以上剂量的单药对舌移植瘤的生长无明显抑制作用,但联合使用rimegepant后可以显著增强肿瘤饥饿治疗的疗效。
92.本实例表明:使用cgrp受体抑制剂rimegepant可以有效增强肿瘤饥饿治疗的疗效。
93.以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1