一种利格列汀片及其制备方法与流程
1.本发明涉及药物制剂技术领域,尤其涉及一种利格列汀片及其制备方法。
背景技术:
2.利格列汀是一种具有黄嘌呤骨架的口服选择性dpp-4(二肽基肽酶4)抑制剂,其对dpp-4有很高的选择性,作用持续时间长,可以每日服用一次便可达到预期的疗效。在人体中,dpp-4能够降解肠促胰岛素激素样多肽-1(glp-1)和葡萄糖依赖性促胰岛素多肽(gip),而利格列汀能够升高活性肠促胰岛素激素的浓度,以葡萄糖依赖性的方式刺激胰岛素释放,降低循环中的胰高血糖素水平。一天中肠促胰岛素分泌维持较低的基础水平,进餐后立即升高;在葡萄糖水平正常或升高的条件下,glp-1和gip都能增加胰腺β-细胞胰岛素的生物合成和分泌;此外,glp-1还能减少胰腺α细胞的胰高血糖素分泌,肝葡萄糖排出量减少。
3.利格列汀片(linagliptin)是由勃林格殷格翰公司开发的,最早于2011年5月在美国经fda批准上市,规格为5mg,随后,勃林格殷格翰的利格列汀片在欧盟和日本等多个国家/地区获批上市,并于2013年获批进口中国。利格列汀片除去包衣后显白色或类白色,在原研专利200780016227.3公开了其组成成分,其中包括利格列汀及其稀释剂甘露醇、预交化淀粉,粘合剂共聚乙烯吡咯烷酮,崩解剂玉米淀粉,润滑剂硬脂酸镁和包衣,其包衣中含有羟丙基甲基纤维素、聚乙二醇、滑石粉、二氧化钛及氧化铁等,上述辅料均为湿法制粒的常用辅料。由于利格列汀属于高溶解性药物,辅料及工艺的调整,会影响产品及其质量,主要对杂质的增加会有影响。
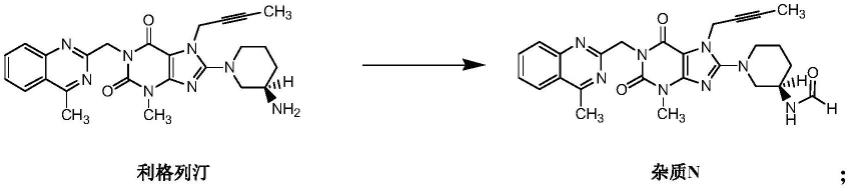
4.利格列汀的杂质主要为杂质n和杂质o。其中,杂质n为制剂中主要的降解产物,由利格列汀在高温或高温高湿下和制剂中的辅料反应生成杂质n,具体生成过程如下:
[0005][0006]
而杂质o为利格列汀酸降解产生:
[0007][0008]
原研专利工艺为湿法制粒,而湿法制粒难以控制杂质n的增长。本发明申请人在前期研究中建立一种利格列汀片的配方及工艺,相关配方和工艺记载在专利202211154627.3中,专利记载的配方配合干法制粒及内外双重颗粒工艺,具备良好的溶出和稳定性。但上述
专利中记载的配方与原研配方存在较大差异。在进一步的研究中,申请人将所述工艺进一步用于原研相似配方的研究,并经过研究调整,得到一种同样具备优异的稳定性和溶出性能的利格列汀片制备工艺。
技术实现要素:
[0009]
为了解决上述技术问题,本发明提供了一种利格列汀片及其制备方法。本发明在利格列汀片的制备方法中采用干法制粒工艺,并设计专门的多重颗粒制备工艺,进而实现有效控制利格列汀溶出和杂质增长的效果。
[0010]
基于上述发现,第一方面,本发明提供了一种利格列汀片,包括包衣和素片,以重量份计,所述素片包括:
[0011][0012][0013]
作为本发明的一种优选技术方案,以重量份计,所述素片由如下组分组成:
[0014][0015]
本发明组合物还包括包衣,通过对包衣工艺的控制,将包衣增重控制在片重的2-5%,优选在3%左右;包衣成分可以包括高分子聚合物、增塑剂、着色剂等多种成分,优选如欧巴代ii。
[0016]
其中,所述共聚维酮优选为共聚维酮va64共聚维酮。
[0017]
第二方面,本发明提供了第一方面所述的利格列汀片的制备方法,所述制备方法包括如下步骤:
[0018]
(1)将利格列汀、预胶化淀粉和部分甘露醇混合,并通过干法制粒,得到内颗粒;
[0019]
(2)将内颗粒与玉米淀粉、剩余甘露醇和共聚维酮混合,并通过干法制粒,得到药物颗粒;
[0020]
(3)将药物颗粒和硬脂酸钙混合,并压片;
[0021]
(4)包衣。
[0022]
本发明利格列汀片采用的多重干法颗粒的制剂形式,同样能够有效控制利格列汀的溶出和杂质增长的问题。
[0023]
本发明整体采用干法制粒工艺,并且设计专用的多重颗粒工艺,能够有效地控制利格列汀片溶出和杂质增长的问题。
[0024]
作为本发明的一种优选技术方案,所述步骤(1)为:将利格列汀、预胶化淀粉和30-50wt%甘露醇混合均匀,并通过干法制粒机制备得到内颗粒。
[0025]
作为本发明的一种优选技术方案,所述步骤(1)为:将利格列汀、预胶化淀粉和30-50wt%甘露醇混合均匀,得到混合物料,将混合物料置于干法制粒机料斗中,设置压辊速率、压辊间隙、整理速度和筛网孔径,制备得到内颗粒。
[0026]
作为本发明的一种优选技术方案,所述步骤(1)为:将利格列汀、预胶化淀粉和50wt%甘露醇混合均匀,将混合物料置于干法制粒机料斗中,压辊速度10rpm,压辊间隙1.0mm,整粒速度100rpm,筛网孔径0.8mm,制备得到内颗粒。
[0027]
作为本发明的一种优选技术方案,所述步骤(2)为:将内颗粒与玉米淀粉、剩余甘露醇和共聚维酮混合均匀,并通过干法制粒机制备得到药物颗粒。
[0028]
作为本发明的一种优选技术方案,所述步骤(2)为:将内颗粒与玉米淀粉、剩余甘露醇和共聚维酮混合均匀,将混合物料置于干法制粒机料斗中,压辊速度10rpm,压辊间隙1.0mm,整粒速度100rpm,筛网孔径1.2mm,得到药物颗粒。
[0029]
作为本发明的一种优选技术方案,所述步骤(3)为:将药物颗粒与硬脂酸钙混合5min以上,并压片。
[0030]
作为本发明的一种优选技术方案,在所述步骤(4)中,控制包衣增重在2.0-5.0%,优选2.0-4.0%,更优选约3%;本发明中的包衣可以选择用欧巴代水溶性薄膜包衣材料,如欧巴代i或欧巴代ii。
[0031]
作为本发明的一种具体实施方式,所述制备方法包括:
[0032]
(1)称取处方量的利格列汀及各辅料成分;
[0033]
(2)将利格列汀、预胶化淀粉和50%的甘露醇投入至混合罐的料斗中混合均匀,将混合均匀的物料置于干法制粒机料斗中,压辊速度10rpm,压辊间隙1.0mm,整粒速度100rpm,筛网孔径0.8mm,制备得到内颗粒;
[0034]
(3)将制备的内颗粒与玉米淀粉、剩余甘露醇和共聚维酮投入至混合罐的料斗中混合均匀,将混合均匀的物料置于干法制粒机料斗中,压辊速度10rpm,压辊间隙1.0mm,整粒速度100rpm,筛网孔径1.2mm,制备得到药物颗粒;
[0035]
(4)将制备的药物颗粒与外加硬脂酸钙混合5min以上并压片;
[0036]
(5)包衣:增重约3%(约5.4mg/片)。
[0037]
本发明实施例提供的技术方案与现有技术相比具有如下优点:
[0038]
本发明提供的利格列汀片具有较好的溶出行为,符合仿制药一致性的要求,并且具有优异的稳定性,在高温高湿环境下也不会导致杂质的增长。
具体实施方式
[0039]
为了能够更清楚地理解本发明的上述目的、特征和优点,下面将对本发明的方案进行进一步描述。需要说明的是,在不冲突的情况下,本发明的实施例及实施例中的特征可
以相互组合。
[0040]
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但本发明还可以采用其他不同于在此描述的方式来实施;显然,说明书中的实施例只是本发明的一部分实施例,而不是全部的实施例。
[0041]
实施例1
[0042]
本实施例提供了一种利格列汀片及其制备方法。
[0043]
利格列汀片的组成成分见表1:
[0044]
表1
[0045][0046][0047]
制备方法如下:
[0048]
(1)称取处方量的利格列汀及各辅料成分;
[0049]
(2)将利格列汀、预胶化淀粉和50%的甘露醇投入至混合罐的料斗中混合均匀,将混合均匀的物料置于干法制粒机料斗中,压辊速度10rpm,压辊间隙1.0mm,整粒速度100rpm,筛网孔径0.8mm,制备得到内颗粒;
[0050]
(3)将制备的内颗粒与玉米淀粉、剩余甘露醇和共聚维酮va64投入至混合罐的料斗中混合均匀,将混合均匀的物料置于干法制粒机料斗中,压辊速度10rpm,压辊间隙1.0mm,整粒速度100rpm,筛网孔径1.2mm,制备得到药物颗粒;
[0051]
(4)将制备的药物颗粒与硬脂酸钙混合5min以上并压片;
[0052]
(5)包衣:控制包衣增重约3%,使用包衣材料为欧巴代ii。
[0053]
对比例1
[0054]
本对比例提供了一种原研专利配方及工艺。
[0055]
原研专利配方见表2:
[0056]
表2
[0057][0058][0059]
制备方法如下:
[0060]
(1)将处方量的甘露醇、利格列汀、玉米淀粉、预胶化淀粉依次投入制粒机中混合5min,然后再通过蠕动泵喷液的形式加入粘合剂(共聚维酮)溶液进行制粒,制粒参数:搅拌3r/s,剪切25r/s;
[0061]
(2)将制粒完成后的湿颗粒,通过6
×
6mm筛网进行湿整粒;
[0062]
(3)将整粒完成的湿颗粒转移到流化床中进行干燥,设置进风温度55-65℃,水分《2.0%,安装1.2mm筛网,使用整粒机将干燥完的颗粒进行整粒;
[0063]
(4)将整粒后的颗粒加入到混合罐中,再加入硬脂酸镁混合5min,并压片;
[0064]
(5)包衣,控制增重在3%。
[0065]
对比例2
[0066]
本对比例提供了一种利格列汀片及其制备方法。
[0067]
与实施例1的区别在于,在本对比例中,将预胶化淀粉置于步骤(3)中添加,其余方法相同。
[0068]
性能测试
[0069]
(1)在温度40
±
2℃,相对湿度75
±
5%rh恒温恒湿条件下放置6个月,参照中国药典2010版二部附录vd含量测定的方法分别检测实施例和对比例提供的利格列汀片放置1、2、3、6个月前后的杂质含量,参比制剂采用市售利格列汀片,结果见表3。
[0070]
表3
[0071][0072][0073]
由表3可知,本发明得到的利格列汀片的稳定性同样明显优于湿法制粒(对比例1),在杂质n的控制和总杂控制方面均优于后者。同时,与对比例2的比较,其效果虽有略微改善,但并不明显。但从结果可知,相比于将成分直接混合进行湿法制粒并总混的方式,采用本发明提供的多重颗粒工艺能够增加利格列汀片的稳定性。这一结果与在前研究结果一致。
[0074]
(2)以900ml,0.1m hcl为溶出介质,桨法50转,参照中国药典2020年版四部通则0931第一法:溶出度与释放度测定法,经5、10、15、30、30、45、60min时,取样检测并计算利格列汀的溶出(%),结果见表4;
[0075]
表4
[0076][0077]
由表4可知,本发明提供的利格列汀片的溶出行为与参比制剂接近,完全符合相关法规要求。这一结果也与本发明申请人在前研究结果一致。
[0078]
需要说明的是,在本文中,诸如“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
[0079]
以上所述仅是本发明的具体实施方式,使本领域技术人员能够理解或实现本发明。对这些实施例的多种修改对本领域的技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所述的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1