具有修复基质的医用敷料
1.本发明大体涉及生物医学工程技术领域,具体涉及一种具有修复基质的医用敷料。
背景技术:
2.随着现代医学技术的发展,近年来人们逐渐认识到创面愈合与伤口所处的环境息息相关,使创面维持在具有适量创伤部分分泌的渗出液的湿润环境下有利于创伤的愈合。
3.传统的医用敷料通常是由纱布、绷带、棉花等亲水物质构成,通过敷贴在创面上以实现引流等作用。出于保持创面清洁、或者需要换药的目的,通常需要周期性的更换新的敷料,而传统的医用敷料具有较强的吸水性且比较干燥,一般无法在为创面提供合适的湿润环境,影响创面的愈合速度,并且容易粘附伤口,在从伤口上剥离敷料时可能会对伤口造成重复性组织损伤(二次伤害),此外,在剥离时敷料的纤维容易脱落留存在伤口上,可能会造成异物反应,影响伤口的愈合。
4.公开号为cn104287890a的专利文献中公开了一种创伤敷料,其具有层叠设置的透液层、透液限制层、吸收保持层、以及保护层,透液层具有多个贯通孔,并通过毛细作用引导伤口渗出的渗液向贯通孔内移动以对渗液进行积存,且通过透液限制层使贯通孔内渗液的液压处于预定范围,从而使创面的整体表面处于湿润环境中。虽然该专利文献公开的创伤敷料能够使创面处于湿润环境中,但是由于渗出液中也含有炎症介质、杂菌等物质,若过多的渗出液长时间堆积在创面上,可能会导致出现伤口死腔(即以坏死组织为主的空腔)、伤口感染等情况,影响创面的愈合。
5.因此,需要一种能够提供良好的愈合环境、且易于从伤口表面剥离的敷料。
技术实现要素:
6.本公开有鉴于上述现有状况,其目的在于提供一种能够提供良好的愈合环境、且易于从目标表面剥离的医用敷料及其制备方法。
7.为此,本公开提供了一种具有修复基质的医用敷料,其包括中间层、设置在所述中间层上的水溶性的修复基质、以及分别设置在所述中间层相对两面的上底层和下底层,所述中间层具有超亲水性且内部在纵向方向上具有不同的吸水性,所述中间层具有呈多孔状的吸附结构,所述修复基质附着于所述吸附结构,所述上底层具有疏水性,所述下底层具有面向所述中间层的内表面、与所述内表面相对的外表面、贯通所述内表面和所述外表面的多个通孔、以及设置在所述外表面上的超疏水结构,所述超疏水结构包括间隔布置在所述外表面上的多个微米级凸起、以及设置在所述微米级凸起的表面上的纳米颗粒,当所述医用敷料敷贴于具有液层的目标表面时,所述目标表面与所述通孔相对应的第一区域上的液体经由所述通孔而被所述中间层吸收以使所述第一区域和所述通孔保持干燥,所述目标表面与所述超疏水结构相对应的第二区域上的液体至少部分地被保持,并且在所述第一区域上的液体经由所述通孔而被所述中间层吸收的过程中,所述修复基质溶解于所述液体且通
过所述液体而扩散至所述目标表面。
8.在本公开中,医用敷料具有上底层、中间层和下底层,通过将上底层设置为疏水层,能够有效抵抗外部环境中的污染物进入敷料;通过设置在下底层的外表面上的超疏水结构,能够使外表面具有超疏水性能,在医用敷料敷贴于具有液层的目标表面时,能够使目标表面与超疏水结构相对应的第二区域上的液体至少部分地被保持,以使第二区域处于湿润环境中;中间层能够通过贯通下底层的通孔而吸收目标表面与通孔相对应的第一区域上的液体,从而使第一区域和通孔内保持干燥;在第一区域上的液体经由通孔而被中间层吸收的过程中,附着在中间层的修复基质能够溶解于液体并经由液体而扩散至目标表面;而且通过将中间层配置为使其内部在纵向方向上具有不同的吸水性,能够根据目标表面的情况选择具有合适吸水性的医用敷料。
9.在这种情况下,当目标表面为创面时,将本公开的医用敷料敷贴至创面上,通过中间层对伤口多余的渗出液的吸附,能够使创面上的第一区域处于干燥的环境中,通过下底层能够使第二区域处于湿润状态且未浸泡在液体中,另外,在中间层通过通孔对渗出液进行吸附的过程中,水溶性的修复基质溶于渗出液中,并且通过渗出液而扩散至创面,能够有利于创面愈合,通过下底层和中间层的配合,既能够有效减少死腔对伤口愈合带来的不利影响,也能够为创面提供良好的愈合环境;而且不同阶段的创面所需的愈合环境有所不同,本公开的医用敷料的中间层内部在纵向方向上具有不同的吸水性,能够根据创面的愈合情况选择合适的吸水性,为创面提供良好的愈合环境;当需要将医用敷料从创面剥离时,由于第二区域处于湿润环境中,下底层与伤口接触的表面(即外表面)上的超疏水性能能够使其对伤口分泌物以及伤口表面的肉芽组织等表现出防粘连性能,能够减少外表面与伤口新生的肉芽组织的粘连,使其易于从创面剥离,从而避免对伤口造成继发性伤害,而且由于下底层的间隔,中间层的敷料纤维不易脱落至创面,能够有效减少伤口的异物反应;此外,通过上底层能够有效抵抗外部环境中的污染物进入敷料,起到屏障作用,从而降低创面的感染风险。
10.另外,在本公开所涉及的医用敷料中,可选地,所述中间层具有面向所述下底层的下表面以及面向所述上底层的上表面,所述中间层的吸水性从所述下表面至所述上表面逐渐增强或逐渐减弱。在这种情况下,能够根据创面的愈合情况选择当中间层的吸水性从下表面至上表面逐渐增强时,能够通过中间层快速吸收创面上多余的渗出液,处于下层的相对低亲水性的区域有助于形成一个间隔吸附液体与伤口的空气空腔,能够为处于早期阶段的创面提供良好的愈合环境;当中间层的吸水性从下表面至上表面逐渐减弱时,能够使创面上的第一区域处于湿润的环境空气状态中,从而为处于中后期阶段的创面提供良好的愈合环境。
11.另外,在本公开所涉及的医用敷料中,可选地,所述修复基质包括间充质干细胞的上清液。间充质干细胞的上清液中含有能够促进伤口愈合的物质,在这种情况下,当修复基质与创面接触时,能够有利于对伤口的愈合。
12.另外,在本公开所涉及的医用敷料中,可选地,所述修复基质以冻干粉的形式附着于所述吸附结构。在这种情况下,相对于以液态/凝胶态存在的干细胞上清液来说,以冻干粉的形式存在的干细胞上清液的单位体积内的有效活性细胞因子的浓度较高,并且生物活性物质的保存期较长,将呈冻干粉形式的间充质干细胞上清液搭载于中间层时,能够使本
公开的医用敷料便于储存和临床应用。
13.另外,在本公开所涉及的医用敷料中,可选地,所述外表面上的开孔区域的面积不大于所述外表面总体面积的30%。在这种情况下,创面的大部分区域能够维持在湿润环境下,能够有利于创面愈合,也能够使医用敷料易于从创面上剥离。
14.另外,在本公开所涉及的医用敷料中,可选地,所述超疏水结构包括间隔布置在所述外表面上的多个微米级凸起、以及设置在所述微米级凸起的表面上的纳米颗粒。在这种情况下,通过在下底层的外表面设置多个微米级凸起和纳米颗粒,能够在液滴与外表面接触时,由于微米级凸起和纳米颗粒的存在,液滴与外表面之间会形成一层空气膜,阻碍液体对外表面的润湿,从而能够形成超疏水状态,使外表面具有超疏水性。
15.另外,在本公开所涉及的医用敷料中,可选地,所述微米级凸起的高度为20μm至150μm,并且所述多个微米级凸起呈阵列式排布,相邻两个微米级凸起的间距为20μm至200μm。在这种情况下,能够有利于提高外表面的疏水性能,维持第二区域处于湿润环境中,且易于从目标表面剥离;而且外表面各处的疏水性能比较均匀,能够使被保持在第二区域与外表面之间的液体形成的液层厚度大体一致,从而使第二区域的愈合速度基本一致,有利于创面愈合。
16.另外,在本公开所涉及的医用敷料中,可选地,所述纳米颗粒呈球状、锥状、或柱状,并且所述纳米颗粒的粒径为50nm至1000nm。在这种情况下,能够有利于提高外表面的疏水性能,从而便于维持湿润环境,且易于剥离。
17.另外,在本公开所涉及的医用敷料中,可选地,所述通孔的内壁上设置有所述超疏水结构。在这种情况下,能够减少液体挂在通孔的内壁上,有利于维持通孔内的干燥。
18.另外,在本公开所涉及的医用敷料中,可选地,所述通孔呈圆柱状,并且所述通孔的直径为0.5mm至3mm,相邻两个通孔的间距为1mm至5mm。在这种情况下,能够便于中间层通过通孔吸收目标表面的液体。
19.根据本公开,能够提供一种可为创面提供合适的愈合环境、且易于从创面剥离的医用敷料。
附图说明
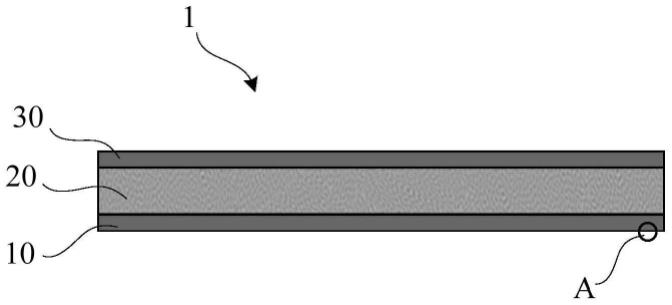
20.图1是示出了本公开的示例所涉及的医用敷料的第一实施例的示意图。
21.图2是示出了图1所示的医用敷料的剖面示意图。
22.图3是示出了图1所示的医用敷料的第一视角的分体示意图。
23.图4是示出了图1所示的医用敷料的第二视角的分体示意图。
24.图5是示出了本公开的示例所涉及的超疏水结构的示意图。
25.图6是示出了本公开的示例所涉及的医用敷料的第二实施例的示意图。
26.图7是示出了本公开的示例所涉及的医用敷料的制备方法的示意图。
27.图8是示出了本公开的示例所涉及的修复基质的制备方法的示意图。
28.附图标记说明:
[0029]1…
医用敷料,10
…
下底层,11
…
内表面,12
…
外表面,13
…
通孔,14
…
超疏水结构,141
…
微米级凸起,142
…
纳米颗粒,20
…
中间层,30
…
上底层,40
…
保护膜,50
…
第二保护膜,9
…
创面,90
…
液层,s1
…
第一区域,s2
…
第二区域。
具体实施方式
[0030]
本公开引用的所有参考文献全文引入作为参考,如同完全阐述的那样。除非另有定义,本公开所使用的技术和科学术语具有与本公开所属领域的普通技术人员通常理解相同的含义。
[0031]
以下,参考附图详细地说明本公开的优选实施方式。在下面的说明中,对于相同的部件赋予相同的符号,省略重复的说明。另外,附图只是示意性的图,部件相互之间的尺寸的比例或者部件的形状等可以与实际的不同。
[0032]
本公开涉及一种具有修复基质的医用敷料,是能够用于保护目标表面的医用敷料。本公开的具有修复基质的医用敷料可以简称为“医用敷料”或“敷料”,也可以称为吸水敷料、创伤敷料、伤口敷料等。通过本公开所涉及的医用敷料,能够吸取目标表面多余的液体,为目标表面提供适宜的湿润环境、且易于从目标表面剥离。
[0033]
在本公开中,目标表面可以是创面。其中,创面是正常皮肤(组织)受伤导致的损害,可以是例如烫伤、擦伤、切割伤、扭伤、溃疡、冻伤等情况造成的创伤。创面也可以称为伤口或创伤。在另一些示例中,目标表面也可以是例如皮肤表面的其他表面。需要说明的是,本公开涉及的医用敷料也可以作为保护层而应用于例如已结痂干燥的半愈合创面。
[0034]
当本公开的医用敷料敷贴于创面时,创面与医用敷料之间至少部分区域内存在由创面分泌的渗出液所构成的液层,从而为创面提供合适的湿润环境,此外,搭载于医用敷料的修复基质能够转移至创面,从而能够为伤口提供良好的愈合环境;当需要将其从创面剥离时,通过具有超疏水性的外表面,能够减少与伤口新生的肉芽组织的粘连,使其易于从创面剥离,从而避免对伤口造成继发性伤害(即二次伤害)。需要说明的是,在本公开中,为创面提供合适的湿润环境/愈合环境是指通过本公开的医用敷料,能够使创面湿润但不浸泡在液体中。
[0035]
以下,以目标表面为具有渗出液层的创面为例,结合附图,对本公开涉及的医用敷料进行说明。
[0036]
图1是示出了本公开的示例所涉及的医用敷料1的第一实施例的示意图。图2是示出了图1所示的医用敷料1的剖面示意图。图3是示出了图1所示的医用敷料1的第一视角的分体示意图。图4是示出了图1所示的医用敷料1的第二视角的分体示意图。在图2中,箭头示意性地表示渗出液的移动方向。另外,需要说明的是,第一视角是斜向下看的视角,第二视角是斜向上看的视角。
[0037]
在一些示例中,医用敷料1可以包括依次层叠设置的下底层10、中间层20、以及上底层30(参见图1)。上底层30可以具有疏水性,下底层10的外表面12可以具有超疏水性,中间层20可以具有超亲水性,当医用敷料1敷贴于目标表面(具有渗出液层90的创面9)时,下底层10可以与创面9接触,中间层20可以用于吸取创面9上的液体(参见图2)。
[0038]
在一些示例中,医用敷料1还可以包括中间层20、设置在中间层20上的水溶性的修复基质、以及分别设置在中间层20相对两面的上底层30和下底层10(参见图1)。在这种情况下,当医用敷料1敷贴于创面9时,修复基质可以在中间层20吸取创面9上渗出液的过程中溶解于渗出液中,并通过渗出液而扩散至创面9进行修复。
[0039]
在一些示例中,下底层10可以具有面向中间层20的内表面11、与内表面11相对的外表面12、以及贯通内表面11和外表面12的多个通孔13(参见图2)。中间层20可以通过通孔
13而吸收创面9上的液体。
[0040]
在一些示例中,下底层10还可以具有设置在外表面12上的超疏水结构14(稍后描述)。由此,能够使外表面12具有超疏水性。在本公开中,超疏水性是指表面的微水滴接触角大于150
°
,滚动角低于10
°
。也就是说,通过在外表面12上设置超疏水结构14,能够使外表面12的微水滴接触角大于150
°
,滚动角低于10
°
。
[0041]
在一些示例中,目标表面与通孔13相对应的区域为第一区域s1,与超疏水结构14相对应的区域为第二区域s2,参见图2,其中示意性地标注了部分的第一区域s1和第二区域s2。
[0042]
在一些示例中,当医用敷料1敷贴于具有液层90的目标表面时,目标表面与通孔13相对应的第一区域s1上的液体经由通孔13而被中间层20吸收以使第一区域s1和通孔13保持干燥,目标表面与超疏水结构14相对应的第二区域s2上的液体至少部分地被保持。在这种情况下,当目标表面为创面9时,将医用敷料1敷贴至创面9上,通过中间层20对伤口多余的渗出液的吸附,能够使创面9上的第一区域s1处于干燥的环境中,通过下底层10的具有超疏水性的外表面12,能够在外表面12与第二区域s2之间保持部分渗出液,使第二区域s2处于湿润的组织接触环境中,既能够有效避免死腔对伤口愈合带来的不利影响,也能够为创面9提供良好的愈合环境;当需要将医用敷料1从创面9剥离时,由于第二区域s2处于湿润环境中,下底层10与伤口接触的表面(即外表面12)上的超疏水性能能够使其对伤口分泌物以及伤口表面的肉芽组织等表现出防粘连性能,能够减少外表面12与伤口新生的肉芽组织的粘连,使其易于从创面9剥离,从而避免对伤口造成继发性伤害,而且由于下底层10的间隔,中间层20的敷料纤维不易脱落至创面9,能够有效减少伤口的异物反应。
[0043]
在一些示例中,通孔13可以呈圆柱状。也就是说,通孔13在内表面11和外表面12的孔径一致。在这种情况下,能够便于中间层20通过通孔13吸收目标表面的液体。
[0044]
在一些示例中,通孔13的直径可以为0.5mm至3mm。在这种情况下,能够便于中间层20以合适的速率从通孔13吸收目标表面上的液体(参见图2,箭头示意性地表示在中间层20吸收渗出液的过程中渗出液的移动方向),以维持通孔13和第一区域s1的干燥。
[0045]
在一些示例中,相邻两个通孔13的间距可以为1mm至5mm。在一些示例中,多个通孔13可以呈阵列式排布(参见图4)。在这种情况下,外表面12上未穿孔的区域(即设有超疏水结构14的区域)也均匀分布,从而能够便于剥离。
[0046]
在一些示例中,外表面13上的开孔区域的面积不大于外表面13总体面积的30%。也就是说,多个通孔3在外表面13上所占的面积不大于外表面13总体面积的30%。在这种情况下,与外表面13的未开孔区域相对应的创面9上的大部分区域能够维持在湿润环境下,能够有利于创面9愈合,也能够使医用敷料1易于从创面9上剥离。
[0047]
图5是示出了本公开的示例所涉及的超疏水结构14的示意图。需要说明的是,图5是图1中的区域a的放大图。
[0048]
在一些示例中,在外表面12上设置有超疏水结构14。可以理解地,超疏水结构14是设置在外表面12上未穿孔的区域。
[0049]
在一些示例中,超疏水结构14可以包括间隔布置在外表面12上的多个微米级凸起141、以及设置在微米级凸起141的表面上的纳米颗粒142(参见图5)。在这种情况下,通过在下底层10的外表面12设置多个微米级凸起141和纳米颗粒142,能够在液滴与外表面12接触
时,由于微米级凸起141和纳米颗粒142的存在,液滴与外表面12之间会形成一层空气膜,阻碍液体对外表面12的润湿,从而能够形成超疏水状态,使外表面12具有超疏水性;当医用敷料1贴附于创面9时,下底层10的外表面12与创面9之间形成有由创面9分泌的渗出液构成的液层90(参见图2),使创面9处于湿润的组织接触环境中,有利于促进创面9愈合;当需要将医用敷料1从创面9剥离时,由于液层90的存在,能够减少外表面12与伤口新生的肉芽组织的粘连,从而易于将医用敷料1从创面9剥离。
[0050]
在本公开中,包括微米级凸起141和纳米颗粒142的超疏水结构14也可以称为微纳结构。
[0051]
在一些示例中,微米级凸起141可以呈乳突状、锥状、或柱状。在一些示例中,微米级凸起141的高度为20μm至150μm。在这种情况下,能够有利于提高外表面12的疏水性能,从而有利于维持湿润环境,且易于剥离。
[0052]
在一些示例中,微米级凸起141可以呈阵列式排布。在一些示例中,相邻的两个微米级凸起141的间距可以为20μm至200μm。在这种情况下,外表面12各处的疏水性能比较均匀,能够使被保持在第二区域s2与外表面12之间的液体形成的液层90厚度大体一致,从而使第二区域s2的愈合速度基本一致,有利于创面9愈合。
[0053]
在一些示例中,相邻两个微米级凸起141的间距与微米级凸起141的高度的比值可以为1至1.3。在这种情况下,能够便于液滴在多个微米级凸起141间进行滚动,减小外表面12上的滚动角,从而有利于提高外表面12的疏水性能。例如,相邻两个微米级凸起141的间距与微米级凸起141的高度的比值可以为1:1、1:1.1、1:1.2、或1:1.3。
[0054]
在一些示例中,纳米颗粒142可以呈球状、锥状、柱状、或不规则立体状。由此,能够有利于进一步提高外表面12的疏水性能,从而便于维持湿润环境,且易于剥离。
[0055]
在一些示例中,纳米颗粒142的粒径范围可以为50nm至1000nm。需要说明的是,粒径范围在纳米颗粒142呈球状时指的是其直径,在形状不是球状的情况下,指的是在其立体结构的等效直径。
[0056]
在一些示例中,纳米颗粒142的数量可以为多个,并且多个纳米颗粒142的粒径和形状可以相同或不同(参见图5)。
[0057]
在一些示例中,设置在外表面12上的超疏水结构14可以通过激光加工的方式形成。具体而言,可以通过采用飞秒激光在下底层10的外表面12进行激光刻蚀形成双尺度的微纳结构,即在外表面12上形成多个微米级凸起141以及形成在微米级凸起141表面上的多个纳米颗粒142,激光刻蚀后可以对外表面12进行清洗去除表面的杂质颗粒,得到设有超疏水结构14的外表面12。需要说明的是,受限于现有的加工精度,在制备微纳结构时,制成的微米级凸起141和/或纳米颗粒142在微观层面可能无法形成完全规则的形状,只要形成具有一定高度的大体轮廓比较规则的类乳突状结构即可起到疏水的作用。
[0058]
在一些示例中,通过在外表面12上设置超疏水结构14,可以使外表面的微水滴接触角大于150
°
,滚动角低于10
°
。在这种情况下,通过在外表面12上设置超疏水结构14能够提高疏水性,使外表面具有超疏水性能,从而有利于维持外表面12与创面9之间的湿润环境,且易于将医用敷料1从创面9剥离。
[0059]
在一些示例中,超疏水结构14与水基微液滴之间的接触界面润湿状态为稳定的cassie-baxter润湿状态,其稳定性表现为:8μl水基微液滴在0.3m高度的位置以自由落体
形式滴落在超疏水结构14表面,表现出弹跳行为。
[0060]
在一些示例中,超疏水结构14可以与外表面12一体成型。在一些示例中,超疏水结构14的材料可以与下底层10的材料一致。也就是说,可以直接通过例如激光加工的方式,在外表面12上雕刻出超疏水结构14。在这种情况下,能够便于制备具有超疏水结构14的下底层10,并且能够有利于保持外表面12的疏水性。
[0061]
在一些示例中,还可以在通孔13的内壁上设置超疏水结构14。在这种情况下,能够减少液体挂在通孔13的内壁上,有利于维持通孔13内的干燥。
[0062]
在一些示例中,下底层10的厚度可以为0.1mm至2mm。需要说明的是,在本公开中,下底层10的厚度是包括微米级凸起141以及纳米颗粒142总体的厚度。在这种情况下,下底层10薄厚适中,能够保持良好的透气性,也能够便于中间层20通过通孔13吸收目标表面的液体。在一些示例中,优选地,下底层10的厚度可以为0.1mm至1mm。
[0063]
在一些示例中,下底层10可以由疏水性材料构成。换言之,下底层10可以具有疏水性。也即,下底层10的内表面11以及通孔13上的接触角可以大于90
°
。在这种情况下,能够便于保持外表面12与创面9之间的湿润环境。
[0064]
例如,在一些示例中,下底层10的材料可以为硅胶。在一些示例中,下底层10可以为硅橡胶薄膜,也可以称为pdms(聚二甲基硅氧烷)膜。在这种情况下,下底层10质地柔软且具有良好的生物相容性和透气性,对人体组织无刺激性,能够有利于创面9愈合。
[0065]
在一些示例中,中间层20可以吸收液体。在一些示例中,被中间层20所吸收的液体可以附着于中间层20,也即,被中间层20吸收的液体可以保持在中间层20而不向外扩散。
[0066]
在这种情况下,目标表面中与通孔13相对应的第一区域s1上的液体能够经由通孔13而被中间层20吸收,并且通孔13中的液体也能够被中间层20吸收,从而能够使第一区域s1和通孔13内保持干燥,从而能够抑制例如死腔等对伤口愈合产生不利影响,为创面9愈合提供良好的愈合环境。其中,本领域技术人员能够理解,使第一区域s1和通孔13内保持干燥可以是指相对干燥的环境;具体而言,通常情况下,通过中间层20对渗出液的吸附,能够使第一区域s1和通孔13内保持干燥。需要说明的是,在某些情况下,由于下底层10的间隔,第一区域s1与中间层20不接触,第一区域s1表面上的部分液体(例如第一区域s1上未处于通孔13内的部分液体)可能会出现未能及时被中间层20吸收的情况,随着该部分液体的增多并往通孔13附近流动,仍会被中间层20吸收。这种情况也属于本公开所说的“第一区域s1和通孔13内保持干燥”的范围内,也就是说,通过中间层20的吸附至少能维持通孔13内的干燥环境。
[0067]
也就是说,在本公开中,通过中间层20的吸附既能够保持创面9的润湿性,又能够有效避免死腔对伤口愈合带来的不利影响。另外,在本公开中,通过中间层20,能够吸收多余的渗出液,使创面9湿润但不浸泡在液体中,为创面9提供良好的愈合环境。
[0068]
在一些示例中,中间层20可以包括亲水性材料。由此,能够使中间层20具有亲水性。
[0069]
在一些示例中,中间层20可以具有超亲水性。也就是说,水滴与中间层20的接触角接近于0
°
,中间层20极易被润湿。在这种情况下,能够便于中间层20充分吸收创面9上多余的渗液,并且渗液进入中间层20后易于在中间层20的内部扩散,有利于提高中间层20的吸液性能。在本公开中,超亲水性是指表面与水滴的接触角不大于5
°
。也就是说,水滴与具有
超亲水性的中间层20的表面的接触角可以不大于5
°
。例如,水滴与具有超亲水性的中间层20的表面的接触角可以为5
°
、4
°
、3
°
、2
°
、1
°
、0.8
°
、0.6
°
、0.5
°
、0.3
°
、0.2
°
、或0.1
°
。
[0070]
在一些示例中,中间层20也可以包括高亲水纤维。例如,在一些示例中,中间层20的材料可以包括羧甲基纤维素钠。在这种情况下,一方面能够使中间层20具有超亲水性,另一方面还能够增强中间层20的保水效果。
[0071]
在一些示例中,中间层20还可以包括棉絮。在一些示例中,中间层20可以为海绵片、网状无纺布、或者包括棉絮的医用棉垫等。在这种情况下,中间层20具有较高的亲水性并且质地柔软,能够吸收多余渗出液,并且能够为从而为创面9提供良好的愈合环境。
[0072]
在一些示例中,中间层20的厚度可以为0.5mm至5mm。在这种情况下,中间层20具有良好的透气性和吸水性,能够有利于提供良好的愈合环境,并且通过对各个功能层厚度的设置,能够使医用敷料1整体具有良好的机械强度。在一些示例中,优选地,中间层20的厚度可以为1mm至1.5mm。在这种情况下,能够在具有良好的吸水性的情况下,进一步优化医用敷料1整体的透气性能。
[0073]
在一些示例中,中间层20的内部可以具有不同的吸水性。具体来说,中间层20的内部可以在纵向方向上具有不同的吸水性。不同阶段的创面9所需的愈合环境有所不同(稍后描述),在这种情况下,通过将中间层20配置为使其内部在纵向方向上具有不同的吸水性,能够根据创面9的愈合情况选择合适的吸水性,为创面9提供良好的愈合环境。
[0074]
在一些示例中,中间层20具有面向下底层30的下表面以及面向上底层10的上表面。纵向方向可以是指正交于下表面和上表面的方向。
[0075]
在一些示例中,中间层20的吸水性可以从下表面至上表面逐渐增强。为了便于描述,将中间层20相对靠近上底层30的部分称为上层,将相对靠近上底层10的部分称为下层(并不意味着本公开的中间层20只包括间隔分明的两层)。在伤口出现的早期阶段,创面9分泌的渗出液较多,在这种情况下,当医用敷料1敷贴于处于早期阶段的创面9时,创面9的渗出液由通孔13移动至与中间层20的下层接触并被下层所吸收,相对于上下层吸水性一致的中间层20来说,由于该示例中中间层20的上层的吸水性大于下层,位于下层内部的渗出液大部分更倾向于朝向上层扩散,仅少部分会在下层内横向扩散,此时未饱和的下层会继续快速吸收第一区域s1和通孔13内的渗出液,由此,能够通过中间层20快速吸收创面9上多余的渗出液,并且下层的相对低亲水性的区域有助于形成一个间隔吸附液体与伤口的空气空腔,能够为处于早期阶段的创面9提供良好的愈合环境。
[0076]
在另一些示例中,中间层20的吸水性也可以从下表面至上表面逐渐减弱。在伤口形成的中后期阶段,创面9分泌的渗出液较少,并且创面9上的部分区域可能已经出现结痂,在这种情况下,通过将中间层20的下层的吸水性配置为强于上层的吸水性,当医用敷料1敷贴于处于中后期阶段的创面9时,创面9上的渗出液通过通孔13而被中间层20的下层吸收,位于下层内的渗出液大部分更倾向于在下层内部横向扩散,大部分渗出液被保持在中间层20的下层,能够使创面9上的第一区域s1处于湿润的环境空气状态中,由此,能够为处于中后期阶段的创面9提供良好的愈合环境。
[0077]
在一些示例中,中间层20的吸水性从下表面至上表面逐渐增强或逐渐减弱时可以呈梯度变化。具体而言,以中间层20的厚度为3mm,并且中间层20的吸水性从下表面至上表面逐渐增强的示例为例,将中间层20根据厚度划分为3个厚度为1mm的分层,从下表面至上
表面依次为第一层、第二层和第三层,各个分层的内部的吸水性均一致,并且各个分层的吸水性满足:第一层的吸水性<第二层的吸水性<第三层的吸水性。由此,能够便于制备具有不同吸水性的中间层20。
[0078]
在一些示例中,伤口出现的早期阶段可以是指出现伤口的前三天,中后期阶段可以是指出现伤口三天后的时期。当然,需要说明的是,由于每个患者自身的体质不同,即使经过相同的时间,创面9的恢复程度也可能不同,可以根据伤口分泌的渗出液的量而选择中间层20的不同配置。具体来说,伤口的愈合一般可分为凝血期、炎症期、修复期、成熟期四个阶段,本公开的伤口出现的早期阶段可以是指伤口处于凝血期和/或炎症期的阶段,中后期阶段可以是指伤口处于修复期和/或成熟期的阶段。
[0079]
在一些示例中,中间层20可以包括相对靠近上底层30的上层、以及相对靠近上底层10的下层。在一些示例中,上层的吸水性可以大于下层的吸水性。由此,能够为处于早期阶段的创面9提供良好的愈合环境。在另一些示例中,上层的吸水性可以小于下层的吸水性。由此,能够为处于中后期阶段的创面9提供良好的愈合环境。
[0080]
在一些示例中,中间层20还可以包括位于上层与下层之间的过渡层。过渡层的吸水性大小处于上层的吸水性和下层的吸水性之间。
[0081]
在一些示例中,中间层20的具有不同吸水性的部分可以由不同的材料构成、或者具有不同的结构。由此,能够使中间层20内具有不同的吸水性。在一些示例中,可以通过改变中间层20内部的网状结构的致密程度以调整其吸水性。例如,可以通过增加网状结构的致密程度以提高对应区域的吸水性。
[0082]
在一些示例中,中间层20可以具有吸附结构。由此,能够对修复基质进行吸附。
[0083]
在一些示例中,吸附结构可以呈多孔状,并且修复基质可以附着于吸附结构。其中,修复基质可以为水溶性材料。在这种情况下,在中间层20通过通孔13对渗出液进行吸附的过程中,水溶性的修复基质溶于渗出液中,并且通过渗出液而扩散至创面9,从而能够有利于创面9的愈合。也就是说,修复基质可以可释放地附着于吸附结构。在修复基质未接触到液体时,其可以附着于吸附结构,当修复基质接触液体后,可以溶解于该液体并且在该液体内进行分子扩散运动(即被吸附结构释放)。
[0084]
在一些示例中,吸附结构可以设置在中间层20相对靠近下底层10的表面上。例如,吸附结构可以为设置在中间层20相对靠近下底层10的表面上的多个凹槽结构。由此,能够通过凹槽结构容纳并吸附修复基质。
[0085]
在一些示例中,修复基质可以包括间充质干细胞和/或间充质干细胞的衍生物。例如,在一些示例中,修复基质可以包括间充质干细胞的上清液。间充质干细胞的上清液中含有能够促进伤口愈合的物质,在这种情况下,当修复基质与创面9接触时,能够有利于对伤口的愈合。
[0086]
在一些示例中,间充质干细胞的上清液中可以包括间充质干细胞衍生的外泌体。其中,外泌体是由细胞分泌的包含复杂rna和蛋白质的细胞外囊泡。在这种情况下,通过间充质干细胞衍生的外泌体能够利用旁分泌作用促进创面9愈合,能够抑制创面9炎性反应、促进血管生成、改善细胞外基质环境,并动员机体自身细胞迁移到损伤部位,从而对创面9进行修复。
[0087]
在一些示例中,间充质干细胞的上清液中还可以包括血管内皮生长因子、表皮生
长因子、转化生长因子-β、肝脏生长因子、过氧化物歧化酶、白细胞介素-6、胶原蛋白、纤维粘连蛋白和血小板衍生因子中的一种或多种。在这种情况下,通过修复基质能够有利于促进伤口愈合。
[0088]
在一些示例中,间充质干细胞的上清液可以包括间充质干细胞的外泌体、血管内皮生长因子、表皮生长因子、转化生长因子-β、肝脏生长因子、过氧化物歧化酶、白细胞介素-6、胶原蛋白、纤维粘连蛋白和血小板衍生因子中的一种或多种。在这种情况下,能够进一步提高修复基质的修复能力,从而促进伤口愈合。
[0089]
本公开不限于此,可以根据创面9的实际情况选择相应的修复基质。例如,在一些示例中,修复基质还可以包括其他有助于伤口愈合的成分。例如,修复基质还可以包括止血粉末等。
[0090]
在一些示例中,间充质干细胞可以为脐带间充质干细胞、骨髓间充质干细胞、或脂肪间充质干细胞。修复基质可以包括多种间充质干细胞和/或间充质干细胞的衍生物。也就是说,在一些示例中,修复基质可以包括脐带间充质干细胞、骨髓间充质干细胞、以及脂肪间充质干细胞中的一种或多种的衍生物。在这种情况下,各类间充质干细胞及其衍生物均能够有利于伤口的愈合,并且来源丰富,可以方便地根据进行实际需要对修复基质的成分进行调整。
[0091]
在一些示例中,修复基质可以以冻干粉的形式附着于吸附结构。在这种情况下,相较于以液态/凝胶态存在的干细胞上清液来说,以冻干粉的形式存在的干细胞上清液的单位体积内的有效活性细胞因子的浓度较高,并且生物活性物质的保存期较长,将呈冻干粉形式的间充质干细胞上清液搭载于中间层20时,能够使本公开的医用敷料1便于储存和临床应用。
[0092]
在一些示例中,修复基质可以包括脐带间充质干细胞外泌体、骨髓间充质干细胞、和/或脂肪间充质干细胞衍生的外泌体。
[0093]
在一些示例中,以包括脐带间充质干细胞上清液的修复基质的冻干粉为例,其制备方法可以包括:取脐带上的华通氏胶,离体培养获得脐带间充质干细胞;进行传代培养;培养预定时间后,收集细胞上清液并进行离心,获得含有脐带间充质干细胞的上清液;向含有脐带间充质干细胞的上清液中加入冻干保护剂并进行冷冻干燥,获得包括脐带间充质干细胞上清液的修复基质的冻干粉。其中,华通氏胶是指脐带羊膜和血管之间的凝胶状填充。由此,能够得到具有良好的修复作用的包括脐带间充质干细胞上清液的修复基质的冻干粉。当然,本实施方式不限于此,也可以通过其他方式得到包括脐带间充质干细胞上清液的修复基质的冻干粉,不应当理解为是限定性的。
[0094]
在一些示例中,在包括脐带间充质干细胞外泌体的修复基质的冻干粉的制备方法中,将离体培养获得脐带间充质干细胞记为p0代,在进行传代培养时,可以传代3-5次,至p3-p5代后,更换无血清的空白培养基继续培养。
[0095]
在一些示例中,在包括脐带间充质干细胞外泌体的修复基质的冻干粉的制备方法中,培养预定时间可以是指培养24h至96h。
[0096]
在一些示例中,在包括脐带间充质干细胞外泌体的修复基质的冻干粉的制备方法中,还可以将含有脐带间充质干细胞外泌体的上清液在2℃至6℃条件下,以800rpm/min至2000rpm/min的转速离心5min至15min,取上清,再加入冻干保护剂进行冷冻干燥。在这种情
况下,能够有利于进一步去除杂质,得到纯度较高的含有脐带间充质干细胞外泌体的上清液。
[0097]
在一些示例中,呈粉末状的修复基质在中间层20相对靠近下底层10的表面上的密度为0.5mg/cm2至5mg/cm2。在这种情况下,能够有利于创面9的愈合。
[0098]
在一些示例中,呈粉末状的修复基质可以均匀地洒在中间层20的靠近下底层10的表面上并且被中间层20吸附。在另一些示例中,在中间层20相对靠近下底层10的表面的与通孔13相对的区域上,修复基质的密度可以高于该表面上的其他区域。由此,能够便于修复基质在中间层20从通孔13吸收渗出液的过程中通过渗出液而扩散至创面9上对创面9进行修复。
[0099]
在另一些示例中,也可以将中间层20浸渍在含有脐带间充质干细胞外泌体的上清液中,再对搭载有上清液的中间层20进行冷冻干燥,从而使修复基质可释放地附着于中间层20,并且均匀分布在中间层20中。
[0100]
在一些示例中,在将医用敷料1敷贴至创面9之前,可以先将药物施加至创面9,再将医用敷料1敷贴至创面9上。其中,药物的成分可以与修复基质的成分一致,也可以是其他能够促进伤口愈合的成分。在这种情况下,修复基质与药物配合能够进一步提高对伤口的修复能力,从而促进伤口愈合。
[0101]
例如,在一些示例中,药物的成分也可以包括脐带间充质干细胞的外泌体,并且药物也以冻干粉的形式存在,此时可以先将药物均匀地洒在创面9上,再将医用敷料1敷贴于创面9。在这种情况下,能够有利于脐带间充质干细胞的外泌体发挥其生物学效应,促进创面9愈合。
[0102]
在一些示例中,上底层30可以包括疏水性材料。由此,能够使上底层30具有疏水性。在这种情况下,通过上底层30能够有效抵抗外部环境中的污染物进入敷料1,起到屏障作用,从而降低创面9的感染风险。
[0103]
在一些示例中,上底层30的面向中间层20的表面上、以及与该表面相对的表面上可以分别设有超疏水结构14。在这种情况下,能够增强上底层30的两个表面的疏水性,从而能够抑制位于中间层20内的渗出液向外蒸发,有利于为创面9提供合适的湿润环境;另外,还能够有效抵抗外部环境中的污染物,特别是可能携带细菌的物质(特别是液体)进入医用敷料1而移动至创面9,降低创面9的感染风险。
[0104]
在一些示例中,上底层30的厚度可以为0.2mm至1mm。在这种情况下,上底层30具有良好的透气性以及较强的机械强度,能够有效起到屏障作用,为创面9提供良好的愈合环境。在一些示例中,优选地,上底层30的厚度可以为0.2mm至0.5mm。在这种情况下,能够在起到屏障作用的情况下进一步提高上底层30的透气性。
[0105]
在一些示例中,上底层30的材料可以为硅胶。也就是说,上底层30可以为硅橡胶薄膜,也可以称为pdms(聚二甲基硅氧烷)膜。在这种情况下,上底层30质地柔软且具有良好的透气性,能够为创面9提供良好的愈合环境。
[0106]
在一些示例中,下底层10、中间层20和上底层30可以呈片状。也就是说,医用敷料1可以呈片状。在这种情况下,能够便于覆盖目标表面。
[0107]
在一些示例中,上底层30、中间层20、以及下底层10中相邻的两层通过胶粘剂而相互接合,并且中间层20与所述通孔13相对应的区域内不设置胶粘剂。在这种情况下,各层之
间能够紧密结合,且便于中间层20通过通孔13而吸收目标表面的液体。
[0108]
在一些示例中,中间层20与下底层10之间的外周缘区通过胶粘剂而相互接合。
[0109]
在一些示例中,医用敷料1可以呈长卷状。使用时可以将医用敷料1切割成期望尺寸(例如能够覆盖创面9的形状)后再使用。
[0110]
在一些示例中,医用敷料1的长度可以为20mm至120mm,宽度可以为20mm至120mm。在这种情况下,能够适配于小型创面9,且便于携带。本公开不限于此,医用敷料1的尺寸也可以根据实际需要进行调整。例如,当目标表面的面积较大时,可以采用能够覆盖目标表面尺寸的医用敷料1对其进行保护。
[0111]
在一些示例中,可以通过医用胶带将医用敷料1贴附于创面9。也可以直接将上底层30的两端均向外延伸,并使上底层30向外延伸出去的两端的内壁设有胶黏剂,也即形成创可贴的形式,从而能够将医用敷料1贴附于创面9。
[0112]
在一些示例中,医用敷料1的使用期可以为0.5天至3天。在一些示例中,医用敷料1的使用期优选为12小时至36小时。其中,使用期是指医用敷料1敷贴于目标表面的时长。在这种情况下,能够有利于保持良好的透气性,为创面9提供合适的愈合环境。
[0113]
图6是示出了本公开的示例所涉及的医用敷料1的第二实施例的示意图。
[0114]
在一些示例中,医用敷料1还包括可剥离地覆盖外表面12的保护膜40(参见图6)。在这种情况下,通过设置保护膜40能够维持外表面12在被使用前处于洁净状态,当需要将医用敷料1贴附于创面9时,将保护膜40从外表面12剥离即可。
[0115]
在一些示例中,保护膜40的形状可以与下底层10的形状一致。例如在下底层10呈片状的实施例中,保护膜40也可以呈片状,并且呈片状的保护膜40的面积不小于下底层10的外表面12的面积。
[0116]
在一些示例中,医用敷料1还包括可剥离地覆盖上底层30的相对远离中间层20的表面的第二保护膜50(参见图6)。在这种情况下,通过设置第二保护膜50能够维持上底层30相对远离中间层20的表面在被使用前处于洁净状态,当需要将医用敷料1贴附于创面9时,将第二保护膜50从该表面剥离,不会对上底层30的透气性产生影响。
[0117]
在一些示例中,保护膜40和/或第二保护膜50可以为离型纸。由此,能够进行有效防护。
[0118]
根据本公开涉及的医用敷料1,能够用于保护目标表面,为目标表面提供湿润的组织接触环境、且易于从目标表面剥离。
[0119]
本公开的第二方面涉及一种医用敷料的制备方法,通过本公开的制备方法制备的医用敷料能够用于保护目标表面,并且医用敷料能够吸取目标表面多余的液体,为目标表面提供适宜的湿润环境、且易于从目标表面剥离。在本公开中,医用敷料的制备方法可以简称为“制备方法”。通过本公开的制备方法制备的医用敷料可以简称为敷料,也可以称为吸水敷料、创伤敷料、伤口敷料等。
[0120]
当本公开的制备方法制得的医用敷料敷贴于创面时,创面与医用敷料之间至少部分区域内存在由创面分泌的渗出液所构成的液层,从而为创面提供合适的湿润环境,此外,搭载于医用敷料的修复基质能够转移至创面,从而能够为伤口提供良好的愈合环境;当需要将其从创面剥离时,通过具有超疏水性的外表面,能够减少与伤口新生的肉芽组织的粘连,使其易于从创面剥离,从而避免对伤口造成继发性伤害(即二次伤害)。
[0121]
以下,以目标表面为具有渗出液层的创面为例,结合附图,对本公开涉及的医用敷料的制备方法进行说明。
[0122]
图7是示出了本公开的示例所涉及的医用敷料1的制备方法的示意图。
[0123]
在一些示例中,如上所述,医用敷料1可以包括依次层叠设置的下底层10、中间层20、以及上底层30(参见图1)。当医用敷料1敷贴于目标表面(具有渗出液层90的创面9)时,下底层10可以与创面9接触,中间层20可以用于吸取创面9上的液体(参见图2)。
[0124]
在一些示例中,医用敷料1还可以包括水溶性的修复基质。修复基质可以附着于中间层20。在这种情况下,当医用敷料1敷贴于创面9时,修复基质可以在中间层20吸取创面9上渗出液的过程中溶解于渗出液中,并通过渗出液而扩散至创面9进行修复。
[0125]
在一些示例中,将创面9的与通孔13相对应的区域称为第一区域s1,将创面9的与下底层10的外表面12上未穿孔的区域相对应的区域称为第二区域s2。参见图2,其中示意性地标注了部分的第一区域s1和第二区域s2。
[0126]
在一些示例中,下底层10可以具有面向中间层20的内表面11、以及与内表面11相对的外表面12(参见图2)。
[0127]
在一些示例中,医用敷料1的制备方法可以包括:制备下底层10,在下底层10上制作贯通内表面11和外表面12的多个通孔13(步骤s100);制备呈超亲水性的中间层20,中间层20内设有吸附结构(步骤s200);将水溶性的修复基质附着于中间层20的吸附结构(步骤s300);制备呈疏水性的上底层30(步骤s400);将上底层30、中间层20、以及下底层10依次层叠以得到医用敷料1(步骤s500)(参见图7)。其中,需要说明的是,步骤s100、步骤200、以及步骤s400的次序不分先后,不应当理解为是限定性的。例如,步骤s100、步骤200、以及步骤s400可以依次进行、同时进行、也可以打乱顺序进行。
[0128]
在一些示例中,在步骤s100中,可以通过在下底层10上制作贯通内表面11和外表面12的多个通孔13,使中间层20能够通过通孔13而吸收创面9上的液体。
[0129]
在一些示例中,在步骤s100中,可以在外表面12上间隔布置多个微米级凸起141、并且在微米级凸起141的表面上设置纳米颗粒142。由此,能够使外表面12具有超疏水性。在本公开中,超疏水性是指表面的微水滴接触角大于150
°
,滚动角低于10
°
。微米级凸起141、以及在微米级凸起141的表面上的纳米颗粒142可以称为超疏水结构14,也可以称为微纳结构。也就是说,通过在外表面12上设置超疏水结构14,能够使外表面12的微水滴接触角大于150
°
,滚动角低于10
°
。
[0130]
在一些示例中,当本公开的制备方法制备的医用敷料1敷贴于具有液层90的目标表面时,目标表面与通孔13相对应的第一区域s1上的液体经由通孔13而被中间层20吸收以使第一区域s1和通孔13保持干燥,目标表面与超疏水结构14相对应的第二区域s2上的液体至少部分地被保持。在这种情况下,当目标表面为创面9时,将医用敷料1敷贴至创面9上,通过中间层20对伤口多余的渗出液的吸附,能够使创面9上的第一区域s1处于干燥的环境中,通过下底层10的具有超疏水性的外表面12,能够在外表面12与第二区域s2之间保持部分渗出液,使第二区域s2处于湿润的组织接触环境中,由此,既能够有效避免死腔对伤口愈合带来的不利影响,也能够为创面9提供良好的愈合环境;当需要将医用敷料1从创面9剥离时,由于第二区域s2处于湿润环境中,下底层10与伤口接触的表面(即外表面12)上的超疏水性能能够使其对伤口分泌物以及伤口表面的肉芽组织等表现出防粘连性能,能够减少外表面
12与伤口新生的肉芽组织的粘连,使其易于从创面9剥离,从而避免对伤口造成继发性伤害,而且由于下底层10的间隔,中间层20的敷料纤维不易脱落至创面9,能够有效减少伤口的异物反应。
[0131]
在一些示例中,在步骤s100中,通孔13可以呈圆柱状。也就是说,通孔13在内表面11和外表面12的孔径一致。在这种情况下,能够便于中间层20通过通孔13吸收目标表面的液体。
[0132]
在一些示例中,在步骤s100中,通孔13的直径可以为0.5mm至3mm。在这种情况下,能够便于中间层20以合适的速率从通孔13吸收目标表面上的液体(参见图2,箭头示意性地表示在中间层20吸收渗出液的过程中渗出液的移动方向),以维持通孔13和第一区域s1的干燥。
[0133]
在一些示例中,在步骤s100中,相邻两个通孔13的间距可以为1mm至5mm。在一些示例中,多个通孔13可以呈阵列式排布(参见图3)。在这种情况下,外表面12上未穿孔的区域(即设有超疏水结构14的区域)也均匀分布,从而能够便于剥离。
[0134]
在一些示例中,在步骤s100中,外表面12上的开孔区域的面积不大于外表面12总体面积的30%。也就是说,多个通孔13在外表面12上所占的面积不大于外表面12总体面积的30%。在这种情况下,与外表面12的未开孔区域相对应的创面9上的大部分区域能够维持在湿润环境下,能够有利于创面9愈合,也能够使医用敷料1易于从创面9上剥离。
[0135]
在一些示例中,在步骤s100中,还可以包括在外表面12上未穿孔的区域设置超疏水结构14。在这种情况下,通过在下底层10的外表面12设置多个微米级凸起141和纳米颗粒142,能够使外表面12具有超疏水性,当医用敷料1贴附于创面9时,下底层10的外表面12与创面9之间形成有由创面9分泌的渗出液构成的液层90(参见图2),使创面9处于湿润的组织接触环境中,有利于促进创面9愈合;当需要将医用敷料1从创面9剥离时,由于液层90的存在,能够减少外表面12与伤口新生的肉芽组织的粘连,从而易于将医用敷料1从创面9剥离。
[0136]
在一些示例中,在步骤s100中,微米级凸起141可以呈乳突状、锥状、或柱状。在一些示例中,微米级凸起141的高度为20μm至150μm。在这种情况下,能够有利于提高外表面12的疏水性能,从而有利于维持湿润环境,且易于剥离。
[0137]
在一些示例中,在步骤s100中,微米级凸起141可以呈阵列式排布。在一些示例中,相邻的两个微米级凸起141的间距可以为20μm至200μm。在这种情况下,外表面12各处的疏水性能比较均匀,能够使被保持在第二区域s2与外表面12之间的液体形成的液层90厚度大体一致,从而使第二区域s2的愈合速度基本一致,有利于创面9愈合。
[0138]
在一些示例中,在步骤s100中,纳米颗粒142可以呈球状、锥状、柱状、或不规则立体状。由此,能够有利于进一步提高外表面12的疏水性能,从而便于维持湿润环境,且易于剥离。
[0139]
在一些示例中,在步骤s100中,纳米颗粒142的粒径范围可以为50nm至1000nm。需要说明的是,粒径范围在纳米颗粒142呈球状时指的是其直径,在形状不是球状的情况下,指的是在其立体结构的等效直径。
[0140]
在一些示例中,在步骤s100中,纳米颗粒142的数量可以为多个,并且多个纳米颗粒142的粒径和形状可以相同或不同(参见图5)。
[0141]
在一些示例中,在步骤s100中,超疏水结构14可以与外表面12一体成型。在一些示
例中,超疏水结构14的材料可以与下底层10的材料一致。也就是说,可以直接通过例如激光加工的方式,在外表面12上雕刻出超疏水结构14。在这种情况下,能够便于制备具有超疏水结构14的下底层10,并且能够有利于保持外表面12的疏水性。
[0142]
在一些示例中,在步骤s100中,微米级凸起141和/或纳米颗粒142可以为采用激光在外表面12进行激光刻蚀而形成。具体而言,可以通过采用飞秒激光在下底层10的外表面12进行激光刻蚀形成双尺度的微纳结构,即在外表面12上形成多个微米级凸起141以及形成在微米级凸起141表面上的多个纳米颗粒142,激光刻蚀后可以对外表面12进行清洗去除表面的杂质颗粒,得到设有超疏水结构14的外表面12。
[0143]
在一些示例中,在步骤s100中,在外表面12上进行激光刻蚀的参数可以为:激光波长为200nm至400nm,输出功率为0.5w至15w,激光脉冲宽度为0.05ps至10ps,激光频率为10khz至1000khz,光束扫描速度为100mm/s至5000mm/s。考虑到在下底层10为pdms薄膜的示例中,pdms薄膜为无色高透光性材料,对红外波段和绿光波段的激光吸收率较低,对紫外波段激光吸收率较高,因此选用波长为200nm至400nm的激光对下底层10进行加工;另外,该参数的激光(可以称为超快激光或飞秒激光)具有极高的峰值功率,在加工过程产生的热效应较小,能够降低对周围材料的损伤,从而制备更高精度的微纳结构。
[0144]
需要说明的是,受限于现有的加工精度,在制备微纳结构时,制成的微米级凸起141和/或纳米颗粒142在微观层面可能无法形成完全规则的形状,只要形成具有一定高度的大体轮廓比较规则的类乳突状结构即可起到疏水的作用。
[0145]
在一些示例中,在步骤s100中,可以通过在外表面12上设置超疏水结构14,使外表面12的微水滴接触角大于150
°
,滚动角低于10
°
。在这种情况下,在外表面12上设置的超疏水结构14能够提高疏水性,使外表面12具有超疏水性能,从而有利于维持外表面12与创面9之间的湿润环境,且易于将医用敷料1从创面9剥离。
[0146]
在一些示例中,在步骤s100中,超疏水结构14与水基微液滴之间的接触界面润湿状态为稳定的cassie-baxter润湿状态,其稳定性表现为:8μl水基微液滴在0.3m高度的位置以自由落体形式滴落在超疏水结构14表面,表现出弹跳行为。
[0147]
在一些示例中,在步骤s100中,还可以包括在通孔13的内壁上设置超疏水结构14。在这种情况下,能够减少液体挂在通孔13的内壁上,有利于维持通孔13内的干燥。
[0148]
在一些示例中,在步骤s100中,可以将下底层10制备成片状。
[0149]
在一些示例中,在步骤s100中,制备的底层10的厚度可以为0.1mm至2mm。需要说明的是,在本公开中,下底层10的厚度是包括微米级凸起141以及纳米颗粒142总体的厚度。在这种情况下,下底层10薄厚适中,能够保持良好的透气性,也能够便于中间层20通过通孔13吸收目标表面的液体。在一些示例中,优选地,下底层10的厚度可以为0.1mm至1mm。
[0150]
在一些示例中,在步骤s100中,可以选择疏水性材料制备下底层10。由此,能够使下底层10具有疏水性。也即,下底层10的内表面11以及通孔13上的接触角可以大于90
°
。在这种情况下,能够便于保持外表面12与创面9之间的湿润环境。
[0151]
在一些示例中,在步骤s100中,可以采用硅胶制备下底层10。例如,下底层10可以为硅橡胶薄膜,也可以称为pdms(聚二甲基硅氧烷)膜。在这种情况下,上底层30质地柔软且具有良好的生物相容性和透气性,对人体组织无刺激性,能够有利于创面9愈合。
[0152]
在一些示例中,在步骤s200中,可以选择亲水性的材料制备中间层20。在这种情况
下,中间层20具有亲水性。在一些示例中,中间层20可以吸收液体,被中间层20所吸收的液体可以附着于中间层20,也即,被中间层20吸收的液体可以保持在中间层20而不向外扩散。
[0153]
在一些示例中,在步骤s200中,中间层20可以具有超亲水性。水滴与中间层20表面的接触角接近于0
°
,中间层20极易被润湿。在这种情况下,能够便于中间层20充分吸收创面9上多余的渗液,并且渗液进入中间层20后易于在中间层20的内部扩散,有利于提高中间层20的吸液性能。在本公开中,超亲水性是指表面与水滴的接触角不大于5
°
。也就是说,水滴与具有超亲水性的中间层20的表面的接触角可以不大于5
°
。例如,水滴与具有超亲水性的中间层20的表面的接触角可以为5
°
、4
°
、3
°
、2
°
、1
°
、0.8
°
、0.6
°
、0.5
°
、0.3
°
、0.2
°
、或0.1
°
。
[0154]
在这种情况下,目标表面中与通孔13相对应的第一区域s1上的液体能够经由通孔13而被中间层20吸收,并且通孔13中的液体也能够被中间层20吸收,从而能够使第一区域s1和通孔13内保持干燥,从而能够抑制例如死腔等对伤口愈合产生不利影响,为创面9愈合提供良好的愈合环境。其中,本领域技术人员能够理解,使第一区域s1和通孔13内保持干燥可以是指相对干燥的环境;具体而言,通常情况下,通过中间层20对渗出液的吸附,能够使第一区域s1和通孔13内保持干燥。需要说明的是,在某些情况下,由于下底层10的间隔,第一区域s1与中间层20不接触,第一区域s1表面上的部分液体(例如第一区域s1上未处于通孔13内的部分液体)可能会出现未能及时被中间层20吸收的情况,随着该部分液体的增多并往通孔13附近流动,仍会被中间层20吸收。这种情况也属于本公开所说的“第一区域s1和通孔13内保持干燥”的范围内,也就是说,通过中间层20的吸附至少能维持通孔13内的干燥环境。
[0155]
也就是说,在本公开中,通过中间层20的吸附既能够保持创面9的润湿性,又能够有效避免死腔对伤口愈合带来的不利影响。另外,在本公开中,通过中间层20,能够吸收多余的渗出液,使创面9湿润但不浸泡在液体中,为创面9提供良好的愈合环境。
[0156]
在一些示例中,在步骤s200中,中间层20的材料可以包括高亲水纤维。例如,在一些示例中,中间层20的材料可以包括羧甲基纤维素钠。在这种情况下,一方面能够使中间层20具有超亲水性,另一方面还能够增强中间层20的保水效果。
[0157]
在一些示例中,在步骤s200中,中间层20还可以包括棉絮。在一些示例中,中间层20可以为海绵片、网状无纺布、或者包括棉絮的医用棉垫等。在这种情况下,中间层20具有较高的亲水性并且质地柔软,能够吸收多余渗出液,并且能够为从而为创面9提供良好的愈合环境。
[0158]
在一些示例中,在步骤s200中,可以将中间层20制备成片状。
[0159]
在一些示例中,在步骤s200中,制备的中间层20的厚度可以为0.5mm至5mm。在这种情况下,中间层20具有良好的透气性和吸水性,能够有利于提供良好的愈合环境,并且通过对各个功能层厚度的设置,能够使医用敷料1整体具有良好的机械强度。在一些示例中,优选地,中间层20的厚度可以为1mm至1.5mm。在这种情况下,能够在具有良好的吸水性的情况下,进一步优化医用敷料1整体的透气性能。
[0160]
在一些示例中,在步骤s200中,可以将中间层20配置为使其内部可以具有不同的吸水性。
[0161]
在一些示例中,在步骤s200中,可以将中间层20配置为吸水性从相对靠近下底层10的下表面至相对靠近上底层30的上表面逐渐增强。为了便于描述,将中间层20相对靠近
上底层30的部分称为上层,将相对靠近底层10的部分称为下层(并不意味着本公开的中间层20只包括间隔分明的两层)。在伤口出现的早期阶段,创面9分泌的渗出液较多,在这种情况下,当医用敷料1敷贴于处于早期阶段的创面9时,创面9的渗出液由通孔13移动至与中间层20的下层接触并被下层所吸收,相对于上下层吸水性一致的中间层20来说,由于该示例中中间层20的上层的吸水性大于下层,位于下层内部的渗出液大部分更倾向于朝向上层扩散,仅少部分会在下层内横向扩散,此时未饱和的下层会继续快速吸收第一区域s1和通孔13内的渗出液,由此,能够通过中间层20快速吸收创面9上多余的渗出液,并且下层的相对低亲水性的区域有助于形成一个间隔吸附液体与伤口的空气空腔,能够为处于早期阶段的创面9提供良好的愈合环境。
[0162]
在另一些示例中,在步骤s200中,也可以将中间层20配置为吸水性从相对靠近上底层30的上表面至相对靠近下底层10的下表面逐渐增强。在伤口形成的中后期阶段,创面9分泌的渗出液较少,并且创面9上的部分区域可能已经出现结痂,在这种情况下,中间层20的下层的吸水性强于上层的吸水性,当医用敷料1敷贴于处于中后期阶段的创面9时,创面9上的渗出液通过通孔13而被中间层20的下层吸收,位于下层内的渗出液大部分更倾向于在下层内部横向扩散,大部分渗出液被保持在中间层20的下层,能够使创面9上的第一区域s1处于湿润的环境空气状态中,由此,能够为处于中后期阶段的创面9提供良好的愈合环境。
[0163]
在一些示例中,在步骤s200中,可以通过将中间层20配置为由不同的材料构成、或者设置有不同的结构而使中间层20的内部具有不同吸水性。
[0164]
在一些示例中,在步骤s200中,可以在中间层20上制备吸附结构。由此,能够对修复基质进行吸附。
[0165]
在一些示例中,在步骤s200中,吸附结构可以呈多孔状,并且修复基质可以附着于吸附结构。其中,修复基质可以为水溶性材料。在这种情况下,在中间层20通过通孔13对渗出液进行吸附的过程中,水溶性的修复基质溶于渗出液中,并且通过渗出液而扩散至创面9,从而能够有利于创面9的愈合。也就是说,修复基质可以可释放地附着于吸附结构。在修复基质未接触到液体时,其可以附着于吸附结构,当修复基质接触液体后,可以溶解于该液体并且在该液体内进行分子扩散运动(即被吸附结构释放)。
[0166]
在一些示例中,在步骤s200中,吸附结构可以包括中间层20的表面上、以及中间层20内部的网状结构。由此,能够便于对修复基质进行吸附。
[0167]
在一些示例中,在步骤s200中,吸附结构可以设置在中间层20相对靠近下底层10的表面上。例如,吸附结构可以为设置在中间层20相对靠近下底层10的表面上的多个凹槽结构。由此,能够通过凹槽结构容纳并吸附修复基质。
[0168]
在一些示例中,在步骤s300中,修复基质可以具有水溶性。在这种情况下,在中间层20通过通孔13对渗出液进行吸附的过程中,水溶性的修复基质溶于渗出液中,并且通过渗出液而扩散至创面9,从而能够有利于创面9的愈合。
[0169]
在一些示例中,在步骤s300中,修复基质可以包括间充质干细胞和/或间充质干细胞的衍生物。例如,在一些示例中,修复基质可以包括间充质干细胞的上清液。间充质干细胞的上清液中含有能够促进伤口愈合的物质(例如活性细胞因子、rna、多肽、以及多种生物活性物质等),在这种情况下,当修复基质与创面9接触时,能够有利于对伤口的愈合。
[0170]
在一些示例中,在步骤s300中,间充质干细胞的上清液中可以包括间充质干细胞
衍生的外泌体。其中,外泌体是由细胞分泌的包含复杂rna和蛋白质的细胞外囊泡。在这种情况下,通过间充质干细胞衍生的外泌体能够利用旁分泌作用促进创面9愈合,能够抑制创面9炎性反应、促进血管生成、改善细胞外基质环境,并动员机体自身细胞迁移到损伤部位,从而对创面9进行修复。
[0171]
在一些示例中,在步骤s300中,间充质干细胞的上清液中还可以包括血管内皮生长因子、表皮生长因子、转化生长因子-β、肝脏生长因子、过氧化物歧化酶、白细胞介素-6、胶原蛋白、纤维粘连蛋白和血小板衍生因子中的一种或多种。在这种情况下,通过修复基质能够有利于促进伤口愈合。
[0172]
在一些示例中,在步骤s300中,间充质干细胞的上清液可以包括间充质干细胞的外泌体、血管内皮生长因子、表皮生长因子、转化生长因子-β、肝脏生长因子、过氧化物歧化酶、白细胞介素-6、胶原蛋白、纤维粘连蛋白和血小板衍生因子中的一种或多种。在这种情况下,能够进一步提高修复基质的修复能力,从而促进伤口愈合。
[0173]
本公开不限于此,可以根据创面9的实际情况选择相应的修复基质。例如,在一些示例中,修复基质还可以包括其他有助于伤口愈合的成分。例如,修复基质还可以包括止血粉末等。
[0174]
在一些示例中,在步骤s300中,间充质干细胞可以为脐带间充质干细胞、骨髓间充质干细胞、或脂肪间充质干细胞。在一些示例中,在步骤s300中,修复基质可以包括脐带间充质干细胞外泌体、骨髓间充质干细胞、和/或脂肪间充质干细胞衍生的外泌体。
[0175]
在一些示例中,修复基质可以包括多种间充质干细胞和/或间充质干细胞的衍生物。也就是说,在一些示例中,修复基质可以包括脐带间充质干细胞、骨髓间充质干细胞、以及脂肪间充质干细胞中的一种或多种的衍生物。在这种情况下,各类间充质干细胞及其衍生物均能够有利于伤口的愈合,并且来源丰富,可以方便地根据进行实际需要对修复基质的成分进行调整。
[0176]
在一些示例中,在步骤s300中,修复基质可以以冻干粉的形式附着于吸附结构。在这种情况下,相较于以液态存在的干细胞上清液来说,以冻干粉的形式存在的干细胞上清液的单位体积内的有效活性细胞因子的浓度较高,并且生物活性物质的保存期较长,将呈冻干粉形式的间充质干细胞上清液搭载于中间层20时,能够使本公开的医用敷料1便于储存和临床应用。
[0177]
在一些示例中,呈粉末状的修复基质在中间层20相对靠近下底层10的表面上的密度为0.5mg/cm2至5mg/cm2。在这种情况下,能够有利于创面9的愈合。
[0178]
在一些示例中,呈粉末状的修复基质可以均匀地洒在中间层20的靠近下底层10的表面上并且被中间层20吸附。在另一些示例中,在中间层20相对靠近下底层10的表面的与通孔13相对的区域上,修复基质的密度可以高于该表面上的其他区域。由此,能够便于修复基质在中间层20从通孔13吸收渗出液的过程中通过渗出液而扩散至创面9上对创面9进行修复。
[0179]
在另一些示例中,在步骤s300中,也可以将中间层20浸渍在含有脐带间充质干细胞外泌体的上清液中,再对搭载有上清液的中间层20进行冷冻干燥,从而使修复基质可释放地附着于中间层20,并且均匀分布在中间层20中。
[0180]
图8是示出了本公开的示例所涉及的修复基质的制备方法的示意图。
[0181]
在一些示例中,在步骤s300中,以脐带间充质干细胞上清液的冻干粉作为修复基质为例,其制备方法可以包括:取脐带上的华通氏胶,离体培养获得脐带间充质干细胞(步骤s31);进行传代培养(步骤s32);培养预定时间后,收集细胞上清液并进行离心,获得脐带间充质干细胞的上清液(步骤s33);向脐带间充质干细胞的上清液中加入冻干保护剂并进行冷冻干燥,获得包括脐带间充质干细胞上清液的修复基质的冻干粉(步骤s34)(参见图8)。其中,华通氏胶是指脐带羊膜和血管之间的凝胶状填充。由此,能够得到具有良好的修复作用的包括脐带间充质干细胞上清液的修复基质的冻干粉。当然,本实施方式不限于此,也可以通过其他方式得到包括脐带间充质干细胞上清液的修复基质的冻干粉,不应当理解为是限定性的。
[0182]
在一些示例中,可以将步骤s31中离体培养获得的脐带间充质干细胞记为p0代,在步骤s32中,可以传代3-5次,至p3-p5代后,更换无血清的空白培养基继续培养。
[0183]
在一些示例中,在步骤s33中,培养预定时间的范围可以为24h至96h。
[0184]
在一些示例中,在步骤s33中,还可以将脐带间充质干细胞的上清液在2℃至6℃条件下,以800rpm/min至2000rpm/min的转速离心5min至15min,取上清,再加入冻干保护剂进行冷冻干燥。在这种情况下,能够有利于进一步去除杂质,得到纯度较高的脐带间充质干细胞上清液。
[0185]
在一些示例中,在步骤s33中,得到脐带间充质干细胞的上清液后,可以通过酶联免疫吸附测定(enzyme linked immunosorbent assay,简写elisa或elasa)对上清液中的例如vegf(血管内皮生长因子)、egf(表皮生长因子)、fgf、tgf-β(转化生长因子-β)、hgf(肝脏生长因子)、sod(过氧化物歧化酶)、il-6(白细胞介素-6)、胶原蛋白、fn(纤维粘连蛋白)、以及血小板衍生因子(pdgf)等关键细胞因子、rna、多肽、以及生物活性物质等的含量进行检查,确定其含量处于预定范围内时,再进行步骤s34。其中,细胞因子是指由免疫细胞和部分非免疫细胞经刺激而合成/分泌的具有广泛生物学活性的小分子蛋白,能够有利于损伤组织的修复。由此,能够便于获得具有期望修复性能的冻干粉。
[0186]
在一些示例中,在步骤s34中,冻干保护剂可以包括海藻糖。海藻糖的玻璃化转变温度高、吸水性较弱、结晶率较低、并且不含还原基,在这种情况下,通过以海藻糖作为冻干保护剂,能够有效抑制脐带间充质干细胞上清液在转变为冻干粉的过程中含有的细胞因子的生物学特性发生改变,维持细胞因子的活性并提高其的稳定性,且能够有利于搭载有修复基质的医用敷料1在常温下的保存和运输,也能够延长含有细胞因子的冻干粉的保存期限。
[0187]
在一些示例中,在步骤s34中,对上清液进行冷冻干燥可以包括预冻阶段、升华阶段、以及解吸阶段。具体而言,预冻阶段可以将上清液从室温降至第一预定温度,并维持第一预定时间;升华阶段可以在预定压力下,对经过预冻的上清液进行升温处理,使上清液升温至第二预定温度;解吸阶段可以进行再次升温,使上清液升温至第三预定温度,并维持第三预定时间。在这种情况下,通过预冻阶段能够使上清液整体充分降温至第一预定温度,并且能抑制在上清液在升华阶段发生不期望的特性变化;通过升华阶段能够使上清液脱水干燥,去除上清液中大部分的水分;通过解吸阶段能够进一步去除上清液中的水分,由此,能够获得富含活性细胞因子和外泌体的脐带间充质干细胞上清液的冻干粉。
[0188]
需要说明的是,上述对上清液进行冷冻干燥的方法并不局限于只能应用在脐带间
充质干细胞上清液中,也可以用于对其他类型的间充质干细胞上清液进行冷冻干燥。此外,将修复基质冷冻干燥形成冻干粉的方式也不仅限于上述对上清液进行冷冻干燥的方法,也可以采用其他方法将修复基质制备为呈冻干粉的形式。
[0189]
在一些示例中,第一预定温度可以为-40℃。在这种情况下,能够有利于上清液中的活性成分进行玻璃化转变。在一些示例中,第一预定时间可以为40min至70min。例如,第一预定时间可以为40min、45min、50min、55min、60min、65min、或70min。
[0190]
在一些示例中,升华阶段和解吸阶段可以在真空干燥箱内进行。
[0191]
在一些示例中,在升华阶段中,预定压力可以为0.13mbar至0.3mbar。在这种情况下,能够有利于上清液中水分的升华。
[0192]
在一些示例中,第二预定温度可以为4℃。由此,能够得到处于的低温状态的上清液冻干粉。在一些示例中,可以采用两次升华方式将上清液的温度从第一预定温度升至第二预定温度。例如,在一些示例中,第一预定温度为-40℃,第二预定温度为4℃,可以在第一次升温时先将上清液的温度上升至-20℃,第二次升温时再将上清液的温度从-20℃升温至4℃。在这种情况下,能够抑制出现由于升温过快/温差过大造成的内外分层现象,从而有利于形成均匀干燥的上清液冻干粉。
[0193]
在一些示例中,第一次升温的持续时间可以在60min左右。第二次升温的持续时间可以控制在90min左右。在这种情况下,能够有利于上清液整体充分转变至相应的目标温度。
[0194]
在一些示例中,在解吸阶段中,预定压力可以为0.18mbar至0.28mbar。在这种情况下,能够进一步去除上清液中的水分。
[0195]
在一些示例中,第三预定温度可以为-30℃。在一些示例中,第三预定时间可以为150min至180min。例如,第三预定时间可以为150min、155min、160min、165min、170min、175min、或180min。
[0196]
在一些示例中,在解吸阶段中,上清液从第二预定温度转变至第三预定温度的过程持续时间可以小于30min。也就是说,上清液可以在30min内由第二预定温度转变至第三预定温度。在这种情况下,能够有利于维持上清液中细胞因子等物质的活性。
[0197]
在一些示例中,在将医用敷料1敷贴至创面9之前,可以先将药物施加至创面9,再将医用敷料1敷贴至创面9上。其中,药物的成分可以与修复基质的成分一致,也可以是其他能够促进伤口愈合的成分。在这种情况下,修复基质与药物配合能够进一步提高对伤口的修复能力,从而促进伤口愈合。例如,在一些示例中,药物的成分也可以包括脐带间充质干细胞的外泌体,并且药物也以冻干粉的形式存在,此时可以先将药物均匀地洒在创面9上,再将医用敷料1敷贴于创面9。在这种情况下,能够有利于脐带间充质干细胞的外泌体发挥其生物学效应,促进创面9愈合。
[0198]
在一些示例中,在步骤s400中,可以选择疏水性材料制备上底层30。由此,能够使上底层30具有疏水性。在这种情况下,通过上底层30能够有效抵抗外部环境中的污染物(特别是可能携带有细菌/病菌的液体)进入敷料1,起到屏障作用,从而降低创面9的感染风险。
[0199]
在一些示例中,在步骤s400中,可以将上底层30制备成片状。
[0200]
在一些示例中,在步骤s400中,制备的上底层30的厚度可以为0.2mm至1mm。在这种情况下,上底层30具有良好的透气性以及较强的机械强度,能够有效起到屏障作用,为创面
9提供良好的愈合环境。在一些示例中,优选地,上底层30的厚度可以为0.2mm至0.5mm。在这种情况下,能够在起到屏障作用的情况下进一步提高上底层30的透气性。
[0201]
在一些示例中,在步骤s400中,可以采用硅胶制备上底层30。例如,上底层30可以为硅橡胶薄膜,也可以称为pdms(聚二甲基硅氧烷)膜。在这种情况下,上底层30质地柔软且具有良好的透气性,能够为创面9提供良好的愈合环境。
[0202]
在一些示例中,在步骤s400中,可以在上底层30的面向中间层20的表面、以及与该表面相对的表面上分别设置超疏水结构14。在这种情况下,能够增强上底层30的两个表面的疏水性,从而能够抑制位于中间层20内的渗出液向外蒸发,有利于为创面9提供合适的湿润环境;另外,还能够进一步增强上底层30抵抗污染的性能,降低创面9的感染风险。
[0203]
在一些示例中,在步骤s500中,可以通过胶粘剂而使上底层30、中间层20、以及下底层10中相邻的两层相互接合,并且中间层20与通孔13相对应的区域内不设置胶粘剂。在这种情况下,各层之间能够紧密结合,且便于中间层20通过通孔13而吸收目标表面的液体。
[0204]
在一些示例中,在步骤s500中,可以在中间层20与下底层10之间的外周缘区涂抹胶粘剂而使中间层20与下底层10相互接合。
[0205]
在一些示例中,上述步骤中,可以将下底层10、中间层20、以及上底层30均制备成片状。在一些示例中,在步骤s500中,将下底层10、中间层20、以及上底层30依次层叠,得到呈片状的医用敷料1。由此,能够便于覆盖目标表面。
[0206]
在另一些示例中,也可以在上述步骤中将下底层10、中间层20、以及上底层30制备成长条片状,并且在步骤s500中,将下底层10、中间层20、以及上底层30依次层叠,得到呈长条片状(即长卷状)的医用敷料1。在这种情况下,使用时可以将医用敷料1切割成期望尺寸(例如能够覆盖创面9的形状)后再使用。
[0207]
在一些示例中,医用敷料1的长度可以为20mm至120mm,宽度可以为20mm至120mm。在这种情况下,能够适配于小型创面9,且便于携带。本公开不限于此,医用敷料1的尺寸也可以根据实际需要进行调整。例如,当目标表面的面积较大时,可以采用能够覆盖目标表面尺寸的医用敷料1对其进行保护。
[0208]
在一些示例中,可以通过医用胶带将医用敷料1贴附于创面9。也可以在步骤s400中,将上底层30的两端设置成向外延伸,并使上底层30向外延伸出去的两端的内壁设有胶黏剂,也即形成创可贴的形式,从而能够便于将医用敷料1贴附于创面9。
[0209]
在一些示例中,本公开的制备方法制得的医用敷料1的使用期可以为0.5天至3天。在一些示例中,医用敷料1的使用期优选为12小时至36小时。其中,使用期是指医用敷料1敷贴于目标表面的时长。在这种情况下,能够有利于保持良好的透气性,为创面9提供合适的愈合环境。
[0210]
在一些示例中,还可以在下底层10的外表面12上设置可剥离地覆盖外表面12的保护膜40(参见图6)。在这种情况下,通过设置保护膜40能够维持外表面12在被使用前处于洁净状态,当需要将医用敷料1贴附于创面9时,将保护膜40从外表面12剥离即可。
[0211]
在一些示例中,保护膜40的形状可以与下底层10的形状一致。例如在下底层10呈片状的实施例中,保护膜40也可以呈片状,并且呈片状的保护膜40的面积不小于下底层10的外表面12的面积。
[0212]
在一些示例中,还可以在上底层30的相对远离中间层20的表面上设置可剥离地覆
盖该表面的第二保护膜50(参见图6)。在这种情况下,通过设置第二保护膜50能够维持上底层30相对远离中间层20的表面在被使用前处于洁净状态,当需要将医用敷料1贴附于创面9时,将第二保护膜50从该表面剥离,不会对上底层30的透气性产生影响。
[0213]
在一些示例中,保护膜40和/或第二保护膜50可以为离型纸。由此,能够进行有效防护。
[0214]
根据本公开的第二方面涉及的制备方法,能够制备得到可用于保护目标表面,能够为目标表面提供湿润的组织接触环境、且易于从目标表面剥离的医用敷料1。
[0215]
虽然以上结合附图和实施方式对本公开进行了具体说明,但是可以理解,上述说明不以任何形式限制本公开。本领域技术人员在不偏离本公开的实质精神和范围的情况下可以根据需要对本公开进行变形和变化,这些变形和变化均落入本公开的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1