1,8-桉树脑在防治非小细胞癌NCI-H1975中的新用途
1,8-桉树脑在防治非小细胞癌nci-h1975中的新用途
技术领域
1.本发明属于医药技术领域,具体的说,涉及1,8-桉树脑在防治非小细胞癌nci-h1975中的新用途。
背景技术:
2.非小细胞肺癌(nsclc)作为全世界癌症中死亡最多的肺癌对人类的健康危害严重,尽管目前人们对肺癌发展、控制与治疗有了初步了解和进步,但在其治疗方面仍然不太理想。
3.近年来对 nsclc 的临床治疗手段常以手术切除、放疗及辅助化疗为主的综合治疗,其中综合治疗与单一治疗是 nsclc 临床上比较关注的治疗方法,而其他治疗方法提到的较为缺乏,所以对于不同的患者情况而言,仍然无法确定最佳的治疗方案。同时,经由手术、化疗、放疗带来的副作用对患者预后有很大影响,会出现病情反复 的情况,在一定程度上降低了患者的生活质量。鉴于种种原因,目前需要寻找一种低毒、高效能够治疗肺癌细胞的抗癌活性成分,通过抑制肿瘤细胞的增殖同时能促进肿瘤细胞的凋亡来达到治疗癌症的目的,来解决肿瘤细胞给人体带来的危害和痛苦,从而改善患者的生活质量。
4.1,8-桉树脑(1,8-cineole)又名桉叶油素或者桉树醇,是一种存在于桉树中的天然单萜环醚类化合物,化学结构为:。其具有樟脑和清凉的草药气味,广泛存在于桉叶油等270多种天然精油中,未见现有技术中公开1,8-桉树脑用于防治非小细胞癌nci-h1975的报道。
技术实现要素:
5.为了克服背景技术中存在的问题,本发明提供1,8-桉树脑在预防和/或治疗非小细胞癌nci-h1975中的新用途。
6.本发明还提供一种预防和/或治疗非小细胞癌nci-h1975的药物,其中含有1,8-桉树脑和药学上可接受的药物载体。
7.进一步的,所述的药物载体包括:表面活性剂、润滑剂、吸收促进剂、稀释剂。
8.进一步的,所述的药物剂型为片剂、散剂、汤剂、丸剂或胶囊剂。
9.本发明的有益效果:本发明为非小细胞癌nci-h1975的防治提供了一种新方法。
附图说明
10.图1为1,8-桉树脑对 nci-h1975 细胞存活率影响图;图2为1,8-桉树脑能够促进 nci-h1975 细胞凋亡图;图3为1,8-桉树脑对 nci-h1975 细胞的 egfr、erk 蛋白表达的影响图。
具体实施方式
11.为了使本发明的目的、技术方案和有益效果更加清楚,下面将对本发明的优选实施例进行详细的说明,以方便技术人员理解。
12.实施例一、细胞毒性实验(1)mtt 接板,在 37 ℃水浴锅提前预热无血清培养基和 1
×
pbs,观察细胞 培养皿中细胞在 100 mm 的培养皿中生长状态到 70%-80%的汇合状态时接板,用胰酶 (0.5 ml/皿)消化细胞 3 min,离心后用移液枪吸除上清液,加入完全培养基重悬细 胞。在 200μl ep 管中加入台盼蓝和细胞悬浮液(1:1)混和均匀,在细胞计数板中 加入台盼蓝和细胞悬浮液(1:1)混合液 10μl ,用细胞计数仪对混合液中的细胞 进行计数。
13.(2)细胞饥饿:nci-h1975 细胞培养汇合状态 70%-80%进行饥饿处理,吸弃培养皿中的完全培养基,pbs 用水浴锅水浴加热至 37 ℃,用移液枪吸取 8 ml 37 ℃pbs 洗培养皿一遍,后加入高糖无血清培养基后移至孵育箱进行细胞饥饿处理 4 h。
14.(3)加药处理:4 h 后,37 ℃孵育加入相应体积不同浓度的 1,8-桉树脑,37 ℃ 孵育箱孵育 10 min 后,吸出培养基并用 4 ℃pbs 清洗 2 遍,加入细胞裂解液 150μl/ 皿提取细胞蛋白并进行 wb 分析。然后上样量分别为 40ug 和 30ug。
15.二、流式细胞术当 nci-h1975 细胞长至培养皿中 70%-80%状态时我们开始将细胞转移至 6 孔板内,观察到细胞贴壁时,将细胞转移到 dmem 培养基中培养 24 h,接着用移液枪吸去培养基的上清液,再用提前预热的 37 ℃pbs 冲洗 1 遍,重新向6孔培养板中加入 1,8-桉树脑处理 24 h,24 h 后用15 ml 离心管进行收集,用4 ℃预冷的 pbs 清洗一次,吸弃pbs,稀释 av/pi 试剂盒中的 buffer,并用稀释后的 buffer 轻轻吹匀细胞,对照组加 1 ml buffer,其余处理组加 500μl。然后将细胞混匀转移至1.5 ml ep 管,加入 av、pi 染色液,轻弹混匀。用锡箔纸将 ep 管包裹上,需在室温条件下避光染色15 min。染色完成后,向 ep 管中加入400μl buffer。取出ep管中的混合液体,在超净台用滤布过滤到流式管,避光放入冰盒中保存,用流式细胞仪检测细胞凋亡。
16.二、sds-page 凝胶电泳细胞加药处理:当 2.4.2 中 nci-h1975 细胞饥饿处理后,从孵育箱中取出已经饥 饿 4 h 的细胞,往培养皿内加入相应体积不同浓度的 1,8-桉树脑(0 μmol/l,50 μmol/l, 100 μmol/l,150 μmol/l,200 μmol/l,300 μmol/l),移至 37 ℃孵育箱孵育 10 min。
17.细胞蛋白提取:吸弃培养皿内的培养基,然后用 4 ℃pbs 清洗两遍,吸走 pbs 后倾斜放置培养皿,用真空抽滤泵将皿底部残留的 pbs 清洗液完全吸出。根据培养 皿的数量配制细胞裂解液,用细胞快速裂解液与 pmsf(100:1)配制细胞裂解液, 往每个培养皿内
分别加入 150 μl 配制好的细胞裂解液,左右摇晃培养皿,使裂解液 铺满皿底部,与细胞与裂解液充分反应。然后快速将细胞培养皿放入事先准备好的冰 盒中进行细胞裂解,计时器计时 30 min。同时利用离心机对其进行降温操作,使其温 度降至 4 ℃,转速为 15000 rpm,用干净枪头底部将皿上蛋白刮下并收集在相应 1.5 ml ep 管,放入离心机中进行离心操作 10 min。取管内上清液并转移到另一个相 同规格的 ep 管中,放置冰盒中暂时保存或以便进行后续实验,或放入-20 ℃冰箱冻 存。
18.细胞蛋白定量:提前准备好冰板,蛋白样品(1 mg/ml),pbs,定量稀释板, 96 孔酶标板,移液枪,枪头等实验所需的物品。
19.蛋白样品稀释:将定量稀释板放置在冰板上,用 100 μl 的移液枪吸取 68 μl 标 准蛋白加入定量稀释板孔中,再加入 pbs 进行倍比稀释,稀释浓度梯度为 0.5 mg/ml, 0.25 mg/ml,0.125 mg/ml,0.0625 mg/ml,0.03125 mg/ml,0 mg/ml。将稀释混匀 后的标准蛋白用 50 μl 排枪吸至 96 孔酶标板中,每孔 20 μl,稀释 3 组平行浓度。 分别用移液枪吸取 200 μl 配制好的 bca 定量显色工作液(a 液:b 液=1:50)加入 各个孔中,盖上酶标板的盖并用一次性塑料手套封好,然后将 96 孔酶标板放入 37 ℃ 恒温箱孵育 30 min。孵育结束后测其吸光度。设置酶标仪相关参数,选择双波长数值 为 560 nm、630 nm,将只有 pbs 的孔设置为空白孔,并设置每孔都带空白,准备就 绪后将 96 孔酶标板放入酶标仪测吸光度。
20.细胞蛋白制样:根据测出的吸光度数值计算出蛋白上样量。取相应体积的蛋白样 品和一定量还原载样液于 200 μl 的 pcr 管中混匀后离心三次,移至煮样器,95 ℃ 煮样 8 min 后放入-80 ℃冰箱保存待用。
21.western blot:(1)配胶:配 4 块胶,首先准备 4 块胶条,4 个夹子,4 套胶板,承载的架子, 将准备好的胶条放在架子上,然后把大小一套胶板放入夹子中夹紧,胶板底部必须光 滑平行,夹紧后放入承载的架子上,紧贴内侧,按压,卡入枪头,直至夹子不会晃动。
22.(2)配置 8%的分离胶:拿移液枪:10
ꢀµ
l,100
ꢀµ
l,200
ꢀµ
l,5 ml;枪头;sds、 aps、1.5m、30%的制胶液、temed 和新的 up 水和 8%分离胶的管,按表逐一放入试 剂,在放 sds、aps、temed 时需打入液面以下,加入 temed 前,需将 5 ml 的 枪调至 3600 刻度并装好枪头,200
ꢀµ
l 的枪装上枪头,加入 temed 后摇晃管,用 5 ml 的枪快速加入分离胶,至绿线,不能有气泡,接着用 200
ꢀµ
l 的枪加水至溢出,保持 液面平行枪垂直与胶板,等待 30 min;收东西,等待 30 min 后吸水,勿触胶。
23.(3)配置 4 %的浓缩胶:拿枪:10
ꢀµ
l、100
ꢀµ
l、1 ml、5 ml;枪头;10 孔的梳子; sds、aps、0.5m、30%的制胶液、temed 和 up 水,按一定比例逐一放入试剂,配 置好后加入胶板中。随后从左往右斜插入胶板中,不能有气泡,将中间和两夹角补满 胶,静置 15 min。
24.(4)准备电泳:按比例配置电泳液,配置好后放入冰柜。找电泳盒子、盖子、 开机器,等待 15 min 后,拆下胶板,洗去多余部分,泡在 up 水中,将胶板安装在电 泳盒里的架子中,胶板上方两侧的要卡紧,电泳液,从中间加入,然后拔出梳子,垂直拔出。
25.(5)开始上样:从左往右,在第二孔中加入 marke,第三孔加入样品至第八孔, 最后在第一、第九、第十孔加入载样液。
26.(6)运行仪器:将架子放在有突出电极的位置,盖上盖子,插入电极,黑对黑 红对
红,设置程序:程序 1,电压 50 v,时间 30 min,恒压;程序 2,电压 120 v, 时间 1 h,恒压,开始运行程序,观察是否正常,第二个程序 40 min 后来观察样品是 否到达蓝线。
27.(7)准备转膜:2 块膜 16 张滤纸,2 张 pvdf 膜,2 套黑白夹子(每套 2 块黑 色的胶片),1 个红色的转膜槽,镊子,甲醇,1 个盆,1 个起子,1 个蓝色的小盒, 拿一个冰盒往里装入一个转膜盒并盖上盖子加冰块按紧,2 个小冰块放入转膜盒,;(8)开始转膜:将跑完电泳的胶取出,用起子撬开胶板,缓慢的撬,划开浓缩 胶并弃置,放入装有转膜液的盆中,放入 8 张滤纸;将甲醇倒入蓝色小盒子中,放入 蓝色纸中的膜激活 30 秒,然后放入盆中,依次从盆中取出 4 张滤纸放在手中重叠, 重叠的滤纸不能有气泡存在,取出膜放在滤纸上中间位置,再取胶放在膜上,把剩余 的 4 张滤纸依次取出并重叠在其上,不能有气泡,放入夹子中,黑对胶白对膜,然后 插入转膜盒里红色架子上,倒入转膜液,设置程序;电流 200 ma,时间 1 h,恒流, 开始观察是否恒流;(9)封闭、铺一抗:配置 20 ml 封闭液:1 gbsa 加 20 mlpbs,混合均匀,转 膜 1 小时后,准备放膜的盒子,取出夹子,取出膜放入盒子,先用 1*pbst 洗 5 分钟, 倒入封闭液,用手套密封,放入摇床,横着放,等待 1 h,收东西。1 h 后取出膜,回 收封闭液,倒入 1*pbst,放入摇床,5 min,洗膜 1-2 次,铺一抗放入冰柜摇床过夜。
28.(10)铺二抗:隔天从摇床中取出膜,回收对应抗体,用 200
ꢀµ
l 枪吸取剩余抗 体,用 1*pbst 快速的洗 3 次,然后倒入 1*pbst 没过膜放入速度快的摇床中计时 10 min,重复慢洗 3 次,配置二抗 10 mlbsa+4
ꢀµ
lmouse 抗体和 10 mlbsa+4
ꢀµ
l rabbit 抗体,将 pbst 倒干净,分别加入二抗,放到慢的摇床计时 1 h,回收二抗, 用 1*pbst 快洗三次,倒入 1*pbst 放入快的摇床计时 10 min,重复慢洗 3 次。
29.(11)曝光:按 1:1 的比例配置曝光液,每块膜用 1 ml 曝光液,用 1 ml 的枪 把曝光液打在曝光板上,将洗好的膜取出用吸水纸吸干,先把膜的反面放在刚铺的曝 光液上,拿起膜把正面朝上铺下,不能存在气泡,用锡纸遮住会影响目的条带的部分,推入曝光板,关闭机器的门,点击“expose”开始曝光,曝光自动停止后,调节图片 背景颜色,选择其中最合适的一张进行命名,点击 edit,选择目标图片,u 盘拷贝, 用数据处理分析软件 aic alphaview 对曝光图片的蛋白条带灰度值进行分析。
30.四、数据处理采用数据分析软件 ttest 分析数据差异性。分析方法为单因素方差分析,“*
”ꢀ
表示 p《0.05具有显著性差异,“**”表示 p《0.01具有明显显著性差异,“***”表示 p《0.001差异极显著。*:代表与对照组比较的差异性。
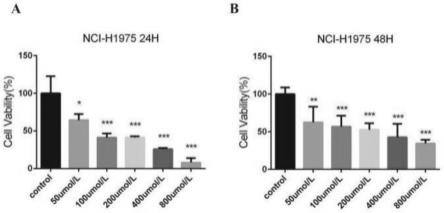
31.五、实验结果1、如图1中a图所示,1,8-桉树脑(0 μmol/l、50 μmol/l、100 μmol/l、200 μmol/l、400 μmol/l、 800 μmol/l)分别处理 nci-h1975 细胞 24 h,与对照组相比,在 1,8-桉树脑的浓度为 50 μmol/l 时显著抑制 nci-h1975 细胞的增殖(p《0.05),在 1,8-桉树脑的浓度为(100 μmol/l、200 μmol/l、400 μmol/l、800 μmol/l)能够显著抑制 nci-h1975 细胞的增 殖(p《0.001),且在 50-800 μmol/l 的浓度范围内呈剂量依赖性。如图1中b图所示, 1,8-桉树脑(0μmol/l、50μmol/l、100μmol/l、200μmol/l、400μmol/l、800μmol/l) 处理 nci-h1975 细胞 48 h,与对照组相比,在 1,8-桉树脑的浓度为 50μmol/l 时显著 抑制 nci-h1975 细胞的增殖(p《0.01),1,8-桉树脑的浓度为(100μmol/l、200μmol/l、 400μmol/
l、800μmol/l)能够显著抑制 nci-h1975 细胞的增殖(p《0.001)。通过以上实验结果能够得出,1,8-桉树脑对于nci-h1975细胞增殖的抑制作用有显著的效果。
32.2、如图2中a-c所示,与对照组相比 1,8-桉树脑(300μmol/l、600μmol/l)分别处理 nci-h1975 细胞24 h后,其细胞死亡与凋亡总和分别由 5.27%增加至 6.48%和 8.71%,而活细胞数量 由 94.73%减少至 93.52%和 91.29%,表明1,8-桉树脑参与 nci-h1975 细胞凋亡进程,并且显著促进其凋亡。
33.3、如图3所示,将 nci-h1975 细胞饥饿处理 4 h,再加入 1,8-桉树脑继续培养细胞 10 min。 在 1,8-桉树脑浓度为(0μmol/l、50μmol/l、100μmol/l、150μmol/l、200μmol/l、 300μmol/l)时作用于 nci-h1975 细胞,与对照组相比,在 1,8-桉树脑的作用下 egfr 蛋白的表达以浓度依赖的方式逐渐降低,1,8-桉树脑在(100μmol/l、150μmol/l、200μmol/l)时可显著抑制 egfr 的表达(p 《0.05),1,8-桉树脑在(300μmol/l)时可 显著抑制 egfr 的表达(p《0.01)。同时检测 1,8-桉树脑对 egfr 信号通路下游蛋白 erk 及其磷酸化水平的影响,如图 c,d 所示,与对照组相比,erk 蛋白的表达在 1,8
‑ꢀ
桉树脑的作用下以浓度依赖的方式逐渐降低,1,8-桉树脑在(100μmol/l、150μmol/l) 时可显著抑制 egfr 的表达(p《0.05),1,8-桉树脑在(200μmol/l、 300μmol/l)时可显著抑制 egfr 的表达(p《0.01)。。以上实验结果表明,1,8-桉树脑能够抑制 nci-h1975 细胞内的 egfr/erk 信号通路在蛋白水平上的表达,证明了 1,8-桉树脑 对 egfr/erk 信号通路有抑制作用。
34.最后说明的是,以上优选实施例仅用于说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1