SIRT7基因在肺动脉高压中的应用
sirt7基因在肺动脉高压中的应用
技术领域
1.本发明涉及生物医药技术领域,尤其是涉及sirt7基因在肺动脉高压中的应用。
背景技术:
2.肺动脉高压(pulmonary arterial hypertension,pah)是由多种因素引起的肺血管结构及功能异常,进而使肺血管阻力进行性升高,随着病程的进展,最终可导致右心衰竭而死亡,具有较高的致死率。
3.pah预后较差,且目前缺乏有效的治疗手段。据统计,pah患者的平均生存期仅为2.8年。我国pah患者数量庞大,由此产生的相关卫生经费,已造成严重的经济负担。因此,提高肺动脉高压的防治水平已经成为重大的公共卫生问题。重点扶持并深入开展肺动脉高压干预效果的研究,对于促进我国居民健康是非常重要而迫切的。目前,研究表明肺动脉高压的病理改变是肺动脉中膜平滑肌细胞异常增殖,血管纤维化、原位血栓形成、丛状病变以及周围血管炎症浸润,导致肺动脉持续性异常收缩。因此,深入探讨pah心血管重构损伤的病理生理机制,对寻求pah新的药物治疗靶点及其临床应用具有重要意义。
4.沉默调节蛋白7(sirtuin 7,sirt7)是哺乳动物sirtuin家族的成员,属于ⅲ类组蛋白脱乙酰酶。sirt7是sirtuin家族中唯一定位于核仁的蛋白,广泛表达于人体不同器官组织中。sirt7特殊的定位提示其与rdna转录、核糖体的生物合成及细胞增殖有关。在过去几年中,发现其在dna损伤修复、应激反应、代谢稳态、衰老、炎症和肿瘤的发生中起到了关键作用,并因其在基因组中的稳定性而受到广泛关注。
5.目前,有研究发现sirt7基因在肿瘤、乙型肝炎和延缓衰老等领域中发挥重要作用。但是,sirt7在肺动脉高压等血管疾病发生发展中的作用仍然未知。
6.有鉴于此,提出本发明。
技术实现要素:
7.本发明的目的在于提供sirt7基因在肺动脉高压心血管损伤中的应用,该分子标志物sirt7可以很好的逆转肺动脉高压所致的肺血管重构,减轻肺动脉高压诱导的右心室重构。
8.本发明提供sirt7基因在制备诊断和/或治疗肺动脉高压心血管损伤产品中的应用,其中,所述sirt7基因的核苷酸序列如seq id no.1所示。
9.基于本发明的sirt7基因可以有效抑制肺动脉细胞的增殖,减轻肺动脉高压所致肺血管重构的发生和发展,并且可以有效减轻肺动脉高压诱导的右心室重构,抑制右心室的纤维化,改善心肌功能紊乱。因此,可以将其用于制备治疗肺动脉高压的新药物,为肺动脉高压提供新的治疗方案。
10.作为本技术方案优选地,所述sirt7基因的蛋白水平和/或酶活性在肺动脉高压肺组织中降低。
11.作为本技术方案优选地,所述sirt7基因在制备治疗肺动脉高压心血管损伤产品
中的应用具体包括:所述sirt7基因在制备降低右心室收缩压、减轻右心室肥厚、增加收缩期三尖瓣位移和抑制肺动脉血管重构中一项或多项的药物中的应用。
12.作为本技术方案优选地,本发明所述sirt7基因之所以能够抑制肺动脉高压的发生及发展,是因为其可有效抑制心血管炎症相关因子和纤维化相关因子的表达,从而减轻肺动脉高血压心血管炎症和纤维化程度。其中,所述促炎症因子包括icam-1、vcam-1和il-6,并且,所述icam-1正向引物的序列如seq id no.2所示,所述icam-1反向引物的序列如seq id no.3所示;所述vcam-1正向引物的序列如seq id no.4所示,所述vcam-1反向引物的序列如seq id no.5所示;所述il-6正向引物的序列如seq id no.6所示,所述il-6反向引物的序列如seq id no.7所示。
13.作为本技术方案优选地,所述纤维化相关因子包括collage1、collage3和periostin,其中,所述collage1正向引物的序列如seq id no.8所示,所述collage1反向引物的序列如seq id no.9所示;所述collage3正向引物的序列如seq id no.10所示,所述collage3反向引物的序列如seq id no.11所示;所述periostin正向引物的序列如seq id no.12所示,所述periostin反向引物的序列如seq id no.13所示。
14.作为本技术方案优选地,所述sirt7基因在制备诊断肺动脉高压心血管损伤产品中的应用具体包括:
15.所述sirt7基因在肺动脉高压心血管损伤诊断或制备用于肺动脉高压心血管损伤诊断的产品中的应用;
16.所述sirt7基因在肺动脉高压心血管损伤辅助诊断或制备用于肺动脉高压心血管损伤辅助诊断的产品中的应用;
17.所述sirt7基因在肺动脉高压心血管损伤筛查或制备用于肺动脉高压心血管损伤筛查的产品中的应用;
18.所述sirt7基因在预测或评估肺动脉高压心血管损伤风险或制备用于预测或评估肺动脉高压心血管损伤风险的产品中的应用;
19.所述sirt7基因在肺动脉高压心血管损伤预后评估或制备用于肺动脉高压心血管早期损伤与预后评估的产品中的应用。
20.本发明还提供了一种检测肺动脉高压心血管损伤的检测试剂盒,也理应属于本发明的保护范围,具体包括用于检测权利要求1所述sirt7基因的mrna表达水平的试剂。
21.具体地,这里mrna表达水平是指在转录水平上检测基因转录的mrna的丰度;蛋白质表达水平是指在翻译水平上检测基因编码的蛋白质的丰度。因此,通过上述用于检测sirt7基因的mrna表达水平或蛋白质表达水平的试剂即可实现对肺组织中sirt7蛋白水平或酶活性的检测,进而用于诊断或辅助诊断肺动脉高压心血管损伤。
22.作为本技术方案优选地,还包括特异性扩增所述sirt7基因的引物组合物和特异性识别所述sirt7基因的探针。
23.此外,该试剂盒中还包括用于提取rna的试剂、用于进行逆转录的试剂盒用于进行实时荧光定量rt-pcr的试剂等等。
24.本发明的肺动脉高压心血管损伤标志物及其检测试剂盒和应用,至少具有以下技术效果:
25.1、本发明的sirt7基因可以有效抑制肺动脉细胞增殖,减轻肺动脉高压所致肺血
管重构的发生和发展;
26.2、本发明的sirt7基因可以有效减轻肺动脉高压诱导的右心室肥厚重构,抑制右心室纤维化,改善右心功能紊乱;
27.3、通过检测sirt7基因的蛋白水平和/或酶活性在心血管组织中的变化,即可用于诊断或辅助诊断肺动脉高压,因此,sirt7基因可以作为检测肺动脉高压心血管损伤的标志物;
28.4、本发明的sirt7基因可以通过降低右心室收缩压和减轻右心室肥厚,改善肺动脉高压患者的肺循环阻力和右心室受累/右心衰竭,因此,sirt7基因可以作为治疗肺动脉高压的治疗靶点,用于制备预防或治疗肺动脉高压的药物;
29.5、通过将sirt7基因作为标志物,可实现对血浆样品或者石蜡组织中sirt7 mrna的定量检测,不仅有利于肺动脉高压的诊断和分子分型,而且提高了对肺动脉高压的临床病理的认识和理解,实现对该疾病的精准治疗。
附图说明
30.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
31.图1为本发明肺动脉高压组(pah)sirt7 mrna水平(a)和蛋白水平(b)相较对照组(con)的变化;
32.图2为本发明sirt7对野百合碱所致肺动脉高压大鼠的右心室压力(a)、右心室壁厚度(b)和三尖瓣收缩期位移(c)的影响;
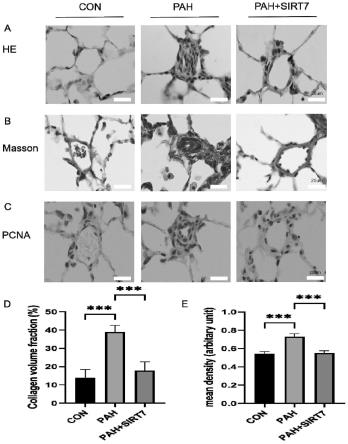
33.图3为本发明通过he染色(a)、masson染色(b)、pcna免疫组化(c)表征sirt7对野百合碱所致肺动脉高压大鼠肺动脉血管重构的影响,(d)和(e)分别为肺血管胶原容积分数和pcna蛋白的平均表达量;
34.图4为本发明通过masson染色(a)、wga染色(c)表征sirt7对野百合碱所致肺动脉高压大鼠右心室重构的影响,(b)和(d)分别为肺动脉高压大鼠右心室胶原容积分数和心肌细胞平均面积;
35.图5为本发明通过rt-pcr表征sirt7对野百合碱所致肺动脉高压大鼠肺组织炎症和纤维化程度的影响。
具体实施方式
36.应该指出,以下详细说明都是示例性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
37.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也包括复数形式,此外,还应当理解的是,当在本说明中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
38.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
39.实施例
40.本发明动物实验中共采用21只6周龄雄性sd大鼠,分为以下三组:
41.对照组(con;n=7);
42.mct+raav-gfp组(pah;n=7);
43.mct+raav-sirt7组(pah+sirt7;n=7);
44.首先,利用腺相关病毒(aav)构建了重组sirt7腺相关病毒(raav-sirt7)以及病毒对照raav-gfp,对6周龄pah组和pah+sirt7组的sd大鼠分别进行raav-gfp、raav-sirt7尾静脉注射,对照组大鼠尾静脉注射等剂量的生理盐水。两周后即大鼠8周龄时对pah组和pah+sirt7组再进行一次性腹腔注射野百合碱(60mg/kg),对照组大鼠给予等剂量的生理盐水,为期四周。对照组及干预组大鼠于12周龄时进行右心导管测压,测量右心室压力,并进行心脏超声。
45.其中,血流动力学指标的测定方法为:在第4周末处理大鼠前,用改良的孙波右心导管术测量每只大鼠rvsp,具体测试方法如下:
46.试验例1
47.大鼠禁食过夜,腹腔注射2%戊巴比妥(50mg/kg)进行麻醉。仰卧位固定,将导管进入颈外静脉后,导管头端保持指向胸腔左侧。插入1~2cm左右到达上腔静脉与腋静脉汇合处,颈静脉波形即出现,其特点为缓慢上升后缓慢下降,波幅较小。
48.导管进入约2cm接近右心耳,将导管旋转至导管头端朝外。导管继续进入到达心房,可见呈小波浪、曲线较平缓、舒张压与收缩压相差不明显的右心房波形。保持原方向继续进管,导管由右心房插入1cm,并逆时针旋转,使导管头端朝向左下,再进0.5cm可进入右心室。其波形特点为骤升骤降、血压波谷降至0mmhg附近。当波形稳定后开始记录右心室压力。
49.本发明采用不同染色方法验证sirt7对肺动脉高压心血管重构及对心脏和肺动脉纤维化的影响情况。
50.试验例2
51.he染色法
52.1、将固定完毕的肺组织用切片机切成约4μm厚度的薄片,然后附着在载玻片上;
53.2、石蜡切片脱蜡至水化
54.将切片依次放入二甲苯i10min-二甲苯ii10min-无水乙醇i 5min-无水乙醇ii 5min-95%酒精5min-90%酒精5min-80%酒精5min-70%酒精5min-蒸馏水洗。
55.3、苏木素染细胞核
56.切片置于苏木素染色3-8min,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗。
57.4、伊红染细胞质
58.切片置于伊红染液中染色1-3min。
59.5、脱水封片
60.将切片依次放入95%酒精i 5min-95%酒精ii 5min-无水乙醇i 5min-无水乙醇ii 5min-二甲苯i 5min-二甲苯ii 5min中脱水透明,将切片从二甲苯中拿出稍晾干,使用中性树胶封片。
61.6、显微镜镜检,图像采集分析
62.试验例3
63.pcna免疫组化
64.1、脱蜡和水化
65.石蜡切片置于新鲜二甲苯中,二甲苯i10min-二甲苯ii 10min-无水乙醇i 5min-无水乙醇ii 5min-95%酒精5min-90%酒精5min-80%酒精5min-70%酒精5min;使用蒸馏水3min*3次,pbs 3min*3次。
66.2、抗原修复
67.将切片浸泡在抗原修复液(1x)中,95-100℃加热约15min,随后在20-30min内冷却至室温;使用pbs 5min*2次,蒸馏水3min*2次。
68.3、阻断内源性过氧化物酶
69.加入适量的内源性过氧化物酶阻断剂,室温孵育10min;pbs缓冲液冲洗3min*3次。
70.4、滴加一抗
71.根据组织大小,滴加100μl适量的一抗,37℃孵育60min;pbs缓冲液冲洗3min*3次。
72.5、滴加反应增强液
73.滴加100μl或适量的反应增强液,37℃孵育20min;pbs缓冲液冲洗3min*3次。
74.6、滴加增强酶标山羊抗兔igg聚合物
75.滴加100μl或适量的增强酶标山羊抗兔igg聚合物,37℃孵育20min;pbs缓冲液冲洗3min*3次。
76.7、dab显色
77.加入适量新鲜配制的dab显色液,室温孵育5-8min。
78.8、复染
79.自来水冲洗,苏木素染色液孵育20秒,0.5%氨水反蓝,1%盐酸酒精分化3秒,自来水冲洗3min。
80.9、脱水、封片
81.脱水,依次置于70%酒精2min-80%酒精2min-95%酒精2min-无水乙醇2min-二甲苯ⅰ3min、二甲苯ⅱ3min,封片。
82.10、阅片
83.试验例4
84.masson三色法染色
85.1、常规脱蜡至水。
86.2、经过苏木素染色5min,清水冲洗。
87.3、经过盐酸酒精分化,清水冲洗。
88.5、0.2%醋酸水溶液冲洗。
89.6、5%磷钼酸分化5min。
90.7、0.2%醋酸水溶液冲洗。
91.8、2%苯胺蓝溶液染30s。
92.9、无水乙醇冲洗,自然晾干。
93.10、使用中性树胶封片。
94.11、镜检,观察,拍照。
95.试验例5
96.wga染色
97.1、脱蜡、复水
98.60℃烤箱处理30min-冷却20min-二甲苯5min*3次-100%乙醇5min*3-95%乙醇5min*2次-80%乙醇3min-70%乙醇3min-双蒸水10min
99.2、抗原修复
100.柠檬酸缓冲液(ph=6.0)95℃水浴锅*15min。
101.3、待切片自然冷却后pbs 5min*3次。
102.4、5ug/ml wga室温孵育30min。
103.5、染核、封片、镜检。
104.由图1可知,肺动脉高压(pah)组与对照组(con)相比,sirt7的mrna表达水平(图1中a)和蛋白表达水平(图1中b)均明显降低;其中,sirt7的正向引物序列为tcagcacggcagcctctatcc,反向引物序列为taggtcggcagcactcacagg。
105.由图2可知,sirt7的预防性给药显著降低了肺动脉高压大鼠的右心室压力(rvsp)(图2中a)和右心室壁厚度(rvwt)(图2中b),并增加了三尖瓣收缩期位移(tapse)(图2中c),表明sirt7延缓并抑制了肺动脉高压右心室重构和右心功能紊乱的发生和进展。
106.由图3可知,结合he染色法(图3中a)、masson染色法(图3中b)和pcna免疫组化(图3中c)结果,分析肺血管胶原容积分数(图3中d)和pcna蛋白平均表达量的变化(图3中e),表明sirt7有效地延缓了肺动脉纤维化的进展,并抑制了肺动脉细胞的增殖,进一步说明sirt7抑制了肺动脉高压肺血管纤维化重构及损伤的发生和发展。
107.由图4可知,结合masson染色法(图4中a)和wga染色法(图4中c)结果,分析心肌胶原容积分数(图4中b)和心肌细胞平均面积(图4中d),表明sirt7干预后可以有效的减少肺动脉高压诱导的右心室重构、减轻并抑制肺动脉高压右心室的纤维化和心肌功能紊乱及恶化。
108.试验例6
109.trizol法获得组织总rna
110.1、将50-100mg的肺组织置于无酶ep管中,加入1ml trizol,匀浆机将组织块磨碎,室温放置5-10min。
111.2、每个ep管加入200ul的氯仿,剧烈震荡15s。
112.3、室温放置2-3min,12000g(4℃)离心15min。
113.4、离心后,ep管中液体会分离成底层浅红、中层酚-氯仿相、上层无色水相的三层液体相,rna存在于上层水相中,转移上层水相至新的ep管中(注意避免触及中层),每个ep管加入500ul异丙醇,室温放置10min,12000(4℃)离心10min。
114.5、离心完后,可见rna附于管底,小心弃去上清,加入1ml 75%乙醇洗涤管底rna,
漩涡震荡,7500g(4℃)离心5min。
115.6、附着于管底的rna在室温自然干燥10min。
116.7、加入30ul无酶水溶解rna,用枪头反复吹打,取1ul测定rna浓度,置于-80℃冰箱短期保存,尽快逆转录为cdna模板,并在转录过程中加入表1中引物。
117.表1炎症相关因子和纤维化相关因子的引物序列
[0118][0119][0120]
由图5可知,sirt7抑制了肺动脉高压大鼠肺组织中的炎症相关因子icam-1、vcam-1和il-6的表达,降低了纤维化相关因子collage1、collage3和periostin的表达。
[0121]
综上,sirt7可作为治疗肺动脉高压新的药物靶点,并为治疗肺动脉高压提供了新的治疗方案。
[0122]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1