丁酸梭菌在结直肠癌辅助治疗上的应用
1.本发明涉及微生物功能技术领域,特别是指丁酸梭菌在结直肠癌辅助治疗上的应用。
背景技术:
2.结直肠癌(colorectal cancer,crc),是人类常见的恶性肿瘤,目前被列为世界第三大癌症。随着人们生活水平的提高和饮食结构的改变,其发病率和死亡率呈上升趋势,严重威胁着人类的健康。已有大量研究报道crc与多种因素有关,如肥胖、糖尿病、久坐生活方式、高脂肪饮食、吸烟、酗酒、年龄、性别、家族史等,但其确切的发病机制仍不明确。
3.有文献报道在结肠癌中肠道菌群的组成发生了变化,提示肠道菌群生态失衡在结直肠癌发生发展中发挥着重要作用。因此,越来越多的研究表明,益生菌的使用可以对抗crc患者肠道菌群的失调,从而恢复疾病导致的肠菌生态失衡,减少细菌引起的炎症、遗传毒性、致癌途径等。
4.目前的研究都停留在丁酸梭菌作为益生菌在一些疾病和癌症的发生发展中有相应的调节作用,但这些调节作用所涉及的机制在很大程度上仍未被探索清楚。因此,对丁酸梭菌的作用机制进行深入挖掘,可以进一步扩大丁酸梭菌在结直肠癌治疗上的应用。
技术实现要素:
5.本发明是基于丁酸梭菌对结直肠癌的作用机制的基础上,深入探索其更多的应用可能,提高丁酸梭菌的应用方向。
6.本发明的研究方向如下:
7.1、通过细胞增殖、克隆形成、结直肠癌类器官的培养,细胞迁移侵袭、流氏细胞术,肺转移裸鼠模型等实验探究c.b cm对结直肠癌细胞的生物学行为的影响。
8.2、转录组学测序显示c.b cm可影响细胞周期导致细胞周期停滞,应用实时荧光定量逆转录聚合酶链反应(qrt-pcr)、免疫印迹(western blot,wb)以及流氏细胞等的方法可验证其对细胞周期相关基因和蛋白的影响。运用泛素化实验和蛋白降解速率的方法研究c.b cm对细胞周期相关蛋白myc的调控作用。
9.3、tcga数据库分析可得myc可正向调控tyms,构建沉默或过表达myc的结直肠癌细胞株,通过qrt-pcr及wb验证其沉默或过表达时tyms也会有同样的下调和上调的状况。通过qrt-pcr及chip实验验证在处理过c.b cm后,myc与tyms该启动子区域的结合减弱。ic50、细胞凋亡、克隆形成实验表明c.b cm可能增强5-fu的敏感性。
10.4、裸鼠皮下成瘤实验,是否c.b cm能够增强5-fu对hct116细胞在裸鼠体内的成瘤抑制的能力。免疫组化(immunohistology,ihc)验证肿瘤增殖凋亡以及myc和tyms的表达情况。
11.5、c57bl/6j小鼠皮下成瘤实验,观察c.b和c.b cm本身是否可以抑制小鼠皮下成瘤,是否可以上调免疫相关蛋白的表达,联合使用anti-pd1同样能够提高anti-pd1对
hct116细胞在裸鼠体内的成瘤抑制的能力。免疫组化(immunohistology,ihc)验证myc等免疫标识相关蛋白的表达情况。
12.在本发明中,证明了丁酸梭菌通过调节包括myc在内的关键信号分子,对crc中的增殖、迁移、干细胞和肿瘤生长进行了重新编程,通过补充c.b可使myc失去稳定,抑制癌细胞增殖/转移,提高5-fu的治疗敏感性,以及增强anti-pd1免疫治疗的应答。myc是胸苷酸合成酶(tyms)的转录因子,而tyms是5-fu的关键耐药靶点。此外,已知myc对pd-1表达有影响。从机制上讲,c.b抑制crc细胞通过增强泛素介导的泛素化,导致myc降解,从而减轻myc介导的5-fu耐药性,提高抗pd1免疫治疗效果。总之,本发明揭示了以前未被认可的c.b和crc细胞信号之间的联系,为深入了解c.b在促进化疗/免疫治疗中的肿瘤发生调节机制提供了线索。
附图说明
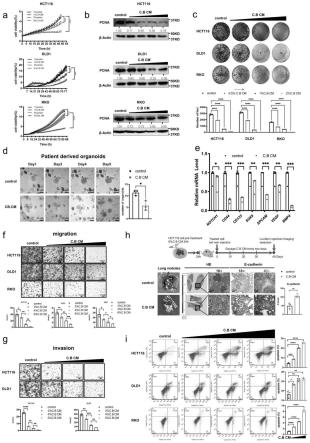
13.图1中,a)不同浓度的c.b cm处理crc细胞的生长曲线(hct116和dld1细胞为1%、3%的c.b cm,rko细胞为1%和5%的c.b cm)。用incucyte仪测定生长。b)免疫印迹分析c.b cm诱导的crc细胞(hct116、dld1和rko细胞)中pcna蛋白的表达。β-肌动蛋白作为内参对照。c)在crc细胞中使用指定浓度的c.b cm(0.5%,1%,2%)处理后进行集落形成试验。培养基每五天更换一次。d)用1.5%的培养基或1.5%的c.b cm处理5天后crc患者来源的类器官的图像和定量。比例尺:25μm。e)采用qrt-pcr分析,测定处理6%培养基或者处理6%c.bcm后hct116细胞中干性标志物的mrna水平。f)transwell实验分析显示,对crc细胞使用指定浓度的c.b cm处理24小时后,c.b cm对crc细胞中细胞迁移能力的影响。比例尺:100μm。g)transwell实验分析显示,对crc细胞使用指定浓度的c.b cm处理24小时后,c.b cm对crc细胞侵袭能力的影响。比例尺:100μm。h)尾静脉静脉转移扩散试验的示意图。hct116-luc肿瘤细胞在静脉注射到balb/c-nu小鼠(1
×
106cells,200μl)。肿瘤细胞注射后第40天,注射荧光素后肺部ivis成像。取样进行he和e-cadherin的ihc染色。比例尺:10x,100μm;40x,25μm。i)流式细胞术分析不同浓度c.b cm(3%、4%、5% c.b cm处理hct116细胞,3%、5%、6%c.b cm处理dld1细胞,4%、6%、8%c.b cm处理rko细胞)处理过后,crc细胞凋亡细胞情况。数据以平均值
±
sem表示。ns,没有意义;*,p《0.05;**,p《0.01;***,p《0.001;双向方差分析检验,无配对双尾学生检验和单向方差分析检验。
14.图2中,a)对照组和c.b cm处理的hct116细胞差异基因表达的火山图(|logfc|》0.5,p-value《0.05)。b)基于gsea分析结果,c.b cm组较对照组显著下调的前20个代表性通路。c)qrt-pcr分析用于测量使用6%培养基或使用6%c.bcm治疗后指示细胞周期相关基因的mrna水平的变化。d)免疫印迹分析显示不同浓度的c.b cm处理的crc细胞中指示的细胞周期相关蛋白的蛋白表达(hct116为3%、4%和6%,dld1细胞为3%、4%、5%和6%)。e)流式细胞术分析c.bcm治疗后crc细胞的细胞周期分布。分析crc细胞通过不同浓度的c.b cm(hct116细胞为3%、4%、5%,dld1细胞为4%、5%和6%,rko细胞为3%,4%和6%)处理24h后细胞周期的分布。f)免疫印迹分析hct116、dld1和hek293t细胞与不同浓度的c.b cm(3%和6%)处理24h后泛素化myc蛋白的变化。将his-ubi和ha-myc质粒共转染细胞。在细胞收获前6h添加mg132。然后将ni-nta和anti-ha抗体加入细胞裂解液中,检测目的蛋白表达。g)3% c.b cm处理24h后hct116、dld1和hek293t细胞中myc蛋白的周转率。chx:环己酰亚胺,
iod:积分光密度。数据以平均值
±
sem表示。ns,没有意义;*,p《0.05;**,p《0.01;***,p《0.001;无配对双尾学生检验和双向方差分析检验。
15.图3中,a)gse4125数据库分析显示,在crc患者中,thymidylate synthetase(tyms)与myc mrna表达呈正相关。b)用qrt-pcr检测6%c.b cm处理24h后crc细胞中tyms的mrna水平。c)qrt-pcr和免疫印迹分析结果显示,表达dld1和hct116的plko-tet-on-shmyc#1和#2细胞在多西环素诱导敲低数小时(dld1细胞为48和72小时,hct116细胞为48、72和96小时)后,tyms的mrna和蛋白水平的变化。d)转染myc过表达质粒的hct116细胞中tyms的mrna和蛋白水平。e)在指示情况下处理dld1细胞后的tyms qrt-pcr分析结果。用多西环素诱导myckd 72小时后用3%c.bcm处理细胞24h。f)用myc过表达质粒转染dld1细胞,然后用6%c.b cm处理24小时。在hct116细胞中,用chip-pcr检测myc与tyms启动子区域的结合。g)cck8测定5-氟尿嘧啶(5-fu)在处理3%c.b cm或处理相同浓度培养基时的ic50。在hct116、dld1和rko细胞中检测。h)采用单克隆形成试验,观察3%c.b cm和5-fu(dld1细胞为200μm,hct116细胞为100μm,rko细胞为150μm)在crc细胞中的协同作用。细胞在12孔板中培养9天,每5天更换一次培养基。i)流式细胞术分析3%c.b cm和5-fu处理24h crc细胞(dld1细胞:200μm 5-fu,hct116细胞:100μm 5-fu)时的凋亡情况。j)3% c.b cm+5-fu(250μm)和3% c.b cm和5-fu(250μm)在hct116和dld1细胞中的cleaved parp蛋白水平。数据以平均值
±
sem表示。ns,没有意义;*,p《0.05;**,p《0.01;***,p《0.001;单因素方差分析检验,无配对双尾学生检验,双因素方差分析检验。
16.图4中,a)hct116细胞异种移植瘤体内实验示意图和代表性图像,对照组(n=5)、c.b cm组(n=5)、5-fu组(n=5)和c.b cm+5-fu组(n=5)。b)各组肿瘤体积。c)各组肿瘤重量。d)表示指定组的ihc图像和ki67、caspase3、tyms和myc的定量分析。染色强度定量。比例尺:10x,100μm;40x,25μm。数据以平均值
±
sem表示。ns,没有意义;*,p《0.05;**,p《0.01;***,p《0.001;单因素方差分析检验和双向方差分析检验。
17.图5中,a)c57bl/6j小鼠模型及c.b治疗方案示意图。b)对照组和c.b组肿瘤生长曲线。c)显示对照组(n=4)和c.b组(n=4)的肿瘤重量和具有代表性的ihc图像。d)对照组和c.b组肿瘤组织中ki67、myc、cd4和cd8免疫组化染色图像。染色强度定量。比例尺:10x,100μm;40x,25μm。e)c57bl/6j小鼠模型及c.b cm治疗方案示意图。f)对照组和c.b cm组肿瘤生长曲线。g)显示对照组(n=4)和c.b cm组(n=4)的肿瘤重量和肿瘤代表性图像。h)代表对照组和c.b cm组肿瘤组织中ki67、myc、cd4和cd8免疫组化染色图像。染色强度定量。比例尺:10x,100μm;40x 25μm。无配对双尾学生检验,双向方差分析检验。
18.图6中,a)c57bl/6j小鼠模型及治疗方案示意图。b)对照组、anti-pd-1组、c.b+anti-pd-1组肿瘤生长曲线。c)显示对照组、anti-pd-1组和c.b+anti-pd-1组肿瘤重量。d)对照组、anti-pd-1组、c.b cm+anti-pd-1组肿瘤生长曲线。e)显示对照组、抗pd1组和c.b cm+anti-pd-1组肿瘤重量。f)对照组和c.b组肿瘤组织中ki67、myc、cd4、cd8、granzyme b和foxp3免疫组化染色图像。染色强度定量。比例尺:10x,100μm;40x,25μm。数据以平均值
±
sem表示。ns,没有意义;*,p《0.05;**,p《0.01;***,p《0.001;无配对双尾学生检验,双向方差分析检验和单向方差分析检验。
具体实施方式
19.为让本领域的技术人员更加清晰直观的了解本发明,下面将结合附图,对本发明作进一步的说明。
20.丁酸梭菌涉及结直肠癌细胞增殖,结直肠癌患者来源类器官(pdo)生长,以及结直肠癌转移的调控。
21.丁酸梭菌参与调节细胞增殖。
22.材料方法:
23.1.丁酸梭菌(c.b)的培养以及菌以及菌上清的准备
24.丁酸梭菌(atcc 19398)由中国微生物菌种采集中心提供。在37℃厌氧条件下,将丁酸梭菌的单克隆接种于100ml疱肉培养基中24h。当od达到0.8时,3000g离心5min,用注射器通过millex gp过滤器(0.22μm孔径,millipore)过滤上清液,然后将上清液(c.bcm)储存在-80℃下。用完整的细胞培养基稀释以备进一步使用。
25.在细胞实验中,我们使用体积比的方式进行上清液(c.b cm)的相关处理,如:处理组为3%,表示上清液(c.b cm)占细胞培养基的体积比为3%。相应的对照组则为高压过的3%丁酸梭菌培养基占细胞培养基的体积比。若为浓度梯度的处理,则处理组采用梯度稀释,对照组的浓度与处理组最大浓度一致添加单纯培养基。
26.2.细胞培养
27.人源结直肠癌细胞rko在mem中培养;人胚胎肾细胞hek293t、人源结直肠癌细胞hct116在dmem中培养;人源结直肠癌细胞dld1在rpmi-1640中培养。以上所有细胞均购自atcc,用于细胞培养时需同时加入10%胎牛血清的细胞培养基,1%的青链霉素以及1%的l-谷氨酰胺然后置于37℃,5% co2的培养箱中培养。
28.3.细胞生长曲线
29.1)消化细胞并计数,按2.5
×
105/孔的细胞数量均匀种在六孔板中;
30.2)待细胞贴壁之后按照相应的丁酸梭菌上清(c.b cm)的浓度1%,3%,5%(c.bcm占细胞培养基的体积比为1%,3%,5%。相应的对照组则为相应丁酸梭菌培养基占细胞培养基的体积比)处理细胞并放入incucyte;
31.3)3-4天后分析获得细胞增殖曲线。
32.4.蛋白质免疫印迹法(western blot)
33.1)结直肠癌细胞处理不同浓度的c.b cm(3%,4%,6%)诱导的crc细胞(hct116、dld1和rko细胞)24小时所有浓度的体积都用细菌培养基补充到细胞培养基6%的体积,对照组为高压过的6%细菌培养基。
34.2)sds-page凝胶配制(gel preparation):
35.①
准备配胶所需玻璃板清洗干净,并安装好玻璃板,注意去除干净边缘残留的碎胶。
36.②
根据目的检测蛋白大小,配制sds-page分离胶以及浓缩胶。
37.配制完成混匀后迅速灌胶,分离胶灌入适当体积后用无水乙醇补齐压平下胶去除气泡,1小时后分离胶凝固,倒出乙醇,自然水轻柔冲洗。提前根据上样量洗干净的10孔(小于50μl)或15孔的梳子(小于30μl),在浓缩胶配制完成且混匀后快速灌入(避免气泡),然后快速插入准备好的梳子。室温0.5小时,待浓缩胶完全凝固后将玻璃板安装固定在电泳槽
中,玻璃板槽内加入新配的1
×
running buffer,槽外可用回收的。
38.3)细胞总蛋白提取(所有步骤均在冰上进行)
39.①
弃去细胞培养基,用冷pbs洗两遍,弃净pbs,根据细胞的数量加入适量的细胞裂解液lysis 50-150μl,冰上静置5min,用细胞刮将细胞收集并装入无菌1.5ml的ep管中并做好标记,将收集的细胞置于冰上。
40.②
使用超声波细胞粉碎机裂解细胞,将超声裂解后的样本斜着插入碎冰中在摇床摇晃30min使其充分裂解。
41.③
4℃,12000rpm,离心25min,上清即为总蛋白裂解液。
42.4)总蛋白的浓度检测(bca)
43.根据bca蛋白定量试剂盒的说明书步骤进行总蛋白定量。用1μg/μl的蛋白标准液进行蛋白标准曲线的绘制。
44.5)蛋白变性:根据定量结果,用lysis buffer进行浓度调整,最后加入5xloading buffer放入金属浴95度,15min。
45.6)蛋白质免疫印迹法(western blot)
46.①
上样(loading)电泳:每孔蛋白样总量15~30μg,marker3μl-5μl,先80v恒压30min使蛋白marker分离,然后120v恒压1小时。
47.②
转膜(transferring):提前取出pvdf膜,泡入甲醇中活化1min。提前转膜液到塑料小盆里,黑色转膜夹边泡在盆里,红色一边搭在盆边上按照顺序:黑-海绵-滤纸-胶-膜(注意正反上下做好标记)-滤纸-海绵红,注意避免气泡产生,然后夹起来,黑对黑红对红装入槽内,然后加入1
×
transfer buffer。在四度或者冰浴的条件下260ma恒流3h。
48.③
封闭(blocking):取出转好的pvdf膜放入5%脱脂牛奶封闭液中,低速摇床室温1小时。
49.④
孵育一抗:封闭结束后1
×
tbst洗三次,每次5min,将pvdf膜根据目的蛋白大小位置的不同进行裁剪,放入pcna和β-肌动蛋白抗体4度摇床孵育过夜。
50.⑤
孵育二抗:1
×
tbst中洗三次,每次5min,洗去膜上残留一抗。然后放到二抗溶液中,60转/min摇床低速孵育1小时。显影:1
×
tbst中洗三次,每次5min,洗去膜上
51.⑥
残留二抗。(1:1)配制混匀ecl化学发光显色液。避光,将膜泡在显色液中4-5s。放入las-3000fujifilm内进行扫膜以及图片保存。
52.5.平板克隆形成实验
53.1)12孔板铺板:将人源结直肠癌细胞按照300个细胞每孔的密度均匀接种到12孔细胞培养板中(一个组三个孔作为平行对照),待细胞贴壁纸后对细胞进行相应浓度的处理c.b cm(0.5%,1%,2%)在细胞培养箱中培养7~10天,三天一换液。当细胞克隆可从板底肉眼观察到且克隆间没有连成一片时收获。
54.2)固定及染色:弃去培养基,放入自来水中涮洗掉残留培养基,每孔加入0.5%c/v结晶紫/甲醇1ml,避光静置30min或者包好保鲜膜密封过夜。回收染色液,泡入自来水中洗去残留染料,重复洗至水不变蓝,倒扣于室温晾干。
55.3)拍照计数:晾干后以白板为背景用手机拍照。imagej定量。
56.实验结果
57.我们收集了c.b液体培养24h后的上清(c.b cm)并且用不同浓度的c.b cm去处理
crc,研究丁酸梭菌(c.b)的潜在抗肿瘤作用,通过用incucyte监测细胞的生长曲线以及通过克隆形成实验监测细胞的增殖活性,结果表明与对照组相比,c.b cm以剂量依赖的方式降低了crc细胞的存活率和增殖能力(图1a,c)。并且细胞增殖标志物pcna蛋白水平被c.b cm下调,这同样与生长曲线一致(图1b)。
58.丁酸梭菌抑制结直肠癌细胞的干性
59.实验方法
60.1.结直肠癌病人来源类器官培养以及处理
61.crc患者的肿瘤组织用冷磷酸盐缓冲盐(pbs)清洗并切成小块,然后用edta消化。在消化成细胞团后,将样本接种在24孔板中的matrigel中。在matrigel聚合后(37℃,10min),500μl人类培养基(含有高级dmem/f12,1
×
n2(life technologies),10mm hepes,2mm glutamax,1
×
b27,10nm胃泌素i(biogems),50ng/ml重组egf,500nm a83-01(biogmes),100ng/ml重构noggin(peprotech),500ng/ml r-spondin-1(peproech),10μmsb202190(sigma)10μm y-27632(abmole),10mm烟酰胺(西格玛)、1mm n-乙酰半胱氨酸(西格马)和青霉素/链霉素。样品用1.5%培养基和1.5%c.b cm处理,然后每3天更换一次新鲜培养基。在第5天对每个孔中的类器官数量进行量化。
62.2.细胞的rna提取
63.1)将结直肠癌细胞均匀接种至六孔板中待细胞密度至60%时处理6%的丁酸梭菌上清液(c.b cm),对照组处理相同浓度的细菌培养基。
64.2)弃掉细胞培养基后加入1ml的trizol试剂,室温静置5min,使其细胞裂解。
65.3)把1)trizol转移到新的1.5ml ep管中,0.2ml氯仿1mltrizol的比例加入氯仿,充分震荡混匀,室温2-3min。4℃预冷高速离心机,离心机以12000rpm转速离心15min。
66.4)吸最上层透明水相转移到一个新的无菌ep管中(注意不要吸到蛋白层和有机层),将0.5ml异丙醇加入装有上层水相的ep轻柔混匀,室温静置10min,然后放入预冷好的4℃离心机中,12000rpm转10min。
67.5)弃去所有上清。加入1ml 75%乙醇,轻柔地颠倒ep管使白色沉淀悬浮达到清洗异丙醇的作用,然后放入预冷离心机,4℃,12000rpm,离心5min。重复此步骤一次。
68.6)尽量弃去几乎所有上清,12000rpm空转甩2min,然后用小枪头将管内剩余液体全部吸干。管口敞开室温放置15min挥发掉残余酒精。根据沉淀的体积加入20-50μl depc水用枪头上下吹打溶解混匀rna。然后使用nanodrop 2000超微分析仪进行rna浓度、质量的检测,一般推荐将rna样品浓度控制在100ng/μl~1000ng/μl。
69.3.rna逆转录
70.1)本实验使用promega的逆转录试剂盒根据试剂盒自带的说明步骤进行逆转操作。
71.4.qpcr引物设计与合成
72.用ncbi找到所需基因的gene id,然后结合网站(https://pga.mgh.harvard.edu/primerbank/index.html)可搜索得到对应qpcr引物的序列然后由深圳华大基因合成,引物序列见表1。
73.表1:qrt-pcr引物
74.引物引物方向序列(5
’‑3’
)
cd44forwardctgccgctttgcaggtgta reversecattgtgggcaaggtgctattsox9forwardagcgaacgcacatcaagac reversectgtaggcgatctgttggggepcamforwardaatcgtcaatgccagtgtactt reversetctcatcgcagtcaggatcataavegfforwardagggcagaatcatcacgaagt reverseagggtctcgattggatggcaβ-actinforwardtgctatccctgtacgc reversetgcctcagggcagcggaaccnotch1forwardgaggcgtggcagactatgc reversecttgtactccgtcagcgtgacd133forwardagtcggaaactggcagatagc reverseggtagtgttgtactgggccaatbmp4forwardaaagtcgccgagattcaggg reversegacggcactcttgctaggc
75.5.实时荧光定量pcr
76.先将cdna、混合好的上下游引物以及decp水混合,以每孔8μl加入96孔板中,然后再加入对应需检测的基因引物2μl,最后封膜瞬离后将96孔板放入罗氏480仪器检测荧光信号,一般对目的基因进行相对定量分析。
77.实验结果
78.c.b cm还可以抑制crc患者来源类器官的生长(图1d)。然后我们进一步检测了几种干细胞标志物,如notch1、cd44、cd133、sox9、epcam、vegf、bmp4,发现在结直肠癌细胞中c.b cm可以下调这些干细胞标志物的mrna表达(图1e),这表明c.b cm可以抑制结直肠癌细胞的干性。
79.丁酸梭菌抑制结直肠癌的转移
80.实验方法:
81.1.细胞迁移侵袭能力检测
82.对于迁移和侵袭分析,使用8.0μm pet径迹蚀刻膜跨孔(bd falcon,franklin lakes,nj,usa),将每个跨孔插入24孔板(中国上海nest)以形成上下腔室,并使用matrigel(bd)评估细胞侵袭。hct116、dld1和rko细胞用不同指示浓度的c.b cm预处理24h。然后消化细胞取一定细胞(1
×
105细胞迁移,或1.5
×
105细胞侵袭)用300μl无血清培养基混匀均匀铺于上部小室中。将700μl补充有10%fbs的rpmi 1640或dmem置于下层小孔中。24小时后对迁移和侵袭进行评分,在室温下用4%多聚甲醛固定培养箱下层迁移的细胞5分钟,并用结晶紫染色15分钟。在显微镜下拍照计数。
83.2.肺转移小鼠模型
84.雄性balb/c裸鼠(5-6周龄,16
–
20g)通过尾静脉静脉注射1
×
106/200μl hct116-luc细胞,细胞用6%的c.b cm或6%的对照培养基预处理24小时。然后每两天用200μl c.bcm(在动物实验中直接使用od达到0.8时,3000g离心5min,用注射器通过millex gp过滤
器(0.22μm孔径,millipore)过滤后的丁酸梭菌上清液(c.b cm))。或者小鼠的培养基进行口服灌胃。40天后,小鼠腹腔内注射vivoglo荧光素(promega,#1043,100μl/10g小鼠体重)。10分钟后,使用体内成像系统(ivis)检测到信号。对肺脏进行he以及ihc染色。
85.实验结果:
86.c.b cm与对照组相比可以抑制crc细胞的迁移和侵袭(图1f。g)。为了验证细胞实验的结果,我们在动物模型中采用尾静脉注射结直肠癌肿瘤细胞hct116-luc的方式验证其对肺转移的影响。结果显示c.b cm处理可导致肺转移数量减少(图1h)。ihc染色显示c.b cm处理组可以增加e-cadherin的表达(图1h)。
87.丁酸梭菌促进结直肠癌细胞凋亡
88.实验方法:
89.1.细胞凋亡检测
90.结直肠癌细胞均匀接种到六孔板中然后处理不同浓度的c.b cm(3%、4%、5%c.bcm处理hct116细胞,3%、5%、6% c.b cm处理dld1细胞,4%、6%、8% c.bcm处理rko细胞),24小时后收集细胞,使用联科生物annexin v/pi apoptosis kit检测细胞凋亡情况,按照试剂盒说明书进行操作上机,最后用flowjo 7.6.1进行结果分析。
91.实验结果:
92.annexin v-fitc/pi染色法被用来检测c.b cm对细胞凋亡的影响。流式细胞术结果显示,c.b cm处理可诱导hct116、dld1和rko细胞凋亡(图4)最后用flowjo 7.6.1进行结果分析。
93.丁酸梭菌可使myc泛素化并且可以降低其蛋白稳定性。
94.丁酸梭菌对结直肠癌细胞基因表达以及信号通路的影响。
95.通过mrna测序和差异表达基因分析((degs),探讨c.b cm抑制结肠癌生长的潜在分子机制,我们用c.b cm处理hct116细胞,并分析其对基因表达的影响。火山图显示,c.b cm改变了基因表达谱(图2a)。我们进一步进行了基因集富集分析(gsea),列出了每个生物过程中大量deg显著富集的前20条途径。“hallmark_g2m_checkpoint”该通路表明涉及细胞增殖调节(图2b)。
96.丁酸梭菌可诱导结直肠癌细胞周期阻滞。
97.实验方法:
98.1.细胞周期相关基因引物设计如表2所示:
99.表2 qrt-pcr引物
[0100][0101][0102]
2.细胞周期检测
[0103]
结直肠癌细胞均匀接种到六孔板中然后处理不同浓度的c.b cm(hct116细胞为3%4%、5%,dld1细胞为4%、5%和6%,rko细胞为3%,4%和6%),24小时后收集细胞使用联科生物cell cycle staining kit根据试剂盒说明书进行操作并上机。
[0104]
实验结果:
[0105]
由于c.b cm可诱导细胞周期阻滞,我们利用实时荧光定量pcr技术检测细胞周期相关基因的表达。结果显示,c.b cm可以影响细胞周期相关基因的表达,如p21、gadd45、cyclin d、cdk4、1433σ等(图2c)。此外,免疫印迹分析显示,c.b cm处理可降低myc和cdk2的蛋白表达,而增加细胞周期抑制剂的表达,包括p21和1433σ(图2d)。并且着重检查了myc表达水平,因为众所周知myc的高表达可导致增殖、emt、干性、迁移、侵袭能力的增强。我们还通过流式细胞术分析了细胞周期分布,结果显示,与未处理对照组相比,c.b cm处理确实可以导致hct116、dld1和rko细胞的g1细胞周期明显停滞(图2e)。
[0106]
丁酸梭菌可使myc泛素化以及降低蛋白稳定性
[0107]
实验方法:
[0108]
1.蛋白降解速率检测实验
[0109]
cycloheximide(放线菌酮)处理细胞可阻遏细胞内的新生蛋白的合成,因此按照
chx处理的不同时间点的已合成蛋白剩余量,可以描出已合成蛋白的降解速率。实验方法如下。
[0110]
1)准备两块六孔板,一块为对照组,一块为处理组,用3%丁酸梭菌培养上清(c.bcm)处理24小时,细胞密度为80-90%时,按设计的时间梯度,逆时间梯度分别加入chx(100μg/ml)。
[0111]
2)待全部时间结束后立即收蛋白及western blot实验测定蛋白降解速率。
[0112]
2.his-ubiquitin泛素化实验
[0113]
1)结直肠癌细胞在100mm培养皿中细胞的密度达到70%左右时转染4μg his-ubi质粒以及2μg目标质粒。
[0114]
2)无血清培养基转染6小时,后换成完全培养基。
[0115]
3)24小时后处理3%的c.b cm,对照组为对应浓度的细菌培养基。
[0116]
4)转染42小时后加入50μg/ml mg132,处理6~8小时后然后用胰酶收细胞,预冷pbs洗一遍,最后细胞沉淀用1ml冷pbs重悬混匀,取50μl作为input正常收蛋白并且定量,剩下的950μl放入离心机中,4℃,4000g离心5min,弃pbs,加入1ml的buffer a重悬沉淀,得到较为黏稠的液体。
[0117]
5)然后进行超声(功率35%,启动2s停2s,共3min)裂解细胞,得到的较为澄清的液体,放入4℃预冷的离心机中,12000rpm离心5min,取上清;根据input蛋白定量的结果对对应泛素化样本进行调整,使所得所有样本总蛋白量一致。
[0118]
6)用buffer a清洗ni-nta珠子,往5)的样本中加入ni-nta珠子,50μl/管,然后把ep管封口后放到旋转摇床,4℃过夜。
[0119]
7)4℃,12000rpm离心2min,弃上清。
[0120]
8)buffer a 洗涤4遍;buffer a/buffer ti(1:3)混合液洗4遍;buffer ti洗涤2遍。
[0121]
9)弃上清,加入50μl 2
×
sds loading buffer,98℃15min,顺离取上清用于western blot。
[0122]
实验结果:
[0123]
由于myc通常由泛素化调控,我们随后检查了c.b cm介导的myc下调是否涉及泛素化机制。结果证明,c.b cm可以促进crc细胞myc泛素化,加快myc的周转率(图2f-g)。这些数据表明,c.b cm增加了泛素介导的myc降解,从而降低了myc蛋白的稳定性。因此,c.b cm可能通过降低myc的稳定性来抑制crc进展的相关功能。
[0124]
丁酸梭菌可拮抗myc介导的tyms表达,从而使5-fu的化疗敏感性增加
[0125]
胸苷酸合成酶(tyms)是5-氟尿嘧啶(5-fu)化疗的重要靶点。5-fu已被用于治疗结直肠癌,但5-fu耐药发生,至少部分原因是由于tyms上调,从而导致患者普遍无反应性。
[0126]
丁酸梭菌可影响结直肠癌细胞基因以及信号通路的改变
[0127]
实验方法:
[0128]
tyms的实时荧光定量pcr引物设计如表3所示:
[0129]
表3:qrt-pcr引物
[0130]
引物引物方向序列(5
’‑3’
)tymsforwardtgcgcttggaatccaagag
ꢀ
reversegatgttgaaaggcacaccga
[0131]
实验结果:
[0132]
tcga分析显示,myc与tyms的mrna表达呈正相关(图3a),提示靶向myc降低tyms可提高5-fu的敏感性。然后我们假设,c.b cm可以通过抑制myc来下调tyms,从而提高结肠癌细胞中5-fu的化疗敏感性。我们发现c.b cm可以下调crc细胞系中tyms的mrna水平(图3b)。
[0133]
myc可正向调控tyms
[0134]
实验方法:
[0135]
1.plko-tet-on系统构建shmyc质粒
[0136]
1)获取shmyc序列:打开sigma官网搜索目的基因,选择shrna页面,获得所有含酶切位点的shmyc序列,筛选目的物种,从所列所有序列中选择已验证且敲低效率最高的三条序列如表4所示,设计相应引物并由华大基因合成。
[0137]
表4:shrna引物序列
[0138][0139]
2)寡核苷酸退火
[0140]
①
将粉末状引物用depc水溶解成0.1nmol/l,吹打混匀。取稀释好的上下游引物各11.25μl于ep管中,再加入2.5μl 10
×
退火缓冲液(annealing buffer:1m nacl,100mm tris-hcl,ph=7.4)吹打混匀置于95℃静止5min,然后自然冷却至室温。
[0141]
②
用0.5
×
退火缓冲液(annealing buffer)稀释上一步中配制好的引物(稀释比例:400:1);
[0142]
③
将plko-tet-on载体提前用限制行内切酶(agei,ecori)进行酶切,凝胶电泳之后进行进行胶回收。
[0143]
④
连接,连接体系如表5所示:
[0144]
表5:连接体系
[0145]
成份用量
②
中稀释好的引物1μl酶切载体plko-tet-on100ng10
×
ligase reaction buffer1μlt4 ligase1μldepc水up to 10
[0146]
吹打混匀后放入pcr中37℃反应4小时。然后进行转化提质粒,或者将连接产物暂
时放入-20℃暂时保存。
[0147]
2.转化
[0148]
取出感受态细胞在冰上融化(stble3:一般用于构造敲除质粒,其他使用dh5a),将连接产物全部加入30μl的感受态细胞中(质粒只需要1μl),混匀后在冰上冰浴30min,然后迅速放入42℃中热激90s,然后放回冰上2min。加入500μl无抗生素lb培养基混匀。放入37℃摇床中150rpm,45min,小摇结束后取连接片段200-300μl,质粒20μl涂布于含有100μg/ml carbenicillin的lb琼脂平板上,37℃培养箱中培养过夜。
[0149]
3.菌液测序,提质粒
[0150]
从培养过夜的菌板上挑单克隆加入2ml含抗生素的lb培养基中,37℃摇床中150rpm,8小时,取1ml送去华大基因测序,做好标记将剩下1ml转移到5ml离心管中37℃,150rpm,16小时4000g,10min离心弃上清。待第二天反馈测序结果,与设计序列进行比对,若没有问题用对应5ml中离心下来的菌沉淀按照小提试剂盒说明步骤进行质粒提取,最后将洗脱出的dna,测定浓度做好标记放入-20℃保存。
[0151]
4.慢病毒包装及感染细胞
[0152]
1)第一天:待状态较好的293t细胞在10cm培养皿中长大到50%时进行转染,取一个无菌1.5ml离心管将10μg构建好的dox诱导型plko-tet-on-shmyc质粒,5μgpspax2质粒,5μg pmd2.g质粒加入500μl无血清dmem中吹打混匀,往另一个装有500μl无血清dmem的离心管加入30μlpei吹打混匀,两个离心管各自静置5min,然后将两个离心管的液体轻柔吹打混匀,室温静置30min。将混合液体全部加入到准备好的293t细胞,培养基为7ml无血清dmem。将细胞放入细胞培养箱中,6小时后将将培养基换成正常含血清的dmem。
[0153]
2)第三天:待转染48小时后收集病毒(细胞培养液),要经过0.45μm的滤膜过滤。然后再加入8ml含血清的dmem,继续放入细胞培养箱中培养。病毒液储存在-80℃冰箱中。
[0154]
3)第四天:再次收集经过0.45μm的滤膜过滤后的病毒(细胞培养液)。病毒液储存在-80℃冰箱中。同时在六孔板中均匀种下1
×
105结直肠癌细胞(hct116、dld1)
[0155]
4)第五天:弃去六孔板内的培养基,每孔加入1ml病毒液,再加入1μlpolybrene(millipore,tr-1003-g),200μl胎牛血清,摇晃混匀,然后将六孔板放回细胞培养箱。
[0156]
5)重复步骤4)
[0157]
6)感染两次病毒后加入嘌呤毒素对细胞进行筛选,由于质粒带有嘌呤毒素抗性,没有成功感染病毒使质粒无法在细胞内表达的细胞将会被嘌呤毒素杀死,而感染成功的细胞会存活下来。用于后续实验。
[0158]
实验结果:
[0159]
为了确认crc细胞中tyms受myc调控,我们在hct116和dld1细胞中进行了myc敲除(kd),发现dox(多西环素)诱导敲除myc后,tyms下调(图3c)。一致地,myc过表达导致tyms mrna上调(图3d)。
[0160]
丁酸梭菌通过降解myc的活性调节tyms的表达
[0161]
实验方法:
[0162]
1.chip
[0163]
用外源性12μg ha-myc转染细胞后,用6%培养基或6%c.b cm处理细胞24小时。后按照实验步骤指示处理,用1%pfa先交联细胞10分钟,然后加入甘氨酸终止。然后在细胞裂
解缓冲液中裂解细胞,以打破细胞膜。然后离心裂解液,再悬浮在核裂解缓冲液中并进行超声处理。离心后,稀释上清液,并用1μg的抗体(抗ha标签、对照兔igg)和chip珠培养过夜。然后使用chip珠将抗体结合蛋白/dna复合物拉下,并用低盐缓冲液、高盐缓冲液和氯化锂缓冲液、te缓冲液清洗。然后,用洗脱缓冲液洗脱每个chip样品。最终用蛋白酶k消化洗脱的蛋白质/dna复合物,使用文献中已知chip引物序列表6,通过qrt-pcr分析纯化的dna样本的myc结合位点。
[0164]
表6
[0165]
引物引物方向序列(5
’‑3’
)chipforwardcgccgagcaggaagaggcggag reversegcggaggatgtgttggatctgc
[0166]
实验结果:
[0167]
为了研究c.b是否通过其降解myc的活性来调控tyms的表达,我们进行了myc kd实验。不出所料,c.b cm和myc kd可降低tyms的表达;然而,c.b cm介导的tyms下调可被myc kd在一定程度上逆转,说明c.b cm介导的tyms下调至少在一定程度上是通过其对myc稳定性的负面影响来调控的(图3e)。
[0168]
chip-qpcr进一步证实myc与tyms的启动子区域(-253~-127)结合。重要的是,在c.b cm处理后,myc与该启动子区域的结合减弱了(图3f)
[0169]
丁酸梭菌可以提高5-fu对结直肠癌细胞的敏感性
[0170]
实验方法:
[0171]
1.cck8试剂盒检测细胞活性增殖
[0172]
5000个细胞每孔均匀接种在96孔板中,24小时后待细胞贴壁,对细胞进行相应的处理,设置收获时间点,收获前避光加入5μl/孔的cck8(避免气泡)95μl/孔培养基,细胞培养箱中孵育3小时后,用酶标仪测定450nm处的吸光度。
[0173]
实验结果:
[0174]
基于以上结果,我们推测c.b cm可能会使5-fu对crc的药物作用增敏。cck8分析显示,与单独使用5-fu相比,5-fu与c.b cm联合使用时ic50较低(图3g),说明c.bcm可增强5-fu的药物作用。同时,5-fu和c.b cm联合使用比单独使用5-fu或c.b cm更有效地减少了克隆形成的能力(图3h)。在细胞凋亡实验中也观察到类似的结果。根据annexin v染色,c.b cm和5-fu联合治疗显著增加了凋亡细胞的百分比(图3i)。此外,与单独使用c.b cm或5-fu相比,cleaved parp蛋白表达增加(图3j)。综上所述,这些结果表明,c.b cm可提高5-fu的治疗效果。
[0175]
体内实验表明丁酸梭菌通过myc-tyms轴增强5-fu对肿瘤生长的抑制作用
[0176]
实验方法:
[0177]
小鼠皮下荷瘤
[0178]
所有动物研究均获得中山大学动物伦理与福利委员会的批准。为了验证5-fu和c.bcm的协同作用,从gempharmatech(中国江苏南京)购买雄性balb/c裸鼠(5-6周龄,16-20g)。hct116细胞(1
×
106细胞/小鼠)异种移植物小鼠分为四组:对照组(n=5)、c.b cm组(n=5)、5-fu组(n=2)和c.b cm+5-fu组(n=5)。小鼠每天用200μl的c.bcm灌胃。同时,小鼠在接种肿瘤后总共腹腔注射5-fu(50mg/kg,pbs)3次。对照组给予相应的对照培养基。每3天
测量肿瘤的长度和宽度,16天后处死小鼠收获肿瘤。根据公式(长
×
宽2)/2计算体积。
[0179]
免疫组织化学
[0180]
1)烘片固定:石蜡切片于65℃烘箱,孵育3小时。2)脱蜡:取出玻片放入二甲苯中脱蜡,15min
×
3次充分脱蜡。3)水化:然后梯度水化:无水乙醇15min
→
95%乙醇15min
→
75%乙醇5min。4)洗涤:ddh2o浸泡1min。5)抗原修复:将切片放入1
×
edta抗原修复液内,微波炉中高火8min,停8min(及时补充抗原修复液,避免干片),中低火7min,自然降温至室温。6)洗涤:pbs洗3次,每次5min。7)h
202
处理:3%过氧化氢浸泡切片,室温避光孵育25min。8)洗涤:pbs洗3次,每次5min。9)封闭:将羊抗血清滴到组织上,使之完全覆盖组织,加盖室温孵育1小时。10)孵育一抗:pbs洗3次,每次5min,将稀释到相应浓度的一抗滴加到组织上,使之完全覆盖组织,放入湿盒中4℃过夜。12-24小时后,将湿盒放入37℃孵育30min(注意如果组织间靠的太近,建议使用疏水笔隔开避免不同抗体相互污染)。11)孵育二抗:pbs洗3次,每次5min,滴加二抗,室温30min。12)显色:pbs洗3次,每次5min,dab显色。13)核染色:pbs洗3次,每次5min,放入苏木素中3min后放入水中上下涮1-2次,然后放入盐酸酒精中3秒,肉眼判断核染是否达到预期颜色深浅,最后用流水冲洗10min。14)晾干:置于通风橱中过夜晾干。15)封片:16-24小时后,树脂封片,置于通风橱中过夜晾干。24h后显微镜下观察拍照。
[0181]
丁酸梭菌增强5-fu对肿瘤生长的抑制作用
[0182]
为了证实c.b cm+5-fu在体内抑制结直肠癌生长的协同作用,我们在裸鼠体内建立了皮下异种移植模型。在将hct116细胞(1
×
106)接种小鼠之前,每天灌胃给药c.b cm或培养基(作为对照),直到肿瘤体积达到10mm3。体内实验设计示意图和各组的代表性图像如下(图4a)。与对照组相比,接受c.b cm、5-fu或同时接受c.b cm和5-fu组的肿瘤体积和重量均降低。重要的是,5-fu的治疗效果通过c.b cm的联合治疗能更有效地抑制肿瘤的生长。(图4b,c)。
[0183]
免疫组化证实丁酸梭菌通过降解myc的活性调节tyms的表达从而提高5-fu的治疗敏感性
[0184]
免疫组化结果显示,与5-fu单独相比,c.b cm+5-fu组ki67表达水平较低,caspase3表达水平较高,myc和tyms表达水平较低(图4d),说明c.b对小鼠异种结直肠癌模型myc-tyms轴的负面影响可以重现。实验结果表明,c.b cm可以通过干扰myc-tyms的调节来提高5-fu化疗在结直肠癌中的疗效。
[0185]
c.b、c.b cm下调myc,cd8+t细胞浸润增加,从而提高anti-pd1的治疗效果
[0186]
各种证据表明,c.b可以调节免疫反应物,赋予保护作用,从而改善疾病状况。进一步研究我们从c.b中确定的信号调控因子,如myc,是否参与形成免疫反应物的调控。我们建立了小鼠皮下crc模型。
[0187]
丁酸梭菌诱导t细胞的浸润抑制肿瘤的生长
[0188]
实验方法:
[0189]
1.小鼠皮下荷瘤
[0190]
为了证实丁酸梭菌及其上清(c.b cm或c.b)可以通过调节机体的免疫微环境来抑制结直肠癌的发生发展,我们在小鼠两侧皮下注射mc38细胞(5
×
105细胞/小鼠)之前,每天用1
×
108cfu的c.b或c.b cm 200ul预处理一周,对照组给予等量的培养基。接种之后当肿瘤大小达到10mm3时,小鼠在收获前每隔两天接受一次c.b或c.b cm口服灌胃(200ul)和瘤
内注射(50ul)。每3天测量肿瘤的长度和宽度。根据公式(长
×
宽2)/2计算体积。最后用免疫组化的方法检测免疫相关标识物的表达情况。
[0191]
为了验证anti-pd-1和c.b cm或c.b的协同作用,在小鼠两侧皮下注射mc38细胞(5
×
105细胞/小鼠)之前,每天用1
×
108cfu的c.b或c.b cm 200ul预处理雄性c57bl/6j小鼠。对照组给予等量的培养基。几天后,当肿瘤大小达到10mm3时,小鼠在收获前每隔两天接受一次c.b或c.b cm口服灌胃(200ul)和瘤内注射(50ul)。同时,在肿瘤接种后每三天(腹腔注射3mg/kg,pbs)治疗一次anti-pd-1。每3天测量肿瘤的长度和宽度。根据公式(长
×
宽2)/2计算体积。
[0192]
实验结果:
[0193]
免疫健全的c57bl/6j小鼠皮下植入小鼠mc38结肠腺癌细胞,并处理c.b(图5a)。可见c.b对皮下肿瘤生长有抑制作用(图5b-c)。同时,免疫组化染色显示,c.b治疗降低了ki67和myc的表达,而促进了t细胞浸润,cd4和cd8标记物的表达增加(图5d)。
[0194]
丁酸梭菌上清诱导t细胞的浸润抑制肿瘤的生长
[0195]
同样,在相同的模型中分析了用c.b.cm处理的mc38细胞的生长情况(图5e)。与对照组相比,c.b cm治疗组肿瘤体积和重量均有所减小(图5f-g)。免疫组化染色显示,c.bcm治疗也降低了ki67和myc的表达,但增加了cd4和cd8标记物的表达(图5h)。综上所述,这些结果表明,c.b和c.b cm在crc中均具有抗肿瘤作用,暗示c.b和c.b cm的抗癌作用均涉及myc下调和肿瘤免疫/t细胞浸润。
[0196]
丁酸梭菌增强ici免疫治疗的疗效
[0197]
免疫检查点抑制剂(icis)的免疫治疗已经彻底改变了各种类型癌症的治疗。然而,大多数患者,包括crc,接受这些ici治疗仍有有限的临床效益。迫切需要提高ici免疫治疗的疗效。
[0198]
丁酸梭菌可增强结肠直肠癌anti-pd-1的免疫治疗效果
[0199]
为了进一步探讨c.b和c.b cm是否能增强anti-pd-1在结直肠癌中的免疫治疗效果,我们在免疫健全的c57bl/6j小鼠中再次建立了c57bl/6j小鼠的mc38皮下肿瘤模型(图6a)。与对照组相比,anti-pd-1组和c.b+anti-pd-1组肿瘤体积和重量均降低。重要的是,联合治疗(c.b+anti-pd-1)的疗效优于anti-pd-1治疗组,提示c.b可以提高anti-pd-1的疗效(图6b-c)。此外,c.b cm在增强anti-pd-1免疫治疗方面与c.b具有相同的作用(图6d-e)。
[0200]
免疫组化结果显示,丁酸梭菌及其上清诱导t细胞的浸润从而增强结肠直肠癌anti-pd-1的免疫治疗效果
[0201]
免疫组化染色显示,联合治疗比单独使用anti-pd-1更有效地增加cd4、cd8和granzyme b的表达(图6f)。c.b或c.b cm通过塑造肿瘤的免疫微环境,显著提高anti-pd-1的疗效,从而增强anti-pd-1的抗肿瘤治疗,增加肿瘤生存期。
[0202]
统计学处理
[0203]
使用软件graphpad prism 9.0(美国加利福尼亚州拉荷亚的graphpad软件公司)进行统计分析。火山图分析是使用omicstudio工具在https://www.omicstudio.cn/tool和其他图形是由graphpad prism创建的。使用平均值
±
sem绘制数据。使用学生t检验、单向方差分析检验和双向方差分析检验分析各组之间的定量数据。p《0.05的值被认为具有统计学意义。
[0204]
上述对实施例的描述是为便于该技术领域的普通技术人员能理解和应用本发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于这里的实施例,本领域技术人员根据本发明的揭示,对于本发明做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1