β-D-吡喃葡萄糖基-乳酸及其衍生物在制备治疗代谢性疾病、炎症药物中的应用
本发明属于药物用途,特别涉及β-d-吡喃葡萄糖基-乳酸及其衍生物在制备治疗代谢性疾病、炎症药物中的应用。
背景技术:
1、炎症性肠病(ibd)是慢性特发性非特异性和复发性胃肠道疾病,主要分为两种类型。克罗恩病和溃疡性结肠炎(uc)[1]。溃疡性结肠炎局限于结肠,以体重减轻、腹泻和腹痛为特征,影响所有年龄的人。尽管病因和发病机制仍不清楚,但人们普遍认为它是遗传学和免疫学、微生物和环境因素的结果[2-4]。巨噬细胞作为单核细胞的成熟形式,参与了先天和适应性免疫。它们通常是先天免疫的第一道防线[5]。一旦病原体突破上皮屏障,侵入肠粘膜,它们可以被巨噬细胞用toll样受体、模式识别受体(prrs)等识别,进一步诱发一系列的通路反应,如nlrp3炎症体,最后导致细胞膜破裂,细胞因子白介素1b(il-1b)和il-18,细胞内容物被释放出来。这种类型的炎症性细胞死亡被称为"热死病"[6-7]。像其他先天性免疫反应一样,热解作用有利于宿主对细菌、真菌和病毒感染的自我防御[8]。然而,失调的热化作用通过破坏肠道上皮屏障和通过促进th17细胞产生il-17和th1细胞产生γ-干扰素(ifn-γ)来诱导适应性免疫失调,密切地促进了uc的发展[9-10]。已经证明,抑制巨噬细胞的热化作用可能是治疗实验性结肠炎的一种新策略[11-12]。免疫细胞可以通过代谢重新编程来调节其功能。羟基酸中的乳酸作为一种代谢底物,已被重新认识为调节性免疫细胞功能中的一个活跃信号[13-14],以前的研究已经揭示了疾病组织中的免疫细胞如何对代谢物的局部积累做出反应的各种机制。乳酸大多以离子形式存在于肠道中,主要由单羧酸转运体1(mct1)吸收和利用[15]。此外,乳酸通过与肠道巨噬细胞表面的gpr81受体结合,下调环amp(camp)和蛋白激酶a(pka)信号,进一步抑制促炎症因子的表达[16]。乳酸可以保护心脏和缺血的神经元,促进成人海马神经发生,并抑制器官损伤后的炎症[17]。乳酸还能促进巨噬细胞中组蛋白h3赖氨酸的乳化,并通过增加arg-1和其他m2类巨噬细胞基因的表达改变巨噬细胞的极化状态[18]。在癌症方面,在缺氧和高浓度的细胞外乳酸的条件下,乳酸可以被运送到细胞内作为代谢底物使用。以前的研究表明,乳酸能增加th1细胞的分化和干扰素-γ(ifnγ)的产生[19],并促进肿瘤相关巨噬细胞(tams)的m2样极化和vegf的表达,部分是由hif1α的激活所介导的[20]。后一项研究提出了一个有趣的想法,即乳酸具有平衡hif1α和糖酵解代谢物的炎症作用的稳态功能。liu等人[21]扩展了我们对肿瘤中高乳酸浓度如何促进m2型促肿瘤tam表型的理解。巨噬细胞对乳酸的吸收激活了哺乳动物雷帕霉素复合物1(mtorc1)介导的信号,导致转录因子tfeb及其下游靶基因的表达减少,包括编码空泡质子泵d2亚单位的atp6v0d2,它使溶酶体酸化并促进蛋白质降解。atp6v0d2的表达减弱导致hif2α的溶酶体降解减少,从而诱导其目标基因的表达,包括veg f和m2类同源基因mrc1、arg1和retnla。这种atp6v0d2-hif2α途径在病理学上是相关的,因为atp6v0d2-/-小鼠表现出异常的血管化和肿瘤体积的增加,这些都被hif2α的抑制所逆转。因此,巨噬细胞内乳酸浓度的增加通过激活hif1α3和hif2α4的不同机制促进了m2型肿瘤生长的表型。最近的一项研究5进一步支持了乳酸的抑制作用,该研究显示,肿瘤酸中毒部分是由有氧糖酵解产生的乳酸和质子的输出导致的,它诱导了促进肿瘤生长的调节性tam表型。2019年发表的一篇论文显示,细胞内乳酸浓度的增加抑制了细胞质rig-i样受体(rlr)[22]对ifnβ的诱导。rlr信号的抑制与酸性ph值无关,是由乳酸分子直接与rlr适配体线粒体抗病毒信号蛋白(mavs)跨膜域结合介导的,mavs被固定在线粒体膜上。乳酸盐与mavs的结合减弱了其在线粒体的定位、与rig-i的相互作用、聚集和下游信号传导以及ifnb激活。抑制rlr的信号传导在生物学上很重要,因为通过遗传或药物靶向糖酵解酶乳酸脱氢酶来阻断乳酸的产生,导致干扰素的产生和病毒清除的增强。这项研究确定了mavs是乳酸的直接传感器,并表明乳酸也可以通过抑制反平衡的促炎症干扰素介导的途径间接促进同源巨噬细胞的极化。2019年还发现了另一个令人惊讶的乳酸盐直接目标--组蛋白中的赖氨酸残基[23]。乳酸盐是骨骼肌和包括脂肪组织在内的其他器官释放的一种重要的代谢中间物,在胰岛素的影响下,葡萄糖会转化为乳酸盐。研究人员[24]表明,乳酸能激活g蛋白偶联受体gpr81,该受体在脂肪细胞中表达,并通过gi依赖性抑制腺苷酸环化酶而介导抗脂肪分解作用。kashan ahmed使用gpr81缺陷的小鼠,证明该受体不参与密集运动期间的脂肪分解调节。然而,在缺乏gpr81的小鼠中,胰岛素诱导的脂肪分解抑制和胰岛素诱导的脂肪细胞camp水平下降强烈地减少,尽管胰岛素依赖的脂肪细胞释放的乳酸在野生型和gpr81缺陷的小鼠中是可比的。因此,乳酸及其受体gpr81意外地在自分泌和旁分泌循环中发挥作用,以介导胰岛素诱导的抗脂肪溶解作用。这些数据表明,乳酸能以类似激素的方式直接调节代谢过程,揭示了乳酸在胰岛素抗脂肪作用的一个新机制。
2、因乳酸在体内生物利用度极差,因此以乳酸作为先导化合物进行结构修饰,通过与葡萄糖连接形成β-糖苷键形成前药以期增加乳酸的生物利用度,增加乳酸的血药浓度以此对炎症型肠病、代谢性疾病进行治疗。
3、参考文献:
4、[1].kobayashi t,siegmund b,le berre c,et al.ulcerative colitis.natrev dis prim[internet](2020);
5、[2].ray g,longworth ms.epigenetics,dna organization,and inflammatorybowel disease.inflammation bowel dis(2019)25(2):235–47.
6、[3].piovani d,danese s,peyrin-biroulet l,nikolopoulos gk,lytras t,bonovas s.environmental risk factors for inflammatory bowel diseases:anumbrella review of meta-analyses.gastroenterol[internet](2019)157(3):647–659.e4.
7、[4].fiocchi c.immunopathogenesis of ibd:current state of the art.natrev gastroenterol hepatol[internet](2016)13(1):13–27.
8、[5].gren st,grip o.role of monocytes and intestinal macrophages incrohn’s disease and ulcerative colitis.inflammation bowel dis(2016)22(8):1992–8.
9、[6].van opdenbosch n,lamkanfi m.caspases in cell death,inflammation,and disease.immun[internet](2019)50(6):1352–64.
10、[7].he wt,wan h,hu l,et al.gasdermin d is an executor of pyroptosisand required for interleukin-1b secretion.cell res[internet](2015)25(12):1285–98.
11、[8].zhou cb,fang jy.the role of pyroptosis in gastrointestinal cancerand immune responses to intestinal microbial infection.biochim biophys actarev cancer[internet](2019)1872(1):1–10.
12、[9].nowarski r,jackson r,gagliani n,et al.epithelial il-18equilibriumcontrols barrier function in colitis.cell(2015)163(6):1444–56.
13、[10].liu l,dong y,ye m,et al.the pathogenic role of nlrp3inflammasome activation in inflammatory bowel diseases of both mice andhumans.j crohns colitis(2017)11(6):737–50.
14、[11].shao bz,wang sl,pan p,et al.targeting nlrp3 inflammasome ininflammatory bowel disease:putting out the fire of inflammation.inflammation(2019)42(4):1147–59.
15、[12].ruiz pa,morón b,becker hm,et al.titanium dioxide nanoparticlesexacerbate dss-induced colitis:role of the nlrp3 inflammasome.gut(2017)66(7):1216–24.
16、[13].lee ys,kim ty,kim y,et al.microbiota-derived lactate acceleratesintestinal stem-cell-mediated epithelial development.cell host microbe[internet](2018)24(6):833–846.e6.
17、[14].iatsenko i,boquete jp,lemaitre b.microbiota-derived lactateactivates production of reactive oxygen species by the intestinal nadphoxidase nox and shortens drosophila lifespan.immun(2018)49(5):929942.e5.
18、[15].erdmann p,bruckmueller h,martin p,et al.dysregulation of mucosalmembrane transporters and drug-metabolizing enzymes in ulcerative colitis.jpharm sci(2019)108(2):1035–46.
19、[16].ranganathan p,shanmugam a,swafford d,et al.gpr81,a cell-surfacereceptor for lactate,regulates intestinal homeostasis and protects mice fromexperimental colitis.j immunol(2018)200(5):1781–9.
20、[17].wang j,cui y,yu z,et al.brain endothelial cells maintain lactatehomeostasis and control adult hippocampal neurogenesis.cell stem cell[internet](2019)25(6):754–67.e9.
21、[18].zhang d,tang z,huang h,et al.metabolic regulation of geneexpression by histone lactylation.nat[internet](2019)574(7779):575–80.
22、[19].peng,m.et al.aerobic glycolysis promotes t helper 1 celldifferentiation through an epigenetic mechanism.science 354,481–484(2016).
23、[20].colegio,o.r.et al.functional polarization of tumour-associatedmacrophages by tumour-derived lactic acid.nature 513,559–563(2014).
24、[21].liu,n.et al.lactate inhibits atp6v0d2 expression in tumor-associated macrophages to promote hif-2α-mediated tumorprogression.j.clin.invest.129,631–646(2019).
25、[22].zhang,w.et al.lactate is a natural suppressor of rlr signalingby targeting mavs.cell 178,176–189(2019).
26、[23].zhang,d.et al.metabolic regulation of gene expression by histonelactylation.nature 574,575–580(2019).
27、[24].kashan ahmed(ahmed k.et alan autocrine lactate loop mediatesinsulin-dependent inhibition of lipolysis through gpr81.cell metab.2010 apr7;11(4):311-9.
技术实现思路
1、基于乳酸在维持机体稳态及正常生理代谢中的重要作用,本发明一方面提供了β-d-吡喃葡萄糖基-乳酸及其衍生物在制备治疗代谢性疾病药物中的应用。
2、所述代谢性疾病为高脂血症、糖尿病、脂肪肝、肥胖、高血压和心脑血管病中的一种或几种;
3、本技术另一方面提供了β-d-吡喃葡萄糖基-乳酸及其衍生物在制备治疗炎症药物中的应用。
4、所述炎症为过敏性脑脊髓炎、炎症性肠病、类风湿性关节炎、脓毒症、急性胰腺炎、慢性胰腺炎、高尿酸血症和银屑病中的一种或几种。
5、所述的药物中还包括其他药学上可接受的助剂、载体或稀释剂;
6、所述的药物剂型选自素片、薄膜包衣片、糖衣片、肠衣片、分散片、胶囊、颗粒剂、口服溶液或口服混悬液。
7、所述的β-d-吡喃葡萄糖基-乳酸的衍生物为β-d-吡喃葡萄糖基-乳酸化合物的立体异构体、互变异构体、药物上可接受的盐、溶剂化物或其前药。
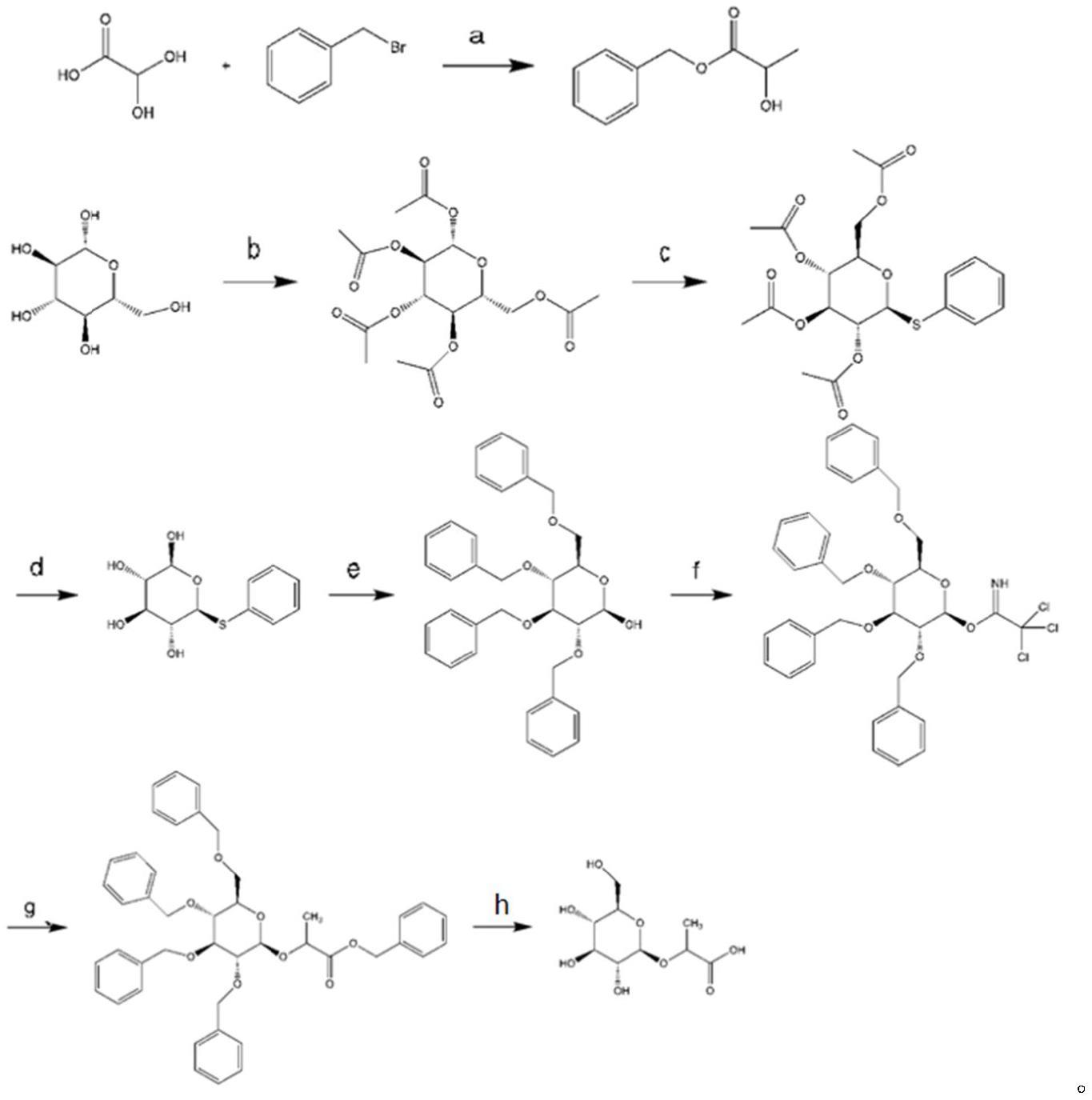
8、本技术该提供了所述的β-d-吡喃葡萄糖基-乳酸的制备方法,所述的制备方法为:以葡萄糖为原料制得糖基三氯乙酰亚胺酸酯,再以d-乳酸和溴化苄为原料制得乳酸苄酯,最后将乳酸苄酯和糖基三氯乙酰亚胺酸酯反应,再脱去苄基得目标化合物。
9、具体包括以下步骤:
10、(1)取d-乳酸溶解于n,n二甲基甲酰胺中,搅拌下用注射器加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu)中搅拌30min后,在0℃搅拌下缓慢加入溴化苄和碘化钾,室温条件下搅拌18h后,将反应液与乙酸乙酯、水混合,分层后取有机相,随后将水相用乙酸乙酯萃取4次,合并有机相,有机相用3倍体积的水洗涤,去除有机相中的dmf,用饱和氯化钠溶液清洗并用无水硫酸钠干燥,通过柱色谱法(石油醚:乙酸乙酯=10:1)纯化得到得白色透明液体bn-lac;
11、(2)将醋酸酐和醋酸钠混合90℃加热回流,完全溶解后缓慢加入d-葡萄糖90℃反应4h,冷却至室温,超声加入冰水,抽滤,得白色固体,无水乙醇重结晶得白色固体glu1。
12、(3)将步骤(2)中得到的glu1溶于无水二氯甲烷中,0℃下加入bf3-et2o,硫苯酚,室温反应5h,加入饱和碳酸氢钠停止反应,二氯甲烷萃取,饱和氯化钠水溶液洗涤,旋干有机层,得黄色油状物glu2,通过柱色谱法(石油醚:乙酸乙酯=3:2)纯化得到glu2;
13、(4)将步骤(3)中得到的glu2溶于无水甲醇中,加入30%甲醇钠/甲醇溶液,反应15h完成后,通过柱色谱法(二氯甲烷:甲醇=10:1)纯化,加入amberlite ir 120调节ph至中性,过滤,旋干溶剂,真空干燥得glu3;
14、(5)将步骤(4)中得到的glu3溶于无水n,n二甲基甲酰胺中,0℃下加入nah分次加入反应混合物中。0℃搅拌30min,,向反应混合物中加入苄基溴,搅拌该混合物22h。向溶液中缓慢加入冷蒸馏水;用二氯甲烷提取水相。用蒸馏水和饱和氯化钠水溶液清洗收集的有机相。在na2so4上干燥收集的有机相。在减压下蒸发溶剂。通过柱色谱法(石油醚:乙酸乙酯=20:1)纯化得到glu4。
15、(6)将步骤(5)中得到的glu4溶于无水二氯甲烷中,在0℃下加入三氯乙腈和1,8-二氮杂二环[5.4.0]十一碳-7-烯,反应2h完成后,通过柱色谱法(石油醚:乙酸乙酯=10:1)glu5;
16、(7)将步骤(6)中得到的glu5放入圆底烧瓶中,加入20ml无水二氯甲烷溶解,冰浴下加入步骤(1)制得的bn-lac,氮气保护下加入tmsotf,在-20℃下反应2h后,加入饱和氯化钠水溶液和少量三乙胺淬灭反应,无水硫酸钠干燥,浓缩后通过柱色谱法(石油醚:乙酸乙酯=30:1)纯化,得无色透明液体glu6,
17、(8)将步骤(7)中得到的glu6溶于99%甲醇中,加入10%pd-c加压常温氢化24h,离心除去pd-c,旋干滤液并用甲醇-乙酸乙酯重结晶得glu7,即为β-d-吡喃葡萄糖基-乳酸。
18、具体反应流程为:
19、
20、(a)dmf,ki,dbu,rt.,overnight;(b)ac2o/acona,90℃,reflux,4h;(c)bf3-et2o,ph-sh,dcm,rt.,5h;(d)meoh/meona,rt.,15h;(e)0℃,nah,dmf,30min,bn-br,rt.,22h;(f)ccl3cn,dbu,dcm,0℃rt.,2h;(g)bn-lac,tmsotf,dcm,n2,0℃–rt.,,2h;(h)pd/c,h2,meoh,24h.
21、如果没有其它说明,本发明的化合物理解为包括游离态和其盐。术语“盐”表示以无机和/或有机酸和碱形成酸式和/或碱式盐。另外,术语“盐可包括两性离子(内盐),如当式i化合物含有碱性片段如胺或吡啶或咪唑环,和酸式片段如羧酸。药物上可接受的(即非毒性、生理学上可接受的)盐是优选的,如可接受的金属和胺盐,其中阳离子没有显著贡献毒性或盐的生物活性。然而,其它盐可是有用的,如在制备过程中采用分离或纯化步骤,因此也包含于本发明范围中。式i化合物的盐可以如式i化合物与一定量的酸或碱形成,如等量,在媒介中如在其中盐可沉淀或其水媒介中,然后进行冻干作用。
22、示例性的酸式加成盐包括乙酸盐(如与乙酸或三卤素乙酸形成,如三氟乙酸)、己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、硼酸盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、环戊丙酸盐、双葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、延胡索酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、盐酸盐(与盐酸形成)、氢溴酸盐(与氢溴酸形成)、氢碘酸盐、2-羟基乙磺酸盐、乳酸盐、马来酸盐(与马来酸形成)、甲磺酸盐(与甲磺酸形成)、2-萘磺酸盐、烟酸盐、硝酸盐、草酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、水杨酸盐、琥珀酸盐、硫酸盐(如与硫酸形成的那些)、磺酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐如甲苯磺酸盐、十一酸盐及其类似物。
23、示例性碱式盐包括铵盐、碱金属盐如钠、钾、钙和锌盐;碱土金属盐如钙和镁盐;钡、锌和铝盐;与有机碱形成的盐(如有机胺)如三烷基胺如三乙胺、普鲁卡因、二苄胺、n-苄基-β-苯乙胺、1-二苯羟甲胺、n,n'-双苄乙二胺、去氢枞胺、n-乙基哌啶、苄胺、二环己胺或类似药物上可接受的胺和与氨基酸的盐如精氨酸、赖氨酸及其类似物。碱式含氮基团可与试剂季铵化如低级烷基卤化物(如甲基、乙基、丙基和丁基氯、溴和碘化物)、二烷基硫酸盐(如二甲基、二乙基、二丁基和二戊基硫酸盐)、长链卤化物(如癸基、十二烷基、十四烷基和十八烷基氯、溴和碘化物)、芳烷基卤化物(如苄基和苯乙基溴化物)和其它物质。优选的盐包括单盐酸盐、硫酸氢盐、甲磺酸盐、磷酸盐或硝酸盐。
24、短语“药物上可接受的”指的是那些化合物、材料、组合物和/或剂型,在完好的医疗评价范围内,适合用于与人类和动物的组织接触,而没有额外的毒性、刺激、过敏反应或其它问题或并发症,具有相称的合理收益/风险比例。
25、此处用到的“药物上可接受的盐”指的是公开化合物的衍生物,其中父系化合物是以酸或其碱式盐修饰。药物上可接受盐的实例包括但不限于碱式基团如胺的无机或有机酸式盐;和酸式基团如羧酸的碱或有机盐。药物上可接受的盐包括传统的非毒性盐或父系化合物形成季铵盐,如由非毒性无机或有机酸。例如,这些传统的非毒性盐包括那些衍生自无机酸如盐酸、氢溴酸、硫磺酸、氨基磺酸、磷酸和硝酸;和由有机酸制备的盐如乙酸、丙酸、琥珀酸、羟基乙酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、帕莫酸、马来酸、羟基马来酸、苯基乙酸、谷氨酸、苯甲酸、水杨酸、磺胺酸、2-乙氧苯甲酸、反丁烯二酸、甲苯磺酸、甲磺酸、乙烷二磺酸、草酸和羟乙磺酸及其类似物。
26、本发明药物上可接受的盐可由含有碱式或酸式片段的父系化合物,通过常规化学方法合成。通常地,这些盐可由这些化合物的游离酸或碱形式与化学计量比的适合碱或酸在水或有机溶剂,或其两种混合物中进行制备;通常地,非水媒介如醚、乙酸乙酯、乙醇、异丙醇或乙腈是优选的。
27、本发明化合物的所有立体异构体是被考虑的,既以混合物或纯或基本纯的形式。立体异构体可包括通过一个或多个手性原子的取代的光学异构体的化合物,以及通过限制旋转一个或多个键(阻转异构体)的光学异构体化合物。本发明化合物的定义包括所有可能立体异构体和其混合物。其尤其包括外消旋形式和具有特别活性的分离光学异构体。通过物理方法拆分外消旋形式,例如分布结晶、分离或立体异构衍生物的结晶或通过手性柱色谱分离。通过常规方法由外消旋盐得到独立的光学异构体如与光学活性的酸形成的盐,然后结晶。
28、本发明化合物的前药和溶剂化物也是被考虑的。术语“前药”表示化合物,基于施予受体,通过代谢性或化学方法经历化学反应生成式i化合物,和/或盐和/或其溶剂化物。在体内转化以提供生物活性试剂(即式i化合物)的任何化合物是本发明范围和精神内的前药。乳酸及其衍生物具有高毒性、低选择性、低水溶性的缺点,这些缺点限制了乳酸及其衍生物作为抗肿瘤药物应用于临床。糖类是一种亲水性较强的极性化合物,当糖类作为辅助基团被引入到化疗药物中时,往往能够改变药物的理化性质,提高水性,降低化疗药物的毒性,从而提高化疗药物的选择性。
29、“药物上可接受的载体”一般指的是通常在该领域中接受的,可传递生物活性试剂至动物,尤其是哺乳动物。配制药物上可接受载体,根据本领域普通技术人员所熟知的许多因素。这些包括没有限制被配制的活性试剂的类型和特性;含试剂组合物施予的受体;组合物施予途径;和定向治疗指示。药物上可接受的载体包括水性和非水性液态媒介,以及多种固态和半固态剂型。这些载体包括许多不同组分和添加剂,除了活性试剂之外,这些额外组分由于多种原因包含于配方中,如活性试剂、粘合剂等的稳定性,这是本领域普通技术人员所熟知的。
30、本发明式i化合物可以治疗症状的任何适合方式施予,取决于位点专一治疗或传递药物的量。局部投药通常优选皮肤相关疾病,癌性或癌性前症状的系统性治疗,但其它传递模式也是考虑的。例如口服施予化合物,如以片剂、胶囊、颗粒、粉末或包括糖浆剂的液体配方形式;局部如以溶液、悬浮液、凝胶或软膏;舌下给药;脸颊地;胃肠外给药如通过皮下、静脉注射、肌肉注射或胸骨内注射或灌注术(如无菌水或非水溶液或悬浮液);经鼻的如通过吸入喷雾;局部地如以乳液或软膏形式;经直肠地如以栓剂形式;或脂质体地。可施予含非毒性、药物上可接受赋形剂或稀释剂的剂量单位配方。可以立即释放或延缓释放的形式施予所述化合物。立即释放或延缓释放可以适合的药物组合物获得,在部分延缓释放的实例中,使用设备如皮下移植或渗透泵。
31、口服施予的示例性组合物包括悬浮液,其可含有如用于传输的微晶纤维素、作为悬浮剂的海藻酸或海藻酸钠、作为粘度增强剂的甲基纤维素和现有技术中已知的那些甜味剂或调味剂;立即释放的片剂可含有如微晶纤维素、磷酸二钙盐、淀粉、硬脂酸镁和/或乳糖和/或其它赋形剂、粘合剂、膨胀剂、崩解剂、稀释剂和润滑剂如现有技术中已知的那些。本发明化合物也可通过舌下和/或颊部施予进行口服传递,如压模、压缩或冻干片剂。示例性组合物可包括快速溶解的稀释剂如甘露醇、乳糖、蔗糖和/或环糊精类。包含在这些配方中也可以是高分子量赋形剂如纤维素或聚乙烯二醇(peg);有助于粘膜附着的赋形剂如羟丙基纤维素(hpc)、羟丙甲基纤维素(hpmc)、羧甲基纤维素钠(scmc)和/或马来酸酐共聚物(如);和控制释放的试剂如聚丙烯酸共聚物(如carbopol)。也可加入润滑剂、助流剂、香料、着色剂和稳定剂有助于制备和使用。
32、喷雾法或吸入施予的示例性组合物包括溶液,所述溶液可含有苄基醇或其它适合防腐剂、提高吸收性和/或生物活性的吸收促进剂、和/或其它可溶性或分散性试剂如现有技术中已知的那些。
33、肠胃外施药的示例性组合物包括注射溶液或悬浮液,其可含有如适合的非毒性、肠胃可接受稀释剂或溶剂,如甘露醇、1,3-丁二醇、水、格林氏溶液、等渗氯化钠溶液,或其它适合的分散或润湿和悬浮试剂,包括合成的单或甘油二酯类,和脂肪酸包括油酸。
34、直肠给药的示例性组合物包括栓剂,其可含如适合的非刺激性赋形剂,如可可脂、合成甘油酯类或聚乙烯二醇类,在普通温度下为固体,但溶解和/或溶入肠胃内释放药物。
35、治疗有效量的本发明化合物可由本领域普通技术人员确定,并对哺乳动物而言包括示例性剂量约从0.05至1000mg/kg;1-1000mg/kg;1-50mg/kg;5-250mg/kg;250-1000mg/kg,按照每天每千克体重的活性化合物量,其可以单一剂量或以单独的分开剂量形式施予,如每天从1到4倍。可以理解的是,对于特别受体的特殊剂量水平和药剂频率可改变病取决于多种因素,包括使用的特殊化合物活性、所述化合物代谢稳定性和作用长度、年龄、体重、一般健康状况、受体性别和饮食、施予模式和时间、排泄速率、药物组合和特殊疾病的严重程度。用于治疗的优选受体包括动物,最优人类、狗、猫、马及其类似物。
- 还没有人留言评论。精彩留言会获得点赞!