一种嗜水气单胞菌的亚单位纳米疫苗及其制备方法和应用
1.本发明涉及一种嗜水气单胞菌的亚单位纳米疫苗及其制备方法和应用,属于生物免疫领域。
背景技术:
2.水产养殖满足了全球近一半的鱼类和贝类消费需求。水产养殖业的绿色健康发展是粮食安全的重要保障,与人类健康息息相关。病害是制约水产养殖发展的重要原因之一。已有研究表明,我国水产动物病害损失占鱼类总产量的15%。嗜水气单胞菌(aeromonas hydrophila)是引发水生动物病害的重要病原微生物之一,广泛分布于各种水域环境中。受嗜水气单胞菌病害影响的鱼类主要包括大口黑鲈、鲤鱼和罗非鱼等。嗜水气单胞菌对宿主的定殖和感染受其结构成分、毒素和细胞外产物共同或单独影响,同时受到宿主免疫系统的影响。嗜水气单胞菌感染的鱼类疾病症状表现为败血症、赤鳍病和肠炎等。
3.近几十年来,疫苗在防控鱼类传染病中一直发挥着关键作用。在水产养殖中,它保护鱼类免受传染病的侵害,有效减少抗生素的使用,避免抗生素引发的细菌耐药性风险。目前,给鱼类接种疫苗的方法包括口服接种、浸泡接种和注射接种。其中,浸泡接种是将疫苗施加于鱼的表面,鱼体通过鳃、皮肤和侧线摄取抗原,刺激黏膜免疫诱发局部黏膜免疫应答,进而出现黏膜igt和全身igm的局部诱导和产生,从而达到免疫的效果,已被证明对预防多种鱼类病毒和细菌引发的疾病有效。施加浸泡疫苗的方式可以是将鱼短时间浸入浓缩疫苗溶液中,也可以是将疫苗溶液喷洒在鱼身上。浸泡接种适用于对幼小而无法进行高通量接种注射疫苗的鱼类进行大规模疫苗接种,对鱼类造成的压力最小。然而,浸泡疫苗的开发面临多个问题,致使其研究进展较为缓慢。首先,由于抗原在粘膜上的摄取效率低下,浸泡免疫需要大量的抗原蛋白;其次,抗原在水体中不稳定,易被分解,浸泡疫苗的效力不如腹腔注射的疫苗。已有研究表明,亚单位抗原具有生产方便,可通过发酵表达大批量制备,安全性更高的优点,可应用于浸泡疫苗的开发。目前,对嗜水气单胞菌亚单位抗原的研究主要集中在外膜蛋白(outer membrane proteins,omp)上。omp是暴露在细胞表面的表位,更容易与宿主免疫系统相互作用,是疫苗开发的良好候选者。omp p5是嗜水气单胞菌的omp之一,具有高免疫原性,能诱导机体产生较强的免疫应答,表现出较好的免疫保护效果。但是,亚单位抗原的免疫原性低,不稳定,需要配伍佐剂和有效的递送系统来增加其成药性。纳米递送技术共负载亚单位抗原和佐剂形成的纳米疫苗具有保护抗原不被水体中的酶降解,增强佐剂的成药性,促进抗原呈递细胞对其摄取及呈递的优势。
技术实现要素:
4.本发明结合亚单位抗原、纳米递送技术和浸泡接种各自的特点,基于生物黏膜组织主要是由带负电的蛋白和其他生物大分子组成,通过制备带正电的纳米疫苗可促进鱼体对疫苗的摄取进而提高疫苗利用度这一原理,开发了一种嗜水气单胞菌亚单位纳米疫苗及其制备方法和应用。
5.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所涉及的实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
6.如本文中使用的,术语“颗粒”是指在一定尺寸范围内具有特定形状的几何体,以离散颗粒、丸粒、珠粒或团粒存在为特征的物质状态,而不管其大小、形状或形态如何。
7.如本文中使用的,术语“纳米颗粒”是指尺寸(即颗粒的最长维度中的直径)小于100纳米的颗粒。
8.如本文中使用的,术语“粒径”即“等效粒径”,是指当被测颗粒的某种物理特性或物理行为与某一直径的同质球体(或组合)最相近时,就把该球体的直径(或组合)作为被测颗粒的等效粒径(或粒度分布)。
9.如本文中使用的,术语“平均粒径”是指对于一个由大小和形状不相同的粒子组成的实际粒子群,与一个由均一的球形粒子组成的假想粒子群相比,如果两者的粒径全长相同,则称此球形粒子的直径为实际粒子群的平均粒径。平均粒径的测量方法是本领域技术人员已知的,例如光散射法;平均粒径的测量仪器包括但不限于马尔文粒径仪。
10.如本文中使用的,术语“室温”是指25
±
5℃。
11.如本文中使用的,术语“免疫佐剂”是指同抗原一起或预先施用于机体内,能增强免疫原性或改变免疫反应类型的物质。免疫佐剂本身可以具有免疫原性,或不具有免疫原性。
12.如本文中使用的,术语“抗原”或“免疫原”是指能够诱导宿主体内的特异性免疫应答的物质。抗原可以包括整个生物体(例如灭活的、减毒的或活的生物体);生物体的亚单位或部分;含有具有免疫原性的插入物的重组载体;在呈递给宿主后能够诱导免疫应答的dna部分或片段;蛋白、糖蛋白、脂蛋白、多肽、肽、抗原表位、半抗原、毒素、抗毒素或其任何组合。
13.本发明选择生物相容性较好的阳离子脂质材料,plga和电中性表面活性剂dspe-peg为改性材料,以重组蛋白omp p5为抗原,以常见的分子佐剂为免疫激动剂,制备了三种适用于浸泡免疫的新型纳米疫苗,并通过统计浸泡免疫后大口黑鲈的相对存活率评价新型纳米疫苗的保护效果。数据表明omp p5重组蛋白纳米疫苗可以作为预防大口黑鲈嗜水气单胞菌感染的候选疫苗。
14.本发明的目的在于克服现有鱼类亚单位疫苗存在的不足和缺陷,提供一种新型鱼用亚单位纳米疫苗。
15.本发明的另一目的在于提供所述新型纳米疫苗的制备方法。
16.本发明的再一目的在于提供所述的新型纳米疫苗的应用。
17.本发明的上述目的是通过以下技术方案给予实现的:
18.本发明提供一种纳米疫苗,包含omp p5蛋白、免疫佐剂、阳离子聚合物、表面活性剂、疏水稳定剂。
19.在一种实施方式中,所述ompp5蛋白的氨基酸序列为genbankabk37458.1。
20.在一种实施方式中,所述免疫佐剂选自poly(i:c)、cpg、mpla、角鲨烯一种或多种。
21.在一种实施方式中,所述免疫佐剂为cpg和/或mpla。
22.omp p5是暴露在细胞表面的抗原,可与宿主免疫系统相互作用,具有高免疫原性,
能诱导机体产生较强的免疫应答,从而产生较高的免疫保护效果。研究表明,omp p5对大口黑鲈嗜水气单胞菌感染具有较好的预防效果。本发明通过静电作用由阳离子磷脂负载ompp5蛋白和阴离子亲水佐剂,以疏水稳定剂稳定粒子。其中,疏水佐剂通过与疏水稳定剂同时加入而被负载,并利用表面活性剂进行修饰,形成含有omp p5蛋白和特定免疫佐剂的纳米疫苗,相比于单独的ompp5蛋白,本发明的纳米疫苗能够产生更优的免疫效果。
23.所述“包裹”并不限于将omp p5蛋白和免疫佐剂完全置于纳米疫苗的内部。本发明的纳米疫苗中,omp p5蛋白和免疫佐剂可以全部位于纳米疫苗内部,也可以部分位于纳米疫苗表面。
24.在一种实施方式中,所述阳离子聚合物选自溴化三甲基-2,3-二油酰氧基丙基铵(dotap)、溴化三甲基-2,3-二油烯氧基丙基铵(dotma)、三氟乙酸二甲基-2,3-二油烯氧基丙基-2-(2-精胺甲酰氨基)乙基铵(dospa)、溴化二甲基双十八烷基铵(ddab)、溴化三甲基十二烷基铵(dtab)、溴化三甲基十四烷基铵(ttab)、溴化三甲基十六烷基铵(ctab)、1,2-二油酰-3-琥珀酰-sn-甘油胆碱酯(dosc)、3β-[n-(n’,n
’‑
二甲基胺乙基)胺基甲酰基]胆固醇(dc-chol)、硬脂胺(sa)中的一种或多种。
[0025]
在一种实施方式中,所述阳离子聚合物为dotap。
[0026]
在一种实施方式中,所述疏水稳定剂选自聚乳酸-羟基乙酸共聚物(plga),聚己内酯(pcl),聚氧化乙烯(peo),聚乳酸(pla)中的一种或多种。
[0027]
在一种实施方式中,所述疏水稳定剂为plga。
[0028]
在一种实施方式中,所述表面活性剂选自二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg-2000)、pf68和pf127中的一种或多种。
[0029]
在一种实施方式中,所述表面活性剂为dspe-peg-2000。
[0030]
在一种实施方式中,所述纳米疫苗为近似球形。
[0031]
在一种实施方式中,所述纳米疫苗的粒径为50~200nm。
[0032]
在一种实施方式中,所述omp p5蛋白:免疫佐剂:阳离子脂质:疏水稳定剂:表面活性剂的质量比为10~30:5~20:3~12:20~50:40~80。
[0033]
在一种实施方式中,当佐剂为poly(i:c)和cpg时,omp p5蛋白:免疫佐剂:阳离子脂质:疏水稳定剂:表面活性剂的质量比为20:10:9:45:60;当佐剂为mpla和角鲨烯时,omp p5蛋白:免疫佐剂:阳离子脂质:疏水稳定剂:表面活性剂的质量比为20:1:7:40:60。
[0034]
本发明还提供一种制备上述纳米疫苗的方法,所述方法包括以下步骤:
[0035]
(1)使一体积的omp p5蛋白和阴离子亲水佐剂混合,磁力搅拌600转/分钟,滴加到10-25体积的阳离子脂质溶液中,混合10分钟,交联得到混合物;或,使一体积的omp p5蛋白和疏水佐剂混合,磁力搅拌600转/分钟,滴加到15-25体积的阳离子脂质溶液中,混合10分钟,交联得到混合物。
[0036]
(2)将12-25体积的疏水稳定剂或者包含疏水佐剂的疏水稳定剂溶液边搅拌边滴加到混合了步骤1形成的混合物中,得到纳米颗粒。
[0037]
(3)将步骤(2)得到的纳米颗粒滴加到50-150体积的表面活性剂中,搅拌5min,然后透析除去其中的有机溶剂。
[0038]
在一种实施方式中,将omp p5蛋白溶于缓冲液得到10~30mg/ml omp p5蛋白溶液;将阳离子脂质溶于有机溶剂,得到3~12mg/ml的阳离子脂质溶液;将疏水佐剂溶于有机
溶剂,得到5~20mg/ml的疏水佐剂;将疏水稳定剂溶于有机溶剂,得到20~50mg/ml的疏水稳定剂溶液;将表面活性剂溶于水,得到20~50mg/ml的表面活性剂溶液。
[0039]
在一种实施方式中,所述缓冲液为pbs盐溶液,ph=8.0。
[0040]
在一种实施方式中,所述疏水稳定剂溶于dmso。
[0041]
在一种实施方式中,所述阳离子脂质溶于乙醇。
[0042]
在一种实施方式中,所述方法中,一体积omp p5蛋白和阴离子亲水佐剂滴加到18体积的阳离子脂质溶液中。
[0043]
有益效果:
[0044]
(1)本发明以omp p5重组蛋白为抗原来制备纳米疫苗,制备得到的纳米疫苗形态规则、外形圆整、表面光滑、分散性好,无明显粘连、破损、坍塌等现象;
[0045]
(2)本发明的纳米疫苗中,omp p5重组蛋白和免疫佐剂具有较高的包封率;
[0046]
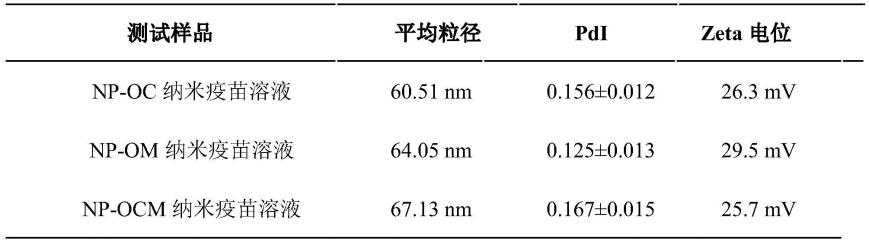
(3)本发明的纳米疫苗施用于试验鱼后,能产生较强的免疫应答,免疫效果优于游离形式的亚单位疫苗;
[0047]
(4)本发明的纳米疫苗可保护抗原,延长抗原的稳定性和有效性;
[0048]
(5)本发明的纳米疫苗能够通过浸泡方式免疫,通过阳离子纳米颗粒介导与鱼鳃部高效结合增强鱼类吸收,同时提高药物利用度,减少抗原和佐剂的使用量。
附图说明
[0049]
图1为实施例4中的纳米疫苗的形态。a为包裹omp p5重组蛋白和cpg免疫佐剂的纳米疫苗在透射电镜下的形态;b为包裹omp p5重组蛋白和mpla免疫佐剂的纳米疫苗在透射电镜下的形态;c为包裹omp p5重组蛋白cpg及mpla双免疫佐剂的纳米疫苗在透射电镜下的形态。
[0050]
图2为实施例4中的纳米疫苗的粒径分布。a为包裹omp p5重组蛋白和cpg免疫佐剂的纳米疫苗的粒径分布图;b为包裹ompp5重组蛋白和mpla免疫佐剂的纳米疫苗的粒径分布图;c为包裹ompp5重组蛋白cpg和mpla双免疫佐剂的纳米疫苗的粒径分布图。
[0051]
图3为实施例6中对大口黑鲈进行嗜水气单胞菌攻毒后20天的生存率。。
[0052]
图4为实施例7中用纳米疫苗接种后大口黑鲈鳃内tnf-α、il-1β、igm和igt基因的相对表达量。
具体实施方式
[0053]
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0054]
实施例1.np-oc纳米疫苗的制备
[0055]
1、试剂:omp p5重组蛋白由大肠杆菌表达系统表达产生,再经过溶解和复性而获得,其氨基酸序列来源于genbank(abk37458.1)。首先,使用特异性引物扩增目的片段,上游引物序列为:5
′‑
cgcggatccatgaataaaacactgattaccttgc-3
′
;下游引物序列为:5
′‑
cccaagcttctgctgaacttccgagatcc-3
′
。然后,将扩增产物纯化后连接到pet-28a载体上,构
建重组表达载体。随后,将重组表达载体转化到大肠杆菌(de3)中,通过菌落pcr和测序筛选阳性转化子。随后,将阳性转化子在lb培养基中培养,用iptg进行诱导。最后,对表达产物进行纯化、复性获得omp p5重组蛋白。详细操作步骤可参考《分子克隆实验指南》第四版。
[0056]
其他试剂均为商购。
[0057]
2、制备过程:
[0058]
(1)将阳离子聚合物dotap溶解于无水乙醇中,在磁力搅拌下溶解得到dotap浓度为1mg/ml,表面活性剂dspe-peg-2000溶于水得到dspe-peg-2000浓度为1m/ml。omp p5重组蛋白和阴离子亲水佐剂cpg分别溶于1
×
pbs缓冲液中得到浓度分别为40mg/ml的omp p5溶液和20mg/ml的cpg溶液。疏水稳定剂plga使用dmso溶解,浓度为5mg/ml。
[0059]
(2)一体积的ompp5溶液和一体积的cpg溶液混合,磁力搅拌600转/分钟,滴加到18体积的dotap溶液中,使dotap与cpg和omp p5蛋白充分混合10分钟,通过静电作用交联得到混合物。
[0060]
(3)然后20体积的plga溶液边搅拌边滴加到混合了(2)中形成的混合物中,形成疏水稳定剂包裹的纳米颗粒。
[0061]
(4)得到的纳米颗粒滴加到120体积的dspe-peg-2000中,搅拌5min,然后透析除去其中的有机溶剂形成纳米疫苗(命名为np-oc纳米疫苗溶液)。
[0062]
实施例2.np-om纳米疫苗的制备
[0063]
(1)将阳离子聚合物dotap溶解于无水乙醇中,在磁力搅拌下溶解得到dotap浓度为1mg/ml,表面活性剂dspe-peg-2000溶于水得到dspe-peg-2000浓度为1m/ml。omp p5溶于1
×
pbs得到浓度分别为20mg/ml的omp p5溶液。疏水佐剂mpla和疏水稳定剂plga使用dmso溶解,浓度分别为1mg/ml和5mg/ml。
[0064]
(2)二体积的omp p5蛋白,磁力搅拌600转/分钟,滴加到18体积的dotap溶液中,使包含dotap与omp p5蛋白充分混合10分钟,通过静电作用交联得到混合物。
[0065]
(3)然后20体积的mpla和plga溶液边搅拌边滴加到混合了(2)中形成的混合物中,形成疏水稳定剂包裹的纳米颗粒。
[0066]
(4)得到的纳米颗粒滴加到120体积的dspe-peg-2000中,搅拌5min,然后透析出去其中的有机溶剂得到纳米疫苗(命名为np-om纳米疫苗溶液)。
[0067]
实施例3.np-ocm纳米疫苗的制备
[0068]
(1)将阳离子聚合物dotap溶解于无水乙醇中,在磁力搅拌下溶解得到dotap浓度为1mg/ml,表面活性剂dspe-peg-2000溶于水得到dspe-peg-2000浓度为1m/ml。omp p5和cpg溶于1
×
pbs得到浓度分别为20mg/ml的omp p5溶液和10mg/ml的cpg溶液。疏水佐剂mpla和疏水稳定剂plga使用dmso溶解,浓度分别为1mg/ml和5mg/ml。
[0069]
(2)二体积的omp p5蛋白和cpg混合溶液滴加到18体积的dotap溶液中,使dotap与ompp5蛋白充分混合10分钟,通过静电作用交联得到混合物。
[0070]
(3)然后20体积的mpla和plga溶液边搅拌边滴加到混合了(2)中形成的混合物中,形成疏水稳定剂包裹的纳米颗粒。
[0071]
(4)得到的纳米颗粒滴加到120体积的dspe-peg-2000中,搅拌5min,然后透析出去其中的有机溶剂得到纳米疫苗(命名为np-ocm纳米疫苗溶液)。
[0072]
实施例4.纳米疫苗的形态表征、粒径测试和电位测试
[0073]
1.形态表征
[0074]
使用透射电镜观察np-oc,np-om,np-ocm纳米疫苗。三种纳米疫苗的形态分别如图1a、1b、1c所示。图1a为包裹omp p5重组蛋白和cpg免疫佐剂的纳米疫苗在透射电镜下的形态;图1b为包裹omp p5重组蛋白和mpla免疫佐剂的纳米疫苗在透射电镜下的形态;图1c为包裹omp p5重组蛋白cpg及mpla双免疫佐剂的纳米疫苗在透射电镜下的形态。
[0075]
如图1所示,三种纳米疫苗形态规则、外形圆整、表面光滑、分散性好,无明显粘连、破损、坍塌等现象。
[0076]
2.粒径测试和zeta电位测试:
[0077]
利用马尔文粒径仪(带有动态光散射检测器)对np-oc,np-om,np-ocm纳米疫苗的平均粒径和zeta电位进行测试,结果如表1所示。
[0078]
表1纳米疫苗的平均粒径和zeta电位
[0079][0080]
图2a、2b、2c分别为np-oc,np-om,np-ocm纳米疫苗的粒径分布图。图2a为包裹omp p5重组蛋白和cpg免疫佐剂的纳米疫苗的粒径分布图;图2b为包裹omp p5重组蛋白和mpla免疫佐剂的纳米疫苗的粒径分布图;图2c为包裹ompp5重组蛋白cpg和mpla双免疫佐剂的纳米疫苗的粒径分布图。如图2所示,四种纳米疫苗均具有较窄的粒径分布。
[0081]
实施例5.纳米疫苗中ompp5重组蛋白的包封率的计算
[0082]
1.取5mlnp-oc纳米疫苗溶液到300kda的超滤管中,在4℃、3000rpm条件下离心30min,取滤出液,采用bradford蛋白检测试剂盒,检测下面滤出液中游离omp p5重组蛋白的含量,按照如下公式计算纳米疫苗中omp p5重组蛋白的包封率。
[0083]
omp p5重组蛋白的包封率=w
0-w1/w0×
100%,其中w0为加入的omp p5重组蛋白的总量;w1为下面滤出液中游离的omp p5重组蛋白的总量。
[0084]
2.按照步骤1中的方法分别测定np-om和np-ocm纳米疫苗中omp p5重组蛋白的包封率。
[0085]
包封率的测定结果如表2所示。
[0086]
表2ompp5重组蛋白的包封率
[0087]
[0088]
从表2的结果可以看出,本发明的上述三种纳米疫苗中,omp p5重组蛋白的包封率较高,有利于纳米疫苗引起强的免疫效果。
[0089]
实施例6.纳米疫苗对大口黑鲈嗜水气单胞菌感染的免疫保护评价
[0090]
大口黑鲈接种ompp5亚单位纳米疫苗:选取规格一致,健康的大口黑鲈(3
±
0.3g)100尾,随机分为5组,每组20尾。采用浸泡接种的方法进行免疫,即对照组(pbs)、游离蛋白抗原组(f-o)和ompp5亚单位纳米疫苗组(np-oc、np-om、np-ocm)分别用含pbs、f-o、np-oc、np-om和np-ocm的水体浸泡5分钟。其中,f-o、np-oc、np-om和np-ocm组添加抗原剂量均为50μg/ml。接种疫苗后,将实验鱼转移至新的水箱继续养殖。
[0091]
接种后细菌攻毒:免疫21天后,将实验鱼转移至含嗜水气单胞菌终浓度为1
×
107cfu/ml的水体中浸泡1h。攻毒后的实验鱼转移至新的水箱中继续养殖,连续观察20天,每天记录大口黑鲈的死亡情况。使用如下公式计算免疫保护率(rps):rps=[1-(免疫组死亡率/对照组死亡率)]
×
100%。
[0092]
结果如图3所示,pbs组、f-o组、np-oc组、np-om组和np-ocm组试验鱼的累积死亡率分别为90%、85%、20%、25%和15%。经计算,与pbs对照相比,接种f-o、np-oc、np-om和np-ocm疫苗对大口黑鲈的免疫保护率分别为5%、78%、72%和83%。由此可见,np-oc、np-om和np-ocm三种纳米疫苗均能够在不同程度上有效地对大口黑鲈产生免疫保护作用,进而提高大口黑鲈抵抗嗜水气单胞菌感染的能力。
[0093]
实施例7.纳米疫苗增强大口黑鲈对嗜水气单胞菌的免疫应答
[0094]
rna提取与反转录:分别在重组omp p5纳米疫苗接种后的第1、3和14天,每组取3尾鱼的鳃组织用于rna提取。按照trizol法提取总rna,加入dnase i,37℃消化1h以去除基因组dna污染,再进行反转录,以反转录产物为模板进行荧光定量检测。
[0095]
qrt-pcr检测鱼体中免疫相关基因的表达:采用荧光定量pcr的方法检测大口黑鲈鱼鳃中tnf-α、il-1β、igm和igt基因的表达水平,以β-actin基因为内参。特异性引物及序列见表3。
[0096]
表3荧光定量pcr特异性引物及序列
[0097][0098]
结果如图4所示,与f-o组相比,np-oc组、np-om组和np-ocm处理的鱼的鱼鳃中tnf-α、il-1β、igm和igt基因的表达量显著增加,这说明浸泡omp p5亚单位纳米疫苗可引起大口黑鲈免疫应答反应的增强,提高宿主对嗜水气单胞菌的抗感染能力。
[0099]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1