一种膜联蛋白ANX1和TNF-α纳米抗体联用在制备溃疡性结肠炎药物中的应用的制作方法
一种膜联蛋白anx1和tnf-α
纳米抗体联用在制备溃疡性结肠炎药物中的应用
技术领域
1.本发明涉及生物技术领域,具体涉及一种膜联蛋白anx1和tnf-α纳米抗体联用在制备溃疡性结肠炎药物中的应用。
背景技术:
2.溃疡性结肠炎(ulcerative colitis,uc)是一种易复发的自身免疫性疾病,属于炎症性肠病(inflammatory bowel disease,ibd)的一种。溃疡性结肠炎在临床上的典型症状表现为血性腹泻、夜间排便、急症和里急后重,在最初的隐匿期后,它表现出粘膜炎症反复发作和缓解的特征。ibd的致病机制尚不明确,遗传、免疫和环境因素,如饮食、压力、吸烟和自由基等,都参与了其发展。
3.在世界范围内,uc的发病率呈现出逐年上升的趋势。uc在发达国家中的发病率较高,而在进入21世纪以来,uc发病率在发达国家中已经趋于稳定,而在南美、亚洲、非洲和中东地区的许多新工业化国家中有所上升。在我国溃疡性结肠炎以往非常少见,总体发病率在1.2/10万人/年,但是随着我国经济的发展,溃疡性结肠炎呈现快速上升的趋势。随着uc患病率的上升,整体医疗成本也会上升。因此,开发新型的高效低毒的治疗药物成为需求。
4.anti-tnf-α纳米抗体药物在20世纪90年代后期开发,在治疗自身免疫性疾病如炎症性肠病,强直性脊柱炎,牛皮癣和类风湿性关节炎方面取得了巨大成功。目前常见的tnf-α纳米抗体药物包括英夫利昔单抗、阿达木单抗、戈利木单抗、赛妥珠单抗和依那西普。
5.虽然tnf-α纳米抗体药物在自身免疫性疾病中取得了显著的作用,然而,随着上述疾病的高效治疗,关于不良反应的报道正在增加。接受anti-tnf-α纳米抗体药物治疗后,ibd,强直性脊柱炎和类风湿性关节炎患者(20%~22%)发生新发的牛皮癣(puig l等,dermatology 2012,225(1):14
–
17;gannes g等,arch.dermatol.2007,143(2):223
–
231;ko jm等,j.dermatol.treat 2009,,20(2):100
–
108)。这种不良反应在应答者而不是无反应者中发展明显,并导致5%至35%的患者停止anti-tnf-α治疗(rahier j等,clin.gastroenterol.hepatol.2010,8(12):1048
–
1055;scaldaferri f等,gut 2014,63(4):699
–
701)。然而,与类风湿性关节炎和ibd患者相比,累积剂量对牛皮癣的发展时间没有影响(scaldaferri f等,gut 2014,63(4):699
–
701)。此外,一项研究表明,接受anti-tnf-α治疗的ibd患者的皮肤病变被th17细胞浸润(tillack c等,gut 2014,63(4):567
–
577)。
6.th17细胞是一个t细胞亚群,其特征是产生大量的il-17a、il-17f、il-21和il-22。th17细胞是由il-6和tgf-β共同诱导下分化的,它的扩张是由il-23促进的(caprioli f等,j.crohn’s colitis 2008,2(4):291
–
295)。由th17细胞产生的il-21反过来增加了其il-23受体的表达,从而形成了一个正向的自动调节反馈回路增强了th17细胞的扩张。th17细胞,特别是其分泌的特征性细胞因子il-17a在肠道炎症中的作用已被广泛研究。与正常黏膜相比,ibd患者血清和病变肠黏膜组织中il-17a的分泌和mrna水平显著高于正常人。uc疾病的
严重程度与il-17a的表达量呈正相关,这表明肠道中的il-17a在促进了ibd患者疾病的发展(gannes g等,arch.dermatol.2007,143(2):223
–
231;cullen g等,aliment.pharmacol.ther.2011,34(11
–
12):1318
–
1327;.milanez fm等,arthritis res.therapy 2016,18(1):52)。目前,已经在各种条件和因素下研究了肠道th17细胞的诱导。有文献表明,抗原特异性th17分化发生在肠道固有层(lp)中,cd11c+dc细胞可以通过吞噬或胞饮作用处理微生物等抗原,通过mhcii途径刺激th17的生成,并且这个过程与肠系膜淋巴结和肠相关淋巴组织无关。
7.膜联蛋白a1(annexin a1,anx1)来源于研究糖皮质激素抑制前列腺素合成的机制的过程,又被称为大皮质激素、肾皮质激素、脂肪调节蛋白和脂皮质素1,其特征是通过影响磷脂酶a2(pla2)的活性来抑制类二十烷的生成。anx1是一个由346个氨基酸组成的单体两亲性蛋白,是膜联蛋白超家族中的一种,大小为37kda。anx1主要在中性粒细胞、嗜酸性粒细胞和单核细胞的亚细胞颗粒中表达,在特定的淋巴细胞亚群中有少量表达。
8.现在的证据表明,anx1通过与甲酰肽受体(formyl peptide receptor,fpr)的相互作用介导其大部分细胞效应。甲酰肽受体是一个包含七个跨膜结构域的g蛋白偶联受体家族的成员,主要在哺乳动物吞噬性白细胞中表达,它们可以诱导对各种配体的反应,在宿主的防御和炎症方面发挥重要的作用。人体内存在三种fpr受体,即fpr1、fpr2和fpr3,三种fpr具有显著的序列同源性。
9.在严重uc患者炎症结肠活检中检测到anx1的分泌,而在健康人结肠,非uc患者或轻微或中度uc患者结肠的活检中没有检测到。英夫利昔单抗可预防dss诱导的wt结肠炎的临床症状,但在anx1-/-小鼠中不能(gaffen sl等,nat.rev.immunol.2009,9(8):556),这表明tnf-α纳米抗体药物英夫利昔单抗需要通过内源性anx1才能发挥急性结肠炎治疗作用。但是,如果anx1作为外源性的药物使用,其作用于细胞外、而无法进入细胞内部时,anx1的作用如何,其与tnf-α纳米抗体药物的作用是怎样的关系。
10.目前,缺乏一种膜联蛋白anx1和tnf-α纳米抗体联用在制备溃疡性结肠炎药物中的应用。
技术实现要素:
11.本发明的目的在于针对现有的tnf-α纳米抗体治疗溃疡性结肠炎的缺陷,提出一种膜联蛋白anx1和tnf-α纳米抗体联用在制备溃疡性结肠炎药物中的应用。
12.为了解决上述问题,本发明提供了如下技术方案:本发明的一种膜联蛋白anx1和tnf-α纳米抗体联用在制备炎症药物中的应用。
13.本发明的一种膜联蛋白anx1和tnf-α纳米抗体联用在制备治疗溃疡性结肠炎药物中的应用。
14.本发明的一种组合药物,所述的组合药物由所述的tnf-α纳米抗体和膜联蛋白anx1组成。
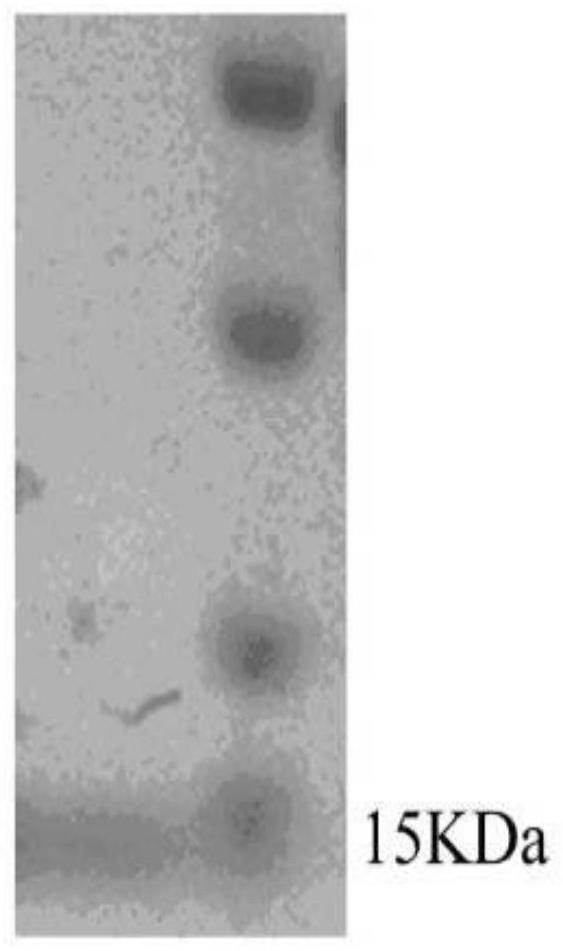
15.进一步地,所述的膜联蛋白anx1的氨基酸序列为seq id no.1所示,具有抑制th17细胞分化和治疗溃疡性结肠炎的能力。
16.进一步地,所述的膜联蛋白anx1通过fpr2-stat3通路抑制tnf-α纳米抗体处理引起th17细胞分化。
17.更进一步地,所述的tnf-α纳米抗体具有如下氨基酸序列:
18.(1)由seq id no.2或3或4所示的氨基酸序列组成的蛋白质;或
19.(2)与序列seq id no.2或3或4限定的氨基酸序列同源性在80%至100%编码相同功能蛋白质的氨基酸序列;或
20.(3)seq id no.2或3或4所示的氨基酸序列经增加、缺失或替换一个或多个氨基酸具有同等活性的由(1)衍生的蛋白。
21.进一步地,所述的膜联蛋白anx1通过fpr2-stat3通路抑制tnf-α纳米抗体处理引起th17细胞分化。
22.进一步地,所述的tnf-α纳米抗体为tnf-α纳米抗体v7、tnf-α纳米抗体v1或tnf-α纳米抗体v19中的任意一种,所述的tnf-α纳米抗体v7为seq id no.2所示的氨基酸序列组成的蛋白质,所述的tnf-α纳米抗体v1为seq idno.3所示的氨基酸序列组成的蛋白质,所述的tnf-α纳米抗体v19为seq idno.4所示的氨基酸序列组成的蛋白质;膜联蛋白anx1能与tnf-α纳米抗体v7、tnf-α纳米抗体v1或tnf-α纳米抗体v19中的任意一种联用。
23.tnf-α纳米抗体与tnf-α抗原/抗体复合物cpr诱导th17细胞分化。cpr是指tnf-α纳米抗体和tnf-α抗原/抗体复合物。
24.更进一步地,tnf-α纳米抗体与tnf-α抗原/抗体复合物cpr促进巨噬细胞的吞噬能力和抗原递呈特征、并与th17细胞分化相关。
25.进一步地,tnf-α纳米抗体与tnf-α抗原/抗体复合物cpr和frp2诱导的th17细胞分化的调节是通过stat3途径介导的。
26.进一步地,在自身免疫性结肠炎小鼠模型中,人重组anx1通过调节socs3/stat3信号传导,限制th17的发育来发挥其免疫抑制的作用,从而减轻了疾病的严重程度。
27.本发明所述的tnf-α纳米抗体的制备方法,包括如下步骤:
28.(1)通过酶切酶联反应将tnf-α纳米抗体的编码基因导入pet28a载体,构建重组表达质粒;
29.(2)将目的质粒转入bl21感受态细胞,转化后取适量菌液涂布在含有卡那霉素的lb平板上37℃过夜培养。
30.(3)挑取阳性克隆在含卡那霉素的lb培养基中进行扩大培养,在15℃条件下加入5mm的iptg诱导20h。通过离心收取细胞沉淀,向体系中加入蛋白缓冲液,使用匀浆机破碎细胞,离心后收取上清液。通过柱层析进行分离纯化,制得tnf-α纳米抗体。
31.具体详细步骤如下:(1)通过酶切酶联反应将如seq id no.2或seq id no.3或seq id no.4所示的tnf-α纳米抗体基因导入pet28a载体,构建表达质粒;
32.(2)将目的质粒转入bl21感受态细胞轻轻混匀后冰浴30min,42℃热激45s,冰上静置2min后加入600μl无抗生素lb培养基后37℃震荡1h,离心(2500rpm,5min)后弃上清,留下少许培养基重悬菌液;转化后取适量菌液涂布在含有卡那霉素的lb平板上37℃过夜培养。
33.(3)挑取阳性克隆在含卡那霉素的lb培养基中进行扩大培养,在15℃条件下加入5mm的iptg诱导20h。表达的tnf-α纳米抗体蛋白中包含his标签;
34.通过离心(4000rpm,20min,4℃)收取细胞沉淀,向体系中加入蛋白缓冲液,使用匀浆机破碎细胞,离心(12000rpm,30min,4℃)后收取上清液;
35.使用蛋白缓冲液平衡含有ni-nta树脂的柱子后,使上清液缓慢通过ni-nta从而将
目的tnf-α纳米抗体结合在ni-nta上,之后使用蛋白洗脱液进行洗脱;在4℃条件下使用hrv3c酶剪切tnf-α纳米抗体上的his标签12h;
36.(4)将溶液重新通过ni-nta以得到不含his标签的tnf-α纳米抗体,使用pbs缓冲液过夜透析后浓缩并保存(-80℃);制得tnf-α纳米抗体。
37.在步骤(3)中,蛋白缓冲液配方:
①
300mm nacl,
②
50mm tris-hcl,
③
0.5mmβ-巯基乙醇,
④
ph 7.8。在步骤(3)中,蛋白洗脱液配方:
①
80mm imidazole,
②
300mm nacl,
③
50mm tris-hcl,
④
0.5mmβ-巯基乙醇,
⑤
ph 7.8。
38.更进一步地,在步骤(4)中,用12%sds-page验证tnf-α纳米抗体的分子量和纯度。
39.本发明所述的anx1的制备方法,包括如下步骤:(1)通过酶切和酶联反应将如seq id no.1所示的anx1基因导入pet28a载体,构建表达质粒;
40.(2)将目的质粒转入bl21感受态细胞,转化后取适量菌液涂布在含有卡那霉素的lb平板上37℃过夜培养。
41.(3)挑取阳性克隆在含卡那霉素的lb培养基中进行扩大培养,在15℃条件下加入5mm的iptg诱导20h。通过离心收取细胞沉淀,向体系中加入蛋白缓冲液,使用匀浆机破碎细胞,离心后收取上清液。通过柱层析进行分离纯化,具体操作步骤如tnf-α纳米抗体纯化过程,制得重组anx1蛋白。
42.有益效果:本发明的anx1具有抑制th17细胞分化的能力,在自身免疫性结肠炎小鼠模型中,外源性的人重组anx1通过调节socs3/stat3信号传导,限制th17的发育来发挥其免疫抑制的作用,从而减轻了疾病的严重程度。针对tnf-α纳米抗体治疗时,tnf-α纳米抗体与tnf-α形成的复合物导致促进th17细胞浸润和il-17a产生、反而促进了ibd患者的疾病状态的难题,本发明发现将anx1与tnf-α纳米抗体联用,可以提高tnf-α纳米抗体对dss小鼠结肠炎的治疗效果。
附图说明
43.图1为本发明的tnf-α纳米抗体的纯化与表征;a:通过亲和层析表达和纯化tnf-α纳米抗体;b:通过mst检测tnf-α纳米抗体与鼠源s-tnf-α的亲和力。
44.图2为本发明的不同剂量tnf-α纳米抗体对dss小鼠体重及结肠长度的影响。a:tnf-α纳米抗体治疗dss诱导的结肠炎期间的一系列体重变化;b:第8天各组的代表性结肠的长度比较。
45.图3为本发明的tnf-α纳米抗体导致小鼠dss小鼠结肠th17细胞增加。a:流式细胞术分析dss和tnf-α纳米抗体(10mg/kg)组小鼠的肠道th17细胞;b:流式细胞术分析肠道cd11c+dc中的bfp荧光。
46.图4为本发明的tnf-α纳米抗体治疗中th17扩增与tnf-α纳米抗体被吞噬。a:tnf-α纳米抗体体外刺激显著增加dss小鼠lpl中th17,而wt小鼠则不能;b:体外刺激tnf-α纳米抗体-bfp后,bfp阳性cd11c+dc增加;c:tnf-α纳米抗体诱导dss小鼠而非wt小鼠肠道cd11c+dc的mhcii上调。
47.图5为本发明的tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr可被cd11c+raw264.7吞噬;a.构建tnf-α纳米抗体-tnf-α抗原/抗体复合物吞噬raw264.7(cpr)的方案;b:cd11c+raw264.7可吞噬tnf-α纳米抗体v7-tnf-α抗原/抗体复合物,但不能吞噬tnf-α纳米抗体v7。
48.图6为本发明的tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr-2具有抗原递呈特征;a:流式细胞术分析不同tnf-α纳米抗体v7-tnf-α抗原/抗体复合物含量的cpr;b:cpr中mhcii、ciita、cd74、h2-aa、tgf-β和il-6的qrt-pcr分析。
49.图7为本发明的tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr使得wt小鼠结肠th17扩增;a:流式细胞术分析经tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr-1或cpr-2治疗的结肠中的th17细胞;b:tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr-1或cpr-2治疗后结肠rorα、rorγt、il-17a和il-23的表达。
50.图8为本发明的tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr使得wt小鼠肠系膜淋巴结中th17扩增图;流式细胞术分析经cpr-1或cpr-2治疗肠系膜淋巴结中的th17细胞。
51.图9为本发明的δciita-raw264.7的构建图;a:通过qrt-pcr检测δciita-cpr-2中mhcii的下调;b:通过qrt-pcr检测的δciita-cpr-2中tgf-β和il-6下调。
52.图10为本发明的δciita-cpr对th17的影响图;a:δciita-cpr-2在结肠中诱导th17的流式分析;b:δciita-cpr-2在mln中诱导th17的流式分析。
53.图11为本发明的tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr-2显著上调结肠中的anx1图;a:通过qrt-pcr分析,与tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr-2相比,δciita-cpr-2中anx1的表达下调;b:流式细胞术分析mln和结肠中anx1结合受体的表达。
54.图12为本发明的anx1激活fpr2图;a:qrt-pcr检测cpr刺激结肠lpl后anx1的表达水平;b:wrw4(10μg/ml)抑制fpr2的表达。
55.图13为本发明的anx1抑制tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr诱导的th17细胞分化图;在cpr-2(105细胞)、anx1(1μg/ml)和wrw4(10μg/ml)处理下,对结肠和mln中分化的th17细胞进行流式细胞术分析。
56.图14为本发明的tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr-2通过stat3途径介导th17分化图;a:通过western blot检测cpr-2(105细胞)、anx1(0.5μg/ml)、anx1(1μg/ml)和wrw4(10μg/ml)下结肠lpl中stat3/p-stat3的表达;b:qrt-pcr检测tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr-2(105细胞)、anx1(1μg/ml)和wrw4(10μg/ml)下socs3、rorγt、il-17a、il-17f和il-23的表达。
57.图15为本发明的不同剂量anx1对dss小鼠体重及结肠长度的影响图;a:anx1治疗dss诱导的结肠炎期间的一系列体重变化;b:第8天各组的代表性结肠的长度比较。
58.图16为本发明的tnf-α纳米抗体v7和anx1联合使用治疗dss诱导的结肠炎图;a:各组小鼠体重变化趋势比较;b:各组小鼠结肠长度比较;c:第7天各组的代表性肛门出血;d:各组疾病活动指数的比较。
59.图17为本发明的anx1(500μg/kg)减少了tnf-α纳米抗体v7(10mg/kg)抗体治疗dss小鼠时th17的扩增图;a:通过流式细胞术比较各处理组小鼠的mln和结肠lpl中的th17细胞;b:统计各处理组中th17细胞的比例。
60.图18为本发明的anx1(500μg/kg)可通过fpr2-stat3通路抑制tnf-α纳米抗体v7(10mg/kg)处理引起的th17细胞分化图;a:通过qrt
–
pcr检测anx1(500μg/kg)、tnf-α纳米抗体v7(10mg/kg)和anx1(500μg/kg)/tnf-α纳米抗体v7(10mg/kg)处理的小鼠结肠lpl中fpr2的表达;b:western blot检测anx1(500μg/kg)、tnf-α纳米抗体v7(10mg/kg)和anx1(500μg/kg)/tnf-α纳米抗体v7(10mg/kg)处理小鼠结肠lpl中stat3/p-stat3的表达。
具体实施方式
61.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
62.本发明的一种膜联蛋白anx1和tnf-α纳米抗体联用在制备炎症药物中的应用。
63.本发明的一种膜联蛋白anx1和tnf-α纳米抗体联用在制备治疗溃疡性结肠炎药物中的应用。
64.本发明的一种组合药物,所述的组合药物由所述的tnf-α纳米抗体和膜联蛋白anx1组成。
65.所述的膜联蛋白anx1的氨基酸序列为seq id no.1所示,具有抑制th17细胞分化和治疗溃疡性结肠炎的能力。
66.所述的膜联蛋白anx1通过fpr2-stat3通路抑制tnf-α纳米抗体处理引起th17细胞分化。
67.所述的膜联蛋白anx1通过fpr2-stat3通路抑制tnf-α纳米抗体处理引起th17细胞分化。所述的tnf-α纳米抗体具有如下氨基酸序列:
68.(1)由seq id no.2或3或4所示的氨基酸序列组成的蛋白质;或
69.(2)与序列seq id no.2或3或4限定的氨基酸序列同源性在80%至100%编码相同功能蛋白质的氨基酸序列;或
70.(3)seq id no.2或3或4所示的氨基酸序列经增加、缺失或替换一个或多个氨基酸具有同等活性的由(1)衍生的蛋白。
71.tnf-α纳米抗体-tnf-α抗原/抗体复合物cpr和frp2诱导的th17细胞分化的调节是通过stat3途径介导的。所述的tnf-α纳米抗体为tnf-α纳米抗体v7或tnf-α纳米抗体v1或tnf-α纳米抗体v19,所述的tnf-α纳米抗体v7为seq id no.2所示的氨基酸序列组成的蛋白质,所述的tnf-α纳米抗体v1为seq id no.3所示的氨基酸序列组成的蛋白质,所述的tnf-α纳米抗体v19为seq id no.4所示的氨基酸序列组成的蛋白质;
72.所述的膜联蛋白anx1通过fpr2-stat3通路抑制tnf-α纳米抗体处理引起th17细胞分化。
73.在自身免疫性结肠炎小鼠模型中,人重组anx1通过调节socs3/stat3信号传导,限制th17的发育来发挥其免疫抑制的作用,从而减轻了疾病的严重程度。
74.在本发明中,使用了2株不同的tnf-α纳米抗体,如seq id no.2和seq idno.3所示,2株tnf-α纳米抗体亲和力不同,其中seq id no.3的抗体比seq idno.2的抗体亲和力高约100倍。两种tnf-α纳米抗体获得的结果基本相同。为此,本发明仅以亲和力较差的、如seq id no.2所示的tnf-α纳米抗体为例,提供具体数据。seq id no.2所示的tnf-α纳米抗体在研究过程中代号为v7。
75.实施例1
76.如图1至图18所示,本发明首先在大肠杆菌中原核表达tnf-α纳米抗体v7,具体步骤为:通过酶切和酶联反应将如seq id no.2所示的tnf-α纳米抗体v7基因导入pet28a载体,构建质粒。
77.将目的质粒转入bl21(de3)感受态细胞轻轻混匀后冰浴30min,42℃热激45s,冰上静置2min后加入600μl无抗lb培养基后37℃震荡1h,离心(2500rpm,5min)后弃上清,留下少
许培养基重悬菌液。
78.转化后取适量菌液涂布在含有卡那霉素的lb平板上37℃过夜培养。
79.挑取阳性克隆在含卡那霉素的lb培养基中进行扩大培养,在15℃条件下加入5mm的iptg诱导20h。表达的v7蛋白中包含his标签。
80.通过离心(4000rpm,20min,4℃)收取细胞沉淀,向体系中加入蛋白缓冲液,使用匀浆机破碎细胞,离心(12000rpm,30min,4℃)后收取上清液。
81.蛋白缓冲液配方:
①
300mm nacl,
②
50mm tris-hcl,
③
0.5mmβ-巯基乙醇。
④
ph 7.8。
82.使用蛋白缓冲液平衡含有ni-nta树脂的柱子后,使上清液缓慢通过ni-nta从而将目的tnf-α纳米抗体v7结合在ni-nta上,之后使用洗脱液进行洗脱。
83.蛋白洗脱液配方:
①
80mm imidazole,
②
300mm nacl,
③
50mm tris-hcl,
④
0.5mmβ-巯基乙醇,
⑤
ph 7.8。
84.在4℃条件下使用hrv3c酶剪切tnf-α纳米抗体v7蛋白上的his标签12h。
85.将溶液重新通过ni-nta以得到不含his标签的tnf-α纳米抗体v7,使用pbs缓冲液过夜透析后浓缩并保存(-80℃)。
86.用12%sds-page验证tnf-α纳米抗体v7的分子量和纯度。
87.如图1a所示,孔道中为纯化后切除his标签后的tnf-α纳米抗体v7的蛋白,约为15kda。
88.实施例2
89.本发明通过mst实验检测了纯化的tnf-α纳米抗体v7对可溶性tnf-α(s-tnf-α)的亲和力,具体步骤为:
90.使用mst缓冲液(50mm hepes,100mm kcl,0.05% tween-20)配制100nm的tnf-α纳米抗体v7溶液。
91.使用pbst缓冲液制备10μm的人源或鼠源的tnf-α溶液。
92.tnf-α溶液的最高配体浓度为5μm,并按照16步梯度稀释法进行稀释,每个稀释系列样品的最终体积为10μl。
93.将10μl 100nm的tnf-α纳米抗体v7与各浓度梯度tnf-α样品混合并摇匀,室温孵育5min后将样品吸到毛细管中,并将毛细管放置于monolith nt.115仪器中进行检测。
94.如图1b所示,tnf-α纳米抗体v7及tnf-α纳米抗体v7和鼠源s-tnf-α的解离常数达到146nm。
95.实施例3
96.本发明所述的anx1的制备方法,包括如下步骤:
97.通过酶切和酶联反应将如seq id no.1所示的anx1基因导入pet28a载体,构建质粒;
98.将目的质粒转入bl21感受态细胞,转化后取适量菌液涂布在含有卡那霉素的lb平板上37℃过夜培养。
99.挑取阳性克隆在含卡那霉素的lb培养基中进行扩大培养,在15℃条件下加入5mm的iptg诱导20h。通过离心收取细胞沉淀,向体系中加入蛋白缓冲液,使用匀浆机破碎细胞,离心后收取上清液。通过柱层析进行分离纯化,具体操作步骤如tnf-α纳米抗体纯化过程,
制得重组anx1蛋白。
100.实施例4
101.本发明证明了tnf-α纳米抗体v7在10mg/kg的剂量下对3%葡聚糖硫酸钠(dss)诱导的急性结肠炎小鼠具有明显的治疗效果,具体步骤如下:
102.选用7-9周c57bl/6雌性小鼠(体重18~20g)进行模型诱导。空白对照组小鼠每日喂养正常饮用水,dss造模组和各给药治疗组小鼠自由饮用含有3%dss的饮用水,共诱导8天。
103.从造模第二天开始,小鼠腹腔注射1mg/kg,5mg/kg,10mg/kg tnf-α纳米抗体v7,给药周期为三天一次。
104.每天记录小鼠的体重和粪便隐血的情况。
105.如图2a所示,10mg/kg(18.40g
±
0.9959g,p=0.0304)和5mg/kg(18.15g
±
0.5949g,p=0.014)组的小鼠体重显著高于dss组(17.03g
±
2.443g),而1mg/kg(18.01g
±
1.674g,p=0.3397)组的小鼠体重无显著变化。如图2b所示,治疗后,与dss组相比,10mg/kg和5mg/kg组的结肠损伤更少。这表明在10mg/kg的剂量下,tnf-α纳米抗体v7对dss小鼠有良好的治疗效果,为tnf-α纳米抗体v7的最佳治疗剂量。
106.实施例5
107.本发明证明了tnf-α纳米抗体v7导致dss小鼠结肠th17细胞增加,具体步骤如下:
108.将小鼠脱颈处死后剖开腹腔,取结肠。
109.用棉签将结肠中残留的粪便排清,用pbs溶液冲洗结肠数次。
110.将结肠纵向剖开,翻转结肠使粘膜面向外置于盛有20ml(含1mmol/l dtt和1mmol/l edta的d-hank’s溶液)的锥形瓶中,37℃孵育1h。
111.将消化后的结肠剪碎放入盛有20ml胶原酶消化液(rpmi1640培养液+1mg/ml的胶原蛋白酶ⅰ)的锥形瓶中,37℃孵育1h。
112.将消化液经300目尼龙筛网过滤后,离心(300g,10min,4℃),弃上清,用rpmi1640培养液洗涤两次。
113.将细胞重悬于5ml 40% percoll,在离心管底部轻轻加入4ml 70% percoll,将细胞重悬液轻轻加入,使两层液体间形成清晰的液面,制成percoll梯度分离液,离心(600g,20min,25℃),收取40% percoll与70% percoll界面间的固有层淋巴细胞。
114.用rpmi1640培养液清洗3次,用1%bsa的pbs重悬细胞备用。
115.离心(250g,4min,4℃),弃上清,用1%bsa的pbs重悬细胞。加入cd4,il-17a抗体4℃孵育标记th17细胞,使用流式细胞仪进行分析。
116.如图3a所示,与dss小鼠(19.82%
±
2.06%)相比,tnf-α纳米抗体v7(10mg/kg)治疗后小鼠的肠道th17细胞显著增加(31.11%
±
2.787%)。
117.实施例6
118.本发明证明了tnf-α纳米抗体v7治疗中dss小鼠th17的增加与cd11c+dc细胞的吞噬相关,具体步骤如下:
119.取3% dss造模5天的小鼠,腹腔注射tnf-α纳米抗体v7-bfp(blue fluorescent protein)10mg/kg。
120.2小时后,提取小鼠结肠固有层淋巴细胞(lamina propria lymphocytes,lpl),加
入cd11c+,mhcii抗体4℃孵育标记,使用流式细胞仪进行分析。
121.如图3b所示,与pbs组相比,经过治疗后的小鼠结肠的cd11c
+
dc有明显的bfp荧光,并且伴随着mhcii的上调。这表明v7治疗过程中,tnf-α纳米抗体v7被吞噬进入cd11c
+
dc细胞中。
122.实施例7
123.本发明证明了tnf-α纳米抗体v7治疗中th17扩增与tnf-α纳米抗体v7-tnf-α复合体吞噬相关,具体步骤如下:
124.从3% dss造模5天的小鼠和wt小鼠中提取小鼠结肠固有层淋巴细胞。
125.对细胞进行以下三种处理:
126.①
用tnf-α纳米抗体v7(10μg/ml)刺激2h,加入cd4,il-17a抗体4℃孵育标记th17细胞,使用流式细胞仪进行分析。
127.②
用tnf-α纳米抗体v7-bfp(10μg/ml)刺激2h,加入cd11c
+
,mhcii抗体4℃孵育标记,使用流式细胞仪进行分析。
128.③
用tnf-α纳米抗体v7(10μg/ml)刺激2h,离心(250g,4min,4℃),弃上清,加入1ml预冷的trizol提取rna。使用逆转录试剂盒合成cdna。按试剂盒说明书方法避光配置qpcr反应体系,设定反应条件在仪器中扩增。
129.如图4a所示,tnf-α纳米抗体v7(10μg/ml)刺激使得dss小鼠结肠lpl中的th17细胞显著增加(tnf-α纳米抗体v7,17.66%
±
1.598%;pbs,29.34%
±
3.818%),而在wt小鼠中没有显著变化(tnf-α纳米抗体v7,7.567%
±
0.7021%;pbs,7.24%
±
2.01%)。
130.如图4b所示,来自dss结肠的bfp阳性cd11c
+
dc明显多于wt结肠的bfp阳性cd11c
+
dc(dss,36.8%
±
2.100%;wt,9.930%
±
1.601%)考虑到tnf-α在dss小鼠的结肠中高表达,tnf-α纳米抗体v7治疗后在dss小鼠结肠中形成tnf-α纳米抗体v7-tnf复合物的量也越多,这表明tnf-α纳米抗体v7-tnf复合物更可能是bfp阳性信号的来源。
131.如图4c所示,tnf-α纳米抗体v7刺激后,dss小鼠结肠的cd11c
+
dc中mhcii也上调,而wt小鼠结肠的cd11c
+
dc中mhcii不上调。
132.如图4d所示,在dss小鼠的lpl中,tnf-α纳米抗体v7(10μg/ml)刺激后,dss小鼠结肠中对抗原呈递至关重要的h2a、ciita和cd74显著上调。
133.实施例8
134.本发明证明了tnf-α纳米抗体v7-tnf-α抗原/抗体复合物可被cd11c
+
raw264.7吞噬,具体步骤如下:
135.raw264.7在6孔板(105个细胞/孔)中培养。
136.tnf-α纳米抗体v7-bfp(10μg)和tnf-α(2μg)在37℃下孵育1小时,形成tnf-α纳米抗体v7-tnf-α抗原/抗体复合物。
137.然后将复合物添加到raw264.7中,并在37℃下一起培养1h。
138.标记cd11c+抗体4℃孵育标记,使用流式细胞仪进行分析。
139.如图5b所示,tnf-α纳米抗体v7被吞噬后,在cd11c
+
cd11b
+
/cd11b-raw264.7中,呈bfp阳性;而单独tnf-α纳米抗体v7刺激raw264.7细胞中则没有(tnf-α纳米抗体v7-tnf-α抗原/抗体复合物,23.63%
±
1.960%,tnf-α纳米抗体v7,2327%
±
0.0832%,p《0.0001)。
140.实施例9
141.本发明证明了raw264.7吞噬tnf-α纳米抗体v7-tnf-α抗原/抗体复合物具有抗原呈递的特征,具体步骤如下:
142.raw264.7在6孔板(105个细胞/孔)中培养。
143.tnf-α纳米抗体v7-bfp和tnf-α在37℃下孵育1小时,形成tnf-α纳米抗体v7-tnf-α抗原/抗体复合物。
144.然后将复合物添加到raw264.7中,并在37℃下一起培养1h,构建了两种吞噬的复合物raw264.7(complex phagocytized raw264.7cells,cpr):
145.cpr-1:raw264.7吞噬复合物1(2μg tnf-α+10μg tnf-α纳米抗体v7)
146.cpr-2:raw264.7吞噬复合物2(6μg tnf-α+30μg tnf-α纳米抗体v7)
147.流式细胞仪分析tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr中bfp荧光;qrt-pcr测定抗原呈递相关因子的转录水平。
148.如图6a所示,随着复合物含量的增加,raw264.7吞噬的量显著增加(cpr-1,12.30%
±
5.499%;cpr-2,73.42%
±
3.73%,p《0.0001)。
149.如图6b所示,对于tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2,与raw264.7相比,mhcii、ciita、cd74和h2aa显著上调,这提示cpr-2具有抗原递呈特征。此外,与raw264.7相比,cpr-2刺中tgf-β和il-6也上调,tgf-β和il-6是刺激th17分化的细胞因子,这表明cpr-2可能会促进th17的生成。
150.实施例10
151.本发明证明了cpr使得wt小鼠结肠th17扩增,具体步骤如下:
152.从wt小鼠结肠分离lpl。
153.用raw264.7(105细胞)、cpr-1(105细胞)和cpr-2(105细胞)体外刺激2小时。
154.加入cd4,il-17a抗体4℃孵育标记th17细胞,使用流式细胞仪进行分析。定量qrt-pcr测定抗原呈递相关因子的转录水平。
155.如图7a所示,cpr-2和cpr-1均比raw264.7显著诱导th17细胞分化(cpr-2,15.46%
±
2.474%;cpr-1,9.183%
±
1.808%;raw264.7,5.277%
±
0.6799%)。然而,与pbs相比,肠道th17细胞对raw264.7刺激也有反应(2.797%
±
0.7223%)。
156.如图7b所示,tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr体外刺激lpl时,cpr-1和cpr-2组的rorα、rorγt、il-23和il-17a均较pbs组上调;而与pbs相比,raw264.7处理组中只有rorγt和il-17a上调。提示cpr在体外能显著诱导肠th17细胞分化。
157.实施例11
158.本发明证明了tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr使得wt小鼠肠系膜淋巴结中th17扩增,具体步骤如下:
159.取wt小鼠肠系膜淋巴结(mesenteric lymphocyte nodes,mln),用磨砂玻片研磨并用pbs冲洗收集。
160.通过300目尼龙网后,收集切除的mln。
161.用rpmi1640培养液清洗3次,用1%bsa的pbs重悬细胞备用。
162.以raw264.7(105细胞)、cpr-1(105细胞)和cpr-2(105细胞)进行体外刺激2小时。
163.冰上孵育cd4,il-17a抗体30min后,使用流式细胞仪进行检测。
164.如图8所示,raw264.7相比,tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2仍然
诱导th17细胞数量显著增加(cpr-2,35.18%
±
3.419%;raw264.7,19.78%
±
3.582%)。然而,比较cpr-1(cpr-1,22.02%
±
2.314%)和raw264.7诱导的th17细胞数量却发现没有显著变化。与pbs(13.29%
±
3.065%)相比,raw264.7没有显著诱导th17细胞分化。这表明体外cpr也可以诱导mln中的th17细胞,但与诱导肠lpl中th17细胞的生成并不完全相同。
165.实施例12
166.本发明证明了tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr通过mhcii在体外影响th17细胞,具体步骤如下:
167.使用genscript的sirna设计中心合成了对应于编码区(5
′‑
aagagaatcgaactcactcag-3
′
)的小鼠ciita sirna。
168.并将小鼠ciita sirna编码dna经bamh1和hindiii限制性酶插入prnau6.1/neo。
169.将重组prnau6.1/neo-ciita转化到dh5α细胞中。
170.将2
×
105raw264.7细胞接种在6孔板的每个孔中。
171.将2μg dna和4μl lipofectamine 2000的复合物37℃孵育15min转染细胞。
172.转染后48小时,收集细胞,并通过qrt-pcr分析验证ciita的表达。
173.如图9a所示,将shrna干扰质粒转染raw264.7后,mhcii的表达有着极显著的下调。如图9b所示,而在δciita-raw264.7吞噬复合物2(cpr2)后所形成的δciita-cpr-2中,tgf-β和il-6的表达均有极显著下调。
174.取wt小鼠的lpl和mln细胞,用δciita-cpr-2(105细胞)和cpr-2(105细胞)体外刺激2h。
175.冰上孵育cd4,il-17a抗体30min后,使用流式细胞仪进行检测。
176.如图10a所示,与δciita-cpr-2(6.050%
±
0.5507%)相比,cpr-2(10.60%
±
0.1572%)诱导了更多的肠道th17细胞。如图10b所示,与δciita-cpr-2(6.003%
±
0.9445%)相比,cpr-2诱导mln的th17细胞更多(10.25%
±
0.9305%)。因此,cpr可以诱导mln和肠道th17细胞,这一过程依赖于mhcii。
177.实施例13
178.本发明证明了tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2显著上调结肠中的anx1,具体步骤如下:
179.取wt小鼠的lpl,用δciita-cpr-2(105细胞)和cpr-2(105细胞)体外刺激2h。
180.通过qrt-pcr分析验证anx1的表达。
181.如图11a所示,与δciita-cpr-2相比,cpr-2显著上调结肠中的anx1,而与raw264.7和pbs处理相比,未发现显著变化。此外,与pbs相比,δciita-cpr-2中anx1的表达也没有显著变化。这一趋势与cpr-2刺激下的肠道th17细胞一致,表明anx1和th17细胞之间存在相关性。
182.取wt小鼠的结肠lpl和mln,用cpr-2(105细胞)刺激2小时。
183.用1%多聚甲醛固定1小时。
184.用anx1-mcherry标记固定细胞,并通过流式细胞仪进行分析。
185.如图11b所示,经过tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2刺激后来自结肠和mln的细胞均能与anx1呈阳性结合。这表明cpr-2治疗后anx1结合受体上调。
186.实施例14
187.本发明证明了anx1激活fpr2,具体步骤如下:
188.取wt小鼠的结肠lpl和mln。
189.用tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2(105细胞),anx1(1μg/ml),wrw4(10μg/ml)刺激2小时。
190.通过qrt-pcr分析验证fpr1,fpr2,fpr3的表达。
191.如图12a所示,与tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2单独刺激相比,fpr2与anx1和cpr-2共同刺激lpl时表现出显著的上调。这表明fpr2在th17细胞分化过程中被anx1激活。如图12b所示,在anx1和cpr-2共同刺激的结肠lpl中,wrw4(10μg/ml)显著下调fpr2。
192.实施例15
193.本发明证明了anx1通过fpr2抑制tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr诱导的th17细胞分化,具体步骤如下:
194.取wt小鼠的结肠lpl和mln。
195.用tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2(105细胞),anx1(1μg/ml),wrw4(10μg/ml)刺激2小时。
196.冰上孵育cd4,il-17a抗体30min后,使用流式细胞仪进行检测。
197.如图13所示,anx1能显著抑制cpr-2诱导的肠th17细胞分化(cpr-2,32.46%
±
2.622%;cpr-2+anx1,16.72%
±
1.425%);而在mln中,由cpr-2诱导的分化th17细胞也被anx1抑制(cpr-2,30.43%
±
1.218%;cpr-2+anx1,9.22%
±
1.255%)。此外,wrw4(结肠:cpr-2+anx1+wrw4,37.49%
±
7.253%;mln:cpr-2+anx1+wrw4,22.31%
±
0.8600%。这些结果表明,anx1可激活fpr2,并抑制cpr诱导的th17细胞分化。
198.实施例16
199.本发明证明了tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2通过stat3途径介导th17分化,具体步骤如下:
200.取wt小鼠的结肠lpl。
201.用tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2(105细胞),anx1(1μg/ml),anx1(0.5μg/ml),wrw4(10μg/ml)刺激2小时。
202.通过western blot检测stat3和p-stat3的表达。
203.采用qrt-pcr检测其中socs3、rorγt、il-17a、il-17f和il-23的表达。
204.如图14a所示,与pbs处理相比,cpr-2刺激使得stat3的磷酸化水平上调;加入anx1后,p-stat3的表达降低并且呈现出剂量依赖性;与anx1和cpr-2治疗组相比,添加cpr-2后,p-stat3的表达增加。
205.如图14b所示,与tnf-α纳米抗体v7-tnf-α抗原/抗体复合物cpr-2治疗组相比,anx1治疗组socs3、rorγt、il-17a和il-23表达下调;添加wrw4后,socs3、rorγt、il-17a和il-23的表达显著上调。这些结果表明,cpr-2和frp2诱导的th17细胞分化的调节是通过stat3途径介导的。
206.试验例1
207.本发明证明了anx1在对dss诱导的结肠炎有治疗效果,具体步骤如下:
208.选用7-9周c57bl/6雌性小鼠(体重18~20g)进行模型诱导。空白对照组小鼠每日
喂养正常饮用水,dss造模组和各给药治疗组小鼠自由饮用含有3%dss的饮用水,共诱导8天。
209.从造模第二天开始,小鼠腹腔注射anx1 100μg/kg,500μg/kg,2mg/kg,给药周期为三天一次。
210.每天记录小鼠的体重和粪便隐血的情况。
211.如图15所示,500μg/kg组的结肠长度和体重与对照组更接近,且明显高于dss组,表明在500μg/kg的剂量下,anx1对dss诱导的结肠炎有一定的治疗效果,为最佳治疗剂量。
212.本发明证明了tnf-α纳米抗体v7(10mg/kg)抗体与anx1(500μg/kg)联用,可以提高tnf-α纳米抗体v7对dss小鼠结肠炎的治疗效果,具体步骤如下:
213.选用7-9周c57bl/6雌性小鼠(体重18~20g)进行模型诱导。空白对照组小鼠每日喂养正常饮用水,dss造模组和各给药治疗组小鼠自由饮用含有3%dss的饮用水,共诱导11天。
214.从造模第二天开始,小鼠腹腔注射anx1(500μg/kg)和tnf-α纳米抗体v7(10mg/kg)给药周期为三天一次。
215.每天记录小鼠的体重和粪便隐血的情况。
216.如图16a所示,在第11天,联合治疗组小鼠的体重显著高于dss小鼠和tnf-α纳米抗体v7治疗组小鼠(tnf-α纳米抗体v7+anx1,19.62g
±
0.4729g;dss组,15.12g
±
1.294g,p=0.0012;tnf-α纳米抗体v7,18.77g
±
1.038g,p=0.0328);而anx1处理的小鼠之间没有显著变化(anx1,18.59g
±
1.274g,p=0.05024)。
217.如图16b所示,对于结肠长度的宏观分析,anx1/tnf-α纳米抗体v7处理的结肠明显长于dss小鼠和anx1处理的小鼠(tnf-α纳米抗体v7+anx1,6.2cm
±
0.5cm与dss组相比,p=0.0057;anx1,5.367cm
±
0.1155cm,p=0.0482);而tnf-α纳米抗体v7处理的小鼠之间没有显著变化(v7,5.3cm
±
0.4359cm,p=0.0785)。
218.如图16c所示,在第7天,在dss、tnf-α纳米抗体v7和anx1中观察到明显的肛门出血,而在anx1/v7处理的小鼠中没有观察到。
219.如图16d所示,结合体重减轻百分比、粪便血液和粪便粘度,计算疾病活动指数(dai)[35]。anx1/v7的dai显著低于dss、tnf-α纳米抗体v7和anx1处理的小鼠(anx1/v7,1.175
±
0.1667与dss相比,4.00
±
0.00,p《0.0001;tnf-α纳米抗体v7,2.583
±
0.631,p=0.032,anx1,2.083
±
0.1667,p=0.046)。这表明,与单独使用v7或anx1治疗相比,tnf-α纳米抗体v7和anx1联合使用可具有明显提高的dss诱导的结肠炎的治疗效果。
[0220]
试验例2
[0221]
本发明证明了anx1(500μg/kg)减少了tnf-α纳米抗体v7(10mg/kg)抗体治疗dss小鼠时th17的扩增,具体步骤如下:
[0222]
选用7-9周c57bl/6雌性小鼠(体重18~20g)进行模型诱导。空白对照组小鼠每日喂养正常饮用水,dss造模组和各给药治疗组小鼠自由饮用含有3%dss的饮用水,共诱导11天。
[0223]
从造模第二天开始,小鼠腹腔注射anx1(500μg/kg)和tnf-α纳米抗体v7(10mg/kg)给药周期为三天一次。
[0224]
取小鼠的lpl和mln。
[0225]
冰上孵育cd4,il-17a抗体30min后,使用流式细胞仪进行检测。
[0226]
如图17所示,在结肠lpl和mln中,tnf-α纳米抗体v7处理的小鼠的th17细胞显著低于anx1/tnf-α纳米抗体v7处理的小鼠(mln:tnf-α纳米抗体v7/anx1,5.93%
±
0.2883%与tnf-α纳米抗体v7相比,8.923%
±
1.25%,p=0.0156;结肠:tnf-α纳米抗体v7/anx1,4.963%
±
0.9839%与tnf-α纳米抗体v7相比,11.87%
±
1.344%,p=0.0002)。这表明,与anti-tnf单药治疗相比,联合anx1治疗对th17细胞分化具有更好的疗效。
[0227]
试验例3
[0228]
本发明证明了anx1(500μg/kg)可通过fpr2-stat3通路抑制tnf-α纳米抗体v7(10mg/kg)处理引起的th17细胞分化,具体步骤如下:
[0229]
选用7-9周c57bl/6雌性小鼠(体重18~20g)进行模型诱导。空白对照组小鼠每日喂养正常饮用水,dss造模组和各给药治疗组小鼠自由饮用含有3%dss的饮用水,共诱导11天。
[0230]
从造模第二天开始,小鼠腹腔注射anx1(500μg/kg)和tnf-α纳米抗体v7(10mg/kg)给药周期为三天一次。
[0231]
通过western blot检测stat3和p-stat3的表达。
[0232]
通过qrt-pcr分析验证fpr2的表达。
[0233]
如图18a所示,与tnf-α纳米抗体v7或anx1处理的小鼠相比,tnf-α纳米抗体v7/anx1组fpr2的表达显著上调。如图18b所示,tnf-α纳米抗体v7组中stat3的磷酸化水平明显高于dss组。anx1/tnf-α纳米抗体v7组的p-stat3水平明显低于tnf-α纳米抗体v7组和anx1组。这些结果表明anx1可通过fpr2-stat3通路抑制tnf-α纳米抗体v7治疗引起的th17细胞分化。
[0234]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1