一种靶向改造Expi293细胞外泌体递送siMMP13的方法
一种靶向改造expi293细胞外泌体递送simmp13的方法
技术领域
1.本发明涉及一种外泌体靶向改造的方法,具体而言,是一种靶向改造expi293细胞外泌体递送simmp13的方法。
背景技术:
2.外泌体是一种可由多种细胞分泌的膜性小泡,其直径在30-150nm之间,内容物为多种非编码rna,蛋白和核酸等,通过与受体细胞结合释放内容物发挥不同的生物学功能。外泌体在体内性质稳定且半衰期长,可以穿越生物屏障到达靶细胞,以不同的方式被受体细胞摄取,作为生物标志物或药物运输载体发挥作用,亦可与传统的病毒载体结合使用,形成一种功能更强的基因治疗工具。作为外泌体的供体细胞,expi293细胞增殖周期短,可无血清高密度悬浮培养,能够大量稳定提供外泌体以满足临床试验的需要。
3.基质金属蛋白酶13(mmp13)是ⅱ型胶原蛋白裂解的关键酶,参与软骨降解的主要分解代谢因子。使用针对mmp13的sirna进行关节组织原位注射,减少了关节组织中mmp13蛋白的产生和促炎基因表达,从而抑制了关节软骨退化和骨赘的形成,达到治疗骨关节炎的效果。
4.cn113018265a提供了一种靶向外泌体包裹mirna-140在治疗骨关节炎药物中的方法。其通过将cap-lamp2b重组质粒转染进小鼠树枝状细胞以得到靶向软骨的外泌体,并通过电穿孔方法将mirna-140包裹到靶向外泌体中。然而,细胞工程获得的靶向外泌体,对细胞培养技术、设备要求高,制作工序繁多,耗时较长。cn113274421a公开了一种膝关节治疗用抗炎型外泌体制剂及制备方法和应用。然而体外培养的脂肪间充质干细胞发生衰老或分化时,由此而来的外泌体也会发生相应的功能降低。此外,贴壁细胞的培养成本高,外泌体的产量低,且存在细胞培养过程中血清污染的可能。
技术实现要素:
5.基于上述背景技术,本发明所要解决的技术问题在于提供一种靶向改造expi293细胞外泌体递送simmp13的方法,即利用二硬脂酰磷脂酰乙醇胺(dspe)作为一种脂质可以插入外泌体的脂双层膜中的性质,把亲和肽(cap)脂质多肽插入到外泌体膜表面,建立一种expi293细胞外泌体体系,使其具有软骨靶向递送作用。
6.本发明第一方面提供一种靶向改造expi293细胞外泌体的方法,所述方法包括如下步骤:
7.(1)制备dspe-cap:连接dspe和对软骨细胞具有靶向作用的亲和肽cap;
8.(2)制备靶向软骨细胞的外泌体dspe-cap-exo:将expi293细胞外泌体与步骤(1)所述dspe-cap孵育,收集靶向软骨细胞的外泌体dspe-cap-exo组分。
9.所述亲和肽cap具有如dwrviipprpsac所示的序列。
10.优选地,在步骤(1)之前还可包括步骤(a)expi293细胞外泌体提取及表征;
11.优选地,所述步骤(a)具体包括:从expi293细胞获取expi293细胞外泌体;
12.优选地,步骤(2)具体包括:将expi293细胞外泌体与步骤(1)所述dspe-cap孵育,通过sec柱子去掉未结合到外泌体膜上的dspe-cap多肽,收集4-12组分的液体得到靶向软骨细胞的外泌体;
13.优选地,所述孵育的ph为7-9,更优选为8;
14.优选地,所述孵育的温度为4℃-40℃,更优选为25-30℃;
15.优选地,所述孵育的时间为10分钟至16小时;
16.优选地,所述孵育为4℃,16小时或所述孵育为30℃,30分钟。
17.本发明第二方面提供一种靶向软骨细胞的外泌体dspe-cap-exo,其根据第一方面所述的靶向改造expi293细胞外泌体的方法所制备。
18.本发明第三方面提供一种靶向软骨细胞并敲低mmp13的外泌体的构建方法,所述方法包括将靶向mmp13的sirna电转进第二方面所述的靶向软骨细胞的外泌体dspe-cap-exo,使sirna加载到外泌体上。
19.优选地,将外泌体dspe-cap-exo加入到电转缓冲液中,同时加入simmp13,混匀,电转;然后通过sec柱子去掉未加载到外泌体的游离simmp13,收集4-12组分,得到负载simmp13的外泌体。
20.优选地,所述电转缓冲液为1mm edta;
21.优选地,采用genepulser xcell电转仪(biorad),电转电压参数设置为450v和120ms;
22.优选地,在电穿孔过程中形成的外泌体聚集体可以通过移液枪强力吹打,之后放到22℃静置2h。
23.本发明第四方面提供一种靶向软骨细胞并敲低mmp13的外泌体dspe-cap-exo/simmp13,其根据权利要求第三方面所述的外泌体的构建方法所制备。
24.本发明第五方面提供如第二方面所述的靶向软骨细胞的外泌体dspe-cap-exo或如第四方面所述的靶向软骨细胞并敲低mmp13的外泌体dspe-cap-exo/simmp13在制备治疗骨关节炎的药物中的用途。
25.本发明第六方面提供一种用于治疗骨关节炎的药物组合物,其包含如第二方面所述的靶向软骨细胞的外泌体dspe-cap-exo或如第四方面所述的靶向软骨细胞并敲低mmp13的外泌体dspe-cap-exo/simmp13。
26.与现有技术相比,本发明的有益效果是:本发明实现了sirna药物的治疗潜力,高效、靶向的递送药物用于治疗骨性关节炎;本发明中的expi293细胞适应于无血清高密度悬浮培养,可进行外泌体大规模、标准化生产,从源头上解决了外泌体的批次差异;相较于基因工程方法改造细胞获得的靶向外泌体,本发明中使用的dspe将外泌体与靶向肽进行偶联的方法简单,靶向肽的装载效率高,生物安全性高;本发明的外泌体可用于治疗骨关节炎,能显著抑制mmp13表达,减缓骨关节炎动物模型的软骨损伤过程,起到软骨保护作用,对骨关节炎治疗具有积极作用。
附图说明
27.图1为化学改造方法构建新型的expi293细胞外泌体递送体系流程图;
28.图2为expi293细胞外泌体靶向递送体系的鉴定及表征图:(a)western blot检测
expi293细胞外泌体改造后相关蛋白表达情况(b)纳米粒径分析仪检测expi293细胞外泌体改造前后粒径(c)电镜鉴定expi293细胞外泌体改造前后形态;
29.图3为dspe-cap-exo靶向软骨细胞效率图;
30.图4为软骨细胞中simmp13敲低效果评价图;
31.图5为dspe-cap-exo靶向递送simmp13至软骨细胞效率和敲低效果图;
32.图6为体外构建骨关节炎并评价dspe-cap-exo-simmp13效果图;
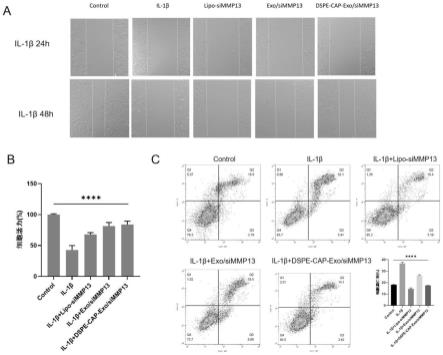
33.图7为载药外泌体对细胞表型影响效果图;
34.图8为dspe-cap-exo的体内代谢评价图;
35.图9为dspe-cap-exo的组织靶向效果评价图;
36.图10为dspe-cap-exo的内脏器官(心肝脾肺肾)he染色图;
37.图11为dspe-cap-exo肝肾生化测定图;
38.图12为dspe-cap-exo/simmp13的体内治疗效果图。
具体实施方式
39.为了加深对本发明的理解,下面将结合实施例对本发明做进一步详细描述,该实施例仅用于解释本发明,并不对保护范围构成限定。所用的仪器设备、耗材和试剂除特别说明以外,均为市售商品化产品。
40.为了加深对本发明的理解,下面将结合实施例对本发明做进一步详细描述,该实施例仅用于解释本发明,并不对保护范围构成限定。所用的仪器设备、耗材和试剂除特别说明以外,均为市售商品化产品。
41.实施例1
42.第一步:expi293外泌体的获得
43.expi293细胞以1e+06个/ml接种到250ml的培养瓶中,当密度达到4e+06个/ml时,收集上清。在4℃下离心500g 10min以去除细胞沉淀。收集上清,4℃3000g 20min以去除细胞碎片。收集上清,4℃10000g 30min,收集上清并通过0.22um滤膜。过滤后的上清在4℃130000g 70min条件离心,去掉上清。底部白色沉淀中加入36ml pbs混匀,在4℃130000g 70min条件离心,弃上清,用500ul左右pbs重悬获得外泌体,收集置于-80℃冰箱备用。
44.第二步:expi293外泌体的软骨靶向性改造,获得dspe-cap-exo
45.首先,称取5mg dspe-peg-mal(购自merk公司),加入200ul无水乙醇使其溶解;同时用1ml ph值为6.8~7.4的tris
·
hcl溶解cap-csy肽(dwrviipprpsac,南京肽业公司合成),将其加入dspe溶液中,用tris
·
hcl溶液将体系补齐至5ml,锡纸包裹反应管置于摇床之上混匀过夜。次日,将溶液转移至透析膜中,用皮筋绑紧透析膜两端,确认无误后将其放入装有2l去离子水和适量无水乙醇的大烧杯中,将烧杯置于磁力搅拌器上搅拌过夜,得到dspe-cap多肽。
46.其次,将100ug纯化的外泌体与dspe-cap多肽(0.23ug/ml)在37℃下孵育30min,通过sec柱子去掉未结合到外泌体膜上的dspe-cap多肽,收集4-12组分,得到dspe-cap多肽修饰的软骨靶向外泌体(dspe-cap-exo)。
47.实施例2
48.实验过程:(a)western blot检测expi293细胞外泌体改造后相关蛋白表达情况
49.在expi293细胞或expi293细胞外泌体加入100ul的sds-page蛋白上样缓冲液(1x)(biosharp),短暂涡旋震荡后,在95℃条件下加热10min使蛋白质裂解。使用nano drop测定来自细胞及外泌体提取的蛋白质浓度。取expi293细胞及其外泌体的蛋白裂解物(20μg),在各泳道加入蛋白marker和蛋白样品,利用15%的bis-tris凝胶(bio-rad)分离蛋白,190v恒压电泳60min。随后将蛋白胶电转移到0.2-μm pvdf(milipore)膜上,275ma恒流转膜70min。加入1%bsa封闭,室温摇床孵育1小时,然后在4℃在1%bsa封闭缓冲液中稀释的一抗中孵育过夜。使用的一抗如下:anti-cd9(ab134045,abcam)、anti-cd81(ab92726,abcam)、anti-hsp70(ab9485,abcam)、anti-calnexin antibody。之后,在1xtbst中漂洗6次,每次5min,然后将pvdf膜放入1%bsa稀释的二抗中,室温孵育1小时。孵育结束后在室温(rt)下,用1xtbst漂洗6次,每次5min,加入显影液进行曝光。如图2a所示,wb检测了cd9,cd81,hsp70,canx在expi293细胞和expi293细胞外泌体中的表达。
50.(b)纳米粒径分析仪检测expi293细胞外泌体改造前后粒径。
51.nanocoulter仪器用于检测纳米囊泡。对于每个样本,测试前检测稀释液的颗粒个数,60s的粒子记录个数少于5个,对外泌体进行稀释后,取200ul加入检测孔中,记录100个粒子的大小。结果如图2b所示,与exo相比,工程化外泌体dspe-cap-exo直径略大。
52.(c)电镜检测外泌体改造前后形态。
53.1%戊二醛固定外泌体,将5-10ul外泌体溶液滴加到铜网上,室温吸附10min左右,用滤纸小心吸去多余的液体。然后向铜网上滴加10ul 2%的磷钨酸溶液(ph=6.5),在室温下对外泌体染色处理2min,小心用滤纸吸去多余的染色液,将铜网在室温下晾干。通过tem(fei,hillsboro,or,usa)成像,观察电压为120kv。图2c显示了exo和dspe-cap-exo的代表性透射电镜图像。
54.实施例3
55.实验过程:通过体外实验验证所获得的软骨靶向的外泌体(dspe-cap-exo)靶向效应,体外细胞实验采用dii标记的外泌体,比较cap靶向的外泌体(dspe-cap-exo)与非靶向外泌体(exo)对软骨细胞的亲和效应。具体步骤如下:
56.将expi293细胞分离获得的外泌体(exo)/具有软骨靶向的外泌体(dspe-cap-exo)与1mm的dii染料按照体积比400:1在37
°
避光孵育30min,sec柱子去掉游离未结合的染料,得到dii标记的外泌体。
57.12孔板底部铺好细胞爬片,每孔加入8w个大鼠软骨细胞,37℃培养箱静置过夜。取20ug exo/dspe-cap-exo加入到12孔板中,分别在6,8,12h,弃去细胞培养基。pbs洗涤3遍,4%多聚甲醛固定20min。pbs洗3遍,加入500ul dmem并滴一滴hochest染色,37℃孵育30min。滴一滴抗猝灭试剂在载玻片上,固定爬片,使用共聚焦fv1000检测细胞摄取外泌体的效率。结果如图3所示,在dspe-cap-exo处理组中,观察到显著的dii信号,而在exo处理组中观察到少量的dii信号,表明cap序列可以更高效地引导外泌体特异性结合并进入软骨细胞中。
58.实施例4
59.体外实验验证simmp13对大鼠软骨细胞中mmp13的的敲低效果。
60.第一步:将大鼠软骨细胞消化下来制备成单细胞悬液并计数,按6w细胞/孔种于12孔板中,当细胞融合度达到50%-70%进行转染。
61.第二步:配置simmp13-lipofectamine 2000复合物,如下:
62.a:分别将2.5ul,5ul,7.5ul的simmp13(20um)加进100μl无血清无双抗的dmem培养基中,轻轻混匀;
63.b:将2μl lipofectamine 2000(invitrogen)加进100μl无血清无双抗的dmem培养基中,轻轻混匀室温孵育5分钟;
64.c:将a液加进b液体中,轻轻吹打混匀(共200ul),室温孵育20分钟。
65.第三步:去除皿中旧培养基,pbs洗2遍,更换含10%胎牛血清的无双抗dmem培养基,每孔1ml;
66.第四步:每孔均匀滴加200μl simmp13-lipofectamine 2000复合物(即ab混合液),轻轻摇匀;
67.第五步:使用trizol试剂(invitrogen)提取细胞中总rna,将rna定量到1ug进行逆转录(南京诺维赞生物科技股份有限公司,mr101-02),采用2xuniversal sybr green fast qpcr mix(abclonal,rm21203),以gapdh为内对照,采用2-δδct法计算rna相对表达量,定量mrna的表达。结果所示,我们所筛选的simmp13序列可起到较好的敲低效果(图4)。
68.实施例5
69.通过体外实验验证所获得的simmp13在软骨细胞的靶向递送和细胞内功能。体外细胞实验采用fam标记simmp13和dii标记的外泌体,探讨实施例1获得的软骨细胞靶向外泌体(dspe-cap-exo)是否将simmp13更有效递送到软骨细胞中,同时检测递送的simmp13是否在软骨细胞中发挥功能。具体步骤如下:
70.将实施例1获得的外泌体dspe-cap-exo和exo通过电转负载fam标记simmp13,将外泌体加入100ul电转缓冲液(1mm edta),同时加入2ug的simmp13,轻柔和混匀,放于100ul电击管中,采用genepulser xcell电转仪(biorad),电转电压参数设置为450v和120ms,电击一次。立即放入冰上5min,在电穿孔过程中形成的外泌体聚集体可以通过移液枪强力吹打,之后放到22℃静置2h。通过sec柱子去掉未加载到外泌体的游离simmp13,收集4-12组分,得到负载simmp13的外泌体(dspe-cap-exo/simmp13和exo/simmp13)。
71.12孔板底部铺好细胞爬片,每孔加入8w个大鼠软骨细胞,37℃培养箱静置过夜。将制备好的dspe-cap-exo/simmp13和exo/simmp13加入到细胞中,分别在4h,6h,弃去细胞培养基。pbs洗涤3遍,4%多聚甲醛固定20min。pbs洗3遍,加入500ul dmem并滴一滴hochest染色,37℃孵育30min。滴一滴抗猝灭试剂在载玻片上,固定爬片,使用共聚焦fv1000检测细胞摄取外泌体的效率。实验结果如图5a所示,在dspe-cap-exo/simmp13处理组中,可以观察到显著的fam和dii信号,而在exo/simmp13处理组中则很少。且两种信号存在重叠,提示软骨细胞中si-mmp13和外泌体共定位。
72.接下来,我们检测软骨细胞中递送的simmp13是否发挥功能。按每孔1.5
×
105细胞种于6孔板中,37℃培养箱静置过夜。将制备好的dspe-cap-exo/simmp13和exo/simmp13加入到细胞中,24小时后收rna,rt-qpcr检测mmp13基因表达水平;48小时后收蛋白检测mmp13蛋白表达水平。如图5b和5c所示,dspe-cap-exo/simmp13组处理能够使细胞内mmp13水平有效降低。相比之下,无靶向作用的外泌体exo/simmp13处理组敲低mmp13的效率较低。
73.本研究所设计sirna序列和qpcr所需引物序列
[0074][0075][0076]
实施例6
[0077]
体外诱导骨关节炎模型,探讨实施例5制备的dspe-cap-exo/simmp13在体外模型基础上敲低mmp13的效果。
[0078]
取大鼠软骨细胞,按照8e+04个细胞/孔铺板,用50ng/ml的rat-il-1β(sinobiological)处理细胞,24h后检测mmp13,col2a1和aggrecan基因表达。实验结果显示,il-1β处理细胞后,col2a1,aggrecan基因表达量降低,mmp13基因表达量升高,同时cck8结果显示,il-1β处理软骨细胞后,细胞活力降低,均证实体外骨关节炎模型(oa)构建成功(图6a和6b)。在体外oa模型构建成功的基础上,将制备好的dspe-cap-exo/simmp13和exo/simmp13加入到细胞中,qpcr结合wb检测mmp13敲低效果,结果显示,在体外oa模型诱导成功的基础上,与exo/simmp13相比,dspe-cap-exo/simmp13组处理能够更有效降低软骨细胞中mmp13表达(图6c和6d)。
[0079]
实施例7
[0080]
通过体外实验,探讨实施例5制备的dspe-cap-exo/simmp13的细胞毒性和其改善炎症细胞的功能。实验过程:取大鼠软骨细胞,按照8e+04个细胞/孔铺板,50ng/ml的rat-il-1β(sinobiological)处理24h后,将制备好的dspe-cap-exo/simmp13和exo/simmp13与软骨细胞共培养24h,检测对软骨细胞的细胞表型影响,结果如图7a-c所示,il-1β处理软骨细胞后,细胞迁移能力和细胞活力下降,细胞凋亡水平增加。然而,通过dspe-cap-exo/simmp13和exo/simmp13与软骨细胞共培养后,可以有效逆转这种作用。同时,相比于lipo处理组,dspe-cap-exo/simmp13和exo/simmp13处理组对细胞毒性较小,可以更有效恢复细胞的迁移能力和细胞活力。
[0081]
实施例8
[0082]
实验过程:通过体内实验验证dspe-cap-exo的靶向效应。体内实验采用dir标记的dspe-cap-exo,dir是一种荧光染料,可突出外泌体的脂质膜。通过关节内注射,将dir标记的dspe-cap-exo注射到大鼠关节,并在给药后4h,d1,d2,d3,d4,d5,d6通过动物活体成像监测其在大鼠体内的分布情况。dir的荧光信号表明,在关节腔原位注射后,没有cap的exo显示出更广泛的分布并扩散到身体的其他部位。d6后检查主要器官exo除了在关节腔中,在肾脏中也有富集。而dspe-cap-exo都保留在关节腔中。因此,软骨细胞靶向性限制了关节腔内注射后标记的外泌体,而不会明显扩散到其他器官,显示了在临床试验中靶向递送的效果(图7,图8)。大鼠在d6天后被解剖,he染色显示dir、cap、dir+exo、dspe-cap-exo对主要器官无毒(图9),血生化检测不同处理组对大鼠肾功能没有影响,对肝功能有轻微损伤(图10)。
[0083]
实施例9
[0084]
dspe-cap-exo/simmp13动物实验效果评价。将实施例5获得的dspe-cap-exo/simmp13进行关节炎动物模型的骨关节腔注射。其中,关于关节炎动物模型,本项目选用6周龄sd大鼠,采用内侧半月板不稳定(dmm)手术造模构建膝关节oa模型。由于dmm的手术模型已成为研究创伤后骨关节炎(oa)发病和进展的金标准,我们采用了该模型并开发了oa大鼠。
[0085]
dmm手术方法:
[0086]
无菌条件下,膝关节内侧入路,髌骨与胫骨平台内侧2mm做5mm纵行切口,钝性分离皮下肌肉及软组织,眼科剪剪开关节囊。钝性分离髌下脂肪垫。髌骨脱位后,肉眼可直视内侧半月板胫骨韧带,显微手术刀离断内侧半月板胫骨韧带,生理盐水冲洗关节腔,复位髌骨,对损伤韧带进行缝合修补,后关闭关节囊,逐层缝合关节囊,肌肉,筋膜,皮肤。
[0087]
oa治疗效果检测:组织切片检测软骨缺损情况。dmm手术两周后,将pbs、exo/simmp13、dspe-cap-exo/simmp13分别经膝关节注射入骨关节炎模型大鼠关节腔,药物注射四周后,二氧化碳安乐处死大鼠,取双侧膝关节,4%多聚甲醛固定48小时后,样品置于edta碱性溶液中脱钙两个月。样品经脱水,包埋,切片后行h&e染色,甲苯胺蓝染色和番红固绿染色。结果提示与pbs、exo/simmp13相比,dspe-cap-exo/simmp13有更好的治疗oa效果(见图12)。
[0088]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1