鼻内肾上腺素制剂及治疗疾病的方法与流程
发明领域本文描述了鼻内(in)肾上腺素制剂和使用这样的制剂治疗病况或疾病的方法。发明背景过敏反应是一种医疗紧急情况,可能需要复苏措施,如气道管理、补充供氧、大量静脉输液和密切监测。施用肾上腺素是治疗的选择。需要给予肾上腺素的无针且非侵入性方法。本文提供了用于治疗过敏反应和其他病况的方法、制剂和装置。
背景技术:
技术实现思路
1、本文公开了方法、肾上腺素的药物制剂及其用于治疗诸如1型超敏反应(全身变态反应)、哮喘和心脏停搏等病况的方法。
2、过敏反应是严重的、可能危及生命的1型超敏反应(全身变态反应),其影响许多身体系统,通常在静脉内暴露于抗原后的平均约5至30分钟以及在口腔暴露后约2小时快速发作。过敏反应是由从肥大细胞和嗜碱性粒细胞释放的炎症介质和细胞因子引起,该释放通常是由于免疫反应,但有时是由于非免疫机制。最常见的受影响身体区域包括:皮肤(80-90%)、呼吸道(70%)、胃肠道(30-45%)、心脏和脉管系统(10-45%)以及中枢神经系统(10-15%),通常单次发作涉及两个或更多个区域。
3、过敏反应是一种医疗紧急情况,可能需要复苏措施,如气道管理、补充供氧、大量静脉输液和密切监测。施用肾上腺素是治疗的选择,抗组胺剂和类固醇(例如,地塞米松)常用作辅助剂。由于担心两阶段过敏反应,在人恢复正常后通常需要2至24小时的院内观察期。
4、肾上腺素(肾上腺素,(r)-4-(1-羟基-2-(甲氨基)乙基)苯-1,2-二醇)是过敏反应的主要治疗方法,对其使用没有绝对的禁忌症。目前,肾上腺素作为通过注射给予的溶液进行施用,优选地,一旦怀疑有过敏反应,立即注射到大腿前外侧中部。如果响应不充分,则可每5至15分钟重复注射。16-35%的发作需要第二次给药,但很少需要超过两次给药。肌内途径优于皮下施用,因为后者可能具有延迟的肾上腺素吸收。然而,尽管仅报告了由肾上腺素导致的轻微不良反应(震颤、焦虑、头痛和心悸),但已有许多报告称,注射产品的暴露是高度可变的,取决于注射的位置(肌内或皮下),以及其他因素如体重指数(bmi)。
5、医学界中非常需要开发将会有助于改善在院外环境下临床管理过敏反应的产品。虽然肾上腺素在通过肌内注射递送时是有效的,但公开的证据表明,药代动力学是高度可变的,取决于注射部位(肌内或皮下)。采用复杂技术的经批准的自动注射器也存在显著的产品质量问题,导致美国fda对这些产品进行了许多次召回。肾上腺素自动注射器如还难以携带,并且需要训练和时间才能在可能危及生命的情况下适当地施用。
6、对用于给予肾上腺素的替代、无针且非侵入性的方法的需求是显而易见的,因为许多患者害怕注射并因此不愿意使用任何种类的自动注射器。此外,自动注射器大且沉,因此许多有需要的患者没有一直携带肾上腺素注射器。在公共环境中不愿意自行施用剂量也是显而易见的。
7、因此,需要在紧急情况下给予肾上腺素的改进或替代的方法,以及改进或替代的制剂和装置。期望的改进单独地和组合地包括:方便(鼻内与肌内),更快速施用,更可靠,更一致的剂量,无针,更分立以在公共场合给药,以及可由未经训练的个体或非专业人员施用。
8、因此,本文提供了用于治疗过敏反应和其他病况的方法、制剂和装置,包括使用小型压缩单位剂量喷雾装置来施用肾上腺素的鼻内制剂。
9、在一个方面,本文描述了鼻腔喷雾药物制剂,其包含约0.40mg至约2.4mg的肾上腺素或其盐。在另一个方面,本文描述了鼻腔喷雾药物制剂,其在单剂量的鼻腔喷雾药物制剂中包含约0.40mg至约2.4mg的肾上腺素或其盐。在另一个方面,本文描述了鼻腔喷雾药物制剂,其在单剂量鼻腔喷雾药物制剂中包含约0.40mg至约2.4mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾药物制剂包含约0.40mg至约2.0mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾药物制剂包含约0.40mg至约1.8mg的肾上腺素或其盐。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约0.5mg至约2.0mg的肾上腺素或其盐。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约0.5mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约0.5mg至约0.7mg的肾上腺素或其盐。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约1.0mg的肾上腺素或其盐。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约1.3mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,向受试者鼻内施用单剂量的所述鼻腔喷雾药物制剂提供对于治疗急性超敏反应有效的血浆肾上腺素浓度。在一些实施方案中,所述鼻腔喷雾药物制剂是水性溶液、水性悬浮液、水性乳液、非水性溶液、非水性悬浮液、非水性乳液或干粉。
10、在一个方面,本文描述了鼻腔喷雾制剂,其包含从装置分配的每剂量约0.40mg至约2.4mg的肾上腺素或其盐。在一些实施方案中,本文描述了鼻腔喷雾制剂,其包含从装置分配的每剂量约0.5mg至约2.0mg的肾上腺素或其盐;从装置分配的每剂量约0.5mg至约1.5mg的肾上腺素或其盐;从装置分配的每剂量约0.5mg至约0.7mg的肾上腺素或其盐;从装置分配的每剂量约1.0mg的肾上腺素或其盐;或从装置分配的每剂量约1.3mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,当鼻内施用时,单剂量的鼻腔喷雾制剂提供对于治疗急性超敏反应有效的血浆肾上腺素浓度。在一些实施方案中,所述肾上腺素或其盐以对于治疗急性超敏反应有效的量存在于所述药物制剂中。在一些实施方案中,所述鼻腔喷雾制剂是水性溶液、水性悬浮液、水性乳液、非水性溶液、非水性悬浮液或非水性乳液。
11、在一些实施方案中,所述鼻腔喷雾制剂包含每剂量约1mg/ml至约40mg/ml的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含每剂量约5mg/ml至约40mg/ml的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含每剂量约1mg/ml至约20mg/ml的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含每剂量约3mg/ml至约20mg/ml的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含每剂量约3mg/ml至约15mg/ml的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含每剂量约3mg/ml、约4mg/ml、约5mg/ml、约6mg/ml、约7mg/ml、约8mg/ml、约9mg/ml、约10mg/ml、约11mg/ml、约12mg/ml、约13mg/ml、约14mg/ml、约15mg/ml、约16mg/ml、约17mg/ml、约18mg/ml、约19mg/ml或约20mg/ml的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂的剂量包含约100μl的本文所述的鼻腔喷雾肾上腺素制剂。
12、在一些实施方案中,本文所述的鼻腔喷雾制剂包含约1mg/ml至约40mg/ml的肾上腺素或其盐。在一些实施方案中,本文所述的鼻腔喷雾制剂包含约1mg/ml至约20mg/ml的肾上腺素或其盐。在一些实施方案中,本文所述的鼻腔喷雾制剂包含约1mg/ml至约18mg/ml的肾上腺素或其盐。在一些实施方案中,本文所述的鼻腔喷雾制剂包含约1mg/ml、约2mg/ml、约3mg/ml、约4mg/ml、约5mg/ml、约6mg/ml、约7mg/ml、约8mg/ml、约9mg/ml、约10mg/ml、约11mg/ml、约12mg/ml、约13mg/ml、约14mg/ml、约15mg/ml、约16mg/ml、约17mg/ml、约18mg/ml、约19mg/ml或约20mg/ml的肾上腺素或其盐。在一些实施方案中,本文所述的鼻腔喷雾制剂包含约3mg/ml、约5mg/ml、约6mg/ml、约6.5mg/ml、约7mg/ml、约7.5mg/ml、约8mg/ml、约8.5mg/ml、约9mg/ml、约9.5mg/ml、约10mg/ml、约10.5mg/ml、约11mg/ml、约11.5mg/ml、约12mg/ml、约12.5mg/ml、约13mg/ml、约13.5mg/ml、约14mg/ml、约14.5mg/ml或约15mg/ml的肾上腺素或其盐。在一些实施方案中,本文所述的鼻腔喷雾制剂包含约10mg/ml的肾上腺素或其盐。在一些实施方案中,本文所述的鼻腔喷雾制剂包含约6mg/ml至约8mg/ml的肾上腺素或其盐。在一些实施方案中,本文所述的鼻腔喷雾制剂包含约13mg/ml至约15mg/ml的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂的剂量包含约100μl的本文所述的鼻腔喷雾肾上腺素制剂。
13、在一些实施方案中,约100μl的剂量的本文所述的鼻腔喷雾制剂包含1mg/ml至约40mg/ml的肾上腺素或其盐。在一些实施方案中,约100μl的剂量的本文所述的鼻腔喷雾制剂包含1mg/ml至20mg/ml的肾上腺素或其盐。在一些实施方案中,约100μl的剂量的本文所述的鼻腔喷雾制剂包含3mg/ml、3.5mg/ml、4mg/ml、4.5mg/ml、5mg/ml、6mg/ml、6.5mg/ml、7mg/ml、7.5mg/ml、8mg/ml、8.5mg/ml、9mg/ml、9.5mg/ml、10mg/ml、10.5mg/ml、11mg/ml、11.5mg/ml、12mg/ml、12.5mg/ml、13mg/ml、13.5mg/ml、14mg/ml、14.5mg/ml或15mg/ml的肾上腺素或其盐。
14、在一些实施方案中,所述鼻腔喷雾制剂包含一种或多种吸收促进剂。
15、在一些实施方案中,所述鼻腔喷雾制剂提供在肌内(im)注射给予在大腿外侧时类似于im注射的药代动力学,或类似于皮下(sc)的吸收或介于二者之间。
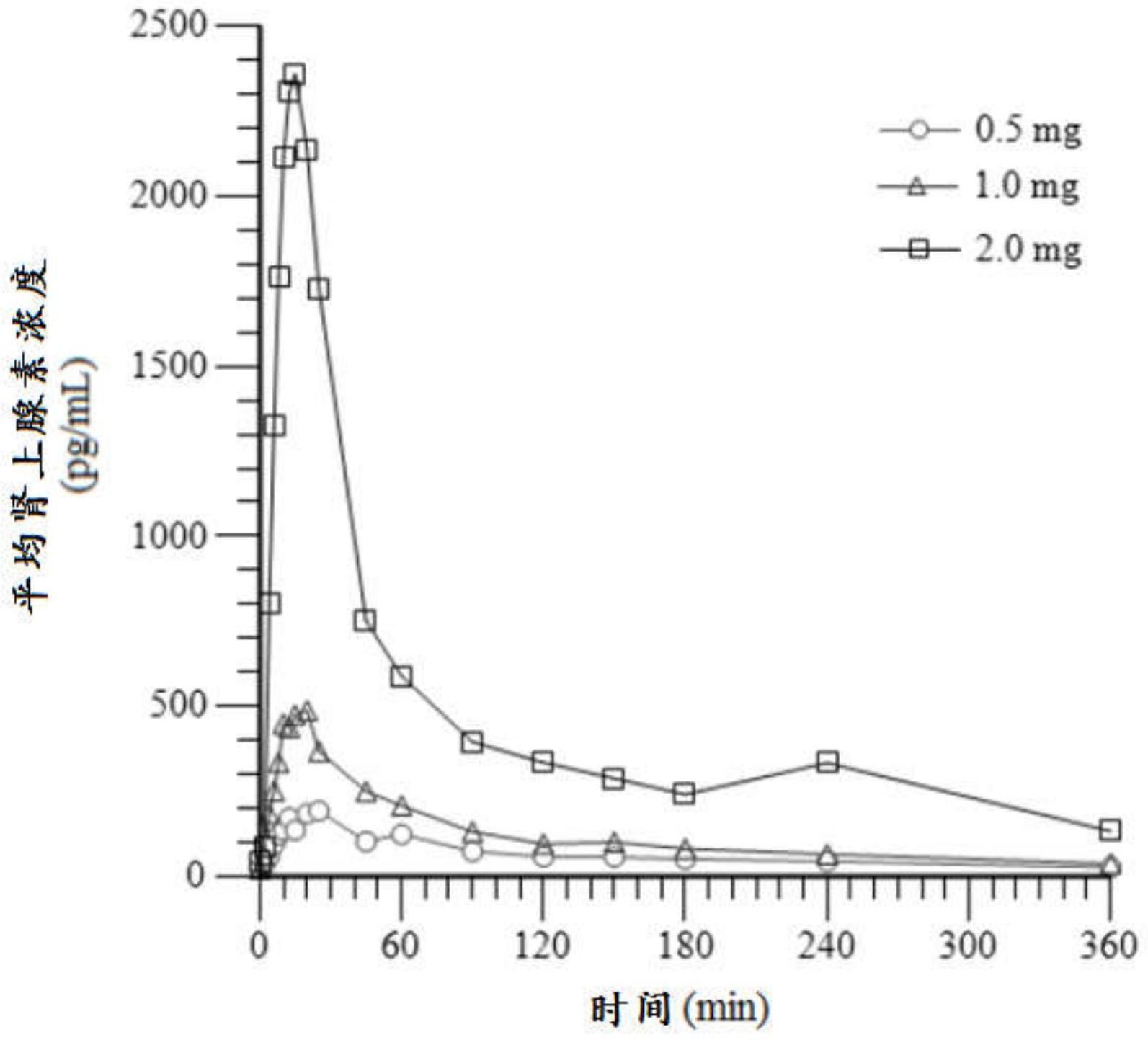
16、在一些实施方案中,所述鼻腔喷雾制剂提供类似于肌内(im)注射的吸收。
17、在一些实施方案中,所述鼻腔喷雾制剂提供类似于皮下(sc)的吸收,并且sc药代动力学谱具有至少100pg/ml的cmax和150h*pg/ml的auc0-240min。
18、在一些实施方案中,向受试者鼻内施用单剂量的所述鼻腔喷雾药物制剂提供类似于肌内(im)注射的吸收。
19、在一些实施方案中,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.3mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.3mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;或者在大腿中的最佳给药条件下类似于im注射的吸收。在一些实施方案中,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.3mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.3mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;以及在大腿中的最佳给药条件下类似于im注射的吸收。
20、在一些实施方案中,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.15mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.15mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;或者在大腿中的最佳给药条件下类似于im注射的吸收。在一些实施方案中,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.15mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.15mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;以及在大腿中的最佳给药条件下类似于im注射的吸收。
21、在一些实施方案中,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.5mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.5mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;或者在大腿中的最佳给药条件下类似于im注射的吸收。在一些实施方案中,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.5mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.5mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;以及在大腿中的最佳给药条件下类似于im注射的吸收。
22、在一些实施方案中,所述鼻腔喷雾制剂包含相对于每摩尔肾上腺素约0.5至约1.1摩尔当量的酸。在一些实施方案中,所述酸是己二酸、氯化铵、柠檬酸、乙酸、盐酸、乳酸、磷酸、丙酸、硫酸或酒石酸。在一些实施方案中,所述酸是盐酸。在一些实施方案中,在所述鼻腔喷雾制剂的制备期间未向其中添加碱。在一些实施方案中,所述鼻腔喷雾制剂的ph在约2.0至约6.0之间。在一些实施方案中,所述鼻腔喷雾制剂的ph为约4.0。
23、在一些实施方案中,所述鼻腔喷雾制剂包含每剂量约5mg/ml至约40mg/ml的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.9mg至约2.40mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.5mg至约2.0mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.9mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.75mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.45mg至约1.15mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约1.0mg至约2.0mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.5mg至约2.0mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.5mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.5mg至约0.7mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约1.0mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约1.3mg至约1.5mg的肾上腺素或其盐。
24、在一些实施方案中,所述鼻腔喷雾药物制剂包含一种或多种吸收促进剂;以及任选的一种或多种选自以下的药剂:等渗剂;稳定剂;防腐剂;掩味剂;粘度改进剂;抗氧化剂;缓冲剂和ph调节剂;其中所述鼻腔喷雾药物制剂的ph在约2.0至约6.0之间。
25、在一些实施方案中,所述鼻腔喷雾药物制剂的ph在约3.0至约5.0之间。在一些实施方案中,所述鼻腔喷雾药物制剂的ph为约4.0。在一些实施方案中,所述鼻腔喷雾药物制剂包含ph调节剂。在一些实施方案中,所述ph调节剂是酸、碱、缓冲剂或其组合。在一些实施方案中,所述酸是己二酸、氯化铵、柠檬酸、乙酸、盐酸、乳酸、磷酸、丙酸、硫酸或酒石酸;所述碱是氢氧化钠、柠檬酸钠、碳酸氢钠、碳酸钠;并且所述缓冲剂是磷酸盐缓冲剂、乙酸盐缓冲剂或柠檬酸盐缓冲剂。在一些实施方案中,所述鼻腔喷雾药物制剂包含相对于每摩尔肾上腺素约0.5至约1.1摩尔当量的酸。在一些实施方案中,所述酸是盐酸。
26、在一些实施方案中,所述鼻腔喷雾制剂包含一种或多种吸收促进剂,所述吸收促进剂选自十二烷基麦芽糖苷、苯扎氯铵、油酸或其盐、聚山梨酯20、聚山梨酯80和十二烷基硫酸钠。
27、在一些实施方案中,所述制剂包含一种或多种吸收促进剂,所述吸收促进剂选自乙醇、抑肽酶、苯扎氯铵、苯甲醇、癸酸、神经酰胺、十六烷基氯化吡啶鎓、壳聚糖、环糊精、脱氧胆酸、癸酰基、二甲基亚砜、甘油单油酸酯、糖原质、糖原质、糖基化鞘氨醇、甘草次酸、2-羟丙基-β-环糊精、月桂醇聚醚-9、月桂酸、月桂酰肉碱、溶血磷脂酰胆碱、薄荷醇、泊洛沙姆407或f68、聚-l-精氨酸、聚氧乙烯-9-月桂醚、肉豆蔻酸异丙酯、棕榈酸异丙酯、羊毛脂、轻质矿物油、亚油酸、薄荷醇、肉豆蔻酸、肉豆蔻醇、油酸或其盐、油醇、棕榈酸、聚山梨酯20、聚山梨酯80、丙二醇、聚氧乙烯烷基醚、聚氧甘油酯、吡咯烷酮、皂树皂苷、水杨酸、钠盐、β-谷甾醇β-d-葡糖苷、十二烷基硫酸钠、蔗糖椰油酸酯、牛磺胆酸、牛磺脱氧胆酸、牛磺二氢梭链孢酸、百里香酚、三辛精、三油精和烷基糖。
28、在一些实施方案中,所述制剂包含一种或多种吸收促进剂,所述吸收促进剂选自十二烷基麦芽糖苷、苯扎氯铵、油酸或其盐、聚山梨酯20、聚山梨酯80和十二烷基硫酸钠。
29、在一些实施方案中,所述一种或多种吸收促进剂是:约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷;或约0.001(w/v)至约1%(w/v)苯扎氯铵;或约0.001(w/v)至约1%(w/v)油酸或其盐;或约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)苯扎氯铵的组合;或约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)油酸或其盐的组合;或约0.001(w/v)至约1%(w/v)苯扎氯铵与约0.001(w/v)至约1%(w/v)油酸或其盐的组合。
30、在一些实施方案中,所述一种或多种吸收促进剂是:约0.005%(w/v)至约0.08%(w/v)苯扎氯铵;或约0.01%(w/v)至约0.06%(w/v)苯扎氯铵;或约0.01%(w/v)至约0.04%(w/v)苯扎氯铵;其中苯扎氯铵是所述制剂中唯一的吸收促进剂,或与一种或多种另外的吸收促进剂一起存在于所述制剂中。
31、在一些实施方案中,所述制剂包含防腐剂。在一些实施方案中,所述防腐剂是苯扎氯铵。
32、在一些实施方案中,所述鼻腔喷雾药物制剂包含等渗剂。在一些实施方案中,所述等渗剂是葡萄糖、甘油、甘露醇、氯化钾或氯化钠。在一些实施方案中,所述等渗剂是氯化钠。
33、在一些实施方案中,所述鼻腔喷雾制剂额外地包含稳定剂。在一些实施方案中,所述稳定剂是乙二胺四乙酸(edta)或其盐。在一些实施方案中,所述edta是edta二钠。在一些实施方案中,所述鼻腔喷雾制剂包含约0.001%(w/v)至约1%(w/v)的edta二钠。
34、在一些实施方案中,所述鼻腔喷雾制剂额外地包含防腐剂。在一些实施方案中,所述防腐剂是苯扎氯铵。
35、在一些实施方案中,所述鼻腔喷雾制剂包含一种或多种吸收促进剂,所述吸收促进剂选自烷基糖苷类、苯扎氯铵、油酸或其盐、聚山梨酯20、聚山梨酯酯80、十二烷基硫酸钠、环糊精、中链脂肪酸和长链脂肪酸或其盐、饱和脂肪酸和不饱和脂肪酸或其盐、乙醇、甘油、丙二醇、peg 300/400和苯甲醇。
36、在一些实施方案中,所述鼻腔喷雾制剂进一步包含抗氧化剂。在一些实施方案中,所述鼻腔喷雾制剂进一步包含抗氧化剂,所述抗氧化剂选自α生育酚、花生四烯酸、抗坏血酸、抗坏血酸棕榈酸酯、苄索氯铵、苄索溴铵、苯扎氯铵、丁化羟基苯甲醚(bha)、丁化羟基甲苯(bht)、癸酸、己酸、二氧化碳、十六烷基氯化吡啶鎓、螯合剂、壳聚糖衍生物、一水柠檬酸、二甲基氨基丙酸十二酯、庚酸、异抗坏血酸、油酸乙酯、富马酸、甘油油酸酯、甘油单硬脂酰酯、月桂酸、柠檬烯、亚麻酸、赖氨酸、苹果酸、薄荷醇、甲硫氨酸、单硫甘油、肉豆蔻酸、油酸、棕榈酸、壬酸、薄荷油、磷酸、聚山梨酯、焦亚硫酸钾、丙酸、没食子酸丙酯、抗坏血酸钠、亚硫酸氢钠、癸酸钠、脱氧胆酸钠、脱氧乙醇酸钠、甲醛合次硫酸氢钠、甘氨胆酸钠、羟基苯甲酰基氨基辛酸钠、十二烷基硫酸钠、焦亚硫酸钠、亚硫酸钠、牛磺胆酸钠、硫代硫酸钠、硬脂酸、二氧化硫及其组合。
37、在一些实施方案中,所述鼻腔喷雾制剂进一步包含与所述抗氧化剂一起的增效剂,所述增效剂选自一水柠檬酸、酒石酸、百里香酚、生育酚(α生育酚)、tocopherasol、维生素e和维生素e聚乙二醇琥珀酸酯及其组合。
38、在一些实施方案中,所述鼻腔喷雾制剂进一步包含穿透促进剂,所述穿透促进剂选自乙醇、花生四烯酸、苄索氯铵、苄索溴铵、苯扎氯铵、癸酸、己酸、香芹酮、十六烷基氯化吡啶鎓、壳聚糖、柠檬酸、6-环己基-1-己基-β-d-吡喃麦芽糖苷、正癸基-β-d-吡喃麦芽糖苷、二甲基亚砜、二甲基氨基丙酸十二酯、1-o-正十二烷基-β-d-吡喃麦芽糖苷、十二烷基聚乙二醇醚、依地酸二钠二水合物、庚酸、甘油单油酸酯、甘油单硬脂酰酯、糖原质、肉豆蔻酸异丙酯、棕榈酸异丙酯、壬酸、羊毛脂、月桂酸、轻质矿物油、柠檬烯、亚油酸、赖氨酸、薄荷醇、肉豆蔻酸、肉豆蔻醇、油酸、油醇、棕榈酸、薄荷油、聚氧乙烯烷基醚、聚氧甘油酯、聚山梨酯、吡咯烷酮、癸酸钠、脱氧胆酸钠、脱氧乙醇酸钠、甘氨胆酸钠、羟基苯甲酰基氨基辛酸钠、十二烷基硫酸钠、牛磺胆酸钠、硬脂酸、百里香酚、三辛精、三油精、十一碳烯酸及其组合。
39、在一些实施方案中,所述鼻腔喷雾制剂包含:约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷;约0.001(w/v)至约1%(w/v)苯扎氯铵;约0.001(w/v)至约1%(w/v)油酸或其盐;约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)苯扎氯铵的组合;约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)油酸或其盐的组合;或约0.001(w/v)至约1%(w/v)苯扎氯铵与约0.001(w/v)至约1%(w/v)油酸或其盐的组合;或约0.001(w/v)至约1%(w/v)苯扎氯铵与约0.001(w/v)至约1%(w/v)油酸或其盐以及0.001%至1%焦亚硫酸钠的组合;或约0.001(w/v)至约1%(w/v)苯扎氯铵与约0.001(w/v)至约1%(w/v)油酸或其盐以及约0.001%至10%聚山梨酯80和0.001%至1%焦亚硫酸钠的组合;或约0.001(w/v)至约1%(w/v)苯扎氯铵与约0.001(w/v)至约1%(w/v)油酸或其盐以及约0.001%至10%聚山梨酯80和0.001%至1%焦亚硫酸钠和0.001%至1%柠檬酸的组合。
40、在一些实施方案中,所述鼻腔喷雾制剂包含:约0.005%(w/v)至约0.08%(w/v)苯扎氯铵;约0.01%(w/v)至约0.06%(w/v)苯扎氯铵;或约0.01%(w/v)至约0.04%(w/v)苯扎氯铵;其中苯扎氯铵是所述鼻腔喷雾制剂中唯一的吸收促进剂,或与一种或多种另外的吸收促进剂一起存在于所述制剂中。
41、在一些实施方案中,所述鼻腔喷雾制剂包含:约0.001%至1%的本文所述的任何一种抗氧化剂,或本文所述的任何一种抗氧化剂的组合。
42、在一些实施方案中,所述鼻腔喷雾制剂包含缓冲剂。缓冲剂包括但不限于己二酸、硼酸、碳酸钙、氢氧化钙、乳酸钙、三代磷酸钙、一水柠檬酸、磷酸氢二钠、二乙醇胺、甘氨酸、马来酸、苹果酸、甲硫氨酸、磷酸二氢钠、单乙醇胺、谷氨酸一钠、磷酸、柠檬酸钾、乙酸钠、碳酸氢钠、硼酸钠、碳酸钠、柠檬酸钠二水合物、氢氧化钠、乳酸钠和三乙醇胺。
43、在一个方面,本文提供了治疗由肾上腺素能受体介导的病况的方法,所述方法包括鼻内施用如本文所述的任何一种制剂。在一些实施方案中,所述病况选自1型超敏反应(全身变态反应)、急性哮喘发作、心脏停搏和stokes-adams综合征。在一些实施方案中,所述病况是1型超敏反应(全身变态反应)。在一些实施方案中,所述1型超敏反应选自变应性哮喘、变应性结膜炎、变应性鼻炎、过敏反应、血管性水肿、荨麻疹、嗜曙红细胞增多、药物变态反应和食物变态反应。在一些实施方案中,所述药物变态反应是抗生素变态反应。
44、在一个方面,本文描述了包含肾上腺素或其盐的鼻腔喷雾制剂,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.3mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.3mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;或者在大腿中的最佳给药条件下类似于im注射的吸收。在另一个方面,本文描述了包含肾上腺素或其盐的鼻腔喷雾制剂,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.3mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.3mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;以及在大腿中的最佳给药条件下类似于im注射的吸收。
45、在另一个方面,本文描述了包含肾上腺素或其盐的鼻腔喷雾制剂,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.15mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.15mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;或者在大腿中的最佳给药条件下类似于im注射的吸收。在另一个方面,本文描述了包含肾上腺素或其盐的鼻腔喷雾制剂,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.15mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.15mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;以及在大腿中的最佳给药条件下类似于im注射的吸收。
46、在另一个方面,本文描述了包含肾上腺素或其盐的鼻腔喷雾制剂,当施用于受试者时,所述鼻腔喷雾制剂产生以下药代动力学特征中的一种或多种:平均auc0-20min和auc0-t均为0.5mg肌内注射产生的auc0-20min和auc0-t的至少80%;平均cmax为0.5mg肌内注射产生的cmax的至少80%且不超过该cmax的150%;平均tmax小于45分钟;或者在大腿中的最佳给药条件下类似于im注射的吸收。
47、在一些实施方案中,所述鼻腔喷雾制剂是药物制剂。
48、在一些实施方案中,所述肾上腺素或其盐以对于治疗急性超敏反应有效的量存在于所述鼻腔喷雾制剂中。
49、在一些实施方案中,向受试者鼻内施用单剂量的鼻腔喷雾药物制剂提供对于治疗急性超敏反应有效的血浆肾上腺素浓度。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约0.5mg至约2.0mg的肾上腺素或其盐。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约0.5mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约0.5mg至约0.7mg的肾上腺素或其盐。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约1.0mg的肾上腺素或其盐。在一些实施方案中,单剂量的所述鼻腔喷雾药物制剂包含约1.3mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,所述制剂是水性溶液、水性悬浮液、水性乳液、非水性溶液、非水性悬浮液、非水性乳液、加压定量吸入器或干粉。
50、在一些实施方案中,所述鼻腔喷雾制剂是水性溶液、水性悬浮液、水性乳液、非水性溶液、非水性悬浮液或非水性乳液。
51、在一些实施方案中,所述鼻腔喷雾制剂具有在肌内(im)注射给予在大腿外侧时类似于im注射的药代动力学,或类似于皮下(sc)的吸收或介于二者之间。
52、在一些实施方案中,所述鼻腔喷雾制剂具有类似于皮下(sc)的吸收,并且sc药代动力学谱具有至少100pg/ml的cmax和150h*pg/ml的auc0-240min。
53、在一些实施方案中,所述鼻腔喷雾制剂具有类似于肌内(im)注射的吸收。
54、在一些实施方案中,所述鼻腔喷雾制剂包含吸收促进剂。
55、在一些实施方案中,所述鼻腔喷雾药物制剂包含一种或多种吸收促进剂;以及任选的一种或多种选自以下的药剂:等渗剂;稳定剂;防腐剂;掩味剂;粘度改进剂;抗氧化剂;缓冲剂和ph调节剂;其中所述鼻腔喷雾药物制剂的ph在约2.0至约6.0之间。在一些实施方案中,所述鼻腔喷雾药物制剂的ph在约3.0至约5.0之间。在一些实施方案中,所述鼻腔喷雾药物制剂的ph为约4.0。
56、在一些实施方案中,所述鼻腔喷雾药物制剂包含ph调节剂。在一些实施方案中,所述ph调节剂是酸、碱、缓冲剂或其组合。在一些实施方案中,所述酸是己二酸、氯化铵、柠檬酸、乙酸、盐酸、乳酸、磷酸、丙酸、硫酸或酒石酸;所述碱是氢氧化钠、柠檬酸钠、碳酸氢钠、碳酸钠;并且所述缓冲剂是磷酸盐缓冲剂、乙酸盐缓冲剂或柠檬酸盐缓冲剂。
57、在一些实施方案中,所述鼻腔喷雾制剂包含相对于每摩尔肾上腺素约0.5至约1.1摩尔当量的酸。在一些实施方案中,所述酸是己二酸、氯化铵、柠檬酸、乙酸、盐酸、乳酸、磷酸、丙酸、硫酸或酒石酸。在一些实施方案中,所述酸是盐酸。在一些实施方案中,在所述制剂的制备期间未向其中添加碱。在一些实施方案中,所述鼻腔喷雾制剂的ph在约2.0至约6.0之间。在一些实施方案中,所述鼻腔喷雾制剂的ph为约4.0。
58、在一些实施方案中,所述鼻腔喷雾制剂包含每剂量约5mg/ml至约40mg/ml的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.40mg至约2.40mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.9mg至约2.40mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.5mg至约2.0mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.9mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.75mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约0.45mg至约1.15mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔喷雾制剂包含从装置分配的每剂量约1.0mg至约2.0mg的肾上腺素或其盐。
59、在一些实施方案中,所述鼻腔喷雾制剂包含一种或多种吸收促进剂,所述吸收促进剂选自乙醇、抑肽酶、苯扎氯铵、苯甲醇、癸酸、神经酰胺、十六烷基氯化吡啶鎓、壳聚糖、环糊精、脱氧胆酸、癸酰基、二甲基亚砜、甘油单油酸酯、糖原质、糖原质、糖基化鞘氨醇、甘草次酸、2-羟丙基-β-环糊精、月桂醇聚醚-9、月桂酸、月桂酰肉碱、溶血磷脂酰胆碱、薄荷醇、泊洛沙姆407或f68、聚-l-精氨酸、聚氧乙烯-9-月桂醚、肉豆蔻酸异丙酯、棕榈酸异丙酯、羊毛脂、轻质矿物油、亚油酸、薄荷醇、肉豆蔻酸、肉豆蔻醇、油酸、油醇、棕榈酸、聚山梨酯20、聚山梨酯80、丙二醇、聚氧乙烯烷基醚、聚氧甘油酯、吡咯烷酮、皂树皂苷、水杨酸、钠盐、β-谷甾醇β-d-葡糖苷、十二烷基硫酸钠、蔗糖椰油酸酯、牛磺胆酸、牛磺脱氧胆酸、牛磺二氢梭链孢酸、百里香酚、三辛精、三油精和烷基糖。
60、在一些实施方案中,所述鼻腔喷雾制剂包含一种或多种吸收促进剂,所述吸收促进剂选自十二烷基麦芽糖苷、苯扎氯铵、油酸或其盐、聚山梨酯20、聚山梨酯80和十二烷基硫酸钠。
61、在一些实施方案中,所述鼻腔喷雾制剂包含:约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷;约0.001(w/v)至约1%(w/v)苯扎氯铵;约0.001(w/v)至约1%(w/v)油酸或其盐;约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)苯扎氯铵的组合;约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)油酸或其盐的组合;或约0.001(w/v)至约1%(w/v)苯扎氯铵与约0.001(w/v)至约1%(w/v)油酸或其盐以及约0.001%至1%的抗氧化剂(例如焦亚硫酸钠)的组合。在一些实施方案中,所述鼻腔喷雾制剂包含:约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷;约0.001(w/v)至约1%(w/v)苯扎氯铵;约0.001(w/v)至约1%(w/v)油酸或其盐;约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)苯扎氯铵的组合;约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)油酸或其盐的组合;或约0.001(w/v)至约1%(w/v)苯扎氯铵与约0.001(w/v)至约1%(w/v)油酸或其盐的组合。在一些实施方案中,所述鼻腔喷雾制剂包含:约0.005%(w/v)至约0.08%(w/v)苯扎氯铵;约0.01%(w/v)至约0.06%(w/v)苯扎氯铵;或约0.01%(w/v)至约0.04%(w/v)苯扎氯铵;其中苯扎氯铵是所述鼻腔喷雾制剂中唯一的吸收促进剂,或与一种或多种另外的吸收促进剂一起存在于所述制剂中。
62、在一些实施方案中,所述鼻腔喷雾制剂额外地包含稳定剂。在一些实施方案中,所述稳定剂是乙二胺四乙酸(edta)或其盐。在一些实施方案中,所述edta是edta二钠。在一些实施方案中,所述edta以约0.001%至约1%的量存在。
63、在一些实施方案中,所述鼻腔喷雾制剂额外地包含防腐剂。在一些实施方案中,所述防腐剂是苯扎氯铵。
64、在一个方面,本文描述了治疗由肾上腺素能受体介导的病况的方法,所述方法包括鼻内施用本文所述的任何一种制剂。在一些实施方案中,所述病况选自1型超敏反应(全身变态反应)、急性哮喘发作、心脏停搏和stokes-adams综合征。在一些实施方案中,所述病况是1型超敏反应(全身变态反应)。在一些实施方案中,所述1型超敏反应选自变应性哮喘、变应性结膜炎、变应性鼻炎、过敏反应、血管性水肿、荨麻疹、嗜曙红细胞增多、药物变态反应和食物变态反应。在一些实施方案中,所述药物变态反应是抗生素变态反应。
65、在另一个方面,本文描述了一种治疗过敏反应的方法,其包括以小于约2.0mg的量鼻内施用肾上腺素的鼻内制剂。在一些实施方案中,所述鼻腔药物制剂包含约0.5mg至约1.5mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔药物制剂包含约0.5mg至约0.7mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔药物制剂包含约1.0mg的肾上腺素或其盐。在一些实施方案中,所述鼻腔药物制剂包含约1.3mg至约1.5mg的肾上腺素或其盐。
66、在所述治疗方法的一些实施方案中,所述鼻内制剂包含:一种或多种吸收促进剂;等渗剂;稳定剂;防腐剂;任选的抗氧化剂;以及任选的ph调节剂。在所述治疗方法的一些实施方案中,所述一种或多种吸收促进剂选自:十二烷基麦芽糖苷;苯扎氯铵;油酸或其盐;十二烷基硫酸钠;十二烷基麦芽糖苷与苯扎氯铵的组合;十二烷基麦芽糖苷与油酸或其盐的组合;以及苯扎氯铵与油酸或其盐的组合。在所述治疗方法的一些实施方案中,所述一种或多种吸收促进剂选自:约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷;约0.001(w/v)至约1%(w/v)苯扎氯铵;约0.001(w/v)至约1%(w/v)油酸或其盐;约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)苯扎氯铵的组合;约0.005%(w/v)至约2.5%(w/v)十二烷基麦芽糖苷与约0.001(w/v)至约1%(w/v)油酸或其盐的组合;或约0.001(w/v)至约1%(w/v)苯扎氯铵与约0.001(w/v)至约1%(w/v)油酸或其盐的组合。在所述治疗方法的一些实施方案中,所述制剂包含:约0.005%(w/v)至约0.08%(w/v)苯扎氯铵;约0.01%(w/v)至约0.06%(w/v)苯扎氯铵;或约0.01%(w/v)至约0.04%(w/v)苯扎氯铵;其中苯扎氯铵是所述制剂中唯一的吸收促进剂,或与一种或多种另外的吸收促进剂一起存在于所述制剂中。在所述治疗方法的一些实施方案中,所述等渗剂是氯化钠。在所述治疗方法的一些实施方案中,所述稳定剂是edta。在所述治疗方法的一些实施方案中,所述稳定剂是约0.001%(w/v)至约1%(w/v)的量的edta。在所述治疗方法的一些实施方案中,所述防腐剂是苯扎氯铵。在所述治疗方法的一些实施方案中,所述防腐剂是约0.001%(w/v)至约1%(w/v)的量的苯扎氯铵。
67、提供了制品,其包括包装材料、在所述包装材料内的本文所述的鼻腔喷雾制剂,以及表明所述鼻腔喷雾制剂用于治疗本文所述的任何病况(例如过敏反应)的标签。
68、根据以下的详细说明,本文所述的组合物和方法的其他目的、特征和优点将变得显而易见。然而,应当理解的是,该详细说明和具体实施例在指出具体实施方案时仅以说明的方式给出,因为在本公开内容的精神和范围内的各种变化和修改将从该详细说明中变得对本领域技术人员而言显而易见。
- 还没有人留言评论。精彩留言会获得点赞!