一种靶向调节肠道的口服植物外泌体水凝胶及其制备方法与应用与流程
1.本发明属于生物技术领域,具体涉及一种靶向调节肠道的口服植物外泌体水凝胶及其制备方法与应用。
背景技术:
2.肠道是人体最大的消化器官,研究发现80%的消化和吸收过程是在肠道完成的,肠道不仅是人体最大的“营养供应中心”,也是人体最大的免疫系统。因此肠道屏障完整性和功能性是维持人体健康的根本保障,不健康、不规律的生活习惯会加速肠道衰老,进而容易诱发多种疾病,调节肠道健康是保证人体健康的重要手段。
3.外泌体内含多种活性物质,如核酸(mrna、mirna、incrna、circrna)、蛋白质及脂质等多种物质,是一种内源性的调节物质,具有多种生物学活性,可影响肠道中微生物群的动态平衡,有效调理肠道。外泌体按来源可分为动物细胞外泌体和植物外泌体。动物细胞外泌体来源广泛,有很好的临床应用前景。然而,动物细胞来源的外泌体需要培养大量细胞、产率较低且存在同种异体的免疫原性问题。随着研究的深入,科学家们在植物的分离纯化中也发现了物理性质、组成成分类似于外泌体的纳米颗粒,相比较动物外泌体来说其产率较高、提取周期短,并且来源于可食用水果、蔬菜,免疫原性较低,具有更广阔的应用前景。但直接利用植物外泌体液体或将其进行干燥使用,仍存在以下问题:1.液态的外泌体浓度较低,且对储存条件要求较高,必须冷藏运输;2.直接将外泌体进行冻干,无论是喷雾干燥还是冷冻真空干燥都有可能对外泌体的结构造成破坏,并且无论是直接使用外泌体液体或是冻干后的外泌体粉末,在进入体内后容易受到胆盐、胃酸等影响,其生物活性和靶向性能都会大打折扣。中国发明专利cn114009772a提供了一种植物外泌体微囊包埋冻干粉的制备方法,通过海藻酸钠溶液的一次包衣和壳寡糖的二次包衣形成植物外泌体的微囊包埋包埋冻干粉。但是该方法得到的植物外泌体冻干粉仍存在着靶向效率低、释放不可控等问题,将其直接应用于肠道调节中效果不是很理想。因而需要一种能够稳定、靶向调节肠道的方法。
技术实现要素:
4.为了克服上述现有技术的缺点,本发明的目的在于提供一种靶向调节肠道的口服植物外泌体水凝胶及其制备方法与应用,稳定、靶向调节肠道。
5.为了达到上述目的,本发明采用以下技术方案予以实现:
6.本发明公开了一种靶向调节肠道的口服植物外泌体水凝胶,包括质量比为(0.01~0.5):(2.5~125):(10~500)的植物外泌体、多孔淀粉和海藻酸钠,所述植物外泌体嵌于多孔淀粉的内部孔道中,多孔淀粉嵌于海藻酸钠的三维网络结构中。
7.优选地,还包括小肽d3和混合磷脂,质量比为(0.01~0.5):(0.05~25)(1.5~125)的植物外泌体、小肽d3和混合磷脂的混合物嵌于多孔淀粉的内部孔道中;所述混合磷脂为磷脂和胆固醇的混合物。
8.优选地,植物外泌体、小肽d3和混合磷脂的混合物的粒径范围为100~400nm。
9.优选地,所述植物外泌体在ph值为4~6的条件下提取分离得到。
10.进一步优选地,所述植物外泌体在ph值为5的条件下,与聚乙二醇共同孵育后提取分离得到。
11.优选地,所述植物外泌体来源于茶叶、桑树皮、生姜、姜黄、洋葱、大蒜或葡萄。
12.本发明还公开上述一种靶向调节肠道的口服植物外泌体水凝胶的制备方法,取植物汁液上清,调节ph值为4~6,离心取沉淀悬浮于pbs缓冲液中,取上清过滤,得到植物外泌体溶液;将植物外泌体溶液与磷脂和胆固醇的混合物混合,得到植物外泌体-脂质体;将植物外泌体-脂质体与多孔淀粉混合,去上清,得到植物外泌体-脂质体/多孔淀粉颗粒;将植物外泌体-脂质体/多孔淀粉颗粒与海藻酸钠混合,再利用cacl2溶液固化,得到口服植物外泌体水凝胶。
13.优选地,离心取沉淀之前,将调节ph值至4~6的植物汁液上清与聚乙二醇混合孵育。
14.优选地,将得到的植物外泌体-脂质体/多孔淀粉颗粒与糊化为凝胶的淀粉混合之后,再与海藻酸钠混合。
15.本发明还公开了上述一种靶向调节肠道的口服植物外泌体水凝胶在制备调节肠道药物或保健品中的应用。
16.与现有技术相比,本发明具有以下有益效果:
17.本发明提供的一种靶向调节肠道的口服植物外泌体水凝胶,利用多孔淀粉多孔的性能,一方面,将多孔淀粉作为植物外泌体的吸附载体对植物外泌体予以保护,增加其稳定性;另一方面利用其天然聚合物的特性,与海藻酸钠形成复合凝胶,进一步加强得到的凝胶的稳定性。海藻酸钠一方面能在胃酸中收缩,在肠道的近中性环境中膨胀,从而可避开胃部环境,在肠道中触发释放。另一方面,海藻酸钠与多孔淀粉的结合,利用海藻酸钠对ph值的变化有反应的特性,淀粉类食物摄入反馈调节分泌的淀粉酶对多孔淀粉有特定的水解作用,使得到的水凝胶具有ph和淀粉酶反应的触发释放平台。该凝胶的制备采用多级包埋工艺,首先,植物外泌体最外层的海藻酸钠形成的凝胶壳以及内层的淀粉层,能够保护其在口服后能安全顺利地通过胃部到达小肠停留,与肠粘膜相互作用,此时在肠道ph和淀粉酶的双重刺激响应下实现外壳的逐级崩解,使得内部的外泌体可缓慢释放。其次,该层级结构能够负载更多的活性物质发挥协同作用,包括小分子化合物、大分子蛋白质等,最后,体系中的原料均具有良好的生物安全性,且可食用,可以作为口服递送产品的良好载体。因而该口服植物外泌体水凝胶稳定性好,且能够实现植物外泌体的多级靶向响应递送,更好地发挥肠道调节作用。
18.进一步地,释放后的外泌体又因为膜表面的小肽d3肽靶向肠上皮细胞,使得外泌体脂质体牢牢锚定在肠上皮细胞,通过与肠上皮细胞膜相互融合,释放出外泌体,发挥调节活性。磷脂和胆固醇的混合物一方面能加强植物外泌体的稳定性,另一方面能提供一个更全面、负载更多活性成分的递送载体。
19.进一步地,以聚乙二醇(peg)为基础的低ph值的纳米囊泡分离技术可以通过将纳米囊泡捕获在网状结构中保持其完整性,可以在不丧失植物外泌体的完整性和关键生物活性的情况下,大幅提高植物外泌体的产量,增加外泌体的体外稳定性,不仅操作简单,而且
提取工艺温和。
20.本发明提供的一种靶向调节肠道的口服植物外泌体水凝胶的制备方法,采用多级包埋工艺,在植物外泌体和脂质体混合物外层依次包埋淀粉和海藻酸钠,能够实现有效成分的稳定靶向递送。
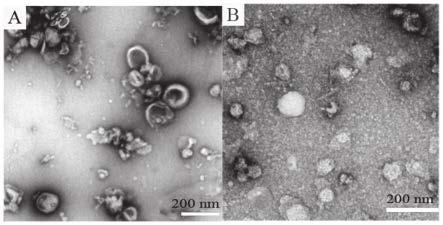
21.进一步地,在多孔淀粉颗粒表面涂覆一层淀粉膜,能够进一步加强内容物的稳定性和可控释放。
附图说明
22.图1为本发明的不同方法分离得到的pdnvs的总收率图;
23.图2为本发明的不同ph值下分离得到的pdnvs的总收率图;
24.图3为本发明的不同方法分离得到的pdnvs的透射电镜图;其中,a为差速离心法得到的pdnvs,b为ph值=5条件下peg沉淀得到的pdnvs;
25.图4为本发明的不同ph值下分离得到的pdnvs的粒径和电位情况图;
26.图5为本发明的多孔淀粉和口服植物外泌体水凝胶的扫描电镜图;其中,a为多孔淀粉,20μm;b为多孔淀粉,10μm;c为口服植物外泌体水凝胶,20μm;d为口服植物外泌体水凝胶,10μm;
27.图6为本发明的口服植物外泌体水凝胶与外泌体、植物外泌体-脂质体和植物外泌体-脂质体/多孔淀粉颗粒的胃肠组织荧光强度对比统计图。
具体实施方式
28.为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
29.需要说明的是,本发明的术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
30.下面结合附图对本发明做进一步详细描述:
31.本发明提供的一种靶向调节肠道的口服植物外泌体水凝胶,包括质量比为(0.01~0.5):(0.05~25):(1.5~125):(2.5~125):(10~500)的植物外泌体、小肽d3、混合磷脂、多孔淀粉和海藻酸钠;植物外泌体、小肽d3和混合磷脂的混合物融合形成一级结构,并嵌于多孔淀粉的内部孔道中,多孔淀粉嵌于海藻酸钠的三维网络结构中形成二级结构。
32.其中,所述植物外泌体的来源为茶叶、桑树皮、生姜、姜黄、洋葱、大蒜、葡萄中的任何一种;在植物外泌体、小肽d3和混合磷脂的混合物中,植物外泌体的最终质量浓度为0.02%~0.1%,小肽d3的最终质量浓度为0.1%~1%,脂质体的最终质量浓度为3%~5%;所述混合磷脂为磷脂和胆固醇混合物。
33.实施例1
34.1.植物外泌体(plant-derived nanovesicles,pdnvs)提取和分离
35.提取分离方法如下:
36.a)称取洗净后的新鲜生姜10g初步捣碎后加入100g无菌磷酸盐缓冲液,并在高速搅拌机中均质(750w,3min)使其完全破碎;
37.b)随后用200μm的尼龙网过滤收集生姜汁液,将收集到的生姜汁液离心30min(2000g,10min;6000g,20min);
38.c)随后弃掉沉淀,在上清液中加入1m hcl或naoh将ph调节到ph值=5,将调节ph后的上清液与peg6000混合置于4℃下孵育过夜,其中peg6000的终浓度为10%(w/v);
39.d)接着离心(8000g,30min)弃掉上清液,将沉淀按照0.5mg/ml悬浮于pbs缓冲液中;
40.e)随后将d)得到的溶液经100kd超滤管超滤浓缩,弃掉超滤管下部液体;
41.f)将浓缩后的液体用0.22μm滤膜过滤,得到生姜外泌体溶液;用透射电镜(tecnai g
2 20s-twin,fei,usa)观察外泌体的形态(具体方法为:将制备好的样品滴加一滴沉积在铜网格表面,然后加入1%乙酸双氧铀染色15秒,然后让样品在室温下干燥以进行后续tem成像)。用纳米粒度分析仪(malvern instruments,malvern,uk)测量外泌体的粒径和表面电荷(具体方法为将外泌体样品稀释100倍,加入样品池中进行测量,每个样品重复三次)。对生姜外泌体溶液采用bca试剂盒的标准操作方法测定蛋白浓度,将其浓度调整为5.0mg/ml,作为储存液置于-80℃冷冻保存,避免反复冻融。
42.同时,为了确定低ph值对外泌体提取的有益作用,我们进一步利用不同ph值来提取外泌体。即将步骤c)中ph值分别调节到ph值=6和ph值=7,其他步骤相同。
43.进一步地对比不同提取方法制备的外泌体差异,采用差速离心法制备生姜外泌体,具体方法如下:将洗净后的新鲜生姜1g初步捣碎后,加入100g无菌磷酸盐缓冲液,并在高速搅拌机中均质(750w,3min)使其完全破碎;随后用200μm的尼龙网过滤收集生姜汁液,将收集到的生姜汁以1000g第一次离心10min,取第一次离心上层清液继续以3000g第二次离心20min,再取获得的第二次离心上层清液以10000g第三次离心40min以去除杂质,最后收集第三次离心的上清液以100000g第四次离心90min,取获得沉淀用pbs洗涤三次之后即为生姜外泌体。
44.通过下述公式计算外泌体的产率:外泌体的产率=收集的生姜外泌体质量/投入新鲜生姜的质量。
45.结果如图1和图2,图1表明相比较差速离心法,低ph值沉淀法制备得到的外泌体产量更高,图2进一步表明降低ph值使其为弱酸环境更有利于提高外泌体产率。同时通过图3结果进一步表明,低ph值沉淀法和差速离心法均制备得到类囊泡结构样的外泌体,但低ph值沉淀法制备的外泌体尺寸更小。图4中不同ph值条件下制备的外泌体的颗粒尺寸和表面电荷情况也进一步表明,其表面电荷没有明显的差异,但外泌体的尺寸随着提取ph值的升高而显著增加,低ph值条件下分离得到的外泌体粒径更小。
46.2.植物外泌体-脂质体(plant-derived nanovesicles-liposome,pdnvs-lp)制备
47.称取小肽d3(参考文献“a novel peptide protects against diet-induced obesity by suppressing appetite and modulating the gut microbiota”中的合成序列和方法)加入到pro-lipo
tm
neo(购于sage chemical(group)co.,ltd)中,混合均匀,得到
磷脂混合液;称取步骤1得到的生姜外泌体溶液,缓慢注入搅拌状态下的磷脂混合液中,注入速度1~4% v/min,磷脂混合液搅拌速度800~1000rpm/min,完成后继续搅拌10min,然后进行梯度均质处理,制备得到粒径范围为100~400nm的植物外泌体-脂质体(pdnvs-lp)。
48.其中,小肽d3的最终质量浓度为0.5%,生姜外泌体的最终质量浓度为0.05%,pro-lipo
tm
neo的最终质量浓度为5%。
49.3.水凝胶制备
50.(1)多孔淀粉(porous starch,ps)制备
51.称取5g玉米淀粉(maize starch,ms,购自宜瑞安食品配料有限公司)加入到95g的pbs缓冲液中形成淀粉浆,然后加入12.5g枯草芽孢杆菌衍生的a-淀粉酶(4000u/g,购自sigma-aldrich)与淀粉浆混合,37℃水浴搅拌反应过夜,转速为200rpm/min。反应完毕后收集悬浮液3000g离心10min后加入2倍质量的无水乙醇洗涤沉淀3次。最后将沉淀置于烘箱中烘干(40℃,过夜)得到多孔淀粉。
52.多孔淀粉也可直接购买得到,购买选择来源为玉米、土豆、大米、小麦、大麦或木薯的多孔淀粉。
53.(2)植物外泌体-脂质体/多孔淀粉颗粒(pdnvs-lp/ps)
54.称取200g步骤2得到的pdnvs-lp与10g步骤3(1)得到的ps,在室温下搅拌使其混合均匀(500rpm,60min),随后静置2h,然后轻轻移去上清,-20℃预冻4h后冷冻干燥过夜得到pdnvs-lp/ps。
55.进一步地,为了防止嵌入ps内部孔道的pdnvs-lp在后续操作步骤中泄漏导致有效成分减少,在pdnvs-lp/ps外层涂覆淀粉凝胶膜,具体步骤如下:
56.称取2g的g70高直链玉米淀粉(购自宜瑞安食品配料有限公司)溶于98g去离子水中,加热,待糊化成为凝胶,冷却至室温,随后称取100g凝胶与50g的pdnvs-lp/ps仔细混合均匀,-20℃预冻过夜,冻干24h,得到包覆了玉米淀粉的植物外泌体-脂质体/多孔淀粉颗粒。
57.(3)植物外泌体-脂质体/多孔淀粉/凝胶(pdnvs-lp/ps/sa)
58.称取4.8g上述包覆了玉米淀粉的植物外泌体-脂质体/多孔淀粉颗粒,加入15.2g去离子水搅拌使其完全溶解。随后称0.8g海藻酸钠(sodium alginate,sa,购自上海阿拉丁生化科技股份有限公司)加入到19.2g去离子水中使其完全溶解,然后将两者混合于室温搅拌使其混合均匀(500rpm/min,30min),使用蠕动泵将上述混合物通过针尖(内径0.51mm)滴入100ml cacl2溶液(1.5%w/v)固化形成水凝胶微珠,将微珠用大量超纯水冲洗2~3次,得到靶向调节肠道的口服植物外泌体水凝胶。
59.4.体系评价实验
60.(1)电镜表征
61.利用扫描电镜(sem,日立,regulus8100,日本)观察多孔淀粉及复合水凝胶冻干后的表面结构。取少量样品置于导电胶上,在真空下喷金2分钟,然后在10kv的工作电压下获得sem图像。由图5中a和b可看出,制备得到的淀粉颗粒呈现多孔结构,含有多个近圆形微孔,这种多孔道结构有利于嵌入更多的内容物。由图5中c和d可看出,口服植物外泌体水凝胶冻干之后呈近似球状,内部隐约可见小孔,但放大之后能看到表面被膜包裹。
62.(2)体外耐胃酸实验
63.利用模拟胃液与上述植物外泌体、植物外泌体-脂质体、植物外泌体-脂质体/多孔淀粉颗粒、口服植物外泌体水凝胶共同孵育,测定游离植物外泌体浓度。具体方法如下:
64.①
模拟胃液配置:用浓盐酸将2mg/ml的nacl溶液的ph调节到ph值=2.0,然后加入一定量胃蛋白酶,胃蛋白酶的终浓度为0.3mg/ml,随后用0.22μm.滤膜过滤除菌备用。
65.②
取植物外泌体、植物外泌体-脂质体、植物外泌体-脂质体/多孔淀粉颗粒和口服植物外泌体水凝胶各1g,置于37℃预热过的9ml模拟胃液中,然后将其分别置于恒温摇床中进行孵育(37℃,100rpm/min),间隔10min、30min、60min、120min和180min时,分别取上述四组混合液各1ml,加入含0.2mol/l的nahco3的无菌磷酸盐缓冲液中,振荡30min,然后用bca法测定游离植物外泌体浓度。结果如表1:
66.表1各组植物外泌体耐胃酸实验结果
[0067][0068][0069]
表1的结果表明层级包埋植物外泌体,能够增强植物外泌体耐胃酸稳定性。
[0070]
(3)体外模拟消化道体系中的稳定性
[0071]
利用模拟消化道液与上述植物外泌体、植物外泌体-脂质体、植物外泌体-脂质体/多孔淀粉颗粒、口服植物外泌体水凝胶共同孵育,测定游离植物外泌体浓度。具体方法如下:
[0072]
①
建立各消化道模拟液模拟模型,参见表2:
[0073]
表2各消化道模拟液ph值及作用时间表
[0074][0075]
其中,阶段1~阶段6的消化道模拟液是模拟食管到胃连续过程的模拟液,配置方法如下:将5mg/ml的胃蛋白酶溶于生理盐水中,分别将ph值调节至指定值后过滤除菌可得。
[0076]
阶段7的消化道模拟液是十二指肠模拟液,配置方法如下:10mg/ml的胰蛋白酶和3mg/ml的胆盐分别溶于生理盐水中后将ph值调节至5.0,过滤除菌。
[0077]
阶段8的消化道模拟液是小肠模拟液,配置方法如下:10mg/ml的胰蛋白酶和3mg/
ml的胆盐分别溶于生理盐水中,加入0.1mol/l的nahco3,然后将ph值调节至6.5,过滤除菌。
[0078]
②
取植物外泌体、植物外泌体-脂质体、植物外泌体-脂质体/多孔淀粉颗粒和口服植物外泌体水凝胶各1g,置于37℃预热过的9ml模拟消化液中,然后将其分别置于恒温摇床中进行孵育(37℃,100rpm/min),作用时间结束后即更换下一阶段模拟液,每次更换模拟液前,10000rpm/min离心2min,弃掉上清液后加入新阶段模拟液,涡旋30s以充分混合。分别取上述四组作用后的混合液各1ml,加入含0.2mol/l的nahco3的无菌磷酸盐缓冲液中,振荡30min,然后用bca法测定游离植物外泌体浓度。结果如表3:
[0079]
表3各组植物外泌体在模拟消化道中的稳定性
[0080][0081]
表3结果表明,植物外泌体在消化系统中会受到一定的破坏,这可能是由于系统的ph值等对其结构有一定的破坏作用,通过不同的包埋手段能够减少这种破坏损失,特别是口服植物外泌体水凝胶体系,能够更好地保护外泌体不被消化系统所破坏。
[0082]
5.靶向调节肠道效果评价
[0083]
(1)肠道靶向性
[0084]
①
实验动物选择
[0085]
雌性c57bl/6小鼠(6-8周龄)和sprague-dawley大鼠(4~6周龄),购于北京维通利华实验动物技术有限公司,在无病原体的洁净动物房按照标准程序适应性喂养一周后进行实验。所有涉及小鼠的实验都得到了空军军医大学实验动物中心动物伦理委员会批准。
[0086]
②
荧光标记的植物外泌体水凝胶制备
[0087]
用荧光亲脂染料dir(购自sigma)对pdnvs进行标记。具体方法如下:称取0.5mg的pdnvs加入到1ml的pbs缓冲液中,向其中加入1μl的dir染料,在室温下避光孵育30min。然后将标记的pdnvs通过100kd的超滤离心管去除游离染料从而得到荧光标记的植物外泌体(dir-pdnvs)。然后用荧光标记后的外泌体按照同样的方法制备外泌体水凝胶。
[0088]
③
体内荧光分布
[0089]
为了证实其肠道靶向性,将上述制备的植物外泌体水凝胶与饲料混合均匀,通过强饲法让禁食12h的小鼠口服摄取,每只小鼠摄入量为5g。口服12h后处死小鼠,采集胃、肠
组织,使用ivis光谱系列活体成像系统进行荧光成像,统计各组织的荧光强度。
[0090]
结果如图6,经过层级包埋之后该口服植物外泌体凝胶在胃组织的荧光强度更高,表明其具有良好的肠道靶向性,且能够较长时间作用于肠道。
[0091]
(2)肠道调节效果
[0092]
将大鼠随机分为两组,对照组每日正常喂食饲料30g,实验组每日喂食15g的植物外泌体水凝胶和15g的正常饲料。同样喂食14天。每天观察并记录大鼠的状态,每周固定同样的时间称重2次,发现sd大鼠在实验期间均行动灵活、毛色顺滑,正常饮食和饮水,体重均正常增加,无明显异常病理和死亡情况。
[0093]
同时在实验结束前4天收集大鼠粪便,每天收集后立即冻存于-80℃冰箱。随后称取大鼠粪便2g,置于200ml含0.1%蛋白胨稀释液的灭菌磨口三角瓶中,剧烈震荡使粪便样品混匀,混匀后梯度稀释至灭菌的装有9ml 0.1%蛋白胨稀释液的厌氧管内,随后取适当稀释后的粪便样品各200μl分别加入倒好的五种固体平板培养基(bbl琼脂、胆汁七夜苷叠氮钠琼脂、结晶紫中性红胆盐琼脂、mrs乳酸菌琼脂)中,涂布均匀,分别用于培养双歧杆菌、肠球菌、大肠杆菌、乳酸杆菌等,其中mrs乳酸菌琼脂置于厌氧罐中37℃培养48h,其余三种直接放于37℃含氧培养箱培养24h。随后按照标准平板计数方法对各平板菌落进行计数,结果如下表4:
[0094]
表4粪便四种菌平板计数统计表
[0095][0096]
注:结果以log
10
表示,*表示与正常饲料组相比有显著差异p《0.05。
[0097]
通过上述结果,喂食了植物外泌体水凝胶之后,有益菌双歧杆菌、乳酸杆菌的含量增加,致病菌肠球菌、大肠杆菌数量减少,表明其可以通过影响肠道菌群,改善肠道菌群分布从而发挥调节肠道的有益作用。
[0098]
同时将连续收集4天的大鼠粪便各取2g,放于烘箱中105℃烘干至恒重,测量烘干后重量,计算含水量:粪便含水量(重量%)=(粪便湿重-粪便干重)/粪便湿重
×
100%=水重/粪便湿重
×
100%。结果如下表5:
[0099]
表5粪便水分统计表
lipo
tm
neo的混合物融合形成一级结构,并嵌于多孔淀粉的内部孔道中,其中在一级结构中姜黄外泌体的终浓度为0.05%,小肽d3的终浓度为0.5%,pro-lipo
tm
neo的终浓度为3%;多孔淀粉嵌于海藻酸钠的三维网络结构中形成二级结构。
[0114]
上述口服植物外泌体水凝胶的制备方法同实施例1。
[0115]
实施例4
[0116]
一种靶向调节肠道的口服植物外泌体水凝胶,包括质量比为0.16:2.5:10:15:80的葡萄外泌体、小肽d3、pro-lipo
tm
neo、多孔淀粉和海藻酸钠;葡萄外泌体、小肽d3和pro-lipo
tm
neo的混合物融合形成一级结构,并嵌于多孔淀粉的内部孔道中,其中在一级结构中葡萄外泌体的终浓度为0.06%,小肽d3的终浓度为1%,pro-lipo
tm
neo的终浓度为4%;多孔淀粉嵌于海藻酸钠的三维网络结构中形成二级结构。
[0117]
上述口服植物外泌体水凝胶的制备方法同实施例1。
[0118]
实施例5
[0119]
一种靶向调节肠道的口服植物外泌体水凝胶,包括质量比为0.2:1:15:25:150的桑树皮外泌体、小肽d3、pro-lipo
tm
neo、多孔淀粉和海藻酸钠;桑树皮外泌体、小肽d3和pro-lipo
tm
neo的混合物融合形成一级结构,并嵌于多孔淀粉的内部孔道中,其中在一级结构中桑树皮外泌体的终浓度为0.04%,小肽d3的终浓度为0.2%,pro-lipo
tm
neo的终浓度为3%;多孔淀粉嵌于海藻酸钠的三维网络结构中形成二级结构。
[0120]
上述口服植物外泌体水凝胶的制备方法同实施例1。
[0121]
实施例6
[0122]
一种靶向调节肠道的口服植物外泌体水凝胶,包括质量比为0.5:10:40:50:250的洋葱外泌体、小肽d3、pro-lipo
tm
neo、多孔淀粉和海藻酸钠;洋葱外泌体、小肽d3和pro-lipo
tm
neo的混合物融合形成一级结构,并嵌于多孔淀粉的内部孔道中,其中在一级结构中洋葱外泌体的终浓度为0.05%,小肽d3的终浓度为1%,pro-lipo
tm
neo的终浓度为4%;多孔淀粉嵌于海藻酸钠的三维网络结构中形成二级结构。
[0123]
上述口服植物外泌体水凝胶的制备方法同实施例1。
[0124]
实施例7
[0125]
一种靶向调节肠道的口服植物外泌体水凝胶,包括质量比为0.4:4:20:20:100的大蒜外泌体、小肽d3、pro-lipo
tm
neo、多孔淀粉和海藻酸钠;大蒜外泌体、小肽d3和pro-lipo
tm
neo的混合物融合形成一级结构,并嵌于多孔淀粉的内部孔道中,其中在一级结构中大蒜外泌体的终浓度为0.1%,小肽d3的终浓度为1%,pro-lipo
tm
neo的终浓度为5%;多孔淀粉嵌于海藻酸钠的三维网络结构中形成二级结构。
[0126]
上述口服植物外泌体水凝胶的制备方法同实施例1。
[0127]
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1