用于治疗肢带肌营养不良的1,2-二氢喹啉-2-酮的制作方法
本发明属于药物化学领域。特别地,本发明涉及一种用于治疗特定类型的肌营养不良(即肢带肌营养不良(lgmd),包括肢带肌营养不良r1钙蛋白酶3相关的,也称为lgmdr1)的方法。
背景技术:
1、肌营养不良(md)是指一组以进行性骨骼肌无力、肌肉蛋白缺陷以及肌肉细胞和组织死亡为特征的肌肉疾病。包括duchenne、becker、肢带、先天性、面肩肱、肌强直性肌、眼咽、远端和emery dreifuss等不同疾病通常被归类为md,但共计有超过100种疾病与md相似。
2、大多数类型的md是具有在身体系统表现的多系统疾病,身体系统包括心脏、胃肠道和神经系统、内分泌腺、皮肤、眼睛甚至大脑。这种病症也可能导致情绪波动和学习困难。症状通常始于生命的前二十年,疾病逐渐恶化,通常导致发病后10或20年丧失行走能力。随后,肌肉退化发展成为一种高度致残的疾病,使患者无法完成简单的日常任务。
3、datta et al.(current neurology and neuroscience reports,2020,20:14)对肌营养不良综述进行了描述。从历史上看,这些疾病被认为很难治疗。然而,在过去的三十年里,在儿科群体中常见的肌营养不良领域,人们在开发新的治疗方法和生物标志物方面做出了许多努力。
4、在肌营养不良疾病中,肢带肌营养不良(lgmd)首次由walton和nattrass于1954年提出,作为肌营养不良分类的一部分。lgmd的特征是进行性对称性萎缩和近肢肌肉无力,以及升高的血清肌酸激酶。肌肉活检显示营养不良病变,以及肌电图显示肌病特征。
5、已经提出了不同的lgdm治疗策略(current neurology and neurosciencereports,2020,20:14),如使用皮质类固醇(泼尼松、平解唑)、抗氧化剂(表儿茶素可可类黄酮和表没食子儿茶素没食子酸绿茶多酚)、抗纤维化剂(辅酶q10和赖诺普利)、抗肌肉生长抑制素、基于基因的治疗和反义寡核苷酸。然而,除了基因检测之外,没有针对lgmd的护理医学疗法标准,也没有用于诊断的特定生物标志物。
6、存在几种类型的lgmd,包括与肢带肌营养不良r1钙蛋白酶3相关的,也称为lgmdr1、lgmd2a或钙蛋白酶病。这种类型是一种由于capn3基因突变的常染色体隐性肌营养不良,其导致骨盆和肩带近端肌肉的进行性退化。
7、肌肉纤维中蛋白质合成和降解之间的正确稳态是维持肌肉从而避免肌肉萎缩和虚弱的关键(scicchitano et al.,2018)。为此,存在某些信号传导途径,如akt/mtor途径,它刺激蛋白质合成、肌原纤维生长并抑制蛋白质降解(glass,2005)。控制肌肉细胞生长和分化的erk1/2mapk途径也参与成人的肌纤维维持(jones et al.,2001;roux et al.,2004;seaberg et al.,2015)。最后,在其他途径中,wnt信号传导参与肌肉发育过程中的分化和成人肌肉纤维的再生(von maltzahn et al.,2012)。
8、根据jaka et al.(expert reviews in molecular medicine,2017,19,1-16),有两种方法用于激活wnt信号途径:frzb的基因沉默和licl的施用。这两种方法都使患者肌管中被下调的β1d整合蛋白水平升高。
9、鉴于体外研究支持可能使lgmdr1患者的各种蛋白质的表达和磷酸化恢复到适当水平的观点,frbz表达的调节被认为是一个潜在的治疗靶点。具体而言,沉默该基因已导致lgmd2a患者肌管中的β1d整合蛋白恢复到正常水平。此外,由于已知frbz调节wnt途径下游β-联蛋白的定位,因此提出frzb可能在整合蛋白和wnt信号传导途径之间的串扰中发挥作用。
10、另一方面,用licl的治疗虽然有一些差异,但产生了与sifrbz获得的相似的结果,观察到frbz基因的表达水平较低,以及原代肌管中整合蛋白的β1d成人同种型水平较高。由于其在wnt信号传导途径中的激活剂作用,某些研究显示了有益的体外结果(duetal.2009,yang et al.2011,abu-baker et al.2013,jaka et al.2017)。然而,锂的参与仅显示在wnt信号传导途径中,而没有显示在与lgmdr1的发展有关的其他信号传导途径中。此外,还提到用licl的治疗与对gsk3β的抑制作用有关。
11、事实上,当wnt信号传导途径活跃时,wnt配体诱导gsk3β失活,阻止β-联蛋白磷酸化,使其在细胞质中积累,并将其作为转录因子移位到细胞核。相反,当wnt信号传导途径不失活时,gsk3β被激活。它磷酸化β-联蛋白,以致其随后被降解(macdonald et al.,2009)。
12、kurgan et al.(cells,2019,8134)公开了,低治疗剂量的锂(0.5mm)已显示出抑制gsk3并增强成肌细胞融合,这表明无毒剂量的锂可能是促进体内肌肉发育的有效选择。然而,在该文件中没有提到特定的疾病,但有一些迹象表明,使用锂可能会减轻在不同病症下观察到的一些肌肉萎缩。
13、whitley et al.(physiological reports,2020,8(14):e 14517)还报道了低剂量licl治疗可有效抑制gsk3β,并通过nfat激活增强某些肌肉的疲劳抵抗力。
14、另一方面,已知为vp0.7的化合物是gsk3的高度选择性和变构调节剂,其可逆地抑制该激酶(luna-medina et al.,journal of neuroscience,2007,27(21),5766-5776;palomo et al.,j.medicinal chemistry,2011,54(24),8461-8470)。该化合物及其衍生物已显示在脆性x(franklin et al.,biological psychiatry,2014,75,198-206)和多发性硬化症(beurel et al.,j.immunology,2013,190:5000-11)的临床前模型中具有活性。vp0.7也被用于促进或扩大干细胞群体中组织细胞生成的制剂以及许多其他gsk3抑制剂中(us2017/0252449、wo2018/191350和wo2020/081838)。据报道,该化合物的衍生物可纠正i型先天性强直性肌营养不良(cdm1)患者成肌细胞中延迟的肌生成(palomo et al.,j.medicinal chemistry,2017,60(12),4983-5001)。
15、鉴于以上所有情况,不存在有效的治疗肢带肌营养不良的疗法,更具体地,不存在用于治疗肢带肌营养不良r1钙蛋白酶3相关(lgmdr1)的疗法。事实上,钙蛋白酶3的缺失引起肌肉萎缩的病理生理机制尚不清楚。因此,非常需要了解lgmdr1患者肌肉中参与信号传导途径(如wnt和mtor)的蛋白质表达的变化,并寻找新的治疗剂来治疗这种疾病。
技术实现思路
1、本发明的作者已经发现,一些1,2-二氢喹啉-2-酮,如vp0.7,恢复参与调节肌肉稳态的信号传导途径(wnt和mtor途径)的关键蛋白的表达和磷酸化,并且在lgmdr1患者的肌肉中显著减少,从而开启了所述化合物作为治疗所述疾病的治疗选择的潜在用途。
2、也就是说,本发明人获得的结果已经证实,在所述患者的肌肉中存在活性β-联蛋白的减少,证实了wnt途径被改变。除此之外,在lgmdr1患者的肌肉中也观察到mtor信号传导途径的改变,这是由于mtor蛋白及其磷酸化的量减少。
3、通过在lgmdr1患者的肌管中施用本发明的化合物,已经观察到gsk3β的完全抑制,这导致β-联蛋白的量增加和mtor途径的激活。所述途径的恢复支持了所述1,2-二氢喹啉-2-酮作为治疗剂用于治疗lgmdr1患者的潜在益处。此外,一些实验已经指出,用所述化合物的治疗不会影响其他组织,从而避免不期望的不良反应。
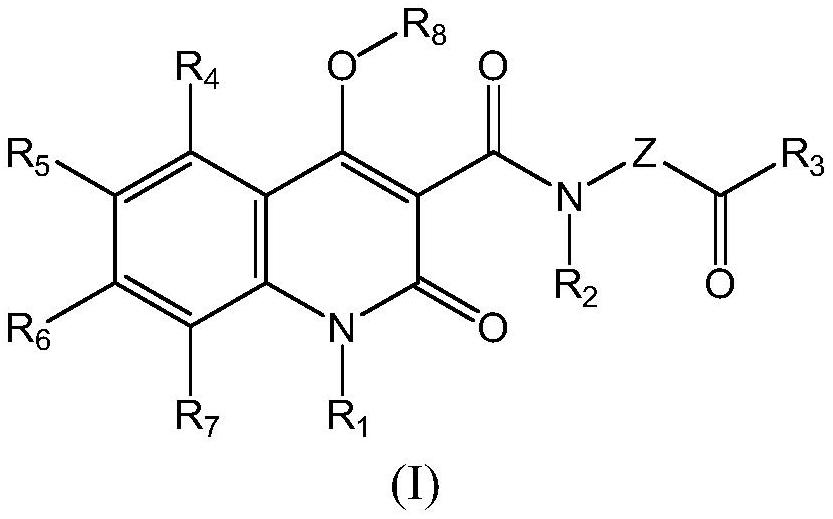
4、因此,本发明的主要方面涉及在治疗肢带肌营养不良中使用的式(i)的1,2-二氢喹啉-2-酮:
5、
6、其中:
7、r1选自h、任选取代的c1-c12烷基和任选取代的c2-c5链烯基;
8、r2是h或c1-c6烷基;
9、r3是任选取代的c1-c20烷基;
10、r4-r7独立地选自h、卤素、任选取代的c1-c6烷基和-or9,其中r9是氢或任选取代的c1-c6烷基;
11、r8选自h和任选c1-c6烷基;
12、z选自-nr10-和任选取代的亚苯基;其中r10选自h和任选取代的c1-c4烷基;
13、或其药学上可接受的盐或溶剂合物。
14、本发明还涉及如上限定的式(i)的化合物在制备用于治疗肢带肌营养不良的药物中的用途。
15、此外,本发明还涉及一种治疗肢带肌营养不良的方法,包括向有需要的患者施用有效量的如上限定的式(i)的化合物或其药学上可接受的盐或溶剂合物。
- 还没有人留言评论。精彩留言会获得点赞!