用于放射性金属标记的螯合剂官能化的靶向偶联物的放射性药物制剂的新试剂盒的制作方法
背景技术:
1、在现有技术中已描述了试剂盒制剂用于制备放射性金属标记的肽、特别是68ga标记的肽的用途:
2、wo2016030103(wouters等)公开了一种放射性标记试剂盒。
3、所述试剂盒包含适量的乙酸盐或缓冲剂、螯合剂官能化的靶向剂和金属抑制剂,所述金属抑制剂是能够使污染性金属失活的共螯合剂。
4、所述申请未解决试剂盒制剂在储存期间的长期稳定性问题。
5、wo2016030104(wouters等)公开了放射性金属标记方法。
6、所述方法包括在放射性标记反应期间使用“金属抑制剂”,以提高放射性金属标记的螯合剂官能化的靶向剂的放射性标记产率。
7、所述申请未解决试剂盒制剂在储存期间的长期稳定性问题。
8、nassiri等(nassiri等:coalitionforpetdrugapproval.files.wordpress.com/2016/06/nassiri-paulus-kit-for-ga-68-dotatate.pdf)公开了一种用于制备镓ga68dota偶联肽(dotatate)的试剂盒。
9、所述试剂盒包含生长抑素类似物dota偶联肽、菲咯啉(作为金属螯合剂)、龙胆酸和甘露糖醇。所述试剂盒在室温下具有12个月的保质期。
10、pandey等(j radioanal nucl chem,2016,1115–1124)描述了用于68ga标记的单瓶amba试剂盒。所述冻干试剂盒制剂含有amba肽、抗坏血酸和乙酸钠。所述试剂盒被储存在-20℃下直至进一步使用。
11、de barros等(appl.rad.and isotopes,2012,1440-2445)描述了一种用于制备99mtc标记的hynic-bala-铃蟾肽(7–14)的试剂盒制剂。所述试剂盒制剂包含用于99mtc标记的氯化亚锡。所述试剂盒制剂在-20℃下的稳定性得到证实。
12、vats等(journal of pharmaceutical and biomedical analysis,2019,39-44)描述了一种含有肽和乙酸钠的试剂盒。
13、本发明要解决的问题是提供一种用于制备放射性金属标记的螯合剂官能化的靶向偶联物、特别是放射性金属标记的螯合剂官能化的grp受体(grpr)靶向偶联物的冻干试剂盒制剂,其:
14、●可以容易地用于制备放射性金属标记的螯合剂官能化的靶向偶联物。
15、●与发生器或回旋加速器衍生的放射性金属溶液一起使用,在制备步骤中不还原所述放射性金属。
16、●对于使用68ga的标记来说,可以与各种发生器(和洗脱方法,例如hcl的体积和浓度)一起使用。
17、●提供所述放射性金属标记的螯合剂官能化的靶向偶联物而不被或很少被辐解分解。
18、●以不低于90%、优选地不低于92%、更优选地不低于95%的高纯度提供所述放射性金属标记的螯合剂官能化的靶向偶联物。
19、●满足肠胃外制剂冻干的监管要求,包括剂量均匀性和稳定性、冻干饼和冻干饼外观。
20、●可以在室温下储存至少一年的时间段而没有所述螯合剂官能化的靶向偶联物的分解(所述螯合剂官能化的肽偶联物的纯度不低于90%,优选地不低于95%,更优选地不低于98%)。
21、nassiri等和wo2016030103(wouters等)教导了在用于螯合剂官能化的肽的试剂盒制剂中使用糖醇(甘露糖醇)作为赋形剂,以获得在室温下稳定12个月并且可以容易地用68ga同位素标记的组合物。尽管存在这个教导,但发现糖醇甘露糖醇不足以用于制造包含螯合剂官能化的grpr靶向肽的冻干试剂盒制剂。
22、pandey等描述了一种单瓶试剂盒。由于所述试剂盒中存在预定量的缓冲剂(乙酸钠),因此所述试剂盒不能灵活地用于各种发生器(hcl体积和浓度的变化)。那些试剂盒的储存在-20℃下进行。此外,存在的乙酸钠不是适合于冻干的赋形剂。
23、由vats等人描述的试剂盒不含使放射性金属标记的螯合剂官能化的靶向偶联物稳定所需(特别是在较高的放射活性水平下)的放射性清除剂。此外,所述试剂盒含有乙酸钠。由于组分的玻璃化温度,无法根据肠胃外制剂冻干的监管要求(包括剂量均匀性和稳定性)实现冻干。
24、与使用甘露糖醇这种糖醇相反,发现含有非还原糖的试剂盒制剂满足冻干试剂盒制剂的要求,具体来说:
25、●所述放射性金属标记的螯合剂官能化的靶向偶联物易于制备。
26、●所述放射性金属标记的螯合剂官能化的靶向偶联物的纯度高。
27、●满足肠胃外制剂冻干的监管要求,包括剂量均匀性和稳定性。
28、●在室温下储存期间稳定性高。
29、本发明涉及一种使用特定试剂盒制剂进行放射性金属标记的螯合剂官能化的靶向偶联物的放射性药物制备的改进方法。
技术实现思路
1、除非另有定义,否则本文中使用的所有技术术语、符号和其他科学术语旨在具有本技术所属领域的普通技术人员通常理解的含义。在某些情况下,为了清楚和/或便于参考,在本文中定义了具有通常理解的含义的术语,并且在本文中包括此类定义不应必定被解释为表示与本领域中通常理解的含义存在实质性差异。
2、当在本文和权利要求书中使用时,单数形式包括复数指称物,除非上下文另有明确规定。
3、当在本文和权利要求书中使用时,术语“剂”与术语“部分”具有相同的含义,并且这两个术语可以相互替换。
4、在适合情况下,本文中说明性描述的本发明可以在不存在本文中未具体公开的任一个或多个要素、任一个或多个限制的情况下实践。因此,例如,在本文中的每种情况下,术语“包含”、“基本上由……组成”和“由……组成”中的任一者可以用其他两个术语中的任一者替换。
5、尽管术语“一个或多个”例如一组成员中的一个或多个成员本身是清楚的,但作为进一步举例,所述术语尤其包括对所述成员中的任一者或所述成员中的任两者或更多者,例如所述成员中的任意>3、>4、>5、>6或>7个等的成员直至所有所述成员的指称。
6、本说明书中引用的所有文件均整体通过引用并入本文。
7、术语“蛋白质”、“肽”和“多肽”可互换使用,表示氨基酸聚合物或一组两个或更多个相互作用或结合的氨基酸聚合物。所述术语适用于其中一个或多个氨基酸残基是相应的天然存在的氨基酸的人工化学模拟物的氨基酸聚合物,以及天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。
8、术语“氨基酸”是指天然存在和合成的氨基酸,以及以类似于天然存在的氨基酸的方式发挥作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的氨基酸,以及后来被修饰的氨基酸例如羟脯氨酸、γ-羧基谷氨酸和o-磷酸丝氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构,即与氢、羧基、氨基和r基团结合的碳的化合物,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。这些类似物具有修饰的r基团(例如正亮氨酸)或修饰的肽骨架,但保留了与天然存在的氨基酸相同的基本化学结构。氨基酸模拟物是指具有与氨基酸的一般化学结构不同的结构,但以类似于天然存在的氨基酸的方式发挥作用的化学化合物。术语“非天然存在的氨基酸”和“非天然氨基酸”是指在自然界中未发现的氨基酸类似物、合成氨基酸和氨基酸模拟物。氨基酸在本文中可以用其通常已知的三字母符号或由iupac-iub生物化学命名委员会推荐的单字母符号来指称。同样,核苷酸也可以用它们普遍接受的单字母代码来指称。
9、术语“标记缓冲液”是指必须无毒,必须有效地将ph维持在3.0至5.0的范围内,不应与镓-68离子竞争,并且优选地相对于螯合剂与靶向剂组装时的能力而言具有低金属螯合能力的溶液。它还必须能够耐受发生器洗脱液体积(以及因此hcl的量)的可能的小变化,即它必须足够强,以在洗脱液体积变化10%的情况下将ph维持在所需范围内。适合的缓冲剂包括例如乙酸盐、甲酸盐、酒石酸盐、柠檬酸盐、磷酸盐等。
10、术语“放射性药物制剂”或“放射性药物组合物”意指采取适合于人类给药的形式的包含本发明的放射性金属络合物的组合物。对于人类给药来说,放射性药物制剂必须是无菌的。或者,本发明的放射性药物制剂也可以以人类注射即用型单位剂量形式提供,并且可以例如被提供成预装无菌注射器。所述含有单位剂量的注射器也将被提供在注射器护套中(以保护操作人员免受潜在的放射活性剂量的影响)。
11、在下面的段落中更详细地定义了本发明的不同方面或实施方式。除非另有陈述,否则如此定义的每个方面和实施方式可以与每个其他方面或实施方式组合。具体而言,在一个实施方式中被指示为优选或有利的任何特征可以与被指示为优选或有利的任何其他一个或多个实施方式相组合。
12、本发明的主题内容是一种用于制备放射性金属标记的螯合剂官能化的靶向偶联物的冻干试剂盒制剂,所述制剂包含:
13、●螯合剂官能化的靶向偶联物,
14、●至少一种选自海藻糖和蔗糖的非还原糖,
15、●至少一种放射稳定剂,其选自抗坏血酸、抗坏血酸盐、龙胆酸、龙胆酸盐或其混合物。
16、本发明的主题内容是一种用于制备放射性金属标记的螯合剂官能化的靶向偶联物的冻干试剂盒制剂,其中具体而言,所述制剂中的非还原糖浓度为10-600μmol,优选为20-500μmol,更优选为50-300μmol。
17、在本发明的试剂盒制剂的一个实施方式中,所述制剂含有5-250mg、优选地10-100mg的海藻糖。
18、在本发明的试剂盒制剂的一个实施方式中,所述制剂含有5-250mg、优选地10-100mg的蔗糖。
19、在所述试剂盒制剂的另一个实施方式中,使用非还原糖的混合物。
20、在本发明的试剂盒制剂的一个实施方式中,所述放射稳定剂选自抗坏血酸、抗坏血酸盐或其混合物。
21、在本发明的试剂盒制剂的一个特定实施方式中,所述放射稳定剂是抗坏血酸。
22、在本发明的试剂盒制剂的一个实施方式中,所述制剂中所述放射稳定剂的浓度为1-500μmol,优选为5-250μmol,更优选为10-100μmol。
23、在本发明的试剂盒制剂的一个实施方式中,所述制剂中抗坏血酸的量为1-20mg,更优选为1-10mg。
24、在本发明的试剂盒制剂的一个实施方式中,所述螯合剂官能化的靶向偶联物包含:
25、●螯合剂或部分,
26、●任选的至少一个接头,其将所述螯合部分与所述靶向部分相连,和
27、●至少一个靶向剂或部分。
28、本文所使用的“螯合剂官能化的靶向偶联物”是指能够利用与靶向剂连接的螯合剂/部分用放射性同位素例如镓-68标记的靶向剂/部分。任选地,存在至少一个接头以将所述螯合剂/部分与所述靶向剂/部分相连。
29、用于对将要用镓-68放射性标记的靶向剂进行官能化的优选螯合剂是那些能够与ga3+、特别是68ga3+(使用hcl从锗-68/镓-68发生器洗脱的放射性同位素生成物)形成稳定螯合物的螯合剂,所述螯合物的持续时间至少足以使用此类放射性标记的靶向剂进行诊断研究。适合的螯合剂包括脂族胺、线性或大环胺例如具有叔胺的大环胺。
30、尽管适合的螯合剂的这些实例不受限制,但它们优选地包括dota、nota及其衍生物例如tacn、tacn-tm、dtac、h3noka、nodasa、nodaga、notp、notpme、prp9、trap、trappistpr、nopo、teta;三(羟基吡啶酮)(thp)及其衍生物,开链螯合剂例如hbed、dfo或去铁胺或甲磺酸去铁胺、edta、6ss、b6ss、pled、tame、ym103;ntp(prhp)3;h2dedpa及其衍生物例如h2dedpa-1、2-h2dedpa、h2dp-bb-ncs和h2dp-n-ncs;(4,6-me02sal)2-bapen;以及柠檬酸盐及其衍生物。在本发明的试剂盒制剂的一个实施方式中,所述螯合部分选自nota及其衍生物和/或dota及其衍生物。在本发明的试剂盒制剂的一个特定实施方式中,所述螯合部分是dota。
31、所述靶向剂可以是肽(例如包含2至20个氨基酸的肽)、多肽、蛋白质、维生素、糖(例如单糖或多糖)、抗体及其衍生物(例如纳米体、双体抗体)、抗体片段、核酸、适体、反义寡核苷酸、有机分子或能够与某种诊断靶结合或表达某种代谢活性的任何其他生物分子。
32、本文所描述的靶向剂优选地具有生物靶向能力。适合的靶向剂的非限制性实例包括靶向vegf受体的分子、铃蟾肽类似物或grp受体(grpr)靶向分子、靶向生长抑素受体的分子、rgd肽或靶向ανβ3和ανβ5的分子、膜联蛋白v或靶向凋亡过程的分子、靶向雌激素受体的分子。更通常来说,无论是有机还是非有机的被螯合剂官能化的靶向分子的名单可以在velikyan等,theranostic 2014,vol.4,第1期“68ga放射性药物的开发前景”(prospectiveof 68ga-radiopharmaceutical development)中找到。
33、本发明的肽可以是天然存在的或合成来源的,但优选是合成的。
34、在本发明的试剂盒制剂的一个实施方式中,所述螯合剂官能化的肽偶联物的靶向部分包含grp受体(grpr)靶向分子,更优选为选自下述的grpr靶向肽序列:
35、-gln-trp-ala-val-gly-his,
36、-d-phe-gln-trp-ala-val-gly-his,
37、-gln-trp-ala-val-gly-his-sta,
38、-d-phe-gln-trp-ala-val-gly-his-sta,
39、-gln-trp-ala-val-gly-his-leuψ(choh-ch2)-(ch2)2-ch3,
40、-d-phe-gln-trp-ala-val-gly-his-leuψ(choh-ch2)-(ch2)2-ch3,
41、-d-phe-gln-trp-ala-val-gly-his-leuψ(ch2nh),
42、-gln-trp-ala-val-gly-his-leuψ(ch2nh),
43、-gln-trp-ala-val-gly-his-sta-leu-nh2,
44、-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2。
45、在本发明的试剂盒制剂的一个实施方式中,所述螯合剂官能化的肽偶联物选自:
46、-dota-4-氨基-1-羧甲基-哌啶-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2,
47、-nota-4-氨基-1-羧甲基-哌啶-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2,
48、-nodaga-4-氨基-1-羧甲基-哌啶-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2。
49、在本发明的试剂盒制剂的一个实施方式中,所述螯合剂官能化的肽偶联物是dota-4-氨基-1-羧甲基-哌啶-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2。
50、在本发明的试剂盒制剂的一个实施方式中,存在至少一个接头,以将所述螯合剂/部分与所述靶向剂/部分相连。所述螯合剂官能化的靶向偶联物的接头选自键、天然氨基酸、非天然氨基酸、线性二胺、环状二胺、线性羧酸、环状羧酸、聚乙二醇(peg)及其组合。接头可以包含约5至9个氨基酸的肽序列,包含或不包含其他基团例如长度为至多5个碳的脂族基团。优选的接头基团是-聚lys-、-聚glu-、-(gly)z-glu-(lys)3-、(gly)2glu-lys-glu-lys-、(phe)2-(ch2)s-、(lys)6-gly-、-(gly)3-(dglu)3-和-(gly)3(氨基己酸)2-。
51、在本发明的试剂盒制剂的一个实施方式中,所述接头选自天然氨基酸、非天然氨基酸、线性二胺、环状二胺、线性羧酸、环状羧酸、聚乙二醇(peg)及其组合。
52、更优选地,所述接头选自4-氨基-l-羧甲基哌啶、(r,s)-二氨基乙酸、peg1-24、sar-10、8-氨基辛酸、6-氨基己酸、4-(2-氨基乙基)-l-羧甲基哌嗪、二氨基丁酸、马尿酸、4-氨基-l-boc-哌啶-4-甲酸、gly-氨基苯甲酸、5-氨基-3-氧杂-戊基-琥珀酰胺酸、peg1-24-4-氨基-l-羧甲基哌啶、dab(莽草酸)、(d-gln)x、(d-asn)x。
53、在本发明的试剂盒制剂的一个实施方式中,所述接头是4-氨基-1-羧甲基-哌啶。
54、在本发明的试剂盒制剂的一个实施方式中,所述试剂盒制剂含有5-500nmol的螯合剂官能化的靶向偶联物,优选地5-150nmol的螯合剂官能化的靶向偶联物,更优选地10-100nmol的螯合剂官能化的靶向偶联物。
55、在本发明的试剂盒制剂的一个实施方式中,处于冻干状态下的所述制剂可以是结晶、部分结晶、部分无定形或无定形制剂。
56、在本发明的试剂盒制剂的一个实施方式中,所述制剂是无定形制剂。
57、在本发明的试剂盒制剂的一个实施方式中,所述制剂具有≤1%、优选地≤0.5%的残留水分。
58、在本发明的试剂盒制剂的一个实施方式中,所述冻干制剂是无菌的。
59、在本发明的试剂盒制剂的一个实施方式中,在25℃/60% rh下储存12个月后,所述制剂中螯合剂官能化的靶向偶联物的分解≤10%,优选地≤5%,更优选地≤3%。
60、在本发明的试剂盒制剂的一个实施方式中,在25℃/60% rh下储存12个月后,从所述制剂制备的放射性金属标记的螯合剂官能化的靶向偶联物的放射化学纯度≥90%,优选地≥93%,更优选地≥95%。
61、在本发明的试剂盒制剂的一个实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用三价或二价放射性金属阳离子标记。
62、在本发明的试剂盒制剂的一个实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用三价放射性金属阳离子标记。
63、在本发明的试剂盒制剂的一个实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用二价放射性金属阳离子标记。
64、在本发明的试剂盒制剂的一个实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用选自ga、cu、lu、y、pb、ac、bi、sc、th的同位素标记。
65、在本发明的试剂盒制剂的一个实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用选自68ga、64cu、67cu、177lu、86y、90y、212pb、225ac、213bi、44sc、227th的同位素标记。
66、在本发明的试剂盒制剂的一个实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用选自68ga、64cu、67cu、177lu、86y、90y、212pb、225ac、213bi、44sc、227th或18f-al的同位素标记。
67、在本发明的试剂盒制剂的一个实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用选自68ga、64cu、67cu、177lu、86y、90y、212pb、225ac、213bi、44sc或18f-al的同位素标记。
68、在本发明的试剂盒制剂的一个特定实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用68ga标记。
69、在本发明的试剂盒制剂的一个实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用177lu标记。
70、在本发明的试剂盒制剂的一个实施方式中,所述用于制备螯合剂官能化的靶向偶联物的制剂用18f-al标记。
71、本发明的主题内容还是一种使用根据本发明所述的试剂盒制剂制备放射性金属标记的螯合剂官能化的靶向偶联物的方法,所述方法包括下述步骤:
72、●将所述放射性金属的溶液与根据前述实施方式中任一项所述的试剂盒制剂混合,
73、●任选地,添加至少一种标记缓冲液或标记缓冲液的混合物,
74、●使根据前述实施方式中任一项所述的螯合剂官能化的靶向偶联物与所述放射性金属络合。
75、在一个实施方式中,所述方法还包括下述步骤:
76、●在所述络合步骤后添加稀释剂,和/或
77、●分配所述放射性金属标记的螯合剂官能化的靶向偶联物的给药体积。
78、在一个实施方式中,所述使用根据本发明所述的试剂盒制剂制备放射性金属标记的螯合剂官能化的靶向偶联物的方法包括下述步骤:
79、●将所述放射性金属的溶液与根据前述实施方式中任一项所述的试剂盒制剂混合,
80、●任选地,添加至少一种标记缓冲液或标记缓冲液的混合物,
81、●使根据前述实施方式中任一项所述的螯合剂官能化的靶向偶联物与所述放射性金属络合,
82、●在所述络合步骤后添加稀释剂,和/或
83、●分配所述放射性金属标记的螯合剂官能化的靶向偶联物的给药体积。
84、在一个实施方式中,所述用于放射性药物制备的方法手动进行。
85、在另一个实施方式中,一种装置被用于
86、●添加所述放射性金属的溶液,
87、●任选地添加至少一种(标记)缓冲液,
88、●进行所述螯合剂官能化的靶向偶联物的络合,或
89、●任选地添加稀释剂,所述稀释剂优选地选自注射用水、盐水或生理缓冲液。
90、在根据本发明的方法的一个特定实施方式中,所述络合步骤在0-150℃之间、优选地在25℃(室温)下或50℃至150℃之间、更优选地在80℃至120℃之间、甚至更优选地在90至110℃之间进行。
91、在根据本发明的方法的一个特定实施方式中,为了络合,可以将所述制剂用任何类型的加热器或微波加热。
92、在根据本发明的方法的一个特定实施方式中,所述络合进行0.5min至30min、优选地1min至20min、优选地1min至10min、更优选地5至10min。
93、在根据本发明的方法的一个特定实施方式中,所述(标记)缓冲液选自乙酸盐缓冲液、甲酸盐缓冲液。
94、在根据本发明的方法的一个特定实施方式中,所述络合在2.5至5、更优选地3.5至4.5的ph值下进行。
95、在根据本发明的方法的一个特定实施方式中,通过这种方法获得的螯合剂官能化的靶向偶联物表现出≥90%、优选地≥92%、更优选地≥95%的纯度。
96、本发明还涉及一种放射性药物组合物,其包含任何上述本发明的放射性金属标记的螯合剂官能化的靶向偶联物。
97、在一个实施方式中,本发明的放射性药物组合物包含:
98、●本发明的放射性金属标记的螯合剂官能化的靶向偶联物,
99、●至少一种选自海藻糖和蔗糖的非还原糖,和
100、●至少一种放射稳定剂,其选自抗坏血酸、抗坏血酸盐、龙胆酸、龙胆酸盐或其混合物。
101、在一个特定实施方式中,本发明的主题内容是一种试剂盒,其包含:
102、●包含如上所述根据本发明所述的冻干试剂盒制剂的小瓶;
103、●包含至少一种标记缓冲液或标记缓冲液的混合物的小瓶或注射器,和/或
104、●包含放射性金属的溶液的小瓶或注射器。
105、在优选实施方式中,所述试剂盒制剂是无菌的。
106、在优选实施方式中,所述标记缓冲液是无菌的。
107、在优选实施方式中,所述稀释剂是无菌的。
108、在优选实施方式中,所述用于放射性药物制备的方法提供了所述放射性金属标记的螯合剂官能化的靶向偶联物的无菌溶液。优选地,所述溶液可随时用于给药到人体中。
109、根据上述背景,下面连续编号的实施方式提供了本发明的其他特定方面:
110、1.一种用于制备放射性金属标记的螯合剂官能化的靶向偶联物的冻干试剂盒制剂,所述制剂包含:
111、●螯合剂官能化的靶向偶联物,
112、●至少一种选自海藻糖和蔗糖的非还原糖,
113、●至少一种放射稳定剂,其选自抗坏血酸、抗坏血酸盐、龙胆酸、龙胆酸盐或其混合物。
114、2.根据实施方式1所述的试剂盒制剂,其中所述制剂中的非还原糖浓度为10-600μmol,优选为20-500μmol,更优选为50-300μmol。
115、3.根据实施方式1或2所述的试剂盒制剂,其中所述试剂盒制剂含有5-250mg、优选地10-100mg的海藻糖。
116、4.根据实施方式1或2所述的试剂盒制剂,其中所述试剂盒制剂含有5-250mg、优选地10-100mg的蔗糖。
117、5.根据实施方式1至4中任一项所述的试剂盒制剂,其中所述放射稳定剂选自抗坏血酸、抗坏血酸盐或其混合物。
118、6根据实施方式1至5中任一项所述的试剂盒制剂,其中所述制剂中所述放射稳定剂的浓度为1-500μmol,优选为5-250μmol,更优选为10-100μmol。
119、7.根据实施方式1至6中任一项所述的试剂盒制剂,其中所述制剂中抗坏血酸的量为1-20mg,更优选为1-10mg。
120、8.根据实施方式1至7中任一项所述的试剂盒制剂,其中所述螯合剂官能化的靶向偶联物包含:
121、●螯合部分,
122、●任选的至少一个接头,其将所述螯合部分与所述靶向部分相连,和
123、●至少一个靶向部分。
124、9.根据实施方式8所述的试剂盒制剂,其中所述螯合部分选自tacn、tacn-tm、dtac、h3noka、nodasa、nodaga、notp、notpme、prp9、trap、trappist pr、nopo、teta;三(羟基吡啶酮)(thp)及其衍生物,开链螯合剂例如hbed、dfo或去铁胺或甲磺酸去铁胺、edta、6ss、b6ss、pled、tame、ym103;ntp(prhp)3;h2dedpa及其衍生物例如h2dedpa-1、2-h2dedpa、h2dp-bb-ncs和h2dp-n-ncs;(4,6-me02sal)2-bapen;以及柠檬酸盐及其衍生物。
125、10.根据实施方式8所述的试剂盒制剂,其中所述螯合部分是nota及其衍生物和/或dota及其衍生物,优选为dota。
126、11.根据实施方式8至10中任一项所述的试剂盒制剂,其中所述接头选自键、天然氨基酸、非天然氨基酸、线性二胺、环状二胺、线性羧酸、环状羧酸、聚乙二醇(peg)及其组合。
127、12.根据实施方式8至11中任一项所述的试剂盒制剂,其中所述接头选自4-氨基-l-羧甲基哌啶、(r,s)-二氨基乙酸、peg1-24、sar-10、8-氨基辛酸、6-氨基己酸、4-(2-氨基乙基)-l-羧甲基哌嗪、二氨基丁酸、马尿酸、4-氨基-l-boc-哌啶-4-甲酸、gly-氨基苯甲酸、5-氨基-3-氧杂-戊基-琥珀酰胺酸、peg1-24-4-氨基-l-羧甲基哌啶、dab(莽草酸)、(d-gln)x、(d-asn)x。
128、13.根据实施方式8至13中任一项所述的试剂盒制剂,其中所述接头是4-氨基-1-羧甲基-哌啶。
129、14.根据实施方式8至13中任一项所述的试剂盒制剂,其中所述靶向部分选自靶向vegf受体的分子、铃蟾肽类似物或grp受体(grpr)靶向分子、靶向生长抑素受体的分子、rgd肽或靶向ανβ3和ανβ5的分子、膜联蛋白v或靶向凋亡过程的分子、靶向雌激素受体的分子。
130、15.根据实施方式14所述的试剂盒制剂,其中所述grp受体(grpr)靶向分子是grpr靶向肽。
131、16.根据实施方式14所述的试剂盒制剂,其中所述grp受体(grpr)靶向分子包含选自下述的肽序列:
132、-gln-trp-ala-val-gly-his,
133、-d-phe-gln-trp-ala-val-gly-his,
134、-gln-trp-ala-val-gly-his-sta,
135、-d-phe-gln-trp-ala-val-gly-his-sta,
136、-gln-trp-ala-val-gly-his-leuψ(choh-ch2)-(ch2)2-ch3,
137、-d-phe-gln-trp-ala-val-gly-his-leuψ(choh-ch2)-(ch2)2-ch3,
138、-d-phe-gln-trp-ala-val-gly-his-leuψ(ch2nh),
139、-gln-trp-ala-val-gly-his-leuψ(ch2nh),
140、-gln-trp-ala-val-gly-his-sta-leu-nh2,
141、-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2。
142、17.根据实施方式1至16中任一项所述的试剂盒制剂,其中所述螯合剂官能化的偶联物选自:
143、-dota-4-氨基-1-羧甲基-哌啶-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2,
144、-nota-4-氨基-1-羧甲基-哌啶-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2,或
145、-nodaga-4-氨基-1-羧甲基-哌啶-d-phe-gln-trp-ala-val-gly-his-sta-leu-nh2。
146、18.根据实施方式1至17中任一项所述的试剂盒制剂,其中所述试剂盒制剂含有5-500nmol的螯合剂官能化的靶向偶联物,优选地5-150nmol的螯合剂官能化的靶向偶联物,更优选地10-100nmol的螯合剂官能化的靶向偶联物。
147、19.根据实施方式18所述的试剂盒制剂,其中所述制剂是结晶、部分结晶、部分无定形或无定形制剂。
148、20.根据实施方式18或19所述的试剂盒制剂,其中所述冻干制剂是无菌的。
149、21.根据实施方式1至20中任一项所述的试剂盒制剂,其中所述制剂具有≤1%、优选地≤0.5%的残留水分。
150、22.根据实施方式1至21中任一项所述的试剂盒制剂,其中在25℃/60% rh下储存12个月后,所述制剂中螯合剂官能化的靶向偶联物的分解≤10%,优选地≤5%,更优选地≤3%。
151、23.根据实施方式1至22中任一项所述的试剂盒制剂,其中在25℃/60% rh下储存12个月后,从所述制剂制备的放射性金属标记的螯合剂官能化的靶向偶联物的放射化学纯度≥90%,优选地≥93%,更优选地≥95%。
152、24.根据实施方式1至23中任一项所述的试剂盒制剂,其中所述用于制备螯合剂官能化的靶向偶联物的制剂用三价放射性金属阳离子或二价放射性金属阳离子标记。
153、25.根据实施方式1至24中任一项所述的试剂盒制剂,其中所述用于制备螯合剂官能化的靶向偶联物的制剂用选自68ga、64cu、67cu、177lu、86y、90y、212pb、225ac、213bi、44sc或18f-al的同位素标记。
154、26.根据实施方式1至25中任一项所述的试剂盒制剂,其中所述用于制备螯合剂官能化的靶向偶联物的制剂用68ga标记。
155、27.一种使用根据实施方式1至26中任一项所述的试剂盒制剂制备放射性金属标记的螯合剂官能化的靶向偶联物的方法,所述方法包括下述步骤:
156、●将所述放射性金属的溶液与根据实施方式1至26中任一项所述的试剂盒制剂混合,
157、●任选地,添加至少一种标记缓冲液或标记缓冲液的混合物,
158、●使根据实施方式1至26中任一项所述的螯合剂官能化的靶向偶联物与所述放射性金属络合。
159、28.根据实施方式27所述的方法,其还包括下述步骤:
160、●在所述络合步骤后添加稀释剂,和/或
161、●分配所述放射性金属标记的螯合剂官能化的靶向偶联物的给药体积。
162、29.根据实施方式27或28所述的方法,其中所述络合步骤在0-150℃之间、优选地在25℃(室温)下或在50℃至150℃之间、更优选地在80℃至120℃之间、甚至更优选地在90至110℃之间进行。
163、30.根据实施方式27至29中任一项所述的方法,其中所述络合通过加热手段、优选为加热器或微波来进行。
164、31.根据实施方式27至30中任一项所述的方法,其中所述络合进行0.5min至30min、优选地1min至20min、优选地1min至10min、更优选地5至10min。
165、32.根据实施方式27至31中任一项所述的方法,其中所述标记缓冲液选自乙酸盐缓冲液或甲酸盐缓冲液。
166、33.根据实施方式27至32中任一项所述的方法,其中通过这种方法获得的螯合剂官能化的靶向偶联物表现出≥90%、优选地≥92%、更优选地≥95%的纯度。
167、34.根据实施方式27至33中任一项所述的方法,其中所述络合在2.5至5、更优选地3.5至4.5的ph值下进行。
168、35.一种放射性金属标记的螯合剂官能化的靶向偶联物,其可通过根据实施方式27至34中任一项所述的方法获得。
169、36.一种放射性药物组合物,其包含根据实施方式35所述的放射性金属标记的螯合剂官能化的靶向偶联物。
170、37.一种放射性药物组合物,其包含:
171、●根据实施方式35所述的放射性金属标记的螯合剂官能化的靶向偶联物,
172、●至少一种选自海藻糖和蔗糖的非还原糖,和
173、●至少一种放射稳定剂,其选自抗坏血酸、抗坏血酸盐、龙胆酸、龙胆酸盐或其混合物。
174、38.一种试剂盒,其包含:
175、●包含根据实施方式1至26中任一项所述的冻干试剂盒制剂的小瓶;
176、●包含至少一种标记缓冲液或标记缓冲液的混合物的小瓶或注射器,和/或
177、●包含放射性金属的溶液的小瓶或注射器。
178、实施例
179、化学品:
180、●rm2-dota(gmp),abx
181、●三水合乙酸钠
182、●甲酸钠,sigma aldrich 456020-25g
183、●l-抗坏血酸钠,sigma,11140-50g
184、●l-抗坏血酸(traceselect,fluka,#:05878;sigma,#:phr1068-2g;20-80号筛网gmp,#0938-05,jt baker;roth,#:6288.1;appli chem,#:141013.1208)
185、●2,5-二羟基苯甲酸,sigma aldrich#:149357
186、●超纯2,5-二羟基苯甲酸,sigma aldrich#:39319-10x10 mg-f
187、●水traceselect,fluka,95305
188、●30% hcl traceselect,merck,1.01514.0500
189、●0.1m hcl(将1.06ml 30% hcl用水traceselect溶解至100ml;rotem prod.#:k72001p;abx prod.#:hcl-103-g)
190、●二水合d-(+)-海藻糖,sigma aldrich t9531-100g
191、●聚乙烯吡咯烷酮k25,fluka,#:90268
192、●聚乙烯吡咯烷酮40,sigma,#:pvp40
193、●海藻糖,fluka,#:phr1344
194、●山梨糖醇固体,sigma,#:phr 1006
195、●d-山梨糖醇,sigma-aldrich,#:97336-1kg-f
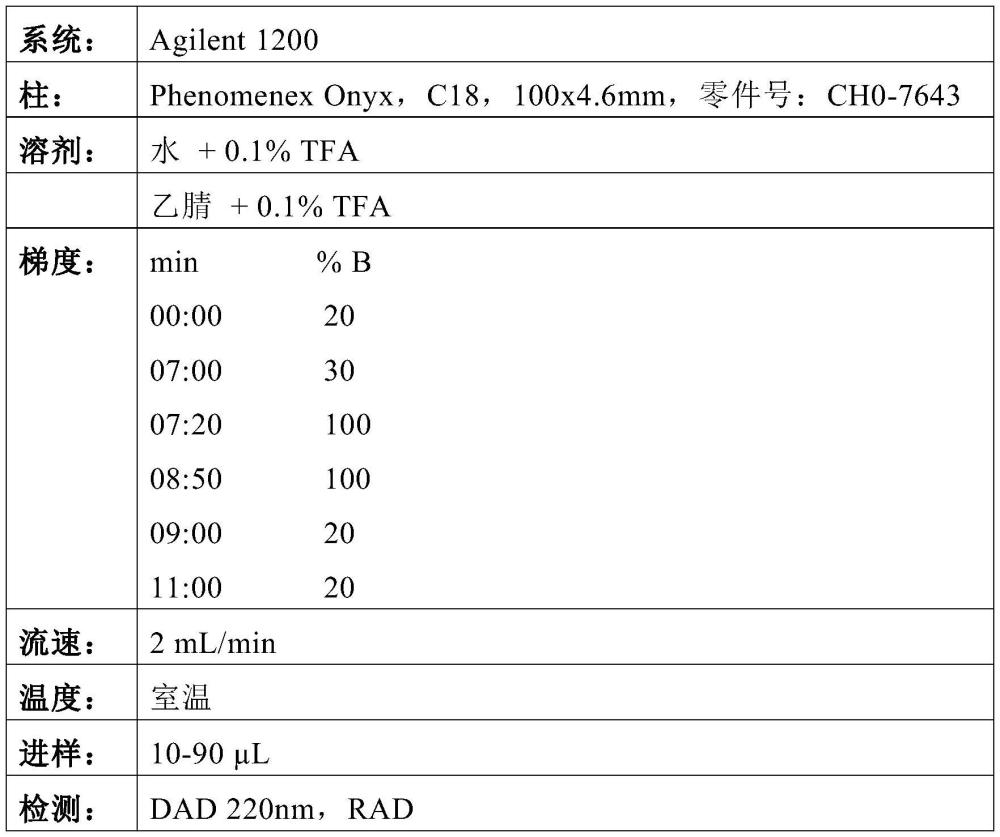
196、●蔗糖,sigma,#:s7903
197、●polysorbat 80,fluka,#:59924-100
198、●polysorbat 20,fluka,#:44112
199、●甘露糖醇,sigma,#:phr 1007
200、●d-甘露糖醇,sigma,#:m8429
201、●2-羟乙基纤维素,aldrich,#:308633
202、●羟丙甲纤维素,sigma,#:h3785
203、●葡聚糖,sigma,#:d9260-50
204、●d-(-)-果糖,sigma,#:f9048-100g
205、●d-(+)-葡萄糖,sigma,#:g7528-250g
206、材料:
207、●顶空小瓶,9,5ml,3131-5245-k 1硼硅酸盐玻璃,e&z
208、●tc-elu-5小瓶(15ml)
209、●“通气小瓶接头”von helapet,#:iv0020
210、●注射用小瓶10r,fiolax–透明玻璃,nipro,#:mg037-002-0049-086(由gilyos交付)
211、●10ml透明schott(fiolax)1plus型(sio2)涂层小瓶(由adelphi交付)
212、●fluoro-tec隔膜,west pharma,#:13194023/50/grey/sil adb(由gilyos交付)
213、●冷冻干燥塞,fluorotec涂层,bromobutyl 4023/50灰色,westar rs p(由adelphi交付)
214、●注射器,f solo,1ml,bbraun#:9166017v
215、●注射器,f solo,5ml,bbraun#:4606051v
216、●金属针头gr.2,g 21x 1/1”,0.80x 0.40,bbraun#:4657527
217、itlc:
218、●agilent technologies,itlc-sg色谱纸,目录号:sgi0001设备:
219、●modular lab pharm tracer+加热器模块hrm-6299+小瓶接头(3111-2603)(eckert&ziegler)
220、●[68ga]gacl3:发生器igg100-50m,批号:1779-14,1856-1eckert&ziegler
221、●[68ga]gacl3:发生器igg101-50mgallia pharm,批号:lghe03,eckert&ziegler
222、●[68ga]gacl3:发生器id:gag-16-151,itg
223、●ph计766,calimatic,knick
224、●磷光成像仪
225、分析方法:
226、所述冻干试剂盒制剂中的肽的稳定性通过分析hplc来确定。所述放射性金属标记的螯合剂官能化的靶向偶联物的放射化学纯度通过hplc和tlc来确定。
227、分析hplc方法1:
228、
229、分析hplc方法2:
230、
231、tlc方法:乙酸铵1m:甲醇(1:1v/v)。保留因子(rf)技术参数如下:未络合的ga 68物质,rf=0至0.1;68ga-rm2,rf=0.8至1。
232、放射性标记程序
233、对于eckert&ziegler发生器gg100或igg 101来说,将所述发生器用5ml 0.1m hcl直接洗脱到冻干试剂盒制剂中。添加标记缓冲液(85mg乙酸钠在200-300μl traceselect水中或100mg甲酸钠在200-300μl traceselect水中),并将小瓶在沸水浴中加热8min。
234、对于itg发生器来说,将所述发生器用4ml 0.05m hcl直接洗脱到冻干试剂盒制剂中。添加标记缓冲液(35mg甲酸钠在200-300μl中),并将小瓶在沸水浴中加热8min。
235、冻干试剂盒制剂的制备
236、小瓶(填充体积1ml)的冷冻/干燥循环包括:
237、●冷冻设定点-45℃,升降温速率1℃/min
238、●一次/二次干燥-30℃–40℃,真空设定点40mtorr,
239、总循环时间:48h。
240、表1:所评估的制剂
241、 制剂 组成 比较性制剂a 50μg肽1 比较性制剂b 50μg肽1,5mg抗坏血酸 比较性制剂c 50μg肽1,40mg甘露糖醇,5mg抗坏血酸 比较性制剂d 50μg肽1,40mg甘露糖醇,0.01%ps 80,5mg抗坏血酸 比较性制剂e 50μg肽1,40mg甘露糖醇,0.01%mgps20,5mg抗坏血酸 制剂1a 50μg肽1,30mg海藻糖,5mg抗坏血酸 制剂1b 50μg肽1,50mg海藻糖,5mg抗坏血酸 制剂1c 50μg肽1,100mg海藻糖,5mg抗坏血酸 制剂1d 50μg肽1,50mg海藻糖,2mg抗坏血酸 制剂1e 50μg肽1,50mg海藻糖,10mg抗坏血酸 制剂2 50μg肽1,50mg海藻糖,5mg抗坏血酸钠 制剂3 50μg肽1,50mg海藻糖,15mg龙胆酸 制剂4 50μg肽2,50mg蔗糖,5mg抗坏血酸 制剂5 50μg肽1,40mg海藻糖,10mg葡聚糖,5mg抗坏血酸
242、冻干试剂盒制剂的外观和残留水分的评估
243、表2:冻干制剂的特征
244、 制剂 饼外观 残留水分(%) 比较性制剂a -(白色液滴) nd 比较性制剂b -(完全坍塌) nd 比较性制剂c +++(完整结构) 0.399±0.033 比较性制剂d +++(完整结构) 0.437±0.044 比较性制剂e +++(完整结构) 0.615±0.029 制剂1a ++(完整结构,微弱收缩) 0.265±0.041 制剂1b ++(完整结构,微弱收缩) 0.314±0.091 制剂1c ++(完整结构,微弱收缩) 0.166±0.045 制剂1d ++(完整结构,微弱收缩) 0.272±0.032 制剂1e ++(完整结构,微弱收缩) 0.376±0.070 制剂2 ++(完整结构,微弱收缩) nd 制剂3 ++(完整结构,微弱收缩) nd 制剂4 ++(完整结构,微弱收缩) 0.136±0.003 制剂5 ++(完整结构,微弱收缩) nd
245、nd未测定
246、冻干试剂盒制剂中肽的稳定性的评估
247、将冻干试剂盒制剂在室温或40℃/60%相对湿度下储存。在基线时和几个时间点通过分析hplc测试肽的稳定性(表3和表4)。
248、在室温以及40℃下储存期间,使用甘露糖醇的试剂盒制剂(比较性制剂c、d、e)导致肽的显著分解。对于含有非还原糖海藻糖或蔗糖的试剂盒制剂来说,没有观察到或仅观察到少量肽降解。
249、表3:冻干制剂在rt下的稳定性
250、
251、nd未测定
252、表4:冻干制剂在40℃下的稳定性
253、
254、nd未测定试剂盒制剂在储存后获得的放射化学纯度的评估
255、表5:冻干制剂的放射性标记
256、
257、nd未测定
- 还没有人留言评论。精彩留言会获得点赞!