索玛鲁肽贮库系统及其用途的制作方法
本发明涉及包含索玛鲁肽的肠胃外持续释放药物组合物及其在治疗2型糖尿病、肥胖症和帕金森氏病中的用途。
背景技术:
1、ii型糖尿病或2型糖尿病(以前被称为非胰岛素依赖型糖尿病(niddm)或成年型糖尿病)是一种以与胰岛素抗性和相对胰岛素缺乏相关的高血糖水平为特征的疾病。尽管通常最初通过增加锻炼和饮食改良来管控,但随着疾病的发展通常需要药物治疗。
2、尽管2型糖尿病的治疗取得了进展,但通常无法实现最佳血糖控制。与许多抗糖尿病药物治疗相关的低血糖症和体重增加可能干扰强化治疗的实施和长期应用。目前的治疗集中在增加胰岛素的可利用性(通过直接胰岛素给药或通过促进胰岛素分泌的药剂)、提高对胰岛素的敏感性、延迟碳水化合物从胃肠道的输送和吸收或增加尿糖排泄。
3、胰高血糖素样肽-1(glp-1)是一种在进餐后由肠道细胞分泌的具有30个氨基酸残基的天然肽。它刺激葡萄糖依赖性胰岛素释放并抑制餐后胰高血糖素的分泌。由于其药代动力学半衰期短,即约为2-5分钟,glp-1在作为治疗剂给药时并不高效,这主要是因为它对二肽基肽酶(dpp-4)的酶促降解敏感。为了延长glp-1的半衰期,已经开发出含有化学修饰和氨基酸替换的代谢稳定的glp-1类似物。
4、索玛鲁肽被设计成通过增加白蛋白结合而具有延长的人体循环半衰期,目的是提供适合于每周给药一次的释放特性。利拉鲁肽(人glp-1肽的修饰的酰化形式)的序列在第8位处用2-氨基异丁酸(aib)基团衍生化,并且保持第34位处的精氨酸和第37位处的甘氨酸。脂肪酸部分和与第26位处的lys的连接化学特性是提供所需的白蛋白结合亲和力增加的关键特征;用延伸的lys26(γglu-2xoeg-c18酸)代替利拉鲁肽中的lys26(γglu-c16酸)提供了索玛鲁肽([aib8,lys26(γglu-2xoeg-c18酸),arg34]-hglp-1-(7-37)-oh),其对人glp-1受体具有0.38nm的结合亲和力和6.2pm的功能效力。第8位处aib氨基酸残基的并入通过针对dpp-4酶降解提供保护而使索玛鲁肽稳定,并且当与提高的白蛋白亲和力相组合时,在小型猪中将iv给药后的血浆半衰期延长至46.1小时,并且在sc给药后平均停留时间为63.6小时。在db/db小鼠模型(2型糖尿病的高血糖、高胰岛素肥胖模型)中,索玛鲁肽产生持续的剂量依赖性疗效,ed50<2nmol/kg(suzuki等,j.med.chem.,2020,13;63(3):905-927;doi:10.1021/acs.jmedchem.9b00835)。
5、索玛鲁肽被指示作为饮食和锻炼的辅助药物,用于在患有2型糖尿病的成年人中改善血糖控制,并在患有2型糖尿病和已确诊的心血管疾病的成年人中降低重大不良心血管事件的风险。最近,美国食品药品监督管理局(fda)批准在患有肥胖症或超重状态以及至少一种体重相关疾病(例如高血压、2型糖尿病和高胆固醇)的成年人中使用每周一次的索玛鲁肽注射进行慢性体重管理。
6、yu等人(adv.drug deli.rev.,130,第113-130页)描述了用于glp-1受体激动剂的各种半衰期延长策略,包括顺序修饰、将脂肪酸附连到肽、与人血清白蛋白融合、与单克隆抗体的可结晶片段(fc)区融合、持续药物递送系统和聚乙二醇化,以及这些策略影响glp-1受体激动剂产品的药代动力学、药效学、安全性、患者可用性以及最终商业成功的方式。yu等人公开了(艾塞那肽)制剂中plga微粒的缺点之一在于它们不能以稳定的速率递送glp-1受体激动剂。
7、wo 2020/210764描述了一种贮库,其包括包含治疗剂的治疗区和包含生物可吸收聚合物和与所述聚合物混合的释放剂的控制区。所述释放剂可以被配置成当所述贮库被放置在体内时溶解,以在所述控制区中形成扩散开口。所述贮库可以经配置以在体内的治疗部位处植入,并且在植入时在所述治疗部位处长时间释放所述治疗剂。
8、wo 2018/136909描述了一种通过在线再循环混合系统生产活性成分的微粒的方法,其中所述在线再循环混合系统包括混合器和偶联到所述混合器的导管。
9、u.s.2020/0298196描述了一种具有改进的安全性和储存稳定性的可生物降解微球及其生产方法。
10、wo 2020/028907描述了包含包埋或掺入到聚合物粒子中的glp-1或其类似物例如艾塞那肽、利拉鲁肽、利西拉肽、阿必鲁肽、度拉糖肽、索玛鲁肽或他司鲁肽的组合物。
11、wo 2021/020885描述了一种用于治疗或预防左旋多巴诱导的运动障碍的药物组合物。当与左旋多巴联合给药时,glp-1受体激动剂或其受控释放制剂表现出降低由左旋多巴的长期给药引起的严重副作用和减少左旋多巴诱导的非自发运动障碍的效果。
12、cn 110101846描述了低突释速率的索玛鲁肽微球及其制备方法。该制剂是一种长效注射剂,由重量为微球重量的1-20%的活性成分索玛鲁肽、重量为微球重量的60-99%的生物相容性聚合物基质和重量为微球重量的0-20%的其他药学上可接受的辅助材料制备。
13、cn 113018277描述了一种注射用持续释放制剂及其制备方法。所述制备方法用于制备基于水包油包水(w1/o/w2)双重乳液的蛋白质多肽药物的持续释放微球。
14、u.s.2019/0133952描述了一种持续释放微粒的制备方法,其特征在于包括下述步骤:1)制备水溶性药物和可生物降解和生物相容的水难溶性聚合物的固体分散体;2)将步骤1)中制备的固体分散体溶解在有机溶剂c中以形成固体分散体乳液,所述有机溶剂c是不能溶解所述水溶性药物但能溶解所述水难溶性聚合物、沸点低于水且不溶于或难溶于水的有机溶剂;3)将步骤2)中获得的固体分散体乳液加入到含有表面活性剂的水性溶液中以形成均匀乳液;和4)通过溶剂挥发或溶剂提取使所述乳液中的微粒固化,收集所述微粒,用超纯水洗涤几次以除去附着到微粒表面的表面活性剂,并干燥以获得所述持续释放微粒。
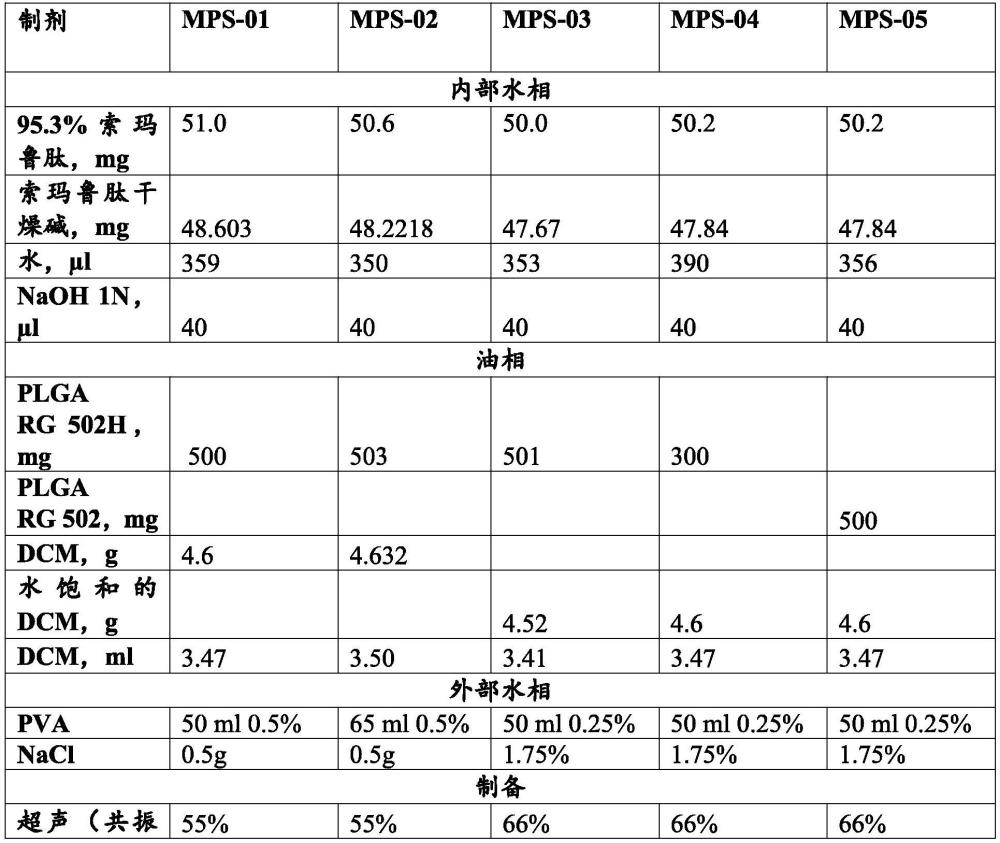
15、对能够在较长时间内安全有效地释放活性成分的索玛鲁肽的改进的长效制剂,仍存在着尚未满足的需求。
技术实现思路
1、本发明提供了包含治疗有效量的glp-1受体激动剂、特别是索玛鲁肽或其药学上可接受的盐的肠胃外药物组合物,其中所述肠胃外药物组合物以贮库形式配制。本发明还提供了治疗2型糖尿病、肥胖症和帕金森氏病的方法,所述方法包括向有需要的受试者给药本发明的肠胃外药物组合物。
2、本发明部分是基于下述令人吃惊的发现,即索玛鲁肽和包括例如聚丙交酯、聚乙交酯和/或聚己内酯的可生物降解载体的贮库制剂,在单次给药后至少6周内提供索玛鲁肽活性成分的长效治疗有效血浆浓度。本发明的制剂在降低hba1c和血糖水平方面是有效的,并且提供了与索玛鲁肽的每周一次注射剂型相同或优越的治疗效果,副作用的发生率降低和/或副作用的严重程度降低。与衍生自其他持续释放药物递送技术的制剂相比,本发明的索玛鲁肽持续释放制剂提供了优异的释放动力学,具有最小的突释、最小的给药后的滞后时间、增加的药物释放持续时间和较低频率的注射,与通过给药可商购索玛鲁肽立即释放制剂获得的血浆水平基本上相同的连续血浆水平,以及由于小的注射体积和小的粒子尺寸而改善的局部组织耐受性。
3、因此,在一方面,本发明提供了一种包含干燥微粒的长效肠胃外药物组合物,其中所述长效肠胃外药物组合物是适合于以每四周一次至每六个月一次的频率在有需要的受试者中的医学上可接受的位置处给药的长效贮库组合物,其中所述干燥微粒通过将油包水包油(w/o/w)双重乳液液滴干燥而形成,所述双重乳液液滴包含:内部水相,其包含治疗有效量的索玛鲁肽或其药学上可接受的盐;与水不混溶的聚合物相,其包含选自聚丙交酯、聚乙交酯、聚己内酯及其组合的可生物降解的载体;和外部水相,并且其中所述干燥微粒的特征在于中值粒径在约5至约20μm的范围内,包括所述指定范围内的每个值。
4、在一个实施方式中,所述干燥微粒的特征在于中值粒径在约7至约17μm的范围内,包括所述指定范围内的每个值。在另一个实施方式中,所述干燥微粒的特征在于中值粒径在约10至约15μm的范围内,包括所述指定范围内的每个值。
5、在某些实施方式中,所述组合物在给药后提供了低于所给药剂量的20%的二十四小时索玛鲁肽突然释放。在其他实施方式中,所述组合物具有这样的物理性质:使其在ph7.4的磷酸盐缓冲液中在24小时内释放出少于20%的索玛鲁肽或其药学上可接受的盐。在其他实施方式中,所述组合物具有这样的物理性质:使其在ph 7.4的磷酸盐缓冲液中在14天内释放出少于80%的索玛鲁肽或其药学上可接受的盐。在又一个实施方式中,所述组合物具有这样的物理性质:使其在ph 7.4的磷酸盐缓冲液中在28天内释放出超过80%的索玛鲁肽或其药学上可接受的盐。
6、在各种实施方式中,所述组合物具有这样的物理性质:使其在单次给药后提供至少约1nmol/ml的索玛鲁肽的平均人类稳态血浆浓度(css,avg)达约四周至约六个月。在额外的实施方式中,所述组合物具有这样的物理性质:使其在单次给药后提供约1nmol/ml至约5nmol/ml的索玛鲁肽的平均人类稳态血浆浓度(css,avg)达约四周至约六个月,包括所述指定范围内的每个值。
7、在另一个实施方式中,索玛鲁肽以持续方式从所述组合物释放。
8、在又一个实施方式中,索玛鲁肽以选自零级、一级、二级和三级释放级数及其任何准级数的受控释放级数从所述组合物释放。每种可能性代表单独的实施方式。
9、在特定实施方式中,索玛鲁肽作为唯一活性成分存在于所述药物组合物中。
10、在各种实施方式中,所述可生物降解的载体是选自聚(d,l-丙-共-乙交酯)(plga)、聚(d,l-丙交酯)(pla)、聚乙交酯(pga)、聚己内酯(pcl)及其组合的可生物降解聚合物。每种可能性代表单独的实施方式。在一个目前优选的实施方式中,所述可生物降解的载体是聚(d,l-丙-共-乙交酯)(plga)。在另一个目前优选的实施方式中,所述可生物降解的载体是聚(d,l-丙交酯)(pla)。在又一个目前优选的实施方式中,所述可生物降解的载体是聚(d,l-丙交酯)-聚己内酯(pla-pcl)。在额外的目前优选的实施方式中,所述可生物降解的载体是聚(d,l-丙-共-乙交酯)和聚(d,l-丙交酯)-聚己内酯的混合物(plga/pla-pcl)。
11、在某些实施方式中,所述可生物降解的载体是分子量小于20kda的聚(d,l-丙-共-乙交酯)(plga)。在其他实施方式中,所述可生物降解的载体是具有约2至约18kda范围内的分子量的聚(d,l-丙-共-乙交酯)(plga),所述分子量包括所述指定范围内的每个值。
12、在额外的实施方式中,所述与水不混溶的聚合物相还包含第一表面活性剂,其包含脂肪酸或其衍生物。在特定实施方式中,所述第一表面活性剂是卵磷脂、氢化卵磷脂、硬脂酸或其混合物或组合。每种可能性代表单独的实施方式。在特定实施方式中,所述第一表面活性剂包含磷脂酰胆碱含量大于90wt.%的氢化卵磷脂。
13、在某些实施方式中,所述内部和外部水相中的每一者独立地还包含第二表面活性剂。在特定实施方式中,所述第二表面活性剂选自聚乙烯醇(pva)、聚山梨醇酯、聚环氧乙烷-聚环氧丙烷嵌段共聚物、聚乙二醇和纤维素酯。每种可能性代表单独的实施方式。在目前优选的实施方式中,所述第二表面活性剂是pva。在另一个目前优选的实施方式中,所述第二表面活性剂是聚乙二醇。
14、在其他实施方式中,所述内部和外部水相中的每一者独立地还包含渗涨度(tonicity)调节剂。在某些实施方式中,所述渗涨度调节剂是包括氯化钠的离子型渗涨度调节剂。在其他实施方式中,所述渗涨度调节剂是包括糖或糖醇的非离子型渗涨度调节剂。在特定实施方式中,所述糖是蔗糖。
15、在某些实施方式中,所述索玛鲁肽或其药学上可接受的盐与可生物降解的载体的比例在约1:2至约1:30(w/w)的范围内,所述比例包括所述指定范围内的比例的所有迭代。在其他实施方式中,所述索玛鲁肽或其药学上可接受的盐与可生物降解的载体的比例在约1:5至约1:20(w/w)的范围内,包括所述指定范围内的比例的所有迭代。在其他实施方式中,所述索玛鲁肽或其药学上可接受的盐与可生物降解的载体的比例在约1:5至约1:15(w/w)的范围内,包括所述指定范围内的比例的所有迭代。
16、在各种实施方式中,所述干燥微粒的特征在于索玛鲁肽药物负载能力在约5%至约15%的范围内,包括所述指定范围内的每个值。在其他实施方式中,所述干燥微粒的特征在于索玛鲁肽药物负载能力在约5%至约12%的范围内,包括所述指定范围内的每个值。在额外的实施方式中,所述干燥微粒的特征在于索玛鲁肽药物负载能力在约5%至约10%的范围内,包括所述指定范围内的每个值。在其他实施方式中,所述干燥微粒的特征在于索玛鲁肽药物负载能力在约7%至约9%的范围内,包括所述指定范围内的每个值。
17、在某些实施方式中,本发明的贮库组合物通过水包油包水(w/o/w)双重乳化过程制备,所述过程包括下述步骤:
18、(i)将索玛鲁肽或其药学上可接受的盐的水性悬液或溶液分散在可生物降解的载体的与水不混溶的挥发性有机溶剂的溶液中,从而获得油包水乳液;和
19、(ii)将所述油包水乳液分散在连续外部水相中,以形成包含水包油包水(w/o/w)双重乳液液滴的微粒。
20、在另一方面,本发明提供了一种制备长效肠胃外药物组合物的方法,所述组合物包含索玛鲁肽或其药学上可接受的盐,适合于以每四周一次至每六个月一次的频率在有需要的受试者中的医学上可接受的位置处给药,所述方法包括下述步骤:
21、(i)将索玛鲁肽或其药学上可接受的盐的水性悬液或溶液分散在所述可生物降解的载体的与水不混溶的挥发性有机溶剂的溶液中,从而获得油包水乳液;和
22、(ii)将所述油包水乳液分散在连续外部水相中,以形成包含水包油包水(w/o/w)双重乳液液滴的微粒。
23、在几个实施方式中,所述过程还包括下述步骤:(iii)通过过滤或离心收集由此形成的微粒。在其他实施方式中,所述过程还包括下述步骤:(iv)洗涤所述收集的微粒。在一个实施方式中,洗涤使用纯化水、缓冲溶液、所述外部水相或其混合物或组合来进行。每种可能性代表单独的实施方式。在另一个实施方式中,洗涤使用包含二价阳离子的水性溶液来进行。在其他实施方式中,所述过程还包括干燥所述收集或洗涤的微粒的步骤。在一个实施方式中,干燥所述收集或洗涤的微粒通过冻干来进行。
24、在某些实施方式中,所述内部水相具有约7至约9的ph,包括所述指定范围内的每个值。在其他实施方式中,所述内部水相具有约7.5至约9.5的ph,包括所述指定范围内的每个值.在其他实施方式中,所述内部水相具有约7.8的ph。在各种实施方式中,所述ph通过酸或碱来调节。每种可能性代表单独的实施方式。优选地,所述ph使用氢氧化钠来调节。
25、在额外的实施方式中,本发明的贮库组合物采取固体微粒、溶液或悬液的形式。每种可能性代表单独的实施方式。在当前优选的实施方式中,所述组合物采取包含悬浮在生理上可接受的溶剂中的固体微粒的悬液的形式。在额外的实施方式中,所述悬液包含在生理上可接受的溶剂中重构的干燥微粒。
26、在其他实施方式中,所述组合物适合于约每四周一次至约每六个月一次的给药方案,包括所述指定范围内的每个值。在其他实施方式中,所述组合物在约一个月至约三个月的时间段内释放索玛鲁肽活性成分,包括所述指定范围内的每个值。在额外的实施方式中,所述组合物在约四周至约六周的时间段内释放索玛鲁肽活性成分,包括所述指定范围内的每个值。在目前优选的实施方式中,所述组合物在约一个月至约两个月的时间段内释放索玛鲁肽活性成分,包括所述指定范围内的每个值。
27、在其他实施方式中,所述组合物以约5mg至约100mg的索玛鲁肽剂量给药,包括所述指定范围内的每个值。在某些实施方式中,所述组合物通过肌肉内给药。在其他实施方式中,所述组合物通过皮下给药。
28、正如本文中设想的,本发明的组合物可用于治疗患有糖尿病,特别是2型糖尿病的受试者。
29、因此,在某些实施方式中,本发明提供了一种治疗2型糖尿病的方法,所述方法包括以每四周一次至每六个月一次的频率向有需要的受试者给药本文所公开的肠胃外药物组合物的步骤,包括所述指定范围内的每个值。在一个实施方式中,所述治疗包括将所述受试者中的空腹血糖水平降低至少约5%、优选地至少约10%、更优选地至少约15%、最优选地至少约20%。每种可能性代表单独的实施方式。在另一个实施方式中,所述治疗包括将所述受试者中的进食血糖水平降低至少约5%、优选地至少约10%、更优选地至少约15%、最优选地至少约20%。每种可能性代表单独的实施方式。在又一个实施方式中,所述治疗包括将所述受试者中的血红蛋白a1c(hba1c)水平降低至少约0.5%、优选地至少约1%、更优选地至少约1.5%、最优选地至少约2%。每种可能性代表单独的实施方式。
30、根据另外的实施方式,本发明的组合物可用于治疗患有帕金森氏病的受试者。因此,在某些实施方式中,本发明提供了一种治疗帕金森氏病的方法,所述方法包括以每四周一次至每六个月一次的频率向有需要的受试者给药本文所公开的肠胃外药物组合物的步骤,所述频率包括所述指定范围内的每个值。
31、根据其他实施方式,本发明的组合物可用于治疗肥胖症。因此,在某些实施方式中,本发明提供了一种治疗肥胖症的方法,所述方法包括以每四周一次至每六个月一次的频率向有需要的受试者给药本文所公开的肠胃外药物组合物的步骤,所述频率包括所述指定范围内的每个值。
32、根据又一方面,本发明提供了一种实现单次给药后索玛鲁肽的平均人类稳态血浆浓度(css,avg)为至少约1nmol/ml达约四周至约六个月的方法,所述方法包括向有需要的受试者给药包含干燥微粒的长效肠胃外药物组合物的步骤,其中所述干燥微粒通过将水包油包水(w/o/w)双重乳液液滴干燥而形成,所述双重乳液液滴包含:内部水相,其包含治疗有效量的索玛鲁肽或其药学上可接受的盐;与水不混溶的聚合物相,其包含选自聚丙交酯、聚乙交酯、聚己内酯及其组合的可生物降解的载体;和外部水相。在各种实施方式中,本发明提供了一种在单次给药后获得约1nmol/ml至约5nmol/ml的索玛鲁肽的平均人类稳态血浆浓度(css,avg)达约四周至约六个月的方法,包括所述指定范围内的每个值。
33、从下文给出的详细描述,本发明的进一步实施方式和全部适用范围将变得明显。然而应当理解,所述详细描述和具体实例尽管指示了本发明的优选实施方式,但仅仅是通过说明的方式给出的,因为对于本领域技术人员来说,在本发明的精神和范围之内的各种变化和修改将从该详细描述变得明显。
- 还没有人留言评论。精彩留言会获得点赞!