用于治疗肝病的培马贝特和/或托格列净的制作方法
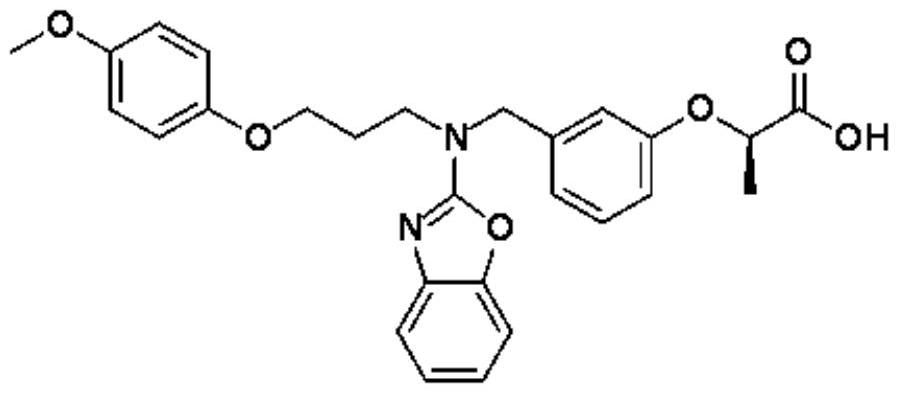
发明领域使用培马贝特(pemafibrate)、托格列净(tofogliflozin)及其组合治疗患有肝病的人患者,特别是患有肝硬度(stiffness)或肝纤维化的nafld或nash患者、具有升高的alt水平的nafld或nash患者、具有升高的ldl-c的nafld或nash患者以及具有健康甘油三酯水平的nafld或nash患者的方法。发明背景非酒精性脂肪肝病(nafld)是过量脂肪在肝脏中积聚的病症。nafld包括无肝细胞损伤迹象的非酒精性脂肪肝(“nafl”)和非酒精性脂肪性肝炎(“nash”),其特征在于脂肪变性、炎症和气球样变。大部分nafld作为肥胖、糖尿病、血脂异常或高血压的结果发生。由于肥胖人群的增加,nafld和nash患者的数量在世界范围内增加,并且估计患病率分别为20-30%和2-6%。培马贝特是选择性pparα调节剂,其在日本被批准用于治疗高脂血症。在化学上将培马贝特描述为(r)-2-[3-[[n-(苯并噁唑-2-基)-n-3-(4-甲氧基苯氧基)丙基]氨基甲基]苯氧基]丁酸,并且具有以下化学结构:培马贝特调节主要与肝脏脂质和糖代谢相关的基因簇的表达。它还通过诱导线粒体解偶联蛋白(“ucp”)3基因表达来增加β-氧化和脂质转运的基因表达并且增强能量代谢。在低密度脂蛋白(“ldl”)受体敲除小鼠和用mcd(甲硫氨酸-胆碱-缺乏)膳食饲喂的kk-a小鼠中的非临床研究已经显示,培马贝特抑制肝细胞的气球样变和脂肪沉积,并且减少kupffer细胞的数量。参见shibata等人的us2016/0136138 a1。在化学上将无水托格列净描述为6-((4-乙基苯基)甲基)-3’,4’,5’,6’-四氢-6’-(羟基甲基)螺(异苯并呋喃-1(3h),2’-(2h)吡喃)-3’,4’,5’-三醇,并且具有以下化学结构:美国选定药名(“usan”)托格列净的适用于一水合物,其为用作药物的形式。国际非专利药名(“inn”)托格列净适用于无水化合物,并且将该药物形式称作托格列净水合物。如本文所用,托格列净是指化学化合物6-((4-乙基苯基)甲基)-3’,4’,5’,6’-四氢-6’-(羟基甲基)螺(异苯并呋喃-1(3h),2’-(2h)吡喃)-3’,4’,5’-三醇,并且由此包括该化合物的所有水合、溶剂化、结晶和无定形形式。托格列净先前由hoffman la-roche inc.和chugai pharmaceutical co,ltd.开发用于治疗2型糖尿病(t2dm)。托格列净是sglt2的有效和选择性抑制剂,其定位于肾小管并且负责从肾滤液中重吸收葡萄糖。nash的hhc小鼠模型中的非临床研究已经显示,培马贝特和托格列净的组合减小了动物肝细胞中脂滴的大小,导致肝细胞气球样变的改善。参见sasaki等人的us 2020/0022960 al。除了表征nash和一些nafld患者的脂肪变性、炎症和气球样变之外,仍然需要治疗和/或预防nash和一些nafld患者的肝硬度和肝纤维化。还需要治疗nafld和nash患者的脂质和肝酶异常,以及表征将从此类治疗中受益最多的患者,特别是在脂质分布方面。发明概述本发明人预料不到地发现,培马贝特、托格列净及其组合可以治疗和/或预防nash和一些nafld患者的肝硬度和肝纤维化。因此,在第一个主要实施方案中,本发明提供了治疗患有非肝硬化性nash或nafld并且nash crn纤维化评分≥1并且<4的患者的肝硬度或肝纤维化的方法,该方法包括向患者施用治疗有效量的:(a)培马贝特或其药学上可接受的盐;(b)托格列净或其药学上可接受的盐;或(c)其组合。本发明人进一步发现,培马贝特、托格列净及其组合可以治疗nash和nafld患者的nash组织学情况,特别是小叶炎症。因此,在第二个主要实施方案中,本发明提供了治疗患有非肝硬化性nash或nafld的患者的小叶炎症的方法,该方法包括向患者施用治疗有效量的:(a)培马贝特或其药学上可接受的盐;(b)托格列净或其药学上可接受的盐;或(c)其组合。在特别优选的实施方案中,在具有nash crn纤维化评分≥1并且<4的患者中采取所述方法而纤维化没有恶化。本发明人进一步发现,本文所述的治疗导致肝酶活性的预料不到的改善,特别是在患有纤维化和高丙氨酸氨基转移酶(“alt”)水平的患者中。因此,在第三个主要实施方案中,本发明提供了改善患有非肝硬化性nash或nafld、nash crn纤维化评分≥1并且<4并且alt评分≥2×uln的患者的如通过alt活性测量的肝功能的方法,该方法包括向患者施用治疗有效量的:(a)培马贝特或其药学上可接受的盐;(b)托格列净或其药学上可接受的盐;或(c)其组合。本发明人还发现,本文所述的治疗导致ldl-c的预料不到的改善,特别是在患有纤维化和高ldl-c水平的患者中。因此,在第四个主要实施方案中,本发明提供了降低患有非肝硬化性nash或nafld、nash crn纤维化评分≥1并且<4并且ldl-c浓度≥100mg/dl的患者的ldl-c的方法,该方法包括向患者施用治疗有效量的:(a)培马贝特或其药学上可接受的盐;(b)托格列净或其药学上可接受的盐;或(c)其组合。令人惊奇地,任一上述方法,包括那些依赖于培马贝特的方法,均可以在甘油三酯水平正常的患者中实施。将本发明的另外的优点部分地在下面的描述中阐述,并且部分地将从该描述中显而易见或者可以通过本发明的实施来了解。本发明的优点将通过所附权利要求中特别指出的要素和组合来实现和获得。应当理解,前述一般描述和以下详细描述仅为示例性和说明性的,而不是对所要求保护的本发明的限制。详细描述术语的定义和用途如本说明书和权利要求书中所使用的,单数形式“一个”、“一种”和“该”包括复数指代物,上下文另有明确规定的除外。例如,术语“规格”是指用于当前公开的方法和系统的一个或多个规格。“成分”包括两种或多种此类成分的混合物等。如本文所用的词语“或”或类似术语意指特定列表的任何一个成员,并且还包括该列表的成员的任何组合。如在本说明书和随后的权利要求书中所使用的,词语“包含”和该词语的变体,例如“包括”和“含有”意指“包括但不限于”,并且不旨在排除例如其它添加剂、组分、整数或步骤。当要素被描述为包含一个或多个组分、步骤或条件时,应当理解,该要素也可以被描述为“由”或“基本上由”组分、步骤或条件或者多个组分、步骤或条件“组成”。“治疗有效量”是指当施用于人以支持或影响代谢过程或者治疗或预防疾病时,足以引起疾病的此类治疗或预防或者支持或影响代谢过程的量。当在本文中使用“药物疗法”、“药物施用”和类似术语时,应当理解,该疗法可以通过任何适合的施用途径、使用任何可接受的剂型来进行,并且药物可以作为游离碱或酸、盐或酯或其它前药部分施用。当在本文中提及组合药物疗法以实现单一终点或治疗目标时,应当理解,该组合中的每种单独的活性成分有助于实现所述终点或治疗目标。此外,应当理解,在优选的实施方案中,每种活性成分在适当动力的患者群体中有助于统计学上显著的临床益处。当要实现多个终点或治疗目标时,应当理解,两种单独的活性成分将有助于实现至少一个终点或治疗目标,优选所有终点和目标,优选在适当动力的患者群体中实现统计学上显著的临床益处,并且未共同贡献的任何终点或治疗目标将通过活性成分的至少一种实现,优选达到统计学上显著的临床益处。当在本文中使用时,术语“约”将补偿制药工业中允许的和该工业中产品固有的变异性,例如由于制造变化和时间诱导的产品降解引起的产品强度差异,以及由于水合的水和不同盐引起的差异。该术语允许在良好生产规范的实践中允许被评估的产品被认为在人中与要求保护的产品的所述强度在治疗上等效或生物等效的任何变化。在一个实施方案中,该术语允许在所述规格或标准的5%内的任何变化。在一个实施方案中,该术语允许在所述规格或标准的10%内的任何变化。每当使用数字来描述本发明的要素时,应当理解,该数字可以被由术语“约”修饰的数字修改和替换。当本文提及公开的测试方法和诊断仪器时,应当理解,该测试方法或诊断仪器基于2021年5月1日生效的版本来执行,本文另有相反说明的除外。当在本文中通过指定范围的可选择的上限和下限来表达范围时,应当理解,端点可以以数学上可行的任何方式组合。因此,例如,50或80至100或70的范围可选择地表示为50至100、50至70以及80至100的一系列范围。当使用短语“和”或“或”使一系列上限和下限相关时,应当理解,上限可以不受下限限制或与下限组合,反之亦然。因此,例如,大于40%和/或小于80%的范围包括大于40%、小于80%以及大于40%但小于80%的范围。除非由术语“之间”另有说明,否则范围的边界(范围的下端和上端)包括在所要求保护的范围内。当通过参考一个或多个实例、元件、属性或特性来定义过程或事物的要素时,应当理解,这些元件、属性或特性中的任意一个或任意组合也可以用于定义所讨论的事项。例如,当在权利要求中(如在马库什分组中)叙述要素的具体实例或者要素由多个特征定义时,这种情况可能发生。因此,例如,如果要求保护的系统包含由要素a1、a2和a3定义的要素a,与由要素b1、b2和b3定义的要素b组合,则本发明还将被理解为覆盖由要素a定义而没有要素b的系统,其中要素a由要素a1和a2定义与由要素b2和b3定义的要素b组合的系统,以及所有其它可能的排列。在本发明的上下文中,就其涉及本文所述的任何疾病状况而言,术语“治疗”意指减少症状或状况的发生,或者缓解或减轻与此类状况相关的至少一种症状,或者减缓或逆转此类状况的进展,或者管理或影响基于此类状况的代谢过程。在本发明的含义内,该术语还表示阻止或“预防”,即延迟发作(即疾病临床表现之前的时期)和/或降低疾病发展或恶化的风险。当具有该状况的人被肯定地叙述时,该术语将被理解为需要缓解或减轻与该状况相关的至少一种症状。生物标志物测试测定-除非本文另有说明,否则本文提及的所有生物标志物测试测定均根据在国家健康和营养检查调查(national health and nutrition examinationsurvey)的2001-2002周期期间采用的标准方法进行。主要实施方案的讨论在第一个主要实施方案中,本发明提供了治疗患有非肝硬化性nash或nafld并且nash crn纤维化评分≥1并且<4的患者的肝硬度或肝纤维化的方法,该方法包括向患者施用治疗有效量的:(a)培马贝特或其药学上可接受的盐;(b)托格列净或其药学上可接受的盐;或(c)其组合。在第二个主要实施方案中,本发明提供了治疗患有非肝硬化性nash或nafld的患者的小叶炎症的方法,该方法包括向患者施用治疗有效量的:(a)培马贝特或其药学上可接受的盐;(b)托格列净或其药学上可接受的盐;或(c)其组合。在特别优选的实施方案中,在具有nash crn纤维化评分≥1并且<4的患者中采取该方法而纤维化没有恶化。在第三个主要实施方案中,本发明提供了改善患有非肝硬化性nash或nafld,nashcrn纤维化评分≥1并且<4并且alt评分≥2×uln的患者的如alt活性测量的肝功能的方法,该方法包括向患者施用治疗有效量的:(a)培马贝特或其药学上可接受的盐;(b)托格列净或其药学上可接受的盐;或(c)其组合。在第四个主要实施方案中,本发明提供了降低患有非肝硬化性nash或nafld,nashcrn纤维化评分≥1并且<4并且ldl-c浓度≥100mg/dl的患者的ldl-c的方法,该方法包括向患者施用治疗有效量的:(a)培马贝特或其药学上可接受的盐;(b)托格列净或其药学上可接受的盐;或(c)其组合。子实施方案的讨论参考可以修饰任何主要实施方案的多个子实施方案可以进一步理解本发明。应当理解,这些子实施方案可以以在数学上和物理上均可能的任意方式组合以创建另外的子实施方案,这又可以修饰任何主要实施方案。如主要实施方案中所述,可以单独使用培马贝特、单独使用托格列净或组合使用培马贝特和托格列净来实施所述方法。因此,在一个子实施方案中,通过向患者施用治疗有效量的培马贝特或其药学上可接受的盐来实施所述方法。在另一个子实施方案中,通过向患者施用治疗有效量的托格列净或其药学上可接受的盐来实施所述方法。在另一个子实施方案中,通过向患者施用治疗有效量的所述组合来实施所述方法。当口服施用时,无论是单独施用还是组合施用,优选的培马贝特的治疗有效量为0.1-0.8mg/天,或0.2-0.4mg/天,以一个、两个或三个分开的剂量施用。特别优选的剂量为0.4mg/天。当口服施用时,无论是单独还是组合,优选的托格列净的治疗有效量为5-60mg/天,或10-40mg/天。特别优选的剂量为20mg/天的托格列净或其药学上可接受的盐。优选的给药方案是单一剂型,优选片剂,每天施用一次。因此,在特别优选的子实施方案中,本发明提供了口服施用的单位剂型,其包含约0.4mg的培马贝特或其药学上可接受的盐和约20mg的托格列净或其药学上可接受的盐。可通过本发明的方法治疗的患者可以通过几种诊断标准来表征。因此,在一个子实施方案中,在该方法开始时,患者具有振动控制瞬时弹性成像cap评分≥290db/m。在另一个子实施方案中,在该方法开始时,患者具有lsm≥7千帕(kpa)并且<19kpa。在另一个子实施方案中,在开始该方法时,患者具有≥20u/l、30u/l、40u/l或50u/l的ast浓度。在又一个子实施方案中,在该方法开始时,患者具有:(a)振动控制瞬时弹性成像cap评分≥290db/m;(b)lsm≥7千帕(kpa)并且<19kpa;以及(c)ast浓度≥20u/l。患者也可以在组织学上表征。因此,在一个子实施方案中,在该方法开始时,患者具有nafld活动评分(“nas”)≥4、≥5、≥6、≥7或=8。在另一个子实施方案中,在该方法开始时,患者具有nash crn脂肪变性评分≥1、≥2或=3。在另一个子实施方案中,在该方法时开始,患者具有nash crn小叶炎症评分≥1、≥2或=3。在另一个子实施方案中,在该方法开始时,患者具有nash crn气球样变评分≥1或=2。在另一个子实施方案中,在该方法开始时,患者具有:(a)nas≥4;(b)nash crn脂肪变性评分≥1;(c)nash crn小叶炎症评分≥1;和(d)nash crn气球样变评分≥1。除酶肝脏活性之外,还可以在组织学上表征患者。因此,在另一个子实施方案中,在该方法开始时,患者具有:(a)nas≥4;(b)nash crn脂肪变性评分≥1;(c)nash crn小叶炎症评分≥1;(d)nash crn气球样变评分≥1;和(e)alt浓度≥1×、2×或3×的uln。在其它子实施方案中,可以通过肝脏成像和/或肝脏酶活性来表征患者。因此,在另一个子实施方案中,在该方法开始时,患者基于mri-pdff具有≥10%、12.5%、15%或17.5%的肝脏脂肪分数。在另一个子实施方案中,在该方法开始时,患者基于mre具有≥2.5kpa、2.75kpa或3kpa的肝硬度。在另一个子实施方案中,在该方法开始时,患者具有alt浓度≥1×、2×或3×的uln。在另一个子实施方案中,在该方法开始时,患者具有:(a)基于mri-pdff的肝脏脂肪分数≥10%;(b)基于mre的肝硬度≥2.5kpa;和(c)alt水平>uln。更进一步的标准可以用于表征可通过本发明的方法治疗的患者。因此,在一个子实施方案中,在该方法开始时,患者具有大于110或120mg/dl的ldl-c浓度。在另一个子实施方案中,在该方法开始时,患者具有大于22、28或32kg/m2的bmi。在另一个子实施方案中,在该方法开始时,患者具有空腹血糖浓度≥100mg/dl。在另一个子实施方案中,在该方法开始时,患者具有空腹tg水平<200、175或150mg/dl。在另一个子实施方案中,在该方法开始时,患者具有nash crn纤维化评分1,2,3,≥1并且<4,或≥2并且<4。在另一个子实施方案中,在该方法开始时,患者具有alt浓度≤5×uln。根据本发明的方法,可以使用几种不同的测量方法来确定成功的治疗。因此,在一个子实施方案中,该方法包括:(a)患者nas的组织学改善≥2分;和(b)患者的nash crn纤维化评分没有恶化。在另一个子实施方案中,该方法包括:(a)脂肪性肝炎的组织学消退,其定义为:(i)不存在脂肪肝病;或(ii)无脂肪性肝炎的孤立性或单纯性脂肪变性,并且炎症的nas为0-1,气球样变的nas为0,脂肪变性的nas为任意值;和(b)nash crn纤维化评分没有恶化。在另一个子实施方案中,该方法包括:(a)患者的nash crn炎症评分≥1的改善;(b)患者的nash crn气球样变评分≥1的改善;和(c)患者的nash crn脂肪变性评分≥1的改善。在另一个子实施方案中,该方法包括:(a)患者的nash crn纤维化评分≥1的改善;(b)患者的nash crn气球样变评分没有恶化;(c)患者的nash crn炎症评分没有恶化;和(d)患者的nash crn脂肪变性评分没有恶化。在另一个子实施方案中,该方法包括:(a)如通过mri-pdff测量的肝脏脂肪含量降低≥30%;和/或(b)alt降低≥30%至<40u/l。实施例在以下实施例中,已经尝试确保关于数字(例如,量、温度等)的准确性,但应考虑到一些误差和偏差。提出以下实施例以便为本领域普通技术人员提供如何制备和评价本文要求保护的方法的完整公开和描述,并且旨在纯粹示例本发明,而不旨在限本发明人视为其发明的范围。实施例1.患有nafld的患者肝硬度和肝脏和脂质代谢血清标志物的改善这是在患有nafld的成人中的安慰剂对照、随机、双盲、平行组研究。在2-8周的筛选期后,给个体施用培马贝特片剂(0.4mg/天,bid)或安慰剂片剂72周。主要终点是在第24周通过mri-pdff测量的肝脏脂肪含量从基线的百分比变化。关键的次要终点是肝硬度和alt水平分别从基线到第72周和第24周的百分比变化。本研究按照相关指南、gcp指南和赫尔辛基宣言进行。招募在基于mri-pdff的肝脏脂肪分数≥10%、肝硬度(使用磁共振弹性成像,mre测量)≥2.5kpa和升高的alt(男性>40u/l,女性>30u/l)的患者。在体重指数(bmi)<22kg/m2、不受控制的糖尿病(hba1c≥8%)、肾功能受损(估计的肾小球滤过率,egfr,<30ml·min-1·1.73-1·m-2或在透析中)、肝硬化、胆道梗阻或除nafld以外的慢性肝病的情况下排除患者。个体口服服用其指定的药物(培马贝特0.2mg片剂或安慰剂),一片,每天两次,持续72周。从治疗开始到第24周每4周设置研究访视,并且从第24周开始每8周设置研究访视。在随机分组前和随后在第0、24、48和72周进行的筛选检查时测量肝脏脂肪含量和肝硬度。所有成像评估程序均在不知情的情况下进行。将所有设施中使用的设备标准化为3.0t mr成像系统(ge healthcare,little chalfont,uk)。作为应用,使用用于mri-pdff的deal-iq和用于mre的mr-touch。详细的成像条件在“成像程序手册”中描述,并且成像程序在所有测试中都是标准化的。在空腹期间(餐后≥4小时)进行成像,并且在整个研究中对每个患者统一测试时间(早餐前/早餐后至午餐前/午餐后)。主要功效终点是肝脏脂肪含量的百分比变化,如使用mri-pdff测量的。使用mre测量的肝硬度是次要终点,并且类似地评估从基线值的百分比变化。其它功效终点包括肝功能、纤维化和炎性标志物以及脂质标志物。将研究群体的选择基线特征呈现于表1中。将选择的结果报告在表2中。表1.研究群体的基线特征(fas)数据为平均值(sd)或n(%)。表2.生物标志物从基线的百分比变化当通过mre测量时,肝硬度的显著改善(相当于肝纤维化的改善)是来自本研究的显著令人惊讶的发现。本研究的其它令人惊讶的发现,特别是当与s.ishibashi等人/atherosclerosis 249(2016)36-43报道的结果相比时,包括:·如通过alt测量的肝功能的显著改善(ishibashi报道了施用培马贝特后alt浓度的更适度的降低);·总胆固醇和ldl胆固醇显著降低(ishibashi报道了由施用培马贝特引起的总胆固醇适度降低和ldl胆固醇增加);和·hdl胆固醇显著降低,特别是考虑到ishibashi 2016报道的hdl胆固醇和粒度数据。尽管hdl胆固醇降低,但在本研究之前不能预测肝硬度、肝功能和胆固醇修饰的改善。实施例2.在患有nash和肝纤维化的患者中评估培马贝特、托格列净以及培马贝特和托格列净的组合的多中心、安慰剂对照、随机、双盲、48-周研究这是双盲、随机、48-周研究,其评估了与安慰剂相比,在患有具有肝纤维化的非肝硬化nash患者中,培马贝特单一疗法(0.4mg/天)、托格列净单一疗法(20mg/天)和k-001(培马贝特0.4mg/天和托格列净20mg/天的组合疗法)的功效和安全性。首先使用fibroscan振动控制瞬时弹性成像控制的衰减参数评分≥290db/m,fibroscan肝硬度测量值≥7千帕(kpa)并且<19kpa,以及天冬氨酸氨基转移酶(ast)≥20u/l来鉴定可能患有具有肝纤维化的非肝硬化nash患者。可能的nash患者将接受确认性肝活检以获得资格,其也将用作组织学评估的基线评估。重要的纳入标准为(i)nas≥4,在nas的每个要素(脂肪变性、小叶炎症和气球样变)中评分至少为1。(ii)在nash crn纤维化分期系统上为1或以上并且低于4的纤维化分期,和(iii)空腹血糖≥100mg/dl。本研究的主要目的在于评估在具有肝纤维化的非肝硬化nash患者中的功效。功效测定基于在第48周nafld活动评分(nas)的肝脏组织学改善≥2分和纤维化评分无恶化作为主要终点。主要功效终点是在第48周nash临床研究网络(crn)纤维化评分上疾病活动度从基线的改善并且肝纤维化没有恶化。将疾病活动度的改善定义为nas改善≥2分。将纤维化的恶化定义为该阶段的任何数值增加。本研究的次要功效终点包括:·在第48周,在总体组织病理学读数上脂肪性肝炎消退,并且在nash crn纤维化评分上肝纤维化没有恶化。将脂肪性肝炎的消退定义为不存在脂肪性肝病或没有脂肪性肝炎的孤立性或单纯性脂肪变性,并且炎症的nas评分为0-1,气球样变的nas评分为0,并且脂肪变性的nas评分为任意值。·在第48周,每种nas要素(炎症、气球样变和脂肪变性)从基线改善≥1分·在第48周,肝纤维化评分从基线改善≥1,并且脂肪性肝炎没有恶化(定义为气球样变、炎症或脂肪变性的nas没有增加)·在第48周,肝脏脂肪含量(mri-pdff)从基线改善或alt从基线改善。肝脏脂肪含量的改善或alt的改善定义为满足以下条件中的任一个:°alt≤40u/l并且≥30%的从基线降低°肝脏脂肪含量(mri-pdff)从基线降低≥30%·在第48周通过mripdff测量的肝脏脂肪含量从基线改善(定义为减少≥30%)·在第48周alt从基线改善(定义为alt≤40u/l,从基线降低≥30%)表3描述了在本实施例中使用的nafld的组织学评分系统,如d.e.golden等人在nonalcoholic steatohepatitis clinical research network.hepatology 41:1313-1321,2005所述。表3.非酒精性脂肪性肝病的组织学评分系统缩写mri-pdff=磁共振成像-质子密度脂肪分数。mre=磁共振弹性成像。lsm=肝硬度测量。alt=丙氨酸氨基转移酶。alt uln=女性30iu/l和男性40iu/last=天冬氨酸氨基转移酶。ldl胆固醇=低密度脂蛋白胆固醇。hdl胆固醇=高密度脂蛋白胆固醇。m2bpgi=mac-2结合蛋白糖基化异构体。elf测试=增强的肝纤维化测试。nash crn=非酒精性脂肪性肝炎临床研究网络。nas=nafld活动评分。实施例3:sglt2抑制剂与磺酰脲在具有nafld的2型糖尿病中的对比纳入标准1.活检符合nafld的诊断2. 2型糖尿病,hba1c>=7.0%淘汰标准肝病毒感染、自身免疫性肝炎、原发性胆汁性肝硬化、硬化性胆管炎、血色素沉着病、抗胰蛋白酶缺乏症、威尔逊病、非肠道营养史和使用已知诱导由物质滥用和/或当前或过去每天饮用超过20g酒精引起的脂肪变性或肝损伤的药物格列美脲和托格列净的超敏反应或禁忌症无2型糖尿病控制不佳的糖尿病不明原因低血糖反复发作伴随感染或计划的手术控制不佳的高血压严重的视网膜病变使用积极治疗方案的恶性肿瘤或未完全缓解或治愈的恶性肿瘤不适于本研究的严重健康问题孕妇或哺乳期女性如研究者所评估的无法参与研究。基线特征随机分配总计40名患者以20mg的剂量每天一次接受托格列净(20名患者)或每天一次接受格列美脲(20名患者)。全部40名患者(100%)完成了本试验。除性别外,两组的人口统计学和基线临床特征相似。患者均为日本人和2型糖尿病。平均年龄为53.9岁,平均体重为82.0kg,平均血红蛋白alc为8.2%,并且平均nas为4.45。总计18名患者(45%)具有fi期纤维化,11名(27.5%)具有f2期,并且5名(12.5%)具有f3期。参与者流量随机分配总计40名患者以20mg的剂量每天一次接受托格列净(20名患者)或每天一次接受格列美脲(20名患者)。全部40名患者(100%)完成了本试验。39名患者(97.5%)可获得与第48周活检相关的主要和确认次要结果的信息。仅一名具有严重不良事件的患者(2.5%)。主要结果在格列美脲组中,从基线到48周的唯一组织学改善是气球样变坏死的减少(p=0.025)。相反,接受托格列净的个体在所有变量中从基线至48周具有显著的组织学改善(脂肪变性、气球样变坏死和小叶炎症改善的患者的比率分别为65%、55%和50%)。在托格列净组中纤维化评分改善(60%,对于治疗前后的评分比较,p=0.001),但是在托格列净组和格列美脲组之间,从基线的变化没有显著差异(p=0.172)。次要结果组织学特征两组中的平均气球样变评分显著降低。平均脂肪变性评分、脂肪变性百分比、小叶炎症评分和纤维化评分仅在托格列净组中显著降低。在两组中,与基线值相比,nas显著改善,并且托格列净组的有益效果大于格列美脲组(p=0.002)。血清酶水平和肝脏试验托格列净组中天冬氨酸氨基转移酶和丙氨酸氨基转移酶水平存在早期并且高度显著的降低。托格列净组和格列美脲组之间相对于基线的变化没有显著差异。γ-谷氨酰转移酶的变化在托格列净组中显著降低(在第48周平均降低23.8iu/l,与格列美脲相比p<0.001)。此外,托格列净组中的fib-4指数显著降低,并且托格列净组中的效果大于格列美脲组中的效果。代谢参数升胰岛素参数例如fpg和hbalc的降低是相似的。在托格列净组中体重、bmi和体脂百分比显著降低(在第48周平均体重降低4.8kg,与格列美脲相比p<0.001)。这些变化发生在前12周,并且在个体接受治疗的整个期间持续。相反,cpr、脂质分布、氧化应激标志物和细胞因子的变化在两组中是相似的。简要概述在具有活检证实的nafld和2型糖尿病的患者中,在类似的血糖水平降低情况下,通过β氧化和减轻肝脏炎症,与格列美脲相比,使用托格列净的肝组织学改善的患者百分比显著更高。托格列净具有一些有利的代谢标志物。sglt2抑制剂可能具有保肝作用。在贯穿于本技术中,引用了多种出版物。这些出版物的公开内容通过引用整体并入本技术,以便更全面地描述本发明所属领域的状态。对于本领域技术人员显而易见的是,在不脱离本发明的范围或精神的情况下,可以在本发明中进行多种修饰和改变。考虑到本文公开的本发明的说明书和实施,本发明的其它实施方案对于本领域技术人员将是显而易见的。说明书和实施例旨在仅被认为是示例性的,本发明的真实范围和精神由所附权利要求指示。
背景技术:
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!