肠降血糖素类似物用于血糖控制和体重管理的制作方法
本公开涉及使用肠降血糖素类似物的方法和具有该类似物的组合物,所述类似物在葡萄糖依赖性促胰岛素多肽(gip)受体、胰高血糖素样肽-1(glp-1)受体和胰高血糖素(gcg)受体之每一者处有活性,尤其涉及使用某些剂量的肠降血糖素类似物和含有某些剂量肠降血糖素类似物的组合物的方法,所述方法可以用于治疗病状、疾病和病症,包括糖尿病(尤其2型糖尿病(t2dm))、肥胖症和与肥胖症相关的合并症(comorbidities),如血脂异常、非酒精性脂肪性肝炎(nash)、非酒精性脂肪肝病(nafld)、阻塞性睡眠呼吸暂停、骨关节炎、多囊性卵巢综合征和慢性肾脏病及其他疾病。
背景技术:
0、背景
1、过去数十年,糖尿病患病率持续升高,糖尿病是以因胰岛素分泌缺陷、胰岛素作用缺陷或这二者缺陷产生的高血糖症为特征的慢性疾病。t2dm是最常见形式的糖尿病,占全部糖尿病的约90%。在t2dm中,受损胰岛素分泌和胰岛素抵抗的联合效果与升高的血糖水平相关。
2、未受控制的糖尿病可能导致一种或多种影响这类个体发病和死亡的病状。t2dm的主要风险因子之一是肥胖症,并且许多t2dm个体(约90%)超重或肥胖。有据可查的是,身体肥胖下降将导致肥胖相关的合并症改善。
3、t2dm的现行标准医护包括膳食和锻炼,以及用口服药物和注射性降糖药物治疗,包括基于肠降血糖素的疗法,如glp-1受体激动剂。尽管治疗选项可获得,但显著数目接受已获批疗法的个体尚未达到血糖控制目标(参见,例如.,casagrande等人(2013)diabetescare 36:2271-22791。
4、国际专利申请公开号wo 2019/125938描述了充当gcg,glp-1和gip(ggg)三受体激动剂且可以用于治疗糖尿病、肥胖症、肥胖症相关合并症的肠降血糖素类似物。这些ggg三受体激动剂显示出延长的活性并且因此似乎适合每周一次施用。
5、然而,存在与施用在gip受体、glp-1受体和gcg受体之每一者处有延长活性的产品相关的潜在问题。例如,众所周知,glp-1单一激动剂治疗与恶心、呕吐和/或腹泻相关。例如,一项研究报道,全部glp-1受体给药方案均显著地增加胃肠道不良事件的发生率。diabetes technol ther.2015jan;17(1):35-42。gip/glp-1和glp-1/gcg双激动剂化合物的临床试验还已经显示,高剂量时耐受性受胃肠道不良事件限制。参见,例如schmitt,c.等人,diabetes obes.metab.2017;19:1436-1445;portron,a.等人,2390-pub,a624,ada-2017;portron,a.等人,diabetes obes.metab.2017;19:1446-1453;ambery p.d.等人,british journal of clinical pharmacology,2018oct;84(10):2325-2335;alba m.等人,clinical obesity,2021apr;11(2):e12432。因此,开发在gcg受体、glp-1受体和gip受体全部三者处具有活性的三重激动剂的有效剂量和给药方案仍是不可预测和有挑战性的任务。与胃肠道不良事件相关的剂量限制可能阻碍达到所需有效剂量的给药,可能破坏患者的治疗依从性,并且可能限制治疗方案的有效性。另外,每周一次施用具有延长活性的化合物可能需要多周以达到稳态活性,尤其平衡活性,这在过渡期(interim)导致高血糖次优控制。
6、因此,需要ggg三受体激动剂的优化剂量和给药方案,它们在需要这种治疗的个体中提供有效的血糖控制和/或有效的体重管理,同时还保留总体可接受的安全性与不良事件特征及个体耐受性。
7、发明简述
8、为了满足这种需求,本公开描述了具有seq id no:1的结构的ggg三受体激动剂的剂量,其中这类剂量可以是约0.5mg至约12.0。在一些情况下,该剂量是约0.5mg至约4.0mg、约2.0mg至约8.0mg或约4.0mg至约12.0mg。在其他情况下,该剂量是≤12.0mg。
9、本公开还描述药物制剂,所述药物制剂以约0.5mg至约12.0mg的剂量包含具有seqid no:1的结构的ggg三受体激动剂。
10、本公开还描述了改善个体中的血糖控制的方法、在超重或肥胖个体中提供长期体重管理的方法,以及治疗糖尿病(尤其t2dm)、血脂异常、代谢综合征、nafld、nash和/或肥胖症、阻塞性睡眠呼吸暂停、骨关节炎、多囊性卵巢综合征和/或慢性肾脏病的方法。
11、在一个方面,本公开描述了改善个体中的血糖控制的方法,其中这类方法包括向个体施用第一每周一次剂量的包含seq id no:1的ggg三受体激动剂至少约1周,其中第一每周一次剂量是约0.5mg至约4.0mg。
12、在一些情况下,这些方法还包括向个体施用第二每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,第二每周一次剂量可以小于第一每周一次剂量。备选地,第二每周一次剂量可以与第一每周一次剂量相同。备选地,第二每周一次剂量可以大于第一每周一次剂量。在一些情况下,第二每周一次剂量是约2.0mg至约8.0mg。
13、在一些情况下,这些方法还包括向个体施用第三每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,第三每周一次剂量可以小于第二每周一次剂量。备选地,第三每周一次剂量可以与第二每周一次剂量相同。备选地,第三每周一次剂量可以大于第二每周一次剂量。在一些情况下,第三每周一次剂量是约4.0mg至约12.0mg。
14、在一些情况下,这些方法还包括向个体施用第四每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,第四每周一次剂量可以小于第三每周一次剂量。备选地,第四每周一次剂量可以与第三每周一次剂量相同。备选地,第四每周一次剂量可以大于第三每周一次剂量。在一些情况下,第四每周一次剂量是约6.0mg至约12.0mg。
15、在一些情况下,这些方法还包括步骤:向个体施用第五每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,第五每周一次剂量可以小于第四每周一次剂量。备选地,第五每周一次剂量可以与第四每周一次剂量相同。备选地,第五每周一次剂量可以大于第四每周一次剂量。在一些情况下,第五每周一次剂量是约8.0mg至约12.0mg。
16、在一些情况下,将每个每周一次剂量(第一每周一次剂量和后续每周一次剂量)施用至少约二周。在一些情况下,将每个每周一次剂量施用至少约四周。
17、在一个实施方案中,第一每周一次剂量是2.0mg,第二每周一次剂量是4.0mg,第三每周一次剂量是8.0mg,并且第四每周一次剂量是12.0mg。在另一个实施方案中,第一每周一次剂量是2.0mg,第二每周一次剂量是4.0mg,第三每周一次剂量是6.0mg,第四每周一次剂量是9.0mg,并且第五每周一次剂量是12.0mg。
18、在另一个方面,本公开描述了改善个体中血糖控制的方法,其中这类方法包括向个体施用第一每周一次剂量的包含seq id no:1的ggg三受体激动剂,其中第一每周一次剂量是约0.5mg至约4.0mg并且将其施用至少1周。该方法进一步包括按约1.0至约4.0mg的增量增加第一每周一次剂量到每周一次剂量≤12.0mg,其中将每个增加的每周一次剂量施用至少1周。
19、在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量施用至少约二周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量施用至少约四周。
20、在一些情况下,第一每周一次剂量是≥1.0mg并且按约1.0、2.0、3.0或4.0mg增量以4周间隔增加直至实现约8.0mg或约9.0mg或约10.0mg或约11.0mg或约12.0mg的剂量。
21、在一些情况下,第一每周一次剂量选自1.0或2.0mg并且增加的每周一次剂量选自2.0、3.0、4.0、6.0、8.0、9.0、10.0或12.0mg。
22、在一个实施方案中,第一每周一次剂量是2.0mg,并且增加的每周一次剂量是4.0、8.0和12.0mg。在另一个实施方案中,第一每周一次剂量是2.0mg,并且增加的每周一次剂量是4.0、6.0、9.0和12.0mg。
23、在另一个方面,本公开描述了改善个体中血糖控制的方法,其中这类方法包括步骤(a)向个体施用约0.5mg至约4.0mg适于每周一次给药至少1周的包含seq id no:1的结构的ggg三受体激动剂。这些方法还包括步骤(b)向个体每周一次施用约2.0mg至约8.0mg的ggg三受体激动剂至少1周。这些方法还包括步骤(c)向个体每周一次施用约8.0mg至约12.0mg的ggg三受体激动剂至少1周。
24、在另一个方面,本公开描述在个体中提供长期体重管理的方法,其中这类方法包括向个体施用第一每周一次剂量的包含seq id no:1的ggg三受体激动剂至少约1周,其中第一每周一次剂量是约0.5mg至约4.0mg。
25、在一些情况下,这些方法还包括向个体施用第二每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,第二每周一次剂量可以小于第一每周一次剂量。备选地,第二每周一次剂量可以与第一每周一次剂量相同。备选地,第二每周一次剂量可以大于第一每周一次剂量。在一些情况下,第二每周一次剂量是约2.0mg至约8.0mg。
26、在一些情况下,这些方法还包括向个体施用第三每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,第三每周一次剂量可以小于第二每周一次剂量。备选地,第三每周一次剂量可以与第二每周一次剂量相同。备选地,第三每周一次剂量可以大于第二每周一次剂量。在一些情况下,第三每周一次剂量是约4.0mg至约12.0mg。
27、在一些情况下,这些方法还包括向个体施用第四每周一次剂量的ggg三受体激动剂至少1周的步骤。在一些情况下,第四每周一次剂量可以小于第三每周一次剂量。备选地,第四每周一次剂量可以与第三每周一次剂量相同。备选地,第四每周一次剂量可以大于第三每周一次剂量。在一些情况下,第四每周一次剂量是约6.0mg至约12.0mg。
28、在一些情况下,这些方法还包括步骤:向个体施用第五每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,第五每周一次剂量可以小于第四每周一次剂量。备选地,第五每周一次剂量可以与第四每周一次剂量相同。备选地,第五每周一次剂量可以大于第四每周一次剂量。在一些情况下,第五每周一次剂量是约8.0mg至约12.0mg。
29、在一些情况下,将每个每周一次剂量施用至少约二周。在一些情况下,将每个每周一次剂量施用至少约四周。
30、在一个实施方案中,第一每周一次剂量是2.0mg,第二每周一次剂量是4.0mg,第三每周一次剂量是8.0mg,并且第四每周一次剂量是12.0mg。在另一个实施方案中,第一每周一次剂量是2.0mg,第二每周一次剂量是4.0mg,第三每周一次剂量是6.0mg,第四每周一次剂量是9.0mg,并且第五每周一次剂量是12.0mg。
31、在另一个方面,本公开描述在个体中提供长期体重管理的方法,其中这类方法包括向个体施用第一每周一次剂量的具有seq id no:1的结构的ggg三受体激动剂,其中第一每周一次剂量是约0.5mg至约4.0mg并且将其施用至少1周。该方法包括按约1.0mg至约4.0mg的增量增加第一每周一次剂量到每周一次剂量≤12.0mg,其中将每个增加的每周一次剂量施用至少1周。
32、在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量施用至少约二周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量施用至少约四周。
33、在某些情况下,第一每周一次剂量是≥1.0mg并且按约1.0、2.0、3.0或4.0mg增量以4周间隔增加直至实现约8.0mg或约9.0mg或约10.0mg或约11.0mg或约12.0mg的剂量。
34、在一个实施方案中,第一每周一次剂量是2.0mg,并且增加的每周一次剂量是4.0、8.0和12.0mg。在另一个实施方案中,第一每周一次剂量是2.0mg,并且增加的每周一次剂量是4.0、6.0、9.0和12.0mg。
35、在另一个方面,本公开描述在个体中提供长期体重管理的方法,其中这类方法包括步骤(a)向个体施用约0.5mg至约4.0mg适于每周一次给药至少1周的具有seq id no:1的结构的ggg三受体激动剂。这些方法还包括步骤(b)向个体施用约2.0mg至约8.0mg的ggg三受体激动剂至少1周。这些方法还包括步骤(c)向个体每周一次施用约8.0mg至约12.0mg的ggg三受体激动剂至少1周。
36、在一些情况下,个体患有糖尿病、尤其t2dm。在一些情况下,个体超重或肥胖或患有肥胖症。在一些情况下,个体起初具有≥27kg/m2但<30kg/m2的身体质量指数(body massindex,bmi)并且因此超重。在其他情况下,个体起初具有≥30kg/m2的bmi并且因此肥胖。
37、在另一个方面,本文还描述了用于治疗糖尿病(尤其t2dm)、血脂异常、代谢综合征、nafld、nash和/或肥胖症、阻塞性睡眠呼吸暂停、骨关节炎、多囊性卵巢综合征和/或慢性肾脏病的方法。
38、除以上方法之外,描述了适于每周一次给药的具有seq id no:1的结构的ggg三受体激动剂在个体中改善血糖控制或提供长期体重管理的用途,其中通过本文所述的一种或多种方法可获得待施用ggg三受体激动剂的剂量。
39、同样,描述了适于每周一次给药的包含seq id no:1的ggg三受体激动剂治疗糖尿病(尤其t2dm)、血脂异常、代谢综合征、nafld、nash和/或肥胖症、阻塞性睡眠呼吸暂停、骨关节炎、多囊性卵巢综合征和/或慢性肾脏病的用途,其中通过本文所述的一种或多种方法可获得待施用ggg三受体激动剂的剂量。
40、本文中剂量、治疗方案、方法和用途的优点是ggg三受体类似物提供较长的作用持续时间并引起更少的ae,因此需要比当前可用肠降血糖素类似物更少的注射,包括频率低如每周一次。这类产品将具有改善接受度和依从性的潜力。
技术实现思路
0、概述
1、gcg是一种参与氨基酸、脂质和糖类代谢的二十九氨基酸激素。gcg在就餐间血糖调节和总体体重减少方面发挥重要作用。glp-1是调节胰岛素和胰高血糖素分泌的肠降血糖素激素。gip是对葡萄糖依赖性胰岛素分泌显示出强力肠降血糖素作用并且与glp-1具有改善葡萄糖控制和体重减轻的已知互补作用的肠抑胃肽。推测ggg三受体激动剂对这三种受体的协同作用产生比现行标准医护更强力、更有效的疗法。国际专利申请公开号wo2019/125938描述了可以用于治疗糖尿病、肥胖症、肥胖症相关合并症和其他医学疾病的ggg三受体激动剂的结构、功能、产生和用途。本文中特别有意义的是实施例12中所述的ggg三受体激动剂,其是脂肪酸酰化、长效ggg三受体激动剂(seq id no:1)。
2、不幸地,许多糖尿病个体不能达到其hbalc目标并且与体重管理作斗争,从而需要能够提供额外血糖控制和/或体重减轻的新疗法和给药方案。另外,尽管在一些情况下,单纯增加治疗剂的剂量或许能够实现疗效增加,但增加治疗剂的剂量,尤其在gip受体、glp-1受体和gcg受体之每一者处有活性的治疗剂的剂量还带来副作用更大的风险。例如,一项ggg三受体激动剂i期研究展示腹泻、呕吐和恶心风险。实际上,在本文所述的i期研究中,i期给药研究中经6.0mg或更高剂量ggg三受体激动剂治疗的个体显示出常与肠降血糖素类似物如ggg三受体激动剂治疗有关的gi ae(例如,呕吐和恶心)的发生率高于预期。
3、本文中描述了用于适合每周一次给药的ggg三受体激动剂的给药方案及其使用方法的多个方面。在某些情况下,本文所述的治疗方案和方法包括确定并施用这类ggg三受体激动剂的初始剂量。在其他方面,本文所述的治疗方案和方法包括确定并施用维持剂量,包含何时和如何调节维持剂量。在其他方面,本文的治疗方案和方法描述一种固定给药方案。
4、除非另外定义,否则本文中所用的全部技术术语和科学术语具有本公开所属领域的技术人员通常所理解的相同意义。尽管与本文所述的那些方法和材料相似或等同的任意方法和材料可以用于实施或检验ggg三受体激动剂、药物组合物和方法,然而本文描述优选的方法和材料。
5、另外,借助非限定冠词“一个”或“一种”对某要素的提及不排除存在多于一个该要素的可能性,除非上下文清楚地要求应当存在一个要素且只存在一个要素。非限定冠词“一个”或“一种”因而通常意指“至少一个”。
6、定义
7、如本文所用,“约”意指处于某值或诸值(例如,所规定浓度、长度、分子量、ph、序列同一性、时间期限、温度或体积)的统计意义范围内。这种值或范围可以处于给定值或范围的某个数量级内,一般处于其20%内、更一般其10%内和甚至更一般地其5%内。“约”涵盖的可允许变异将取决于所研究的具体系统,并且可以为本领域技术人员轻易领会。
8、如本文所用和本文中提及一种或多种gip受体、glp-1受体或gcg受体时,“活性”、“激活”、“激活性”等意指化合物(如本文中的ggg三受体激动剂)与受体结合且在受体处诱导应答的能力,如使用本领域已知的测定法所测量。
9、如本文所用,“氨基酸”意指一种从化学观点看特征为含有一个或多个胺基和一个或多个羧酸基并且可以含有其他官能团的分子。如本领域已知,存在一组指定为标准氨基酸并且作为任何生命体产生的大部分肽/多肽/蛋白质的结构单元使用的二十种氨基酸。
10、如本文所用,“类似物”意指激活靶受体并且激发至少一种由先天受体激动剂激发的体内或体外作用的化合物,如合成肽或多肽。
11、如本文所用,“剂量(dose)”或“剂量(doses)”意指用于每周一次给药的ggg三受体激动剂在特定时间点以分离的量(discrete amount)施用至个体的量。与术语剂量、给药、诸剂量等联系使用时,“调整”意指任何降低或升高至前一周所施用剂量的量。与术语剂量、给药、诸剂量等联系使用时,“治疗方案”意指一套用于确定并施用一剂或多剂和/或对其调整的准则。
12、如本文所用,“有效量”意指本文中一种或多种ggg三受体激动剂或其可药用盐的某个量、浓度或剂量,其中一旦向有需求的个体施用单剂或多剂,所述量、浓度或剂量在接受诊断或治疗的这种个体中提供想要的作用(即,可以在个体的病状方面产生临床可测量差异,如,血糖降低、hba1c降低、体重或体脂减少和/或身体组成变化)。有效量可以由本领域技术人员通过使用已知技术和通过观察类似条件下所获得的结果轻易地确定。在确定个体的有效量时,考虑众多因素,包括但不限于:哺乳动物的物种、其体格、年龄和总体健康状况;所涉具体疾病或病症;疾病或病症的程度或牵涉面或严重程度;个体的反应;施用的ggg三受体激动剂;施用模式;所施用制剂的生物利用度特征;选择的给药方案;伴同用药使用情况;和其他相关条件。
13、如本文所用,“空腹葡萄糖”意指来自个体禁食至少约8小时后所取得血液样品的血糖水平。
14、如本文所用,“血糖控制”意指维持或降低个体hba1c水平。同样地,“改善”和/或“改进的”血糖控制意指hba1c降低。另外,“需要进一步”控制血糖意指需要降低hba1c。
15、如本文所用,“血红蛋白a1c”或“hba1c”意指糖化血红蛋白及其水平,所述糖化血红蛋白在血红蛋白与血液中的葡萄糖接合时形成。hba1c水平是糖尿病个体中血糖控制的常用指标,降低的hba1c水平通常表示血糖控制改善。在本公开的上下文中,这里的剂量、治疗方案和方法导致hba1c下降。在某些情况下,hba1c下降相对于现有用相同或甚至用不同ggg三受体激动剂(包括其他ggg三受体激动剂)治疗所致的hba1c水平降低。
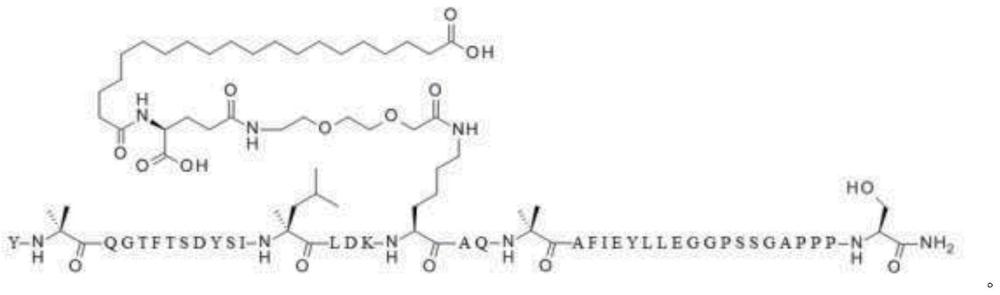
16、如本文所用,“肠降血糖素类似物”意指与gip、glp-1和gcg、尤其人gip、人glp-1和人gcg之每一者具有结构相似性、但有多种差异的化合物。本文中的肠降血糖素类似物包含了产生化合物的氨基酸序列,所述化合物对gip受体、glp-1受体和gcg受体之每一者具有亲和力并在前者每一处有活性(即,三受体激动剂活性)。国际专利申请公开号wo 2019/125929和wo 2019/125938以及国际专利申请号pct/us2020/064512中描述了本文使用的人gip、glp-1和gcg的示例性肠降血糖素类似物和序列。本文中特别有用的是国际专利申请公开号wo 2019/125938实施例12中的ggg三受体激动剂,其具有以下序列:
17、yx2qgtftsdysix13ldkx17ax19x20afieyllx28x29gpssx34appps,
18、其中x2是aib,x13是αmel,x17是k,x19是q,x20是aib,x28是e,x29是g并且x34是g,其中x17处的k通过缀合于k侧链的ε氨基经(2-[2-(2-氨基乙氧基)-乙氧基]-乙酰基)-(γglu)-co-(ch2)18co2h化学修饰,并且其中c端氨基酸酰胺化为c端伯酰胺(seq id no:1),包括作为寻求ggg三受体激动剂产品批准的监管提交的主体的任何蛋白质,所述批准总体上或部分依赖于美国礼来公司涉及这种肠降血糖素类似物提交给监管机构的数据,无论寻求该产品获批的方面是否实际上将肠降血糖素类似物确定为ggg三受体激动剂或使用某个其他术语。
19、除了残基aib2、αmel13、k17和aib20之外,下文使用标准单字母氨基酸代码描述了seq id no:1的ggg三受体类似物的结构,其中已经放大这些氨基酸残基的结构:
20、
21、如本文所用,“有需求的个体”意指患有需要治疗或疗法的病状、疾病、病症或症状(例如,包括本文中所列那些)的哺乳动物,如人。具体地说,优选的待治疗个体是人。
22、如本文所用,“负荷剂量(loading dose)”意指,向个体施用的治疗剂(如,ggg三受体激动剂)的第一剂量,所述第一剂量大于将预计用于长期或维持治疗的剂量。按不同方式描述,负荷剂量是治疗剂的单个剂量,所述单个剂量大于预计每周维持剂量达大约等于以下数量的倍数,其中按所述数量,如与施用单个剂量的预计每周维持剂量后的血清峰浓度相比,在施用足够数目的每周一次预计维持剂量以达到稳态后血浆峰浓度更大。
23、如本文所用,“预计每周维持剂量”意指适合每周一次给药的治疗剂(如,ggg三受体激动剂)的剂量,其中基于诸因素,包括但不限于个体fg、hba1c、低血糖频率和严重程度和其他ae和/或bw,原本预计需要所述剂量在给定的个体中提供血糖控制或体重管理。
24、如本文所用,“维持剂量”意指不为负荷剂量的、适于每周一次给药的治疗剂(如,ggg三受体激动剂)的任何每周一次剂量。
25、如本文所用,就个体而言,“肥胖”或“肥胖症”意指个体具有≥30kg/m2的bmi。
26、如本文所用,就个体而言,“超重”意指个体具有≥27kg/m2但<30kg/m2的bmi。
27、如本文所用,“治疗”、“治疗着”或“以治疗”等意指阻止、延缓、停止或逆转现有病状、疾病、病症或症状的进展或严重程度。治疗示例性病状、疾病、病症和症状包括但不限于治疗t2dm、改善血糖控制、引起糖尿病消退或缓解、预防进程糖尿病、改善体重管理、治疗肥胖症、改善血脂异常、治疗慢性肾脏病、治疗糖尿病性肾脏疾病、治疗动脉粥样硬化性心脏病、治疗射血分数保留性心力衰竭(hfpef)或射血分数降低性心力衰竭(hfref)、治疗非酒精性脂肪肝病、治疗非酒精性脂肪性肝炎、治疗肝硬化、治疗阻塞性睡眠呼吸暂停、治疗肥胖症相关病症和/或并发症、治疗骨关节炎和治疗多囊性卵巢综合征。
28、如本文所用并提到参考肠降血糖素类似物,“三受体激动剂活性”意指在gip受体、glp-1受体和gcg受体之每一者处有活性的肠降血糖素类似物,尤其以下类似物,所述类似物在每种受体处具有平衡和足够的活性以提供该受体的激动作用益处,同时避开与该受体活性太多相关的不想要的副作用。另外,具有三受体激动剂活性的肠降血糖素类似物在gip受体、glp-1受体和gcg受体之每一者处具备延长的作用持续时间,这有利地允许频率低如每天一次、每周三次、每周两次或每周一次给药。
29、如本文所用,“体重管理”意指体重降低和/或体脂组成变化。
30、组合物
31、本文中的组合物包含具有例如seq id no:1的结构的ggg三受体激动剂。可以重组产生或合成产生该ggg三受体激动剂(参见,例如国际专利申请公开号wo 2019/125929、wo2019/125938以及国际专利申请公开号pct/us2020/064512)。美国临时专利申请号63/164,702(2021年3月23日提交)中公开了可以在本文中使用的ggg三受体激动剂的制剂。
32、在一些情况下,配制本文的组合物以包含约0.5mg至约12.0mg的ggg三受体激动剂剂量。在其他情况下,ggg三受体激动剂的剂量可以是约1.0mg至约11.5mg、约1.5mg至约11.0mg、约2.0mg至约10.5mg、约2.5mg至约10.0mg、约3.0mg至约9.5mg、约3.5mg至约9.0mg、约4.0mg至约8.5mg、约4.5mg至约8.0mg、约5.0mg至约7.5mg、约5.5mg至约7.0mg或约6.0mg至约6.5mg。在其他情况下,ggg三受体激动剂的剂量可以是约1.0mg至约2.0mg、约2.0mg至约3.0mg、约3.0mg至约4.0mg、约4.0至约5.0mg、约5.0mg至约6.0mg、约6.0mg至约7.0mg、约7.0mg至约8.0mg、约8.0mg至约9.0mg、约9.0mg至约10.0mg、约10.0mg至约11.0mg或约11.0mg至约12.0mg。在其他情况下,ggg三受体激动剂的剂量可以是约0.5mg、约1.0mg、约1.5mg、约2.0mg、约2.5mg、约3.0mg、约3.5mg、约4.0mg、约4.5mg、约5.0mg、约5.5mg、约6.0mg、约6.5mg、约7.0mg、约7.5mg、约8.0mg、约8.5mg、约9.0mg、约9.5mg、约10.0mg、约10.5mg、约11.0mg、约11.5mg或约12.0mg。备选地,ggg三受体激动剂的剂量≤12.0mg。在某些情况下,ggg三受体激动剂的剂量可以是约0.5mg至约4.0mg、约2.0mg至约8.0mg或约8.0mg至约12.0mg。
33、可以静脉内(iv)、肌内(im)或皮下(sc)、尤其sc施用本文中的组合物。该组合物可以冻干提供并且随后复溶或作为使用预充式一次性笔、可复用笔或自动笔式注射器施用的溶液制剂提供。备选地,可以使用多用途小瓶或泵装置施用该组合物。在一些情况下,该装置是如美国专利号8,734,394所述的自动注射器械。
34、本文中的组合物因此可以在预充式注射器中/多用途小瓶中提供。这种预充式注射器/多用途小瓶可以用于施用每位患者每剂约0.5ml至约1.0ml的组合物。可以使用临床医务人员、医生或其他受训的医学从业人员确定的给药方案施用组合物的剂量。
35、备选地,可以对芯筒(cartridge)制备组合物,并且因此将因包含防腐剂而不同于以上组合物。
36、备选地,可以将组合物制备为制造品(包括组合物)的部分,其中制造品可以是多用途小瓶、可复用笔式注射器、预填充、用后即弃笔、自动注射器或泵。
37、鉴于以上,本文的组合物与可接受的保质期稳定性、在用稳定性和可接受的注射部位体验相关。
38、方法
39、本文中的ggg三受体激动剂可以用于治疗多种病状、病症、疾病或症状。例如,本文中的ggg三受体激动剂可以用于改善血糖控制、提供长期体重管理以及治疗糖尿病(尤其t2dm)、血脂异常、代谢综合征、nafld、nash、肥胖症、阻塞性睡眠呼吸暂停、骨关节炎、多囊性卵巢综合征和/或慢性肾脏病。
40、这些方法可以包括本文所述的步骤,并且这些步骤可以按照如所述那样的顺序实施,但不必然如此。然而,还可构思其他顺序。另外,可以平行地和/或时间上重叠地和/或逐一或在多个重复步骤中实施单个或多个步骤。可以省略一些步骤。另外,这些方法可以包括额外、未指明的步骤。
41、尽管下文提供了每种方法的详情,但每个方法以包括步骤:选择患有或易患糖尿病、尤其t2dm和/或已经出现或易出现超重或肥胖的个体。
42、在一个方面,本文提供一种用于改善个体中血糖控制的方法,其中这类方法包括向个体施用第一每周一次剂量的包含seq id no:1的ggg三受体激动剂(即,肠降血糖素类似物)至少1周,其中第一每周一次剂量是约0.5mg至约4.0mg。在一些情况下,将第一剂量每周一次施用至少约1周、每周一次施用至少约2周或每周一次施用至少约4周。在一些情况下,将第一剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周或每周一次施用约4周。在一些情况下,第一每周一次剂量是1.0mg、2.0mg、3.0或4.0mg。在一些情况下,第一每周一次剂量是1.0mg、2.0mg或4.0mg。在一些情况下,第一每周一次剂量选自约1.0mg至约2.0mg。在一些情况下,第一每周一次剂量是约1.0mg或约2.0mg。在一些情况下,第一剂量是1.0mg。在一些情况下,第一剂量是2.0mg。
43、在一些实施方案中,这些方法还包括步骤:向个体施用第二每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,将第二剂量每周一次施用至少约1周、每周一次施用至少约2周或每周一次施用至少约4周。在一些情况下,将第二剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周或每周一次施用约4周。在一些情况下,第二每周一次剂量小于第一每周一次剂量。备选地,第二每周一次剂量与第一每周一次剂量相同。备选地,第二每周一次剂量大于第一每周一次剂量。在一些情况下,第二每周一次剂量是约2.0mg至约8.0mg。在某些情况下,第二每周一次剂量是2.0mg、3.0mg、4.0mg、6.0mg或8.0mg。在一些情况下,第二每周一次剂量选自约2.0mg至约4.0mg。在一些情况下,第二每周一次剂量是2.0mg、3.0mg或4.0mg。在一些情况下,第二每周一次剂量是4.0mg。
44、在一些实施方案中,这些方法还包括步骤:向个体施用第三每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,将第三剂量每周一次施用至少约1周、每周一次施用至少约2周、每周一次施用至少约4周、每周一次施用至少约6周,或每周一次施用至少约8周或更多周数。在一些情况下,将第三剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周、每周一次施用约4周、每周一次施用约6周、每周一次施用约8周或更多周数。在一些情况下,第三每周一次剂量可以小于第二每周一次剂量。备选地,第三每周一次剂量可以与第二每周一次剂量相同。备选地,第三每周一次剂量可以大于第二每周一次剂量。在一些情况下,第三每周一次剂量是约4.0mg至约12.0mg。在某些情况下,第三每周一次剂量是4.0mg、6.0mg、8.0mg、10.0mg或12.0mg。在一些情况下,第三每周一次剂量选自约4.0mg至约8.0mg。在一些情况下,第三每周一次剂量是4.0mg、6.0mg或8.0mg。在一些情况下,第三每周一次剂量是6.0mg或8.0mg。在一些情况下,第三每周一次剂量是6.0mg。在一些情况下,第三每周一次剂量是8.0mg。
45、在一些实施方案中,这些方法还包括步骤:向个体施用第四每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,将第四个剂量每周一次施用至少约1周、每周一次施用至少约2周、每周一次施用至少约4周、每周一次施用至少约6周,或每周一次施用至少约8周或更多周数。在一些情况下,将第四个剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周、每周一次施用约4周、每周一次施用约6周或每周一次施用约8周或更多周数。在一些情况下,第四每周一次剂量可以小于第三每周一次剂量。备选地,第四每周一次剂量可以与第三每周一次剂量相同。备选地,第四每周一次剂量可以大于第三每周一次剂量。在一些情况下,第四每周一次剂量是约6.0mg至约12.0mg。在某些情况下,第四每周一次剂量是6.0mg、8.0mg、9.0mg、10.0mg、11.0mg或12.0mg。在一些情况下,第四每周一次剂量是6.0mg、8.0mg、9.0mg,10.0mg或12.0mg。在一些情况下,第四每周一次剂量是9.0mg。在一些情况下,第四个剂量每周一次是12.0mg。
46、在一些实施方案中,这些方法还包括步骤:向个体施用第五每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,将第五个剂量每周一次施用至少约1周、每周一次施用至少约2周、每周一次施用至少约4周、每周一次施用至少约6周,或每周一次施用至少约8周或更多周数。在一些情况下,将第五个剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周、每周一次施用约4周、每周一次施用约6周或每周一次施用约8周或更多周数。在一些情况下,第五每周一次剂量可以小于第四每周一次剂量。备选地,第五每周一次剂量可以与第四每周一次剂量相同。备选地,第五每周一次剂量可以大于第四每周一次剂量。在一些情况下,第五每周一次剂量是约8.0mg至约12.0mg。在某些情况下,第五每周一次剂量是8.0mg、9.0mg、10.0mg、11.0mg或12.0。在一些情况下,第五每周一次剂量是8.0mg,10.0mg或12.0mg。在一些情况下,第五每周一次剂量是12.0mg。
47、在一些实施方案中,这些方法还包括向个体施用额外的剂量,如第六每周一次剂量,或第七每周一次剂量,或更多。额外的剂量可以少于、相同于或大于施用的先前剂量。
48、例如,在一些实施方案中,该方法包括向个体施用选自约1.0mg至约2.0mg的第一每周一次剂量、选自约2.0mg至约4.0mg的第二每周一次剂量、选自约4.0mg至约8.0mg的第三每周一次剂量和选自约6.0mg至约12.0mg的第四每周一次剂量。
49、在一些实施方案中,该方法包括向个体施用选自约1.0mg至约2.0mg的第一每周一次剂量、选自约2.0mg至约4.0mg的第二每周一次剂量、选自约4.0mg至8.0mg的第三每周一次剂量、选自约6.0mg至约12.0mg的第四每周一次剂量和选自约8.0mg至约12.0mg的第五每周一次剂量。
50、在一些实施方案中,该方法包括向个体施用选自约1.0mg至约2.0mg的第一每周一次剂量、选自约2.0mg至约4.0mg的第二每周一次剂量、选自约4.0mg至约8.0mg的第三每周一次剂量、选自约6.0mg至约12.0mg的第四每周一次剂量、选自约8.0mg至约12.0mg的第五每周一次剂量和选自约10.0mg至约12.0mg的第六每周一次剂量。
51、在一些实施方案中,该方法包括向个体施用选自约1.0mg至约2.0mg的第一每周一次剂量、选自约2.0mg至约4.0mg的第二每周一次剂量、选自约4.0mg至约8.0mg的第三每周一次剂量、选自约6.0mg至约12.0mg的第四每周一次剂量、选自约8.0mg至约12.0mg的第五每周一次剂量、选自约10.0mg至约12.0mg的第六每周一次剂量和12.0mg的第七每周一次剂量。
52、在多种实施方案中,第一每周一次剂量选自1.0或2.0mg,第二每周一次剂量选自2.0、3.0或4.0mg,第三每周一次剂量选自4.0、6.0或8.0mg,第四每周一次剂量选自6.0、8.0、9.0、10.0或12.0mg,第五每周一次剂量选自8.0、10.0或12.0mg,第六每周一次剂量选自10.0或12.0mg,并且第七每周一次剂量是12.0mg。
53、在一些实施方案中,将每个每周一次剂量施用至少约2周。在一些实施方案中,将每个每周一次剂量施用至少约4周。在一些实施方案中,将每个每周一次剂量施用约2周。在一些实施方案中,将每个每周一次剂量施用约4周。
54、例如,在一些实施方案中,该方法包括向个体施用约2.0mg的第一每周一次剂量至少约4周、约4.0mg的第二每周一次剂量至少约4周、约8.0mg的第三每周一次剂量至少约4周和约12.0mg的第四每周一次剂量至少约4周。
55、在一些实施方案中,该方法包括向个体施用约2.0mg的第一每周一次剂量至少约4周、约4.0mg的第二每周一次剂量至少约4周、约8.0mg的第三每周一次剂量至少约4周、约10.0mg的第四每周一次剂量至少约4周和约12.0mg的第五每周一次剂量至少约4周。
56、在一些实施方案中,该方法包括向个体施用约2.0mg的第一每周一次剂量至少约4周、约4.0mg的第二每周一次剂量至少约4周、约6.0mg的第三每周一次剂量至少约4周、约8.0mg的第四每周一次剂量至少约4周、约10.0mg的第五每周一次剂量至少约4周和约12.0mg的第六每周一次剂量至少约4周。
57、在一些实施方案中,该方法包括向个体施用约2.0mg的第一每周一次剂量至少约4周、约4.0mg的第二每周一次剂量至少约4周、约6.0mg的第三每周一次剂量至少约4周、约9.0mg的第四每周一次剂量至少约4周和约12.0mg的第五每周一次剂量至少约4周。
58、在一些实施方案中,该方法包括向个体施用约1.0mg的第一每周一次剂量至少约4周、约3.0mg的第二每周一次剂量至少约4周、约6.0mg的第三每周一次剂量至少约4周、约9.0mg的第四每周一次剂量至少约4周和约12.0mg的第五每周一次剂量至少约4周。
59、在一些实施方案中,该方法包括向个体施用约1.0mg的第一每周一次剂量至少约4周、约2.0mg的第二每周一次剂量至少约4周、约4.0mg的第三每周一次剂量至少约4周、约6.0mg的第四每周一次剂量至少约4周、约8.0mg的第五每周一次剂量至少约4周、约10.0mg的第六每周一次剂量至少约4周和12.0mg的第七每周一次剂量至少约4周。
60、上述实施方案仅作为示例提供并且不意味着排除其他或额外的实施方案。例如,在一些实施方案中,可以省略一个或多个如上所示的给药步骤或可以基于个体的疗效、安全性和耐受性考虑引入一个或多个新的给药步骤。
61、在一些情况下,改善血糖控制包括降低个体的hb1ac的水平低于7%、低于6.5%或低于6.0%。
62、在一些情况下,个体起初具有≥27kg/m2但<30kg/m2的身体质量指数(bmi)。在一些情况下,个体起初具有≥30kg/m2的bmi。在一些情况下,个体患有2型糖尿病。在一些情况下,个体患有肥胖症。
63、在一些情况下,这些方法还可以包含步骤:在剂量施用期间测量个体的fg或hba1c中至少一者或两者。测量fg和hba1c的方法为本领域技术人员熟知且无需详尽描述。这些方法还可以包括步骤:在剂量施用期间记录个体的低血糖和任选地其他ae的频率和严重程度。在一些情况下,ae可以是腹泻、呕吐、gi不适和恶心。这些方法还可以包括步骤:从个体的fg和/或hba1c和/或从个体的低血糖和任选地其他ae的频率和严重程度确定ggg三受体激动剂的剂量。
64、在另一个方面,本文提供一种用于改善个体中血糖控制的包含seq id no:1的ggg三受体激动剂,其中将第一每周一次剂量的ggg三受体激动剂施用至少1周并且其中第一每周一次剂量是约0.5mg至约4.0mg。
65、在一些实施方案中,将ggg三受体激动剂的第二每周一次剂量施用至少1周。在一些情况下,第二每周一次剂量是约2.0mg至约8.0mg。在一些情况下,第二每周一次剂量小于第一每周一次剂量。备选地,第二每周一次剂量与第一每周一次剂量相同。备选地,第二每周一次剂量大于第一每周一次剂量。
66、在一些实施方案中,将ggg三受体激动剂的第三每周一次剂量施用至少1周。在一些情况下,第三每周一次剂量是约4.0mg至约12.0mg。在一些情况下,第三每周一次剂量可以小于第二每周一次剂量。备选地,第三每周一次剂量可以与第二每周一次剂量相同。备选地,第三每周一次剂量可以大于第二每周一次剂量。
67、在一些实施方案中,将ggg三受体激动剂的第四每周一次剂量施用至少1周。在一些情况下,第四每周一次剂量是约6.0mg至约12.0mg。在一些情况下,第四每周一次剂量可以小于第三每周一次剂量。备选地,第四每周一次剂量可以与第三每周一次剂量相同。备选地,第四每周一次剂量可以大于第三每周一次剂量。
68、在一些实施方案中,将ggg三受体激动剂的第五每周一次剂量施用至少1周。在一些情况下,第五每周一次剂量是约8.0mg至约12.0mg。在一些情况下,第五每周一次剂量可以小于第四每周一次剂量。备选地,第五每周一次剂量可以与第四每周一次剂量相同。备选地,第五每周一次剂量可以大于第四每周一次剂量。
69、在一些实施方案中,额外的剂量,如第六每周一次剂量,或第七每周一次剂量,或更多,可以施用至少1周。额外的剂量可以少于、相同于或大于施用的先前剂量。
70、在多种实施方案中,第一每周一次剂量选自约1.0mg至约2.0mg,第二每周一次剂量选自约2.0mg至约4.0mg,第三每周一次剂量选自约4.0mg至约8.0mg,并且第四每周一次剂量选自约6.0mg至约12.0mg,并且第五每周一次剂量选自约8.0mg至12.0mg。在一些实施方案中,施用选自约10.0mg至约12.0mg的第六每周一次剂量。在一些实施方案中,施用约12.0mg的第七每周一次剂量。
71、在一些实施方案中,第一每周一次剂量是2.0mg,第二每周一次剂量是4.0mg,第三每周一次剂量是8.0mg,并且第四每周一次剂量是12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,第二每周一次剂量是4.0mg,第三每周一次剂量是6.0mg,第四每周一次剂量是9.0mg,并且第五每周一次剂量是12.0mg。
72、在一些实施方案中,将每个每周一次剂量施用至少约2周。在一些实施方案中,将每个每周一次剂量施用至少约4周。
73、在另一个方面,本文提供包含seq id no:1的ggg三受体激动剂在制造在药物中的用途,所述药物用于改善个体中的血糖控制,其中将第一每周一次剂量的ggg三受体激动剂施用至少1周并且其中第一剂量是约0.5mg至4.0mg。在一些实施方案中,将第二每周一次剂量的ggg三受体激动剂施用至少1周。在一些实施方案中,将第三每周一次剂量的ggg三受体激动剂施用至少1周。在一些实施方案中,将第四每周一次剂量的ggg三受体激动剂施用至少1周。在一些实施方案中,将第五每周一次剂量的ggg三受体激动剂施用至少1周。
74、在一些实施方案中,第一每周一次剂量是2.0mg,第二每周一次剂量是4.0mg,第三每周一次剂量是8.0mg,并且第四每周一次剂量是12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,第二每周一次剂量是4.0mg,第三每周一次剂量是6.0mg,第四每周一次剂量是9.0mg,并且第五每周一次剂量是12.0mg。
75、在另一个方面,本文提供一种改善个体中血糖控制的方法,所述方法包括向个体施用第一每周一次剂量的包含seq id no:1的ggg三受体激动剂,其中第一每周一次剂量是约0.5mg至约4.0mg并且将其施用至少1周;并且按约1.0mg至约4.0mg的增量增加第一每周一次剂量到每周一次剂量≤12.0mg,其中将每个增加的每周一次剂量施用至少1周。
76、在一些实施方案中,第一每周一次剂量是1.0mg、2.0mg、3.0mg或4.0mg。在一些实施方案中,第一每周一次剂量是1.0mg或2.0mg。在一些实施方案中,第一每周一次剂量是1.0mg。在一些实施方案中,第一每周一次剂量是2.0mg。
77、在一些实施方案中,第一每周一次剂量和其后每个增加的每周一次剂量按约1.0mg、约2.0mg、约3.0mg或约4.0mg的增量增加,以达到≤12.0mg的每周一次剂量。给药计划中的增量可以相同或不同。例如,剂量可以按2.0mg增加并且下一个或后续剂量可以通过2.0mg的相同增量进一步增加,或按不同增量如1.0mg、3.0或4.0mg增加。
78、将第一剂量和每个增加的剂量每周一次施用至少1周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量每周一次施用至少2周、每周一次施用至少3周,或每周一次施用至少4周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量每周一次施用至少4周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量每周一次施用约2周、每周一次施用约3周或每周一次施用约4周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量每周一次施用约4周。在一些情况下,第一每周一次剂量和后续增加的每周一次剂量每周一次施用约4周直至达到每周一次剂量≤12.0mg。
79、在一些实施方案中,第一每周一次剂量是1.0mg,并且增加的每周一次剂量选自2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0或12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周一次剂量选自3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0或12.0mg。
80、例如,如果第一每周一次剂量是1.0mg,则下一个增加的每周一次剂量可以是2.0、3.0、4.0或5.0mg。如果第一每周一次剂量是1.0mg并且下一个增加的每周一次剂量是3.0mg,则后下一个增加的每周一次剂量可以是4.0、5.0、6.0或7.0mg。如果第一每周一次剂量是1.0mg并且下一个增加的每周一次剂量是3.0mg和6.0mg,则下一个增加的每周一次剂量可以是7.0、8.0、9.0或10.0mg。如果第一每周一次剂量是1.0mg并且下一个增加的每周一次剂量是3.0、6.0和9.0mg,则下一个增加的每周一次剂量可以是10.0、11.0或12.0mg。如果第一每周一次剂量是1.0mg并且下一个增加的每周一次剂量是3.0、6.0、9.0和10.0mg,则下一个增加的每周一次剂量可以是11.0mg或12.0mg。
81、在另一种情况下,如果第一每周一次剂量是2.0mg,则下一个增加的每周一次剂量可以是3.0、4.0、5.0或6.0mg。如果第一每周一次剂量是2.0mg并且下一个增加的每周一次剂量是4.0mg,则下一个增加的每周一次剂量可以是5.0、6.0、7.0或8.0mg。如果第一每周一次剂量是2.0mg并且下一个增加的每周一次剂量是4.0mg和6.0mg,则下一个增加的每周一次剂量可以是7.0、8.0、9.0或10.0mg。如果第一每周一次剂量是2.0mg,并且下一个增加的每周一次剂量是4.0、6.0和9.0mg,则下一个增加的每周一次剂量可以是10.0、11.0或12.0mg。
82、在一些实施方案中,第一每周一次剂量是1.0或2.0mg,并且下一个或第一个增加的每周一次剂量选自2.0、3.0或4.0mg。在一些实施方案中,下一个或第二个增加的每周一次剂量选自4.0、6.0或8.0mg。在一些实施方案中,下一个或第三个增加的每周一次剂量选自6.0、8.0、9.0、10.0或12.0mg。在一些实施方案中,下一个或第四个增加的每周一次剂量选自8.0、10.0或12.0mg。在一些实施方案中,下一个或第五个增加的每周一次剂量选自10.0或12.0mg。在一些实施方案中,下一个或第六个增加的每周一次剂量是12.0mg。
83、在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、8.0和12.0mg。因此,第一每周一次剂量是2.0mg,下一个或第一个增加的每周一次剂量是4.0mg,下一个或第二个增加的每周一次剂量是8.0mg,并且下一个或第三个增加的每周一次剂量是12.0mg。
84、在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、8.0、10.0和12.0mg。因此,第一每周一次剂量是2.0mg,下一个或第一个增加的每周一次剂量是4.0mg,下一个或第二个增加的每周一次剂量是8.0mg,下一个或第三个增加的每周一次剂量是10.0mg,并且下一个或第四个增加的每周一次剂量是12.0mg。
85、在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、6.0、8.0、10.0和12.0mg。因此,第一每周一次剂量是2.0mg,下一个或第一个增加的每周一次剂量是4.0mg,下一个或第二个增加的每周一次剂量是6.0mg,下一个或第三个增加的每周一次剂量是8.0mg,下一个或第四个增加的每周一次剂量是10.0mg,并且下一个或第五个增加的每周一次剂量是12.0mg。
86、在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、6.0、9.0和12.0mg。因此,第一每周一次剂量是2.0mg,下一个或第一个增加的每周一次剂量是4.0mg,下一个或第二个增加的每周一次剂量是6.0mg,下一个或第三个增加的每周一次剂量是9.0mg,并且下一个或第四个增加的每周一次剂量是12.0mg。
87、在一些实施方案中,第一每周一次剂量是1.0mg,并且增加的每周剂量是3.0、6.0、9.0和12.0mg。因此,第一每周一次剂量是1.0mg,下一个或第一个增加的每周一次剂量是3.0mg,下一个或第二个增加的每周一次剂量是6.0mg,下一个或第三个增加的每周一次剂量是9.0mg,并且下一个或第四个增加的每周一次剂量是12.0mg。
88、在一些实施方案中,第一每周一次剂量是1.0mg,并且增加的每周剂量是2.0、4.0、6.0、8.0、10.0和12.0mg。因此,第一每周一次剂量是1.0mg,下一个或第一个增加的每周一次剂量是2.0mg,下一个或第二个增加的每周一次剂量是4.0mg,下一个或第三个增加的每周一次剂量是6.0mg,下一个或第四个增加的每周一次剂量是8.0mg,下一个或第五个增加的每周一次剂量是10.0mg,并且下一个或第六个增加的每周一次剂量是12.0mg。
89、可以根据效力、安全性和个体耐受性调整起始剂量、增量和/或抵达最大剂量≤12.0的步骤数。
90、在一些情况下,个体起初具有≥27kg/m2但<30kg/m2的身体质量指数(bmi)。在一些情况下,个体起初具有≥30kg/m2的bmi。在一些情况下,个体患有2型糖尿病。在一些情况下,个体患有肥胖症。
91、在另一个方面,本文提供一种用于改善个体中血糖控制的包含seq id no:1的ggg三受体激动剂,其中ggg三受体激动剂的第一每周一次剂量是约0.5mg至约4.0mg并且将其施用至少1周,并且其中第一每周一次剂量按约1.0mg至约4.0mg的增量增加至≤12.0mg的每周一次剂量,并且其中将每个增加的每周一次剂量施用至少1周。
92、在一些实施方案中,将第一每周一次剂量和增加的每周一次剂量每周一次施用至少约二周。在一些实施方案中,将第一每周一次剂量和增加的每周一次剂量每周一次施用至少约四周。在一些实施方案中,将第一每周一次剂量和增加的每周一次剂量每周一次施用约二周。在一些实施方案中,将第一每周一次剂量和增加的每周一次剂量每周一次施用约四周。在一些情况下,将第一每周一次剂量和后续增加的每周一次剂量每周一次施用约4周直至实现≤12.0mg的每周一次剂量。
93、在一些实施方案中,第一每周一次剂量选自1.0或2.0mg。在一些实施方案中,增加的每周一次剂量选自2.0、3.0、4.0、6.0、8.0、9.0、10.0、11.0或12.0mg。
94、在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、8.0和12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周一次剂量是4.0、6.0、9.0和12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、8.0、10.0和12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、6.0、8.0、10.0和12.0mg。在一些实施方案中,第一每周一次剂量是1.0mg,并且增加的每周剂量是3.0、6.0、9.0和12.0mg。在一些实施方案中,第一每周一次剂量是1.0mg,并且增加的每周剂量是2.0、4.0、6.0、8.0、10.0和12.0mg。
95、在另一个方面,本文提供一种包含seq id no:1的ggg三受体激动剂在制造药物中的用途,所述药物用于改善个体中的血糖控制,其中ggg三受体激动剂的第一每周一次剂量是约0.5mg至约4.0mg并且将其施用至少1周,并且其中第一每周一次剂量按约1.0mg至约4.0mg的增量增加至≤12.0mg的每周一次剂量,并且其中将每个增加的每周一次剂量施用至少1周。
96、在另一个方面,本文提供用于改善个体中血糖控制的方法,其中这类方法包括步骤(a)向个体施用约0.5mg至约4.0mg的适于每周一次给药的包含seq id no:1的ggg三受体激动剂至少1周,在一些情况下,将ggg三受体激动剂每周一次施用1周、每周一次施用2周或每周一次施用4周,步骤(b)向个体每周一次施用约2.0mg至约8.0mg的ggg三受体激动剂至少1周,和步骤(c)向个体每周一次施用约8.0mg至约12.0mg的ggg三受体激动剂至少1周。
97、在一些情况下,个体起初具有≥27kg/m2但<30kg/m2的身体质量指数(bmi)。在一些情况下,个体起初具有≥30kg/m2的bmi。在一些情况下,个体患有2型糖尿病。在一些情况下,个体患有肥胖症。
98、在另一个方面,本文提供一种适于每周一次给药用于改善个体中血糖控制的包含seq id no:1的ggg三受体激动剂,其中施用约0.5mg至约4.0mg的ggg三受体激动剂剂量至少1周,随后施用约2.0mg至约8.0mg的ggg三受体激动剂剂量至少1周,随后施用约8.0mg至约12.0mg的ggg三受体激动剂剂量至少1周。
99、在另一个方面,本文提供适于每周一次给药的包含seq id no:1的ggg三受体激动剂用于制造药物中的用途,所述药物用于改善个体中的血糖控制,其中施用约0.5mg至约4.0mg的ggg三受体激动剂剂量至少1周,随后施用约2.0mg至约8.0mg的ggg三受体激动剂剂量至少1周,随后施用约8.0mg至约12.0mg的ggg三受体激动剂剂量至少1周。
100、在另一个方面,本文提供长期体重管理方法,其中这类方法包括向个体每周一次施用第一剂量的包含seq id no:1的ggg三受体激动剂(即,肠降血糖素类似物)约1周至约4周,其中第一剂量是约0.5mg至约4.0mg。在一些情况下,将第一剂量每周一次施用至少约1周、每周一次施用至少约2周或每周一次施用至少约4周。在一些情况下,将第一剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周或每周一次施用约4周。在一些情况下,第一每周一次剂量是1.0mg、2.0mg、3.0或4.0mg。在一些情况下,第一每周一次剂量是1.0mg、2.0mg或4.0mg。在一些情况下,第一每周一次剂量选自约1.0mg至约2.0mg。在一些情况下,第一每周一次剂量是约1.0mg或约2.0mg。在一些情况下,第一剂量是1.0mg。在一些情况下,第一剂量是2.0mg。
101、在一些实施方案中,这些方法还包括步骤:向个体施用第二每周一次剂量的ggg三受体激动剂至少1周。在一些情况下,将第二剂量每周一次施用至少约1周、每周一次施用至少约2周或每周一次施用至少约4周。在一些情况下,将第二剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周或每周一次施用约4周。在一些情况下,第二每周一次剂量小于第一每周一次剂量。备选地,第二每周一次剂量与第一每周一次剂量相同。备选地,第二每周一次剂量大于第一每周一次剂量。在一些情况下,第二每周一次剂量是约2.0mg至约8.0mg。在某些情况下,第二每周一次剂量是2.0mg、3.0mg、4.0mg、6.0mg或8.0mg。在一些情况下,第二每周一次剂量选自约2.0mg至约4.0mg。在一些情况下,第二每周一次剂量是2.0mg、3.0mg或4.0mg。在一些情况下,第二每周一次剂量是4.0mg。
102、在一些实施方案中,这些方法还包括步骤:向个体每周一次施用第三剂量的ggg三受体激动剂至少1周。在一些情况下,将第三剂量每周一次施用至少约1周、每周一次施用至少约2周、每周一次施用至少约4周、每周一次施用至少约6周,或每周一次施用至少约8周或更多周数。在一些情况下,将第三剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周、每周一次施用约4周、每周一次施用约6周、每周一次施用约8周或更多周数。在一些情况下,第三每周一次剂量可以小于第二每周一次剂量。备选地,第三每周一次剂量可以与第二每周一次剂量相同。备选地,第三每周一次剂量可以大于第二每周一次剂量。在一些情况下,第三每周一次剂量是约4.0mg至约12.0mg。在某些情况下,第三每周一次剂量是4.0mg、6.0mg、8.0mg、10.0mg或12.0mg。在一些情况下,第三每周一次剂量选自约4.0mg至约8.0mg。在一些情况下,第三每周一次剂量是4.0mg、6.0mg或8.0mg。在一些情况下,第三每周一次剂量是6.0mg或8.0mg。在一些情况下,第三每周一次剂量是6.0mg。在一些情况下,第三每周一次剂量是8.0mg。
103、在一些实施方案中,这些方法还包括步骤:向个体每周一次施用第四个剂量的ggg三受体激动剂至少1周。在一些情况下,将第四个剂量每周一次施用至少约1周、每周一次施用至少约2周、每周一次施用至少约4周、每周一次施用至少约6周,或每周一次施用至少约8周或更多周数。在一些情况下,将第四个剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周、每周一次施用约4周、每周一次施用约6周或每周一次施用约8周或更多周数。在一些情况下,第四每周一次剂量可以小于第三每周一次剂量。备选地,第四每周一次剂量可以与第三每周一次剂量相同。备选地,第四每周一次剂量可以大于第三每周一次剂量。在一些情况下,第四每周一次剂量是约6.0mg至约12.0mg。在某些情况下,第四每周一次剂量是6.0mg、8.0mg、9.0mg、10.0mg、11.0mg或12.0mg。在一些情况下,第四每周一次剂量是6.0mg、8.0mg、9.0mg,10.0mg或12.0mg。在一些情况下,第四每周一次剂量是9.0mg。在一些情况下,第四个剂量每周一次是12.0mg。
104、在一些实施方案中,这些方法还包括步骤:向个体每周一次施用第五个剂量的ggg三受体激动剂至少1周。在一些情况下,将第五个剂量每周一次施用至少约1周、每周一次施用至少约2周、每周一次施用至少约4周、每周一次施用至少约6周,或每周一次施用至少约8周或更多周数。在一些情况下,将第五个剂量每周一次施用约1周、每周一次施用约2周、每周一次施用约3周、每周一次施用约4周、每周一次施用约6周或每周一次施用约8周或更多周数。在一些情况下,第五每周一次剂量可以小于第四每周一次剂量。备选地,第五每周一次剂量可以与第四每周一次剂量相同。备选地,第五每周一次剂量可以大于第四每周一次剂量。在一些情况下,第五每周一次剂量是约8.0mg至约12.0mg。在某些情况下,第五每周一次剂量是8.0mg、9.0mg、10.0mg、11.0mg或12.0。在一些情况下,第五每周一次剂量是8.0mg,10.0mg或12.0mg。在一些情况下,第五每周一次剂量是12.0mg。
105、在一些实施方案中,这些方法还包括向个体施用额外的剂量,如第六每周一次剂量,或第七每周一次剂量,或更多。额外的剂量可以少于、相同于或大于施用的先前剂量。
106、在一些实施方案中,将每个每周一次剂量施用至少约2周。在一些实施方案中,将每个每周一次剂量施用至少约4周。在一些实施方案中,将每个每周一次剂量施用约2周。在一些实施方案中,将每个每周一次剂量施用约4周。
107、例如,在一些实施方案中,该方法包括向个体施用约2.0mg的第一每周一次剂量至少约4周、约4.0mg的第二每周一次剂量至少约4周、约8.0mg的第三每周一次剂量至少约4周和约12.0mg的第四每周一次剂量至少约4周。
108、在一些实施方案中,该方法包括向个体施用约2.0mg的第一每周一次剂量至少约4周、约4.0mg的第二每周一次剂量至少约4周、约8.0mg的第三每周一次剂量至少约4周、约10.0mg的第四每周一次剂量至少约4周和约12.0mg的第五每周一次剂量至少约4周。
109、在一些实施方案中,该方法包括向个体施用约2.0mg的第一每周一次剂量至少约4周、约4.0mg的第二每周一次剂量至少约4周、约6.0mg的第三每周一次剂量至少约4周、约8.0mg的第四每周一次剂量至少约4周、约10.0mg的第五每周一次剂量至少约4周和约12.0mg的第六每周一次剂量至少约4周。
110、在一些实施方案中,该方法包括向个体施用约2.0mg的第一每周一次剂量至少约4周、约4.0mg的第二每周一次剂量至少约4周、约6.0mg的第三每周一次剂量至少约4周、约9.0mg的第四每周一次剂量至少约4周和约12.0mg的第五每周一次剂量至少约4周。
111、在一些实施方案中,该方法包括向个体施用约1.0mg的第一每周一次剂量至少约4周、约3.0mg的第二每周一次剂量至少约4周、约6.0mg的第三每周一次剂量至少约4周、约9.0mg的第四每周一次剂量至少约4周和约12.0mg的第五每周一次剂量至少约4周。
112、在一些实施方案中,该方法包括向个体施用约1.0mg的第一每周一次剂量至少约4周、约2.0mg的第二每周一次剂量至少约4周、约4.0mg的第三每周一次剂量至少约4周、约6.0mg的第四每周一次剂量至少约4周、约8.0mg的第五每周一次剂量至少约4周、约10.0mg的第六每周一次剂量至少约4周和12.0mg的第七每周一次剂量至少约4周。
113、在一些情况下,个体起初具有≥27kg/m2但<30kg/m2的身体质量指数(bmi)。在一些情况下,个体起初具有≥30kg/m2的bmi。在一些情况下,个体患有2型糖尿病。在一些情况下,个体患有肥胖症。
114、在另一个方面,本文提供一种用于提供个体中长期体重管理的包含seq id no:1的ggg三受体激动剂,其中将第一每周一次剂量的ggg三受体激动剂施用至少1周并且其中第一剂量是约0.5mg至4.0mg。
115、在另一个方面,本文提供包含seq id no:1的ggg三受体激动剂在制造药物中的用途,所述药物用于提供个体中的长期体重管理,其中将第一每周一次剂量的ggg三受体激动剂施用至少1周并且其中第一剂量是约0.5mg至4.0mg。
116、在另一个方面,本文提供一种用于提供个体中长期体重管理的方法,所述方法包括向个体施用第一每周一次剂量的包含seq id no:1的ggg三受体激动剂,其中第一每周一次剂量是约0.5mg至约4.0mg并且将其施用至少1周,按约1.0mg至约4.0mg的增量增加第一每周一次剂量到每周一次剂量≤12.0mg,其中将每个增加的每周一次剂量施用至少1周。
117、在一些实施方案中,第一每周一次剂量是1.0mg、2.0mg、3.0mg或4.0mg。在一些实施方案中,第一每周一次剂量是1.0mg或2.0mg。在一些实施方案中,第一每周一次剂量是1.0mg。在一些实施方案中,第一每周一次剂量是2.0mg。
118、在一些实施方案中,第一每周一次剂量和其后每个增加的每周一次剂量按约1.0mg、约2.0mg、约3.0mg或约4.0mg的增量增加,以达到≤12.0mg的每周一次剂量。给药计划中的增量可以相同或不同。例如,剂量可以按2.0mg增加并且下一个或后续剂量可以通过2.0mg的相同增量进一步增加,或按不同增量如1.0mg、3.0或4.0mg增加。
119、将第一剂量和每个增加的剂量每周一次施用至少1周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量每周一次施用至少2周、每周一次施用至少3周,或每周一次施用至少4周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量每周一次施用至少4周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量每周一次施用约2周、每周一次施用约3周或每周一次施用约4周。在一些情况下,将第一每周一次剂量和每个增加的每周一次剂量每周一次施用约4周。在一些情况下,第一每周一次剂量和后续增加的每周一次剂量每周一次施用约4周直至达到每周一次剂量≤12.0mg。
120、在一些实施方案中,第一每周一次剂量是1.0mg,并且增加的每周一次剂量选自2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0或12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周一次剂量选自3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0或12.0mg。
121、在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、8.0和12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、8.0、10.0和12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、6.0、8.0、10.0和12.0mg。在一些实施方案中,第一每周一次剂量是2.0mg,并且增加的每周剂量是4.0、6.0、9.0和12.0mg。在一些实施方案中,第一每周一次剂量是1.0mg,并且增加的每周剂量是3.0、6.0、9.0和12.0mg。在一些实施方案中,第一每周一次剂量是1.0mg,并且增加的每周剂量是2.0、4.0、6.0、8.0、10.0和12.0mg。
122、可以根据效力、安全性和个体耐受性调整起始剂量、增量和/或抵达最大剂量≤12.0的步骤数。
123、在一些情况下,个体起初具有≥27kg/m2但<30kg/m2的身体质量指数(bmi)。在一些情况下,个体起初具有≥30kg/m2的bmi。在一些情况下,个体患有2型糖尿病。在一些情况下,个体患有肥胖症。
124、在另一个方面,本文提供一种用于提供个体中长期体重管理的包含seq id no:1的ggg三受体激动剂,其中ggg三受体激动剂的第一每周一次剂量是约0.5mg至约4.0mg并且将其施用至少1周,并且其中第一每周一次剂量按约1.0至约4.0mg的增量增加至≤12.0mg的每周一次剂量,并且其中将每个增加的每周一次剂量施用至少1周。
125、在另一个方面,本文提供一种包含seq id no:1的ggg三受体激动剂在制造药物中的用途,所述药物用于提供个体中的长期体重管理,其中ggg三受体激动剂的第一每周一次剂量是约0.5mg至约4.0mg并且将其施用至少1周,并且其中第一每周一次剂量按约1.0至约4.0mg的增量增加至≤12.0mg的每周一次剂量,并且其中将每个增加的每周一次剂量施用至少1周。
126、在另一个方面,本文提供用于长期体重管理的方法,其中这类方法包括步骤(a)向个体施用约0.5mg至约4.0mg适于每周一次给药至少1周的具有seq id no:1的结构的ggg三受体激动剂,(b)向个体每周一次施用约2.0mg至约8.0mg的ggg三受体激动剂至少1周,和(c)向个体每周一次施用约8.0mg至约12.0mg的ggg三受体激动剂至少1周。
127、在另一个方面,本文提供一种用于提供个体中长期体重管理的包含seq id no:1的ggg三受体激动剂,其中施用约0.5mg至约4.0mg的ggg三受体激动剂剂量至少1周,随后施用约2.0mg至约8.0mg的ggg三受体激动剂剂量至少1周,随后施用约8.0mg至约12.0mg的ggg三受体激动剂剂量至少1周。
128、在另一个方面,本文提供包含seq id no:1的ggg三受体激动剂在制造药物中的用途,所述药物用于提供个体中的长期体重管理,其中施用约0.5mg至约4.0mg的ggg三受体激动剂剂量至少1周,随后施用约2.0mg至约8.0mg的ggg三受体激动剂剂量至少1周,随后施用约8.0mg至约12.0mg的ggg三受体激动剂剂量至少1周。
129、在另一个方面,本文提供了治疗糖尿病(尤其t2dm)、血脂异常、代谢综合征、nafld、nash和/或肥胖症、阻塞性睡眠呼吸暂停、骨关节炎、多囊性卵巢综合征和/或慢性肾脏病的方法,其中这类方法包括向个体每周一次施用第一剂量的具有seq id no:1的结构的ggg三受体激动剂(即,肠降血糖素类似物)约1周至约4周,其中第一剂量是约0.5mg至约4.0mg。
130、在另一个方面,本文提供一种治疗糖尿病(尤其t2dm)、血脂异常、代谢综合征、nafld、nash、肥胖症、阻塞性睡眠呼吸暂停、骨关节炎、多囊性卵巢综合征和/或慢性肾脏病的方法,所述方法包括向个体施用第一每周一次剂量的包含seq id no:1的ggg三受体激动剂,其中第一每周一次剂量是约0.5mg至约4.0mg并且将其施用至少1周,按约1.0mg至约4.0mg的增量增加第一每周一次剂量到每周一次剂量≤12.0mg,其中将每个增加的每周一次剂量施用至少1周。
131、在另一个方面,本文提供了治疗糖尿病(尤其t2dm)、血脂异常、代谢综合征、nafld、nash和/或肥胖症、阻塞性睡眠呼吸暂停、骨关节炎、多囊性卵巢综合征和/或慢性肾脏病的方法,其中这类方法包括步骤(a)向个体施用约0.5mg至约4.0mg适于每周一次给药至少1周的具有seq id no:1的结构的ggg三受体激动剂,(b)向个体每周一次施用约2.0mg至约8.0mg的ggg三受体激动剂至少1周,和(c)向个体每周一次施用约8.0mg至约12.0mg的ggg三受体激动剂至少1周。
132、在另一个方面,提供用于患有糖尿病、尤其t2dm的个体中改善血糖控制的方法,其中这类方法包括步骤(a)向个体每周一次施用第一剂量具有seq id no:1的结构的ggg三受体激动剂(即,肠降血糖素类似物)施用约1周至约4周,其中第一剂量是约0.5mg至约4.0mg。在一些情况下,将第一剂量每周一次施用持续1周、每周一次施用持续2周、每周一次施用持续3周或每周一次施用持续4周。在一些情况下,第一剂量是1.0mg、2.0mg或4.0mg。
133、这些方法还包括步骤(b):在步骤(a)期间测量个体的fg和hba1c中至少一者。测量fg和hba1c的方法为本领域技术人员熟知且无需详尽描述。
134、这些方法还包括步骤(c):在步骤(a)期间记录个体的低血糖和任选地其他ae的频率和严重程度。在一些情况下,ae可以是腹泻、呕吐、gi不适和恶心。
135、这些方法还可以包括步骤(d):从步骤(b)的个体fg、hba1c或这两者和/或从步骤(c)的个体低血糖和任选地其他ae的频率和严重程度确定第二ggg三受体激动剂剂量。
136、这些方法还包括步骤(e)每周一次向个体施用第二剂量的ggg三受体激至少1周,其中第二剂量是约2.0mg至约8.0mg。在一些情况下,将第二剂量每周一次施用持续1周、每周一次施用持续2周、每周一次施用持续3周,或每周一次施用持续4周。在一些情况下,第二剂量小于第一剂量。备选地,第二剂量与第一剂量相同。备选地,第二剂量大于第一剂量。在某些情况下,第二剂量是4.0mg、6.0mg或8.0mg。
137、这些方法还可以包括步骤(f):在步骤(e)期间测量个体的fg和hba1c中至少一者至少一次。
138、这些方法还包括步骤(g):在步骤(e)期间记录个体的低血糖和任选地其他ae的频率和严重程度。
139、这些方法还可以包括步骤(h):从步骤(f)的个体fg、hba1c或这两者和/或从步骤(g)期间个体低血糖和任选地其他ae的频率和严重程度确定第三ggg三受体激动剂剂量。
140、这些方法还包括步骤(i)每周一次向个体施用第三剂量的ggg三受体激至少1周,其中第三剂量是约8.0mg至约12.0mg。在一些情况下,将第三剂量每周一次施用持续1周、每周一次施用持续2周、每周一次施用持续3周、每周一次施用持续4周、每周一次施用持续6周或每周一次施用持续8周或更多周数。在一些情况下,第三剂量可以小于第二剂量。备选地,第三剂量可以与第二剂量相同。备选地,第三剂量可以大于第二剂量。在某些情况下,第三剂量是8.0mg、10.0mg或12.0mg。
141、在另一个方面,提供用于患有糖尿病、尤其t2dm的个体中改善血糖控制的方法,其中这类方法包括步骤(a)向个体施用约0.5mg至约4.0mg的适于每周一次给药的具有seq idno:1的结构的ggg三受体激动剂至少1周,在一些情况下,将ggg三受体激动剂每周一次施用1周、每周一次施用2周或每周一次施用4周。在一些情况下,该剂量是2.0mg或4.0mg。这些方法还包括步骤(b)每周一次向个体施用第约2.0mg至约8.0mg的ggg三受体激动剂至少1周。在一些情况下,将ggg三受体激动剂每周一次施用1周、每周一次施用2周、每周一次施用3周、每周一次施用4周、每周一次施用6周,或每周一次施用8周或更多周数。在一些情况下,该剂量是4.0mg、6.0mg或8.0mg。这些方法还包括步骤(c):向个体每周一次施用约8.0mg至约12.0mg的ggg三受体激动剂至少1周。在一些情况下,该剂量是8.0mg、10.0mg或12.0mg。
142、在另一个方面,提供用于患有糖尿病、尤其t2dm的个体中改善血糖控制的方法,其中这类方法包括步骤(a)施用适于每周一次给药的具有seq id no:1的结构的ggg三受体激动剂的负荷剂量。在一些情况下,将ggg三受体激动剂每周一次施用1周、每周一次施用2周,或每周一次施用4周。在一些情况下,可以通过将个体的预计每周维持剂量乘以约1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9或3.0确定负荷剂量。在其他情况下,负荷剂量可以与维持剂量相同。在某些情况下,负荷剂量可以是约6.0mg至约12.0mg。备选地,负荷剂量是≤12.0mg。
143、这些方法还包括步骤(b):向个体施用适于每周一次给药的ggg三受体激动剂的维持剂量。在一些情况下,将ggg三受体激动剂每周一次施用持续1周、每周一次施用持续2周、每周一次施用持续3周、每周一次施用持续4周、每周一次施用持续6周或每周一次施用持续8周或更多周数。在一些情况下,维持剂量可以是约2.0mg至约6.0mg。
144、在另一个方面,提供用于体重管理的方法,其中这类方法包括步骤(a)向个体每周一次施用第一剂量具有seq id no:1的结构的ggg三受体激动剂(即,肠降血糖素类似物)施用约1周至约4周,其中第一剂量是约0.5mg至约4.0mg。在一些情况下,将第一剂量每周一次施用持续1周、每周一次施用持续2周、每周一次施用持续3周或每周一次施用持续4周。在一些情况下,第一剂量是1.0mg、2.0mg或4.0mg。
145、这些方法还包括步骤(b):在步骤(a)期间测量个体的bw中至少一者。
146、这些方法还包括步骤(c):在步骤(a)期间记录个体的ae频率和严重程度。在一些情况下,ae是腹泻、呕吐、gi不适、低血糖和恶心。
147、这些方法还可以包括步骤(d):从步骤(b)的个体bw和/或从步骤(c)的个体ae的频率和严重程度确定第二ggg三受体激动剂剂量。
148、这些方法还包括步骤(e)每周一次向个体施用第二剂量的ggg三受体激至少1周,其中第二剂量是约2.0mg至约8.0mg。在一些情况下,将第二剂量每周一次施用持续1周、每周一次施用持续2周、每周一次施用持续3周,或每周一次施用持续4周。在一些情况下,第二剂量小于第一剂量。备选地,第二剂量与第一剂量相同。备选地,第二剂量大于第一剂量。在某些情况下,第二剂量是4.0mg、6.0mg或8.0mg。
149、这些方法还可以包括步骤(f):在步骤(e)期间测量个体的bw至少一次。
150、这些方法还包括步骤(g):在步骤(e)期间记录个体的ae频率和严重程度。
151、这些方法还可以包括步骤(h):从步骤(f)的个体bw和/或从步骤(g)期间个体ae的频率和严重程度确定第三ggg三受体激动剂剂量。
152、这些方法还包括步骤(i)每周一次向个体施用第三剂量的ggg三受体激至少1周,其中第三剂量是约8.0mg至约12.0mg。在一些情况下,将第三剂量每周一次施用持续1周、每周一次施用持续2周、每周一次施用持续3周、每周一次施用持续4周、每周一次施用持续6周或每周一次施用持续8周或更多周数。在一些情况下,第三剂量可以小于第二剂量。备选地,第三剂量可以与第二剂量相同。备选地,第三剂量可以大于第二剂量。在某些情况下,第三剂量是8.0mg、10.0mg或12.0mg。
153、在一些情况下,在步骤(a)个体起初具有≥27kg/m2但<30kg/m2的bmi并且因此超重。在其他情况下,在步骤(a)个体起初具有≥30kg/m2的bmi并且因此肥胖。
154、在另一个方面,提供用于体重管理的方法,其中这类方法包括步骤(a)向个体施用约0.5mg至约4.0mg的适于每周一次给药的具有seq id no:1的结构的ggg三受体激动剂至少1周,在一些情况下,将ggg三受体激动剂每周一次施用1周、每周一次施用2周或每周一次施用4周。在一些情况下,该剂量是2.0mg或4.0mg。
155、这些方法还包括步骤(b)每周一次向个体施用第约2.0mg至约8.0mg的ggg三受体激动剂至少1周。在一些情况下,将ggg三受体激动剂每周一次施用1周、每周一次施用2周、每周一次施用3周、每周一次施用4周、每周一次施用6周,或每周一次施用8周或更多周数。在一些情况下,该剂量是4.0mg、6.0mg或8.0mg。
156、这些方法还包括步骤(c):向个体每周一次施用约8.0mg至约12.0mg的ggg三受体激动剂至少1周。在一些情况下,该剂量是8.0mg、10.0mg或12.0mg。
157、在一些情况下,在步骤(a)个体起初具有≥27kg/m2但<30kg/m2的bmi并且因此超重。在其他情况下,在步骤(a)个体起初具有≥30kg/m2的bmi并且因此肥胖。
158、在另一个方面,提供用于体重管理的方法,其中这类方法包括步骤(a)施用适于每周一次给药的具有seq id no:1的结构的ggg三受体激动剂的负荷剂量。在一些情况下,将ggg三受体激动剂每周一次施用1周、每周一次施用2周,或每周一次施用4周。在一些情况下,可以通过将个体的预计每周维持剂量乘以约1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9或3.0确定负荷剂量。在其他情况下,负荷剂量可以与维持剂量相同。在某些情况下,负荷剂量可以是约6.0mg至约12.0mg。备选地,负荷剂量是≤12.0mg。
159、这些方法还包括步骤(b):向个体施用适于每周一次给药的ggg三受体激动剂的维持剂量。在一些情况下,将ggg三受体激动剂每周一次施用持续1周、每周一次施用持续2周、每周一次施用持续3周、每周一次施用持续4周、每周一次施用持续6周或每周一次施用持续8周或更多周数。在一些情况下,维持剂量可以是约2.0mg至约6.0mg。
160、在一些情况下,在步骤(a)个体起初具有≥27kg/m2但<30kg/m2的bmi并且因此超重。在其他情况下,在步骤(a)个体起初具有≥30kg/m2的bmi并且因此肥胖。
161、在另一个方面,本文提供一种适于每周一次给药的包含seq id no:1的ggg三受体激动剂用于患有2型糖尿病(t2dm)且需要额外血糖控制的个体中改善血糖控制或提供长期体重管理,其中将第一每周一次剂量的ggg三受体激动剂施用至少1周的最短时间为约1周至约4周并且其中第一剂量是约0.5mg至4.0mg,其中在施用第一每周一次剂量期间,测量个体的空腹葡萄糖(fg)和/或血红蛋白a1c(hba1c)至少一次并且记录个体的低血糖和任选地其他不良事件的频率和严重程度,并且从个体的fg、hba1c或两者和/或从个体的低血糖频率和严重程度确定第二剂量,并且将第二ggg三受体激动剂剂量施用至少1周。
162、在另一个方面,本文提供一种适于每周一次给药的包含seq id no:1的ggg三受体激动剂在制造药物中的用途,所述药物用于患有2型糖尿病(t2dm)且需要额外血糖控制的个体中改善血糖控制或提供长期体重管理,其中将第一每周一次剂量的ggg三受体激动剂施用至少1周的最短时间为约1周至约4周并且其中第一剂量是约0.5mg至4.0mg,其中在施用第一每周一次剂量期间,测量个体的空腹葡萄糖(fg)和/或血红蛋白a1c(hba1c)至少一次并且记录个体的低血糖和任选地其他不良事件的频率和严重程度,并且从个体的fg、hba1c或两者和/或从个体的低血糖频率和严重程度确定第二剂量,并且将第二ggg三受体激动剂剂量施用至少1周。
163、在另一个方面,本文提供一种适于每周一次给药的包含seq id no:1的ggg三受体激动剂用于患有2型糖尿病(t2dm)且需要额外血糖控制的个体中改善血糖控制或提供长期体重管理,其中施用选自约0.5mg至4.0mg的ggg三受体激动剂剂量至少1周,随后施用选自约2.0mg至8.0mg的ggg三受体激动剂剂量至少1周,随后施用选自约8.0mg至12.0mg的ggg三受体激动剂剂量至少1周。
164、在另一个方面,本文提供一种适于每周一次给药的包含seq id no:1的ggg三受体激动剂在制造药物中的用途,所述药物用于患有2型糖尿病(t2dm)且需要额外血糖控制的个体中改善血糖控制或提供长期体重管理,其中施用选自约0.5mg至4.0mg的ggg三受体激动剂剂量至少1周,随后施用选自约2.0mg至8.0mg的ggg三受体激动剂剂量至少1周,随后施用选自约8.0mg至12.0mg的ggg三受体激动剂剂量至少1周。
165、在另一个方面,本文提供一种适于每周一次给药的包含seq id no:1的ggg三受体激动剂用于患有2型糖尿病(t2dm)且需要额外血糖控制的个体中改善血糖控制或提供长期体重管理,其中施用ggg三受体激动剂的负荷剂量,随后是ggg三受体激动剂的维持剂量。
166、在另一个方面,本文提供一种适于每周一次给药的包含seq id no:1的ggg三受体激动剂在制造药物中的用途,所述药物用于患有2型糖尿病(t2dm)且需要额外血糖控制的个体中改善血糖控制或提供长期体重管理,其中施用ggg三受体激动剂的负荷剂量,随后是ggg三受体激动剂的维持剂量。
167、实施例
168、出于说明而非限制目的提供以下非限制性示例。
169、单剂量递增(sad)研究和多剂量递增(mad)研究
170、实施例1:sad研究
171、将研究设计为在健康个体中评价ggg三受体激动剂(seq id no:1)的安全性、耐受性、药效动力学(pd)和药代动力学(pk)。sad研究为随机分配、研究者设盲及参与者设盲、安慰剂对照、单剂、单研究中心、剂量递增研究,在健康个体(例如,含年龄21-65岁的总体健康的女性或男性,筛查时bmi为19-40kg/m2)中实施。
172、sad研究中探索ggg三受体激动剂的六个剂量水平-0.1、0.3、1.0、3.0、4.5和6.0mg,以及安慰剂(即,0.0mg)。在健康个体队列中(例如,每个队列6位个体接受ggg三受体激动剂并且2位个体接受安慰剂)评估ggg三受体激动剂的剂量递增。对每个队列进行交错给药,其中施用新的更高剂量的ggg三受体激动剂。全部注射剂均施用入腹壁sc组织,在右侧或左侧下四分之一中。
173、给药前及在给药后4小时(hr)、10小时、14小时、24小时(第1天)、48小时(第2天)、72小时(第3天)、96小时(第4天)、120小时(第6天)、168小时(第7天)、336小时(第14天)、672小时(第28天)和1008小时(第42天)收集血液样品以确定ggg三受体激动剂的血浆浓度。利用血浆浓度在已验证的软件程序(phoenix winnonlin版本8.1)中使用标准非区室法计算pk参数。
174、给药前和在给药后24小时、48小时、168小时、336小时、672小时和1008小时测量胰岛素和c肽。
175、给药前和在给药后24小时、48小时、168小时、672小时和672小时测量满足感vas(视觉模拟评分)。
176、给药前和在给药后168小时、336小时、672小时和1008小时测量bw。
177、生物分析方法:在q2 solutions(ithaca,ny)分析血浆样品。使用验证的液相色谱高分辨质谱法,分析样品的ggg三受体激动剂。定量下限是1.00ng/ml并且定量上限是500.00ng/ml。将定量限之上的样品稀释并再次分析以产生已校准量程内部的结果。验证期间批内准确度(intra-assay accuracy)(相对误差%)为-6.3%至15.7%。验证期间批内精度(相对标准差%)≤14.7%。储存在约-20℃和约-70℃时ggg三受体激动剂稳定直至96天。
178、pd分析:从以下pd标志物的浓度计算绝对值和距基线变化:fg、胰岛素、c肽、gcg、脂质(例如,甘油三酯类、胆固醇、低密度脂蛋白(ldl)胆固醇、和高密度脂蛋白(hdl)胆固醇)、游离脂肪酸和β-羟丁酸酯。
179、使用饥饿、饱腹感(fullness)、满足感(satiety)和预期食物摄入量的vas参数评估食欲感知。将总体食欲评分按照以下等式计算为4个个体评分的平均数(参见,例如.vancan等人(2014)int.j.obes.(lond).38:784-793):
180、
181、较高的总体食欲评分表示较低的食欲。
182、根据研究方案,将体重作为安全性评估结果测量;然而,体重还作为pd标志物提供深入了解。
183、安全性分析:研究期间评估的安全性参数包括:ae(特别留意gi ae如恶心、呕吐和腹泻)、实验室参数(特别留意肝脏生物标志物和胰腺生物标志物)、体检/医学评估结果,生命体征和ecg、bw、注射部位反应、超敏反应和葡萄糖监测(特别留意低血糖)。
184、pk分析:ggg三受体激动剂的血浆浓度在给药前和在给药后4小时、10小时、14小时、24小时、48小时、72小时、96小时、120小时、168小时、336小时、672小时和1008小时测量并且用来在已验证的软件程序(phoenix winnonlin版本8.1)中使用标准非区室法确定以下pk参数:auc(0-∞)、auc(0-tlast)、%auc(tlast-∞)、cmax、tmax、t1/2、cl/f、vz/f和vss/f。
185、在计算全部pk参数和浓度中相对于时间特征使用实际采样时间。
186、从pk参数计算中排除低于测定法可定量下限的浓度值,例外是对在第一可度量浓度之前的那些浓度,将这些浓度设定为0值。
187、如果三分之二的个体数据在该时点时具有可定量的量值,则将浓度平均数对给定样品作图。从平均浓度特征中排除超过计划的时间土10%的采样时间处的浓度。
188、pd结果:sad研究表明,ggg三受体激动剂0.1、0.3、1.0和3.0mg的单个sc剂量耐受良好。ggg三受体激动剂的更高剂量4.5和6.0mg与gi事件(包括呕吐、腹胀和恶心)的发生率升高相关。ae是剂量依赖性并且在严重程度方面方面为轻度至中度。97.1%的个体报告治疗期间出现ae(teae),并且这些个体当中,20个(57.1%)个体报告与研究疗法有关的teae。在所有组中低血糖发作均低。实际上,全部事件均无症状并且迅速恢复。未报告注射部位反应。在ggg三受体激动剂的单个sc剂量后观察到剂量相关性脉搏率升高,但截至第29天脉搏率返回基线或接近基线。还观察到剂量相关性刺激胰岛素分泌及gcg减少。
189、表1:单个剂量的ggg三受体激动剂后空腹葡萄糖距基线的最小二乘平均变化。
190、
191、注:nd=未进行;*=与安慰剂相比,ggg三受体激动剂距基线的最小二乘平均变化的差异为统计显著(90%ci不涵盖1)。
192、表2:单个剂量的ggg三受体激动剂后,空腹胰岛素距基线的最小二乘平均变化。
193、
194、
195、注:nd=未进行;*=与安慰剂相比,ggg三受体激动剂距基线的最小二乘平均变化的差异为统计显著(90%ci不涵盖1)。
196、表3:单个剂量的ggg三受体激动剂后,空腹c肽距基线的最小二乘平均变化。
197、
198、注:nd=未进行;*=与安慰剂相比,ggg三受体激动剂距基线的最小二乘平均变化的差异为统计显著(90%ci不涵盖1)。
199、表4:单个剂量的ggg三受体激动剂后,甘油三酯类距基线的最小二乘平均变化。
200、
201、注:nd=未进行;*=与安慰剂相比,ggg三受体激动剂距基线的最小二乘平均变化的差异为统计显著(90%ci不涵盖1)。
202、表5:单个剂量的ggg三受体激动剂后,胆固醇距基线的最小二乘平均变化。
203、
204、注:nd=未进行;*=与安慰剂相比,ggg三受体激动剂距基线的最小二乘平均变化的差异为统计显著(90%ci不涵盖1)。
205、表6:单个剂量的ggg三受体激动剂后,ldl胆固醇距基线的最小二乘平均变化。
206、
207、注:nd=未进行;*=与安慰剂相比,ggg三受体激动剂距基线的最小二乘平均变化的差异为统计显著(90%ci不涵盖1)。
208、表7:单个剂量的ggg三受体激动剂后hdl胆固醇距基线的最小二乘平均变化。
209、
210、注:nd=未进行;*=与安慰剂相比,ggg三受体激动剂距基线的最小二乘平均变化的差异为统计显著(90%ci不涵盖1)。
211、表8:单个剂量的ggg三受体激动剂后的平均β-羟丁酸酯。
212、
213、注:nc=未计算;数据因水平低于定量限值而不足以计算均数(n<3)。
214、表9:单个剂量的ggg三受体激动剂后,空腹gcg距基线的最小二乘平均变化。
215、
216、
217、表10单个剂量的ggg三受体激动剂后的体重。
218、
219、表11:单个剂量的ggg三受体激动剂后,vas评分距基线的最小二乘平均变化。
220、
221、pk结果:sad研究显示剂量-浓度关系成正比例并且表明每周一次(qw)给药可行。在给予单剂量的ggg三受体激动剂后,给药后1天和3天之间观察到最大观测药物浓度(cmax)。平均终末t1/2是约5至7天(即,6天或约134-165小时),因此支持qw给药方案。预计稳态在约4至5周达到。
222、表12:健康个体中ggg三受体激动剂的pk参数总结。
223、
224、总结:ggg三受体激动剂的安全性特征类似于其他glp-1和gip/glp-1受体激动剂。ggg三受体激动剂的pk特性使得每周一次给药成为可能。另外,单次sc注射ggg三受体激动剂后观察到体重减轻。如健康群体中所预期的那样,单次sc注射ggg三受体激动剂后观察到胰岛素和c肽距基线平均升高。与安慰剂相比,随更高的剂量(4.5mg和6.0mg)观察到显著性差异,如:(1)体重减轻保持直至单次施用两种最高剂量后第43天,和(2)观察到升高的总体食欲评分(表示食欲减退),并且其与安慰剂相比,用4.5mg和6.0mg有明显差异。
225、实施例2:mad研究
226、将研究设计为在糖尿病个体中评价ggg三受体激动剂(seq id no:1)的安全性、耐受性、pd和pk。mad研究是一项在糖尿病个体(即,含年龄20-70岁,女性或男性,患t2dm至少3月并且hba1c在导入和筛查时为≥7.0%和≤10.5%以及筛查之前经单纯饮食与锻炼或稳定剂量的二甲双胍治疗至少3月,随机分配之前体重稳定3个月且筛查时bmi为23-50kg/m2)中实施的随机分配、研究者设盲及参与者设盲、安慰剂对照、多剂量递增、单研究中心研究。
227、历经12周在队列中评估ggg三受体激动剂的剂量递增,起始剂量为0.5mg。对13位个体的第一队列施用0.5mg持续12周。对13位个体的第二队列施用1.5mg持续12周。对15位个体的第三队列施用3.0mg持续12周。对15位个体的第四队列施用3.0mg持续4周且随后施用6.0mg持续8周。对16位个体的第五队列施用3.0mg持续2周,施用6.0mg持续2周,施用9.0mg持续4周,并且随后施用12mg持续4周。可以基于前述队列的紧急安全性数据和耐受性数据引入替代性剂量增量,并且可以减少剂量增量步骤。作为一个非限制性实例,在队列4中,从起始剂量3mg递增可以在达到6mg之前借助逐步剂量4.5mg发生,在队列5中,从起始剂量3mg递增至12mg可以在计划的剂量6mg和9mg之前借助额外的逐步剂量水平4.5mg发生。除这些在队列4和队列5中拟议的替代性治疗方案之外,如果得到安全性数据或耐受性数据的保证,则可以进一步降低各队列间和各队内列内部递增的计划内剂量。
228、在第1天给药前及在给药后12小时、24小时、48小时(第2天)和72小时以及在第7天、第14天和第21天给药前收集血液样品以确定ggg三受体激动剂的血浆浓度。还在第29天给药前及在给药后12小时、24小时、48小时和72小时以及在第36天、第43天和第50天给药前收集血液样品以确定ggg三受体激动剂的血浆浓度。还在第57天给药前及在给药后12小时、24小时、48小时和72小时以及在第64天和第71天给药前收集血液样品以确定ggg三受体激动剂的血浆浓度。还在第78天给药前及在给药后12小时、24小时、48小时和72小时以及在第85天给药前收集血液样品以确定ggg三受体激动剂的血浆浓度。在q2solutions(ithaca,ny)分析来自施用过ggg三受体激动剂的个体的人血浆样品。使用验证的液相色谱高分辨质谱法,分析ggg三受体激动剂的浓度,定量下限是1ng/ml或3ng/ml并且定量上限是500ng/ml。
229、同样在第14周和第16周收集血液样品供pk分析。如上,利用血浆浓度在已验证的软件程序(phoenix winnonlin版本8.1)中使用标准非区室法计算pk参数。
230、对于口服葡萄糖耐量试验(ogtt),研究期间使用本领域已知的方法对每份分析物测量的c肽、胰高血糖素、葡萄糖和胰岛素。另外,在第1、29、57、78和85天以及在第16周测量hba1c。从ogtt导出以下参数以评估胰岛素抵抗和β细胞功能:体内稳态模型评估(homa)-b、homa-ir、胰岛素生成指数、胰岛素敏感度(matsuda指数)和口服葡萄糖胰岛素敏感度(ogis)。
231、按照以下等式计算胰岛素敏感度:
232、
233、其中葡萄糖以mg/dl计并且胰岛素以μu/ml计。
234、按照以下等式计算胰岛素敏感度(matsuda指数):
235、
236、其中葡萄糖以mg/dl计并且胰岛素以μu/ml计。
237、处置指数计算为(igi*isi)。
238、按照以下等式计算ogis:
239、
240、其中b=(p5×(g90-gcl)+1)×clogtt
241、
242、p1=6.50,p2=1951,p3=4514,p4=792,p5=11.8×10-3,p6=173。
243、另外,在禁食后第1、8、15、22、29、36、43、50、57、64、71、78和80天以及在第16周测量满足感vas。使用饥饿、饱腹感、满足感和预测的食物摄入量的vas参数评估食欲感知,并且将总体食欲评分如上文sad研究描述那样计算。
244、在第1、8、15、22、29、36、43、50、57、64、71、78和85天以及在第16周测量bw。
245、在药物超敏反应(速发或非速发)情况下,尽可能接近事件发作时、在事件消退和事件开始后30天收集样品用于抗药物抗体(ada)分析。在bioagilytix labs(durham,nc)使用验证的电化学发光免疫测定法分析样品。
246、pd结果:mad研究表明,ggg三受体激动剂耐受良好。恶心、腹泻和呕吐是报告最多的gi事件,在严重程度方面大部分为轻度且为剂量相关。观察到心率的剂量依赖性升高,但是对于6.0mg组和12.0mg组,部分地补偿收缩压的剂量依赖性下降。对于3/6/9/12mg组,心律>100bpm的个体的百分数类似于安慰剂。到研究结束为止,全部治疗组中c肽和胰岛素均距基线升高。同样地,如依据ogtt所测定,到研究结束为止,除安慰剂和0.5mg ggg三受体激动剂之外的全部治疗组中gcg距基线下降。
247、表13:糖尿病个体中施用ggg三受体激动剂后的ogtt总结。
248、
249、
250、注:dula是杜拉鲁肽(美国礼来公司;印第安纳波利斯,in);ggg是ggg三受体激动剂;nc=未计算;a=在第-2天的平均绝对值。
251、表14:β-细胞功能和从ogtt导出的胰岛素敏感性参数总结。
252、
253、
254、pk结果:mad研究的结果显示pk在健康个体和糖尿病个体之间相似并且表明,鉴于平均半寿期是约6天(134-165小时),qw给药可行。tmax处于给药后12-72小时范围内。
255、表15:第1天时糖尿病个体中ggg三受体激动剂的pk参数总结。
256、
257、注:nd=未进行
258、表16:第29天时糖尿病个体中ggg三受体激动剂的pk参数总结。
259、
260、注:nd=未进行
261、表17:第57天时糖尿病个体中ggg三受体激动剂的pk参数总结。
262、
263、
264、注:nd=未进行;nc=未计算
265、表18:第78天时糖尿病个体中ggg三受体激动剂的pk参数总结。
266、
267、注:nd=未进行;nc=未计算
268、表19:糖尿病个体中施用ggg三受体激动剂后,每日平均血糖的变化。
269、
270、注:dula是杜拉鲁肽(美国礼来公司;印第安纳波利斯,in);ggg是ggg三受体激动剂;nd=未进行。a=基线值是在第-1天的每日均数;*=表示与安慰剂相比,ly3437943距基线的最小二乘平均变化的差异为统计显著(90%ci未涵盖0)。
271、表20:糖尿病个体中施用ggg三受体激动剂后hba1c的变化。
272、
273、
274、注:dula是杜拉鲁肽;ggg是ggg三受体激动剂;nd=未进行。a=基线值是在第→1天的每日均数;*=表示与安慰剂相比,ly3437943距基线的最小二乘平均变化的差异为统计显著(90%ci未涵盖0)。
275、在mad研究期间,在全部ggg三受体激动剂给药组中在评估的每个时间点均观察到平均体重降低,例外是0.5mg组。体重降低趋势似乎为剂量依赖性,其中12周治疗期间结束时体重距基线的平均变化如下:安慰剂是在第85天0.6kg;0.5mg ggg三受体激动剂是在第43天0.6kg(计算的最后均数);1.5mg ggg三受体激动剂是在第43天-1.1kg(计算的最后均数);3.0mg ggg三受体激动剂是在第85天-4.4kg;3/6mg ggg三受体激动剂是在第85天-7.5kg;3/6/9/12mg ggg三受体激动剂是在第85天-8.4kg。在1.5mg杜拉鲁肽12周治疗期间后也观察到平均体重距基线下降,最大降幅1.3kg。安慰剂组中历经12周给药阶段,平均体重保持稳定靠近基线值。
276、另外,在mad研究期间,在全部ggg三受体激动剂给药组中均观察到平均腰围降低;安慰剂组中未观察到这个趋势。12周治疗期间结束时腰围距基线平均变化如下:0.5mg ggg三受体激动剂是在第71天-2.9cm(计算的最后均数);1.5mg ggg三受体激动剂是在第43天-4.6cm(计算的最后均数);3.0mg ggg三受体激动剂是在第85天-5.9cm;3/6mg ggg三受体激动剂是在第85天-2.1cm;并且3/6/9/12mg ggg三受体激动剂是在第85天是-7.0cm。历经1.5mg杜拉鲁肽12周给药阶段观察到平均腰围下降,在第85天距基线下降4.9cm。
277、另外,在mad研究期间,全部治疗组中总体食欲评分总体上跨12周治疗期间距基线升高,例外是0.5mg ggg三受体激动剂和安慰剂。对于1.5、3.0、3/6和3/6/9/12mg ggg三受体激动剂治疗组,总体食欲评分距基线升高相当。到12周治疗阶段结束为止(第78天),全部治疗组中平均总体食欲评分距基线保持升高,安慰剂并非如此,并且截至第106天(末剂后28天),全部治疗组中总体食欲评分均已经返回基线或自其附近。
278、历经12周治疗期间,在全部治疗组中于大部分时间点评估饥饿评分距基线下降,例外是0.5mg ggg三受体激动剂。安慰剂组饥饿评分和0.5mg ggg三受体激动剂贯穿这个12周治疗期间保持稳定并且靠近基线。饥饿评分距基线下降在≥1.5mg ggg三受体激动剂治疗组和杜拉鲁肽治疗组之间类似。
279、历经12周治疗期间,在1.5mg杜拉鲁肽治疗组和3/6mg ggg三受体激动剂治疗组中评估的全部时间点,满足感评分距基线均升高。全部其他ggg三受体激动剂治疗组和安慰剂组的感评分总体上始终保持稳定并且靠近基线。
280、历经12周治疗期间,在全部治疗组(包括安慰剂组)中大部分时间点,预期食物消费量评分总体上距基线下降。1.5mg杜拉鲁肽菌组中观察到食物消费量评分距基线下降最大。除0.5mg ggg三受体激动剂治疗组距基线下降最小之外,食物消费量评分距基线下降总体上在≥1.5mg ggg三受体激动剂治疗组之间类似。
281、历经12周治疗期间,在≥3.0mg ggg三受体激动剂治疗组和1.5mg杜拉鲁肽治疗组中评估的全部时间点,饱腹感评分距基线均升高。安慰剂治疗组和1.5和0.5mg ggg三受体激动剂治疗组中的饱腹感评分始终保持稳定并且靠近基线。饱腹感评分距基线升高总体上在≥3.0mg ggg三受体激动剂治疗组和杜拉鲁肽治疗组之间类似。
282、总结:认为0.5、1.5和3.0mg每周一次剂量的ggg三受体激动剂持续12周耐受良好。≥6.0mg更高剂量的ggg三受体激动剂与升高的ae发生率相关。最常见报告的teae是gi事件,其包括腹泻、恶心、腹胀、嗳气、消化不良、呕吐和便秘。在0.5至12.0mg多个sc剂量的ggg三受体激动剂后没有预料不到的安全性担忧。
283、在ggg三受体激动剂qw给药12周期间,与安慰剂相比在剂量≥3.0mg观察到平均每日血糖和hba1c距基线统计显著地降低。另外,在ggg三受体激动剂qw按剂量1.5至12.0mg给药12周期间观察到体重距基线下降,在剂量≥3.0mg后观察到最大下降。
284、ggg三受体激动剂的几何平均t1/2的值跨全部剂量水平均相似,范围从约135小时至143小时(即,约6天)。在第12周3.0、6.0和12.0mg ggg三受体激动剂剂量水平的剂量比例性分析(dose proportionality analysis)显示,auc(0-τ)和cmax以剂量比例方式升高,而暴露量升高在0.5至3.0mg的3个最低剂量水平显示某种亚比例性(sub-proportionality)。
285、实施例3:对t2dm的ii期研究
286、将研究设计为在糖尿病个体的更大群体中进一步评价ggg三受体激动剂(seq idno:1)的疗效和安全性。该研究是一项在糖尿病个体(即,含年龄18-75岁的女性或男性,患t2dm至少3月并且hba1c在导入和筛查时为≥7.0%和≤10.5%以及筛查之前经单纯饮食与锻炼或稳定剂量的二甲双胍治疗至少3月,随机分配之前体重稳定3个月且筛查时bmi为25-50kg/m2)中实施的随机分配、研究者设盲及参与者设盲、安慰剂对照研究。
287、历经36周在施用ggg三受体激动剂、杜拉鲁肽或安慰剂的队列中评估ggg三受体激动剂的剂量递增。对50位个体的第一队列第1周-第4周施用2.0mg ggg三受体激动剂,第5周-第8周施用4.0mg,第9周-第12周施用8.0mg并且随后第13周-第36周施用12.0mg。对20位个体的第二队列第1周-第4周施用4.0mg ggg三受体激动剂并且随后第5周-第36周施用8.0mg。对20位个体的第三队列第1周-第4周施用2.0mg ggg三受体激动剂,第5周-第8周施用4.0mg并且随后第9周-第36周施用8.0mg。对30位个体的第四队列第1周-第36周施用4.0mg ggg三受体激动剂。对30位个体的第五队列第1周-第4周施用2.0mg ggg三受体激动剂并且随后第5周-第36周施用4.0mg。对50位个体的第六队列第1周-第36周施用0.5mg ggg三受体激动剂。对50位个体的第七队列第1周-第36周施用1.5mg杜拉鲁肽。对50位个体的第八队列第1周-第36周施用安慰剂。
288、给药前和在第24周收集血液样品供hba1c分析。还收集样品以测量从基线至第24周和至第36周的hba1c和fbg变化。另外,从基线至第24周和至第36周评估体重变化(kg)。
289、从第37-第40周对个体实施安全性随访。
290、16周数据支持在所评价的剂量范围内ggg三受体激动剂的疗效、安全性和耐受性。ggg三受体激动剂剂量及以1mg和2mg剂量启动剂量滴定、并且每周一次皮下施用,使用剂量步骤1、2、3或4mg递增至最大剂量12mg的给药方案的收益/风险特征具有可接受的耐受性特征,同时使治疗收益最大化,同时不良事件风险最小。
291、实施例4:针对肥胖症和nafld的ii期研究
292、将研究设计为在肥胖个体或超重个体的更大群体中进一步评价ggg三受体激动剂(seq id no:1)的疗效和安全性。该研究是一项在无糖尿病的肥胖个体或超重个体(即,含年龄18-75岁的女性或男性,在随机分配之前有肥胖症且筛查时bmi≥30kg/m2或在随机分配之前超重且筛查时bmi≥27kg/m2或<30kg/m2,伴体重相关合并症但无t2dm)中实施的随机分配、研究者设盲及参与者设盲、安慰剂对照研究。
293、历经36周在施用ggg三受体激动剂、杜拉鲁肽或安慰剂的队列中评估ggg三受体激动剂的剂量递增。对60位个体的第一队列第1周-第4周施用2.0mg ggg三受体激动剂,第5周-第8周施用4.0mg,第9周-第12周施用8.0mg并且随后第13周-第48周施用12.0mg。对30位个体的第二队列第1周-第4周施用4.0mg ggg三受体激动剂并且随后第5周-第48周施用8.0mg。对30位个体的第三队列第1周-第4周施用2.0mg ggg三受体激动剂,第5周-第8周施用4.0mg并且随后第9周-第48周施用8.0mg。对30位个体的第四队列第1周-第48周施用4.0mg ggg三受体激动剂。对30位个体的第五队列第1周-第4周施用2.0mg ggg三受体激动剂并且随后第5周-第48周施用4.0mg。对60位个体的第六队列第1周-第48周施用1.0mg ggg三受体激动剂。对50位个体的第七队列第1周-第48周施用安慰剂。对另外125位个体评估nafld,后者依据磁共振成像质子密度脂肪分数(mri-pdff)以肝脏脂肪≥10%为特征。
294、在给药前并且在第24周及第48周对体重评估体重变化%。在第24周或第48周测量平均腰围变化(cm)。
295、从第49-第52周对个体实施安全性随访。
296、16周数据支持在所评价的剂量范围2-12mg内,ggg三受体激动剂的疗效、安全性和耐受性。ggg三受体激动剂剂量及以1mg和2mg剂量启动剂量滴定、并且每周一次皮下施用,使用剂量步骤1、2、3或4mg时递增至最大剂量12mg的给药方案的收益/风险特征具有可接受的耐受性特征,同时使治疗收益最大化,同时不良事件风险最小。
297、序列
298、在本公开中提及并在下文提供以下核酸序列和/或氨基酸序列供参考。
299、seq id no:1-肠降血糖素类似物/ggg三受体激动剂
300、y-aib-qgtftsdysi-αmel-ldkk((2-[2-(2-氨基-乙氧基)-乙氧基]-乙酰基)-(γglu)-co-(ch2)18-co2h)aq-aib-afieylleggpssgappps-nh2
- 还没有人留言评论。精彩留言会获得点赞!