一种基于对抗攻击的药物分子重要节点预测方法
本发明涉及一种基于对抗攻击的药物分子重要节点预测技术,属于图神经网络和药物分子设计。
背景技术:
1、目前,临床上仍有大量疾病缺乏安全有效的治疗药物。一方面,新的疾病的出现带来了对研发新药物的更大的需求,另一方面,大量已知的疾病仍缺乏对症的药物,比如各种癌症等。
2、近年来,基于神经网络进行药物分子设计的技术受到广泛关注,但神经网络黑盒模型的不可解释性导致对药物分子设计的结果缺乏一定的理化性质支撑。
3、一方面,经过神经网络设计的药物分子在应用于人体病症时需要进行充分的理论解释以及大量的实验验证。理化性质存在漏洞的药物设计对使用者会带来不可预估的损失。对药物分子性质进行直接的理化性质分析可以为药物药理功能验证提供有力的佐证,进一步的,预测可能出现的副作用,为药物的合理使用提供建议和指导。
4、另一方面,作为分子任务,分类、预测、相似度量等,都是药物研发过程中重要的优化方法。其中,药物分子属性预测,即虚拟筛选和最优化选择,具体来讲包括对药物的结合亲和力、毒性、吸收、分布、新陈代谢和分泌进行预测判断等,对于药物合成和筛选具有重要意义。
5、由此可见,对生成的分子性质进行解释是十分重要的。基于此,本发明旨在以上述神经网络模型为出发点,给出对该模型的解释方案。通过对生成的分子进行合适药理学、毒理学和药代动力学等特性的解释能够利用机器的认知增强药物学家的认知,让药物学家更快地分析出生成药物分子的性质做出改进方案以降低每次迭代的成本,甚至产生更大的实际应用价值。
技术实现思路
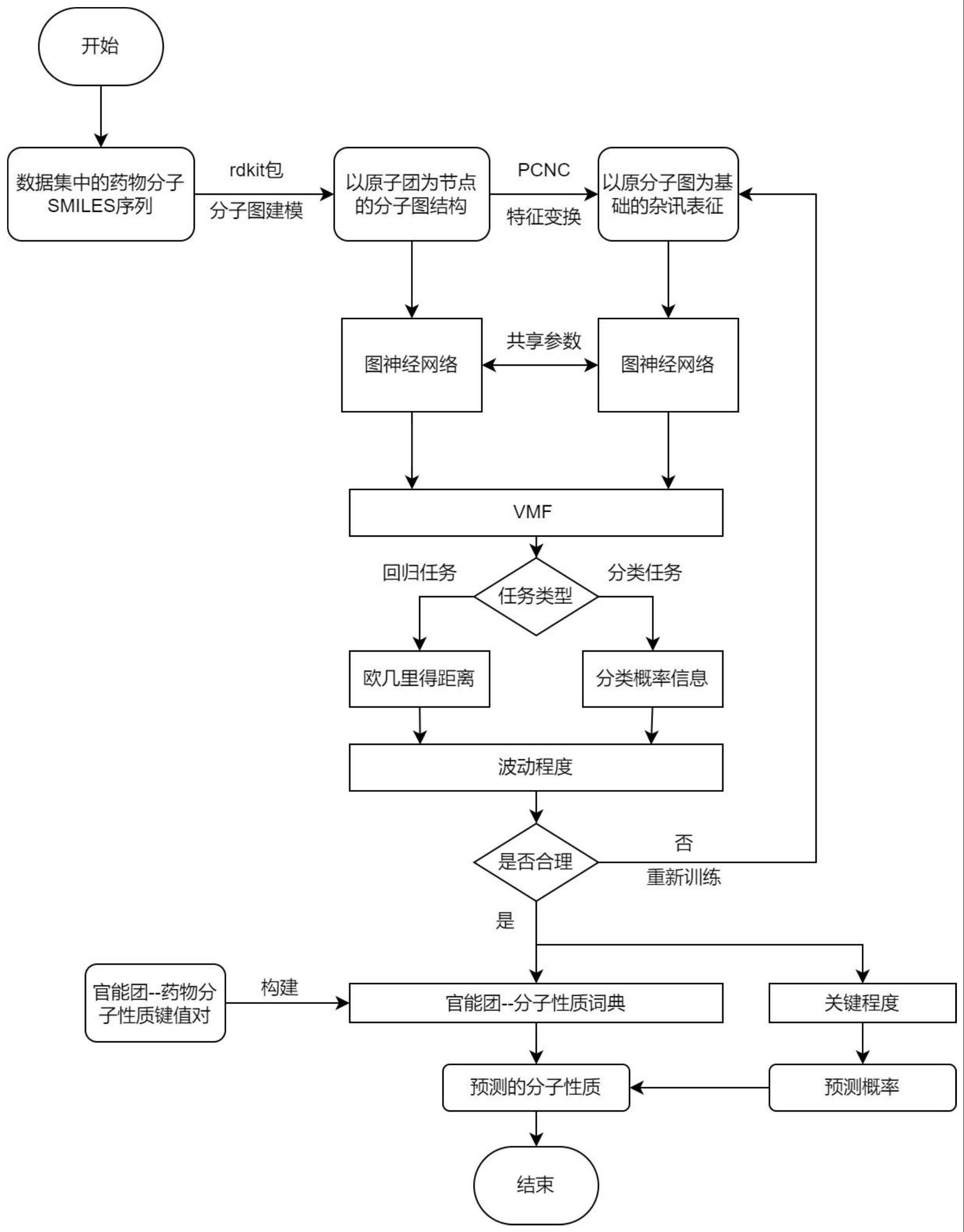
1、本发明旨在解决上述问题,对药物分子的关键官能团进行分析,对药物分子进行图模型建模,分别与构造出的杂讯表征输入共享参数的神经网络模型,选择波动程度衡量函数作为本发明的损失函数,最终得到杂讯表征波动程度最大的权值矩阵,每个权值偏离原特征向量的对应特征值大的特征节点即作为所分析的药物分子关键官能团预测结果,根据预先构建的官能团-分子性质词典可预测药物分子性质,从而在理化性质上对研发的药物分子进行模型解释。
2、为了解决上述技术问题,本发明的技术方案如下:一种基于对抗攻击的药物分子重要节点预测方法,所述方法包括以下步骤:
3、步骤1:对输入的药物分子进行图模型建模,编码得到对应的分子表征向量,输入检验神经网络模型中得到预处理结果;
4、步骤2:对得到的药物分子表征向量进行特征变换,根据pcnc方法(perturbationconstructs noise characterization,基于扰动构造杂讯表征)对分子表征向量进行特征变换,输入与步骤1中所述检验神经网络中得到对应输出结果;
5、步骤3:将步骤1和步骤2分别得到的结果输入波动程度衡量函数vmf(volatilitymeasurement function),得到以波动程度为损失函数的节点重要度;
6、步骤4:重复步骤2至3,直至目标函数接近收敛,得到药物分子重要节点即官能团;
7、步骤5:在药物分子官能团获得后进行分子性质翻译,从而得到预测的药物分子性质。
8、其中,步骤1中,分子图模型建模利用rdkit包将给定的smiles药物分子序列转化为以原子团结构为节点的dgl图,根据生成的dgl图构建邻接矩阵,具体如下:
9、步骤101:将smiles格式的药物分子转化为rdkit的mol对象,通过提取原子特征和化学键特征生成以原子结构为节点的dgl图,再利用基于化学反应模板的brics方法对分子片段库进行构建,划分分子官能团,重新生成以原子团结构为节点的dgl图,
10、步骤102:在药物分子图模型建模中,将药物分子据转换为图数据,所述图数据包括多个节点和多个边,所述节点表征构成所述待测药物分子的官能团,所述边表征所述连接待预测药物分子官能团的化学键,其中连接不同官能团的化学键的权值不同,
11、步骤103:步骤1中所述检验神经网络为事先训练好的检验药物分子功能的模型,固定其参数,将给定的药物分子输入检验神经网络,得到输出结果。
12、其中,步骤2中,根据adversarial attack(对抗攻击)的思想,对药物分子重要节点进行表征掩码学习,从而对给定的药物分子向量进行特征变换。其中,掩码是一个与分子表征向量同维数的零一矩阵,更新掩码是一个迭代的过程。
13、步骤201:第一次迭代时掩码的构建方法(初始化)具体如下:
14、步骤20101:确定重构粒度作为模型超参数之一,重构粒度即掩码中0元素的个数;
15、步骤20202:根据步骤201选取的重构粒度随机初始化一个掩码矩阵,将其与原来的药物分子表征向量逐元素相乘,得到药物分子杂讯表征;
16、步骤20103:将得到的药物分子杂讯表征输入步骤1的检验神经网络中得到输出结果;步骤202:后续迭代时掩码的构建方法具体如下:
17、步骤20201:借助贪心算法对更新上一个掩码矩阵,使得掩码沿使步骤3中的vmf增大的方向更新;
18、步骤20202:将更新后的掩码矩阵与原来的药物分子表征向量逐元素相乘,得到更新后的药物分子杂讯表征;
19、步骤20203:将更新后的药物分子杂讯表征输入步骤1的检验神经网络中得到输出结果;其中,步骤3中,vmf函数根据所选检验神经网络任务分为回归任务与分类任务,具体构建方法如下:
20、步骤301:当所选任务为回归任务时,利用欧几里得距离(eucliden distance)计算步骤1和步骤2得到的结果的差异。
21、
22、其中a表示步骤1中的输出结果矩阵,b表示步骤2中的输出结果矩阵,d(a,b)表示两个矩阵之间的欧几里得距离,ai表示矩阵a中的第i个元素,bi同理;
23、步骤302:当所选任务为分类任务时,由于分类任务通常选用交叉熵损失作为优化目标,故使用图神经网络输出的分类概率信息作为波动程度值。
24、vmf(a,b)=|p(y=a)-p(y'=a)|
25、其中a表示步骤1中得到的分类结果,b表示步骤2中得到的分类结果,p(y=c)表示特征向量输入检验神经网络后分类结果y概率为a的概率,p(y’=c)表示步骤2所构造的杂讯表征输入检验神经网络后分类结果y的概率仍为a的概率,两个概率取差的绝对值得到vmf函数的输出。
26、其中,步骤5中,根据关键官能团预测药物分子属性,具体如下:
27、步骤501:利用已知的官能团与药物分子性质对应关系制作官能团-药物分子性质对照词典,步骤502:通过s1得到的药物分子关键官能团作为查询条件,得到给定的官能团对应的分子性质预测,
28、步骤503:利用预测的官能团关键程度作为对应分子性质预测概率,得到该药物分子的性质预测及其对应概率。
29、本发明提供的方法,还具有以下特征:
30、其中,分子图模型建模利用rdkit包将给定的smiles药物分子序列转化为以原子团结构为节点的dgl图,根据生成的dgl图构建邻接矩阵。
31、其中,进一步地,将smiles格式的药物分子转化为rdkit的mol对象,通过提取原子特征和化学键特征生成以原子结构为节点的dgl图,再利用基于化学反应模板的brics方法对分子片段库进行构建,划分分子官能团,重新生成以原子团结构为节点的dgl图。
32、其中,pcnc方法根据加权扰动函数wpf对原始分子表征向量进行特征变换。
33、本发明提供的方法,还具有以下特征:
34、其中,分子性质翻译需要事先创建官能团-性质词典,在得到官能团后对依照词典对分子性质进行翻译,得到预测的分子性质。
35、与现有技术相比,本发明的技术方案具有以下有益技术效果:
36、对神经网络黑盒模型生成的药物分子进行可解释性分析是药物分子设计的任务之一,本发明采用的是基于对抗攻击预测药物分子的重要官能团,使用图结构表示的药物分子,充分考虑了分子中每一个原子的相互作用,表示药物分子的复杂关系,减少了信息缺失。将药物分子原始表征向量通过pcnc方法构造杂讯表征,根据对抗攻击思想分别输入给定的检验神经网络中,使得可以通过输出结果波动程度得到量化的节点的重要程度,从而进一步地,根据重要节点即官能团对药物分子的性质进行解释,相比于传统的物理化学方法,效率更高。本方法并不局限于小分子药物分子,对于神经网络生成的大分子药物分子依然可以使用本方法进行解释。同时,使用本方法能够为药物分子的解释进行进一步的可视化表达,有助于理解模型的决策过程。总之,使用本发明所提供的一种基于对抗攻击的药物分子重要节点预测方法可以充分考虑药物原子分子结构,高效解释药物分子性质,能够扩展到大分子药物分子,以及有助于提高模型可解释性,为新型药物的设计和研发实现ai赋能。
- 还没有人留言评论。精彩留言会获得点赞!