一种高效化学动力治疗协同增敏铁死亡的多功能纳米材料的制备方法及应用
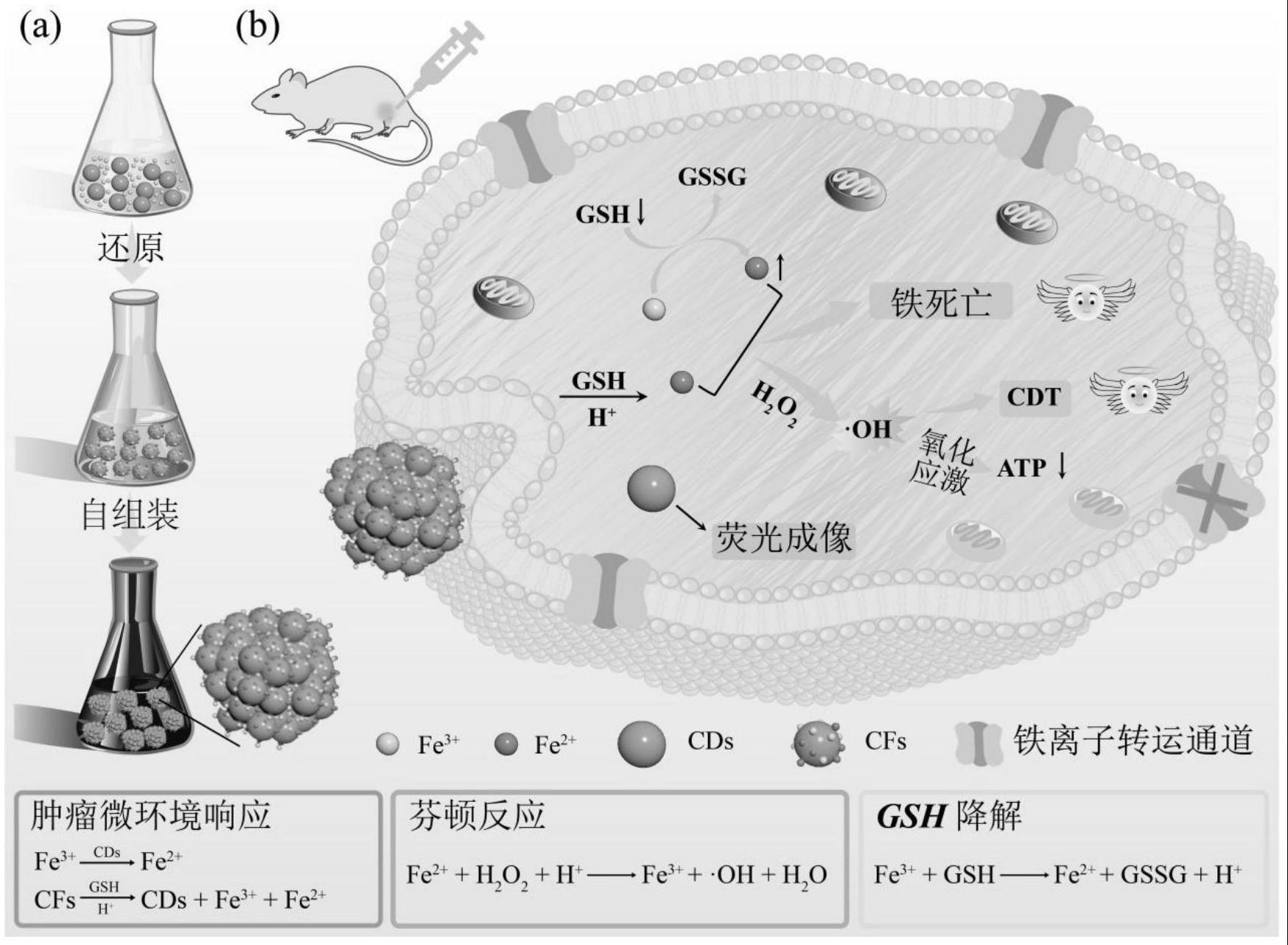
本发明涉及肿瘤的协同治疗,具体涉及一种高效化学动力治疗协同增敏铁死亡的多功能纳米材料的制备方法及应用。
背景技术:
1、细胞内铁的平衡是正常细胞生理活动所必需的。铁死亡是一种新发现的程序性细胞死亡方式。其核心发病机制是细胞内铁依赖性脂质过氧化途径和脂质膜抗氧化系统失衡。这伴随着谷胱甘肽过氧化物酶清除机制的崩溃,导致脂质过氧化物的过度积累。同时,线粒体皱缩,膜密度增加,脊减少,随后导致细胞死亡。为了维持快速的物质和能量代谢,与正常细胞相比,癌细胞对铁的需求增加。这种铁依赖性可使癌细胞更容易受到铁中毒的影响。然而,由于癌细胞的异质性、复杂性和动态性,目前基于铁死亡的治疗策略并不有效。特别是,细胞内高剂量的铁离子(fe3+)及亚铁离子(fe2+)是启动铁死亡的必要条件。已有研究表明,细胞内活性氧的产生会导致细胞铁运输通道的失衡,并促成fe3+在细胞内的大量积聚。现阶段,基于活性氧的新型肿瘤治疗方法层出不穷,包括化学动力疗法、光动力疗法和声动力疗法等。
2、基于芬顿反应或类芬顿反应的化学动力治疗是肿瘤治疗的重要方向,它不需要引入抗癌药物和外部刺激,副作用小,操作简单,能有效克服光穿透组织的限制,更适合治疗深部肿瘤。fe2+具有优异的分解过氧化氢(h2o2)成为羟基自由基(·oh)的能力。同时,外源性fe3+的引入导致细胞内fe3+浓度大幅增加,这有助于铁死亡的发生。然而,癌细胞中还原型谷胱甘肽(gsh)的高度表达会耗尽生成的·oh,直接降低治疗效率。同样,肿瘤微环境中并不足够高的h2o2水平会在很大程度上限制化学动力治疗的效果。值得注意的是,铁死亡导致细胞内还原型gsh水平下降,这有助于fe2+诱发癌细胞的氧化应激。
3、因此,开发一种能补充外源性fe3+并在低水平h2o2下仍能迅速产生大量活性氧的治疗策略,将有助于高效化学动力治疗与铁死亡在癌症治疗中的协同作用。
技术实现思路
1、针对临床肿瘤治疗领域的紧迫性与现有技术的不足,为了达到增强肿瘤治疗的目的,本发明提出一种高效化学动力治疗协同增敏铁死亡的多功能纳米材料。该多功能纳米材料由碳点(cds)和fe3+通过快速的自组装形成。在自组装过程中,cds与fe3+发生氧化还原反应得到fe2+,并且进一步与fe3+和fe2+自组装形成多功能纳米材料。本发明提供的多功能纳米材料在肿瘤微环境刺激下可以释放出具有明亮荧光的cds以及大量的fe3+和fe2+。大量的外源性fe3+为铁死亡的发生提供了可能。fe3+进入细胞后可以消耗gsh并原位增加fe2+浓度。fe2+实现了在低h2o2浓度下的高效化学动力治疗,产生的·oh导致细胞发生氧化应激,破坏肿瘤细胞的氧化还原平衡,诱导细胞凋亡。·oh攻击线粒体,导致细胞内atp含量减少,进一步导致fe3+运输通道失衡,有助于促进fe3+在细胞内的大量积累,协同增敏铁死亡。本发明的多功能纳米材料具有制备简单、价格低廉、生物相容性良好、水溶性好的特性,并为纳米材料在肿瘤协同治疗中的应用提供了新的策略。基于此,本发明的目的在于提供一种高效化学动力治疗协同增敏铁死亡的多功能纳米材料的制备方法及应用。
2、为实现上述目的,本发明采用如下技术方案:
3、第一方面,本发明提供了一种高效化学动力治疗协同增敏铁死亡的多功能纳米材料的制备方法。所述多功能纳米材料由具有还原性的碳点(cds)负载fe3+构建而成,其制备方法包括以下步骤:将铁盐溶液加入至cds分散体系中,搅拌混合,得到所述的多功能纳米材料。
4、所述的多功能纳米材料的制备方法中:铁盐与cds的体积比优选为1:1-50,其中铁盐浓度为5-30mm,cds浓度为2-20mg/ml;所述的铁盐优选为fecl3或fe2(so4)3或fe(no3)3;铁盐溶液的加入方式优选为逐滴加入;所述的搅拌混合条件优选为5-40℃下搅拌0.5-10h。
5、所述的多功能纳米材料的制备方法中:所述的cds优选通过包括如下步骤的方法制备得到:将巯基化合物与苯二胺混合,在pbs溶液中(ph 4-7)分散均匀后加热进行反应,得到cds材料。其中,所述的巯基化合物优选为gsh、半胱氨酸或硫脲,所述的苯二胺优选为邻苯二胺、间苯二胺或对苯二胺。其中巯基化合物与苯二胺的摩尔比优选为1:0.1-10;加热进行反应的条件优选为100-200℃下反应10-120min。
6、第二方面,本发明提供了利用上述方法制备得到的多功能纳米材料。
7、第三方面,本发明提供上述多功能纳米材料在制备肿瘤治疗药物中的应用。所述的肿瘤包括乳腺癌、宫颈癌、白血病、胃腺癌等。
8、进一步地,所述的药物具备荧光成像的能力。
9、更进一步地,所述的药物进行肿瘤治疗的方式应为化学动力治疗与铁死亡的协同治疗。
10、第三方面,本发明提一种肿瘤治疗药物,其包含上述多功能纳米材料。
11、本发明的有益效果:
12、(1)本发明将还原性cds与fe3+通过简单快速的自组装方法合成多功能纳米材料,具有制备简单便捷、成本低廉、合成原料广泛、生物相容性优异、水溶性好等优点,利于成本控制和工业化生产。
13、(2)本发明制备的多功能纳米材料可以有效避免fe3+与fe2+的过早泄露,成功规避了fe3+易于沉淀以及fe2+不稳定的缺点。
14、(3)本发明制备的多功能纳米材料在进入肿瘤细胞后,可以释放出具有明亮荧光的cds以及大量的fe3+和fe2+,为铁死亡的发生提供了可能,实现了癌细胞靶向荧光成像。
15、(4)fe3+可以消耗gsh并原位增加fe2+浓度,fe2+实现了在低h2o2浓度下的高效化学动力治疗。产生的·oh可以导致氧化应激,破坏肿瘤细胞氧化还原平衡,诱导细胞凋亡。
16、(5)化学动力治疗产生的·oh攻击线粒体,导致细胞内atp含量减少,进一步导致fe3+运输通道失衡,有助于促进fe3+在细胞内的大量积累,协同增敏铁死亡。
技术特征:
1.一种高效化学动力治疗协同增敏铁死亡的多功能纳米材料的制备方法,其特征在于,所述多功能纳米材料由具有还原性的cds负载fe3+构建而成。
2.根据权利要求1所述的多功能纳米材料的制备方法,其特征在于,包括以下步骤:将铁盐溶液加入至cds分散体系中,搅拌混合,得到所述的多功能纳米材料。
3.根据权利要求2所述的多功能纳米材料的制备方法,其特征在于,所述的铁盐与cds的体积比为1:1-50,铁盐浓度为5-30mm,cds浓度为2-20mg/ml。
4.根据权利要求2所述的多功能纳米材料的制备方法,其特征在于,所述的铁盐溶液的加入方式为逐滴加入;所述的搅拌混合条件为5-40℃下搅拌0.5-10h。
5.根据权利要求1所述的多功能纳米材料的制备方法,其特征在于,所述的cds通过包括如下步骤的方法制备得到:将巯基化合物与苯二胺混合,分散均匀后加热进行反应,得到cds材料。
6.根据权利要求5所述的cds的制备方法,其特征在于,所述的巯基化合物为gsh、半胱氨酸或硫脲,所述的苯二胺为邻苯二胺、间苯二胺或对苯二胺;所述的巯基化合物与苯二胺的摩尔比为1:0.1-10。
7.根据权利要求5所述的cds的制备方法,其特征在于,所述的加热进行反应的条件为100-200℃下反应10-120min。
8.一种高效化学动力治疗协同增敏铁死亡的多功能纳米材料,其特征在于,所述纳米材料通过权利要求1至7任一项所述的制备方法制得。
9.权利要求8所述的多功能纳米材料在制备肿瘤治疗药物中的应用。
10.一种肿瘤治疗药物,其特征在于,含权利要求8所述的多功能纳米材料。
技术总结
本发明公开了一种高效化学动力治疗协同增敏铁死亡的多功能纳米材料的制备方法及应用。该多功能纳米材料由碳点(CDs)和铁离子(Fe<supgt;3+</supgt;)通过快速的自组装形成。在自组装过程中,CDs与Fe<supgt;3+</supgt;发生氧化还原反应得到亚铁离子(Fe<supgt;2+</supgt;),并且进一步与Fe<supgt;3+</supgt;和Fe<supgt;2+</supgt;自组装形成多功能纳米材料。本发明提供的多功能纳米材料在肿瘤微环境刺激下释放出具有明亮荧光的CDs以及大量的Fe<supgt;3+</supgt;和Fe<supgt;2+</supgt;,实现了癌细胞靶向荧光成像和低过氧化氢(H<subgt;2</subgt;O<subgt;2</subgt;)浓度下的高效化学动力治疗协同增敏铁死亡。本发明的多功能纳米材料具有制备简单、价格低廉、生物相容性良好、水溶性好的特性,并为纳米材料在肿瘤协同治疗中的应用提供了新的策略。
技术研发人员:刘义,张晓阳,李淑兰,姜鹏,蒋风雷
受保护的技术使用者:武汉大学
技术研发日:
技术公布日:2024/1/14
- 还没有人留言评论。精彩留言会获得点赞!